Dynamic susceptibility contrast enhanced MRI in differential diagnosis of glioblastoma, solitary cerebral metastasis and cerebral lymphoma
2017-09-03,,,,,,,*
, , , , , , , *
(1.Graduate School of Tianjin Medical University, Tianjin 300060, China; 2.MRI Division, Tianjin Huanhu Hospital, Tianjin 300350, China)
Dynamic susceptibility contrast enhanced MRI in differential diagnosis of glioblastoma, solitary cerebral metastasis and cerebral lymphoma
LUHao1,2,FENGQuanzhi1,CHENGQiansheng2,DINGYan2,LIDaibin2,LIYuge2,HANBihui2,HANTong2*
(1.GraduateSchoolofTianjinMedicalUniversity,Tianjin300060,China; 2.MRIDivision,TianjinHuanhuHospital,Tianjin300350,China)
Objective To investigate the value of the dynamic susceptibility contrast enhanced MRI (DSC-MRI) in differential diagnosis of glioblastoma, solitary cerebral metastatic tumors and cerebral lymphoma. Methods Seventeen patients with glioblastoma, 15 cases with solitary cerebral metastatic tumor and 17 cases with cerebral lymphoma were analyzed retrospectively. All patients underwent conventional MR imaging, contrast-enhancement and DSC-MRI preoperatively. Pseudo color pictures of cerebral blood volume (CBV) and the time signal intensity curve were obtained from the raw data of DSC-MRI. The relative CBV (rCBV ) were measured from regions of enhanced solid parts of the tumors, peritumoral region and contralateral normal white matter regions respectively. The percentage of signal intensity recovery (PSR) of enhanced solid parts of the tumors were measured. ROC curve analysis was performed to determine optimum indicator in differential diagnosis of three types of tumors, and the sensitivity and specificity were calculated. Results Three types of tumors all showed enhancement of solid area with obvious peritumoral edema. Besides the no difference between glioblastoma and metastasis in rCBV of solid parts of the tumors, there were statistically significant differences in comparisons of two types of tumors (allP<0.05). Besides the no difference between single brain metastases and lymphoma in rCBV of peritumoral regions, there were statistically significant differences in comparisons of two types of tumors (allP<0.05). The PSR of the solid parts of the tumors had no difference between glioblastoma and single brain metastases, while there were statistically significant differences in comparisons of two types of tumors (allP<0.05). ROC curve analysis showed sensitivity and specificity of the PSR values of solid parts of the tumors in differentiating lymphoma and non lymphoma were 100% and 81.3%. The rCBV of peritumoral regions was the optimum indicator for differentiating glioblastoma and solitary brain metastasis, the sensitivity and specificity were respectively 94.1% and 86.7%. Conclusion The combination of rCBV and PSR can improve the efficiency for diagnosing the three types of brain tumors.
Glioblastoma; Single brain metastases; Lymphoma; Magnetic resonance imaging
胶质母细胞瘤、脑转移瘤为颅内常见恶性肿瘤,脑淋巴瘤的发生率也越来越高,三者在影像上虽各有特点,但互有重叠,尤其病史不详时诊断困难。由于其医学分期、外科计划及治疗手段各不相同,故临床上区分3种肿瘤尤为重要。动态磁敏感对比增强磁共振成像(dynamic susceptibility contrast enhanced MRI, DSC-MRI)已成熟应用于临床,对肿瘤的诊断及鉴别诊断有重要意义,本研究旨在分析DSC-MRI鉴别诊断3种肿瘤的价值。
1 资料与方法
1.1 一般资料 收集2014年11月—2016年1月经活检或术后病理证实的脑肿瘤患者49例,其中胶质母细胞瘤17例,男9例、女8例,年龄30~68岁,平均(53.3±8.2)岁;单发脑转移瘤15例(原发肿瘤均为肺癌),男11例、女,4例,年龄41~86岁,平均(63.6±7.3)岁,其中低分化腺癌9例、小细胞癌4例、鳞癌2例;淋巴瘤17例,男8例、女9例,年龄24~80岁,平均(58.1±15.6)岁,其中弥漫大B细胞淋巴瘤15例、滤泡性淋巴瘤1例、套细胞淋巴瘤1例。所有患者均接受常规MRI和DSC-MRI扫描,且检查前均未接受过放化疗、激素治疗及手术。
1.2 仪器与方法 采用Siemens Trio A Tim 3.0T MR扫描仪。常规平扫包括轴位SE序列T1WI(TR 195.0 ms,TE 4.8 ms),轴位FSE序列T2WI(TR 4 000 ms,TE 98.0 ms),轴位FLAIR序列(TR 8 200 ms,TE 84.0 ms),矢状位SE序列T1WI(TR 550.0 ms,TE 8.4 ms),T1WI增强扫描(TR 550.0 ms,TE 8.4 ms)。T2*DSC灌注扫描采用SE-EPI序列,层面选择同增强前T1WI轴位扫描,成像时间1 min 39 s,TR 1 840 ms,TE 32 ms,层厚6 mm,层数17层,FOV 230 mm×230 mm,矩阵128×128,带宽1 346 Hz/Px,翻转角90°,NEX 1次,扫描至第5个时相时以高压注射器经肘前静脉团注Gd-DTPA (0.2 mmol/kg体质量),注射速率3 ml/s,共扫描50个时相,获得850幅灌注原始图。
1.3 图像处理及数据分析 在工作站应用Perfusion MR软件处理DSC-MRI的原始数据,获取脑血容量(cerebral blood volume, CBV)伪彩图。将肿瘤实质最高灌注区定义为瘤体区;将对比剂强化T1WI勾勒的强化肿瘤边界以外、长T2高信号水肿区且距肿瘤强化边缘1 cm范围内定义为瘤周区。瘤体区、瘤周区最高灌注处及病变对侧正常脑白质区分别放置ROI,范围为5~10个体素,瘤体区ROI尽量避开肿瘤出血、坏死区及粗大血管。放置瘤周区ROI时还应注意圆形ROI边缘距增强肿瘤强化区的外缘至少5 mm,以除外部分容积效应的影响;并在满足上述条件的前提下,ROI应尽量靠近肿瘤。测量ROI的CBV值并计算相对CBV(rCBV)值,计算公式为:瘤周或瘤体rCBV=瘤周或瘤体CBV/对侧正常白质区CBV。应用Mean Curve软件重建ROI时间-信号强度曲线,分别获得瘤体对比剂流入前信号强度(SIpre)、信号下降最明显处信号强度(SImin)及对比剂首过后的信号强度(SIpost),并计算瘤体的信号强度恢复百分比(percentage of signal intensity recovery, PSR):PSR=(SIpost-SImin)/(SIpre-SImin)×100%。
1.4 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示。3种肿瘤瘤体rCBV、瘤周rCBV、瘤体PSR的比较采用单因素方差分析,方差齐性检验采用Levene检验,若方差齐,两两比较采用LSD检验;若方差不齐,则采用Dunnett'st检验,P<0.05为差异有统计学意义。应用ROC曲线分析瘤体rCBV、瘤周rCBV、瘤体PSR鉴别诊断淋巴瘤与非淋巴瘤的效能及胶质母细胞瘤与单发脑转移瘤的效能。曲线下面积(area under curve, AUC)为0.5~1.0时为具有诊断价值,计算具有诊断价值指标的最佳界值点、诊断敏感度和特异度。
2 结果
2.1 常规平扫及增强表现 胶质母细胞瘤和单发脑转移瘤均呈不均匀稍长T1长T2信号,囊变、出血多见,周围伴明显水肿,呈明显花环形或斑片状强化(图1、2);淋巴瘤呈稍长T1不均匀长T2信号,其中3例可见囊变,均未见出血,13例周围伴明显水肿,呈明显不规则形或团块状强化(图3)。
2.2 DSC-MRI表现 胶质母细胞瘤和单发脑转移瘤实质区均呈高灌注表现(图1、2);9例淋巴瘤呈低灌注表现(图3),3例呈等灌注表现,5例呈稍高灌注表现。
2.3 DSC-MRI参数结果分析
2.3.1 瘤体rCBV、瘤周rCBV及瘤体PSR比较 胶质母细胞瘤、单发脑转移瘤及淋巴瘤的瘤体rCBV值分别为4.27±2.31、4.03±1.73和1.68±0.83,差异具有统计学意义(F=11.35,P<0.001);两两比较,胶质母细胞瘤与单发脑转移瘤rCBV差异无统计学意义(P>0.05),胶质母细胞瘤和单发脑转移瘤的瘤体rCBV值均大于淋巴瘤,差异均有统计学意义(P均<0.001)。
胶质母细胞瘤、单发脑转移瘤及淋巴瘤的瘤周rCBV值分别为0.36±0.17、0.10±0.09和0.16±0.12,差异有统计学意义(F=14.05,P<0.001);两两比较,单发脑转移瘤与淋巴瘤差异无统计学意义(P>0.05),胶质母细胞瘤的瘤周rCBV大于单发脑转移瘤(P<0.001),胶质母细胞瘤大于淋巴瘤(P=0.006),差异均有统计学意义。
胶质母细胞瘤、单发脑转移瘤及淋巴瘤的瘤体PSR值分别为0.80±0.25、0.78±0.58和1.52±0.78,差异有统计学意义(F=8.78,P<0.05);两两比较,胶质母细胞瘤与单发脑转移瘤差异无统计学意义(P>0.05),胶质母细胞瘤和单发转移瘤的瘤体PSR值均小于淋巴瘤 (P<0.001、P=0.001),差异均有统计学意义。
2.3.2 不同灌注参数鉴别诊断淋巴瘤与非淋巴瘤的效能 以瘤体rCBV、瘤周rCBV、瘤体PSR鉴别诊断淋巴瘤与非淋巴瘤(胶质母细胞瘤和单发脑转移瘤)的AUC分别为0.084(P>0.05)、0.403(P>0.05)、0.875(P<0.05),见图4。瘤体PSR=0.9975时,鉴别诊断淋巴瘤与非淋巴瘤的敏感度为100%,特异度81.3%,约登指数最大为0.813。
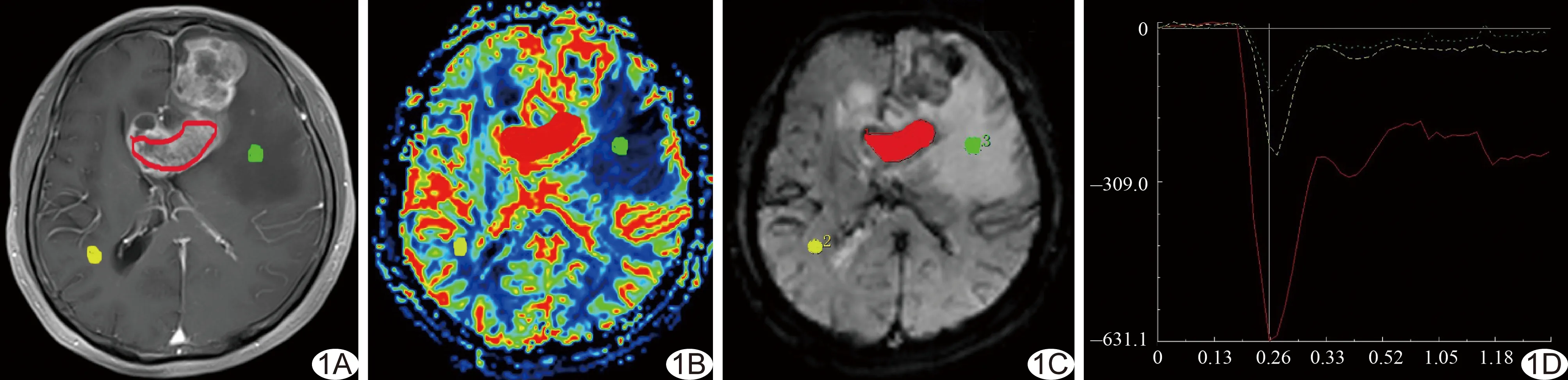
图1 患者男,50岁,胶质母细胞瘤 A~C.T1WI增强图像(A)、CBV伪彩图(B)、灌注原始图(C)示左额、胼胝体区不规则形明显强化灶,周围伴明显水肿,实质区呈明显高灌注状态(红色区域为肿瘤实质部分,黄色为对侧正常脑白质,绿色为瘤周水肿区); D.时间-信号强度曲线表现为首过后信号强度未能达到基线水平

图2 患者男,83岁,单发脑转移瘤(肺腺癌) A~C.T1WI增强图像(A)、CBV伪彩图(B)、灌注原始图(C)示右额顶环形强化病灶,周围伴明显水肿,实质区呈明显高灌注状态( 红色区域为肿瘤实质部分,黄色为对侧正常脑白质,绿色为瘤周水肿区); D.时间-信号曲线表现为首过后信号强度未能达到基线水平

图3 患者女,30岁,淋巴瘤 A~C.T1WI增强图像(A)、CBV伪彩图(B)、灌注原始图(C)示右侧侧脑室旁斑片状明显强化病灶,周围可见水肿,强化区呈等低灌注状态(红色区域为肿瘤实质部分,黄色为对侧正常脑白质,绿色为瘤周水肿区); D.时间-信号强度曲线表现为首过后信号强度超过基线水平

图4 灌注参数诊断淋巴瘤与非淋巴瘤的ROC曲线
2.3.3 不同灌注参数鉴别诊断胶质母细胞瘤与转移瘤的效能 瘤体rCBV、瘤周rCBV、瘤体PSR鉴别诊断胶质母细胞瘤与单发脑转移瘤的AUC分别为0.482(P>0.05)、0.933(P<0.05)、0.592(P<0.05),见图5。瘤周rCBV=0.1800时,鉴别诊断胶质母细胞瘤与单发脑转移瘤的敏感度为94.1%,特异度86.7%,约登指数最大为0.808。
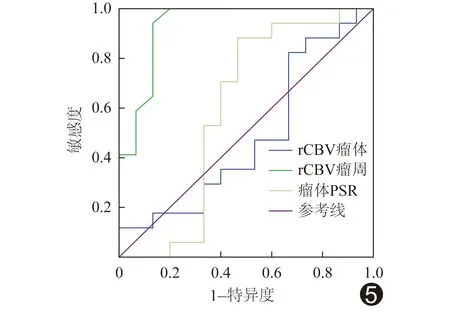
图5 灌注参数诊断胶质母细胞瘤与单发转移瘤的ROC曲线
3 讨论
肿瘤的侵袭及生长依赖于血管内皮细胞增生和新生血管程度[1]。研究[2]表明,高级别星形细胞瘤如胶质母细胞瘤的恶性程度与肿瘤新生血管生成呈明显正相关,微血管结构及新生血管增多可致rCBV值增加。 DSC-MRI是一种快速有效的MR灌注技术,能提供组织微循环及血流动力学信息,目前已广泛应用于评价颅内肿瘤,评价参数多为脑CBV、rCBV、脑血流量(cerebral blood flow, CBF)及平均通过时间(mean through time, MTT)、清除率及微血管密度等,其中rCBV应用最广泛。研究[3]认为rCBV可反映肿瘤内新生血管情况。脑淋巴瘤中,虽然肿瘤呈明显强化改变,但rCBV值通常较低[3]。另外,微血管密度与rCBV值也明显相关,淋巴瘤的微血管密度明显低于胶质母细胞瘤[4]。转移瘤的新生毛细血管类似原发肿瘤,新生血管不存在血脑屏障,故肿瘤呈高灌注[5],但瘤周水肿区的毛细血管结构始终保持正常,无肿瘤细胞浸润[6]。研究[7]表明,转移瘤与胶质母细胞瘤的实质区rCBV值无明显差异,但瘤周水肿区胶质母细胞瘤的rCBV值高于转移瘤。
本研究结果显示,胶质母细胞瘤和单发脑转移瘤的瘤体区rCBV值明显大于淋巴瘤,且胶质母细胞瘤瘤周区rCBV值与单发脑转移瘤也存在显著差异,与之前的结果一致[8-9]。胶质母细胞瘤新生血管丰富,肿瘤细胞常沿神经纤维束或血管间隙向周围浸润生长,故瘤周水肿区常可发现肿瘤细胞存在;单发脑转移瘤保持原发肿瘤的组织特性,无正常的血脑屏障,由于自身血管结构特点及多种肿瘤因子诱导血管通透性变大,加上瘤体压迫邻近引流静脉引起的单纯血管源性水肿,故水肿区无肿瘤细胞浸润,因此两者瘤体区rCBV值均高,而在瘤周区,胶质母细胞瘤rCBV值明显高于转移瘤。张晓琦等[10]也证实,胶质母细胞瘤瘤周区的微血管通透性明显高于转移瘤。本研究结果表明,虽然胶质母细胞瘤和单发脑转移瘤的瘤体区rCBV无统计学差异,但瘤周区二者rCBV存在明显的差异;ROC曲线示瘤周rCBV值对于胶质母细胞瘤与单发脑转移瘤有较高的诊断效能。淋巴瘤组织病理学特点为瘤细胞聚集在血管周围呈袖套状排列[11],缺少新生的毛细血管,故其rCBV值低。在瘤周水肿区,淋巴瘤与转移瘤一样缺乏肿瘤组织,无引起rCBV升高的肿瘤新生血管。本研究淋巴瘤瘤体rCBV与非淋巴瘤(胶质母细胞瘤和单发转移瘤)存在统计学差异,瘤周rCBV与胶质母细胞瘤存在统计学差异,但ROC曲线示瘤体rCBV及瘤周rCBV鉴别诊断淋巴瘤与非淋巴瘤的诊断效能不高。因此选择PSR作为另一个评价指标。
灌注成像评估CBV时,如果血脑屏障完整,则无对比剂渗漏;如果血脑屏障被破坏或发育不完善,对比剂于首过期便快速渗漏出血管外间隙,引起CBV值的低估或高估;而PSR能够通过对比剂到达前后与基线的对比反映血脑屏障破坏的情况,是对CBV参数的补充。研究[12-13]表明,PSR可反映术前颅内肿瘤的血管渗透性变化。本研究表明,淋巴瘤与非淋巴瘤明显强化区内血管渗透性明显不同,淋巴瘤、胶质母细胞瘤、单发脑转移瘤的PSR分别为1.52±0.78、0.80±0.25、0.78±0.58。对比剂首过后,淋巴瘤的信号强度增加超过基线水平,而胶质母细胞瘤和单发脑转移瘤多不能恢复至基线,与Xing等[8]研究一致。团注对比剂后,会引起局部磁场不均匀,T1、T2均缩短,首过期间对比剂在血管内,T2缩短效应大于T1缩短效应,出现负性增强;首过期间或首过后,对比剂渗漏到组织间隙,T1缩短效应增大,超过T2效应时,信号强度会增加甚至超过基线,PSR增高;提示淋巴瘤比胶质母细胞瘤和单发脑转移瘤对比剂渗漏到组织间隙更明显。本研究结果显示,胶质母细胞瘤与单发脑转移瘤PSR值差异无统计学意义,胶质母细胞瘤和转移瘤的瘤体PSR值均小于淋巴瘤,瘤体PSR鉴别淋巴瘤与非淋巴瘤具有较高的效能,与陈杰云等[9]的研究结果不同,这可能与病例选择、处理方法及成像技术等有关。
总之,rCBV值和PSR对3种肿瘤的鉴别有重要意义,前者反映肿瘤血管化程度,后者反映血脑屏障破坏情况,二者联合应用更有助于3种肿瘤的鉴别。
[1] Burger PC. Malignant astrocytic neoplasms: Classification, pathologic anatomy, and response to treatment. Semin Oncol, 1986,13(1):16-26.
[2] 姜新雅,仇斌,王维.星形细胞瘤相对脑血容量与肿瘤血管生成的相关性研究.中国医学影像技术,2006,22(3):401-404.
[3] 张仙海,高明勇,周新韩,等.MR灌注加权成像和磁敏感加权成像评价胶质瘤.中国医学影像技术,2013,29(12):1937-1940.
[4] Liao W, Liu Y, Wang X, et al. Differentiation of primary central nervous system lymphoma and high-grade glioma with dynamic susceptibility contrast-enhanced perfusion magnetic resonance imaging. Acta Radiol, 2009,50(2):217-225.
[5] Law M, Cha S, Knopp EA, et a1.High-grade gliomas and soliaty metastases: Differentiation by using perfusion and proton spectroscopic MR imaging. Radiology, 2002,222(3):715-721.
[6] 张皓,沈天真,陈星荣,等.MR灌注成像在鉴别单发脑转移瘤与高级别胶质瘤中的价值.中华放射学杂志,2006,40(4):393-396.
[7] 杨向丽,张辉,梁丽,等.动态磁敏感对比增强灌注技术在脑肿瘤鉴别诊断中的价值.中西医结合心脑血管病杂志,2011,9(3):319-321.
[8] Xing Z, You RX, Li J, et al. Differentiation of primary central nervous system lymphomas from high-grade gliomas by rCBV and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. Clin Neuroradiol,2014,24(4):329-336.
[9] 陈杰云,林晓莹,陈向荣,等.MR灌注加权成像鉴别诊断单发脑转移瘤与高级别胶质瘤.中国医学影像技术,2015,31(2):215-218.
[10] 张晓琦,李永丽,窦社伟,等.动态对比增强MRI在胶质母细胞瘤与脑转移瘤鉴别诊断中的应用.中华放射学杂志,2015,49(6):410-413.
[11] Deckert M, Engert A, Bruck W, et al. Modern concepts in the biology,diagnosis,differential diagnosis and treatment of primary central nervous system lymphoma. Leukemia, 2011,25(12):1797-1807.
[12] Lupo JM, Cha S, Chang SM, et al. Dynamic susceptibility-weighted perfusion imaging of high-grade gliomas: Characterization of spatial heterogeneity. AJNR Am J Neuroradiol, 2005,26(6):1446-1454.
[13] Cha S, Lupo JM, Chen MH, Lamborn KR, et al. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. AJNR Am J Neuroradiol, 2007,28(8):1078-1084.
天津市卫生局重点攻关基金(12KG115)、天津市科委科技支撑项目重大抗癌专项基金(12ZCDZSY17700)。
卢昊(1986—),男,天津人,在读硕士,技师。研究方向:神经影像学。E-mail: luhaomr23@sina.com
韩彤,天津市环湖医院磁共振室,300350。E-mail: mrbold@163.com
2017-01-03
2017-06-05
DSC-MRI鉴别诊断胶质母细胞瘤、单发脑转移瘤及脑淋巴瘤
卢 昊1,2,冯全志1,程乾胜2,丁 岩2,李代斌2,李雨格2,韩碧辉2,韩 彤2*
(1.天津医科大学研究生院,天津 300060;2.天津市环湖医院磁共振室,天津 300350)
目的 探讨动态磁敏感对比增强磁共振成像(DSC-MRI)鉴别诊断胶质母细胞瘤、单发脑转移瘤及脑淋巴瘤的价值。方法 回顾性分析经活检或术后病理证实的胶质母细胞瘤患者17例、单发脑转移瘤患者15例、淋巴瘤患者17例。患者术前均接受MRI常规平扫、增强及DSC-MRI扫描,获得脑血容量(CBV)伪彩图及时间-信号强度曲线,分别测量瘤体、瘤周水肿区及对侧正常白质区的CBV值,计算相对脑血容量(rCBV)值和瘤体的信号强度恢复百分比(PSR)。应用ROC曲线分析各指标对3种肿瘤的诊断效能。结果 胶质母细胞瘤、单发脑转移瘤及脑淋巴瘤均表现为肿瘤实性区域明显强化伴瘤周水肿。瘤体rCBV除胶质母细胞瘤与单发脑转移瘤无差异外,余两两比较差异均有统计学意义(P均<0.05);瘤周rCBV除单发脑转移瘤与淋巴瘤无差异外,余两两比较差异均有统计学意义(P均<0.05);瘤体PSR值除胶质母细胞瘤与单发脑转移瘤无差异外,余两两比较差异均有统计学意义(P均<0.05)。ROC曲线示瘤体PSR为鉴别淋巴瘤及非淋巴瘤的最佳指标,敏感度、特异度分别为100%和81.3%;瘤周rCBV为鉴别胶质母细胞瘤及单发脑转移瘤的最佳指标,敏感度、特异度分别为94.1%和86.7%。结论 rCBV和PSR结合可提高鉴别诊断3种脑肿瘤的效能。
胶质母细胞瘤;单发脑转移瘤;淋巴瘤;磁共振成像
R739.41; R445.2
A
1003-3289(2017)08-1185-05
10.13929/j.1003-3289.201701139
猜你喜欢
杂志排行
中国医学影像技术的其它文章
- Progresses of CAIPIRINHA-Dixon-TWIST-VIBE in diagnosis of small hepatocellular carcinoma
- Automatic infant brain segmentation based on diffusion tensor imaging
- Quantitative analysis of left ventricle myocardial fibrosis in patients with atrial fibrillation by cardiac MRI
- Comparative analysis of paravertebral lymphatic trunk by MR lymphangiography between intradermal and subcutaneous injection of Gadodiamide in rabbits
- Application value of Doppler ultrasound in early active axial spondyloarthropathy
- Percentage of attenuation drop of intra-mural coronary segment at diastolic phase coronary CTA in prediction of significant systolic compression of myocardial bridge
