尿基肥料中缩二脲含量测定及国际标准制定研究*
2017-08-31章明洪储德韧
章明洪,储德韧,刘 刚
(上海化工研究院有限公司,国家化肥质量监督检验中心〔上海〕 上海 200062)
尿基肥料中缩二脲含量测定及国际标准制定研究*
章明洪,储德韧,刘 刚
(上海化工研究院有限公司,国家化肥质量监督检验中心〔上海〕 上海 200062)
研究开发了利用高效液相色谱法测定尿基肥料中缩二脲含量的新方法。该方法采用的氨基色谱柱能有效地将缩二脲与其他脲基缩合物及干扰物质分离,解决了国家标准《复混肥料(复合肥料)中缩二脲含量的测定》(GB/T 22924—2008)在实施过程中存在的问题。通过对标准物质和一系列有代表性的肥料样品的系统性试验分析,验证了该新方法的适用性、准确度和精密度。通过组织国内外13家分析实验室进行的国际实验室间比对,统计结果表明该新方法适用性广且精密度高,因而被推荐作为新的国际标准。
缩二脲;尿基肥料;国际标准;高效液相色谱法
缩二脲是尿素经由高温(接近或超过尿素的熔点132 ℃)下脱氨产生不稳定中间体氰酸,然后进一步与尿素反应形成的一系列脲基缩合物的一种,此类脲基缩合物通常还包括缩三脲、N,N- 亚甲基二脲等[1- 2]。在尿素熔融法生产复混肥料工艺中,如果反应温度过高且反应时间过长,常导致最终产品中缩二脲含量较高(质量分数>1.5%)[3]。许多研究表明,施于土壤或作物叶面的高浓度缩二脲会对作物体内氮素的代谢及蛋白质的合成造成干扰,从而对作物生长产生抑制作用[1- 2],对作物种子发芽及幼根生长的危害尤为显著[4]。近年来,尿素及尿基肥料(包括脲醛缓释肥料、尿素硝铵溶液、硫包衣尿素、尿基复合/复混肥料等)在全球范围内日益成为最主要的氮素肥料,由施用上述尿素及尿基肥料带来的缩二脲危害作物的问题越来越受到人们的关注[5],业内对肥料中缩二脲含量检测技术的要求也与日俱增[6]。
目前,国际上通用的缩二脲测定方法主要包括两大类。一大类是基于缩二脲等物质在溶液中与Cu2+形成有色配合物的双缩脲反应,采用分光光度法(直接法)或原子吸收光谱法(间接法)检测缩二脲- Cu2+复合物浓度,再换算成缩二脲的质量分数。我国现行国家标准《复混肥料(复合肥料)中缩二脲含量的测定》(GB/T 22924—2008)和农业行业标准《复混肥料中缩二脲含量的测定 分光光度法》(NY/T 1376—2007)、美国公职分析化学家协会(AOAC)标准方法960.04和976.01以及欧盟标准EN 15479:2009都采用类似方法作为标准分析方法。此类方法通常需要在试验中配制含有Cu2+的显色试剂,样品前处理费时费力[2],且含有酰胺键的不少脲基缩合物都有可能与Cu2+形成不同的有色配合物而干扰测定[7],有许多国家正在寻求替代方法。另一大类方法是利用液相色谱分离缩二脲后再采用紫外检测器直接进行测定,该方法的发展得益于高效液相色谱技术的发展,有望实现对缩二脲的直接定量[8]。当前国内外对液相色谱法开展的前沿研究较多,但该方法在样品适用性、杂质干扰下的稳定性方面存在一些缺陷[7- 8],目前只有我国的国家标准GB/T 22924—2008采用此法作为缩二脲测定的标准方法。
在国家标准GB/T 22924—2008的具体实践过程中,试验发现该标准中采用的液相色谱法尽管能够有效地测定绝大多数肥料中的缩二脲含量,但也存在如下问题:①该方法中采用的十八烷基硅烷键合硅胶填料(C18)色谱柱是反相色谱中最常用的通用型色谱柱,适用于分离非极性或弱极性的有机化合物,由于其并非是为分离含有酰胺键的化合物而专门设计的,因此在实际使用中对分离缩二脲、缩三脲、N,N- 亚甲基二脲等含有酰胺键的脲基缩合物效果不佳,直接影响了肥料中缩二脲含量测定的准确程度;②按照标准采用C18色谱柱在波长200 nm下检测含有硝酸根的肥料样品时,由于硝酸根在该波段有强烈的紫外吸收[9],导致硝酸根与缩二脲的分离效果不佳,出现硝酸根干扰缩二脲测定的现象,这一现象在测定尿素硝铵溶液、含硝态氮的尿基复混/复合肥时经常出现,极大地限制了该标准方法的适用性。
针对上述存在的问题,利用专门为分离极性化合物(特别是含有酰胺键的化合物及糖类)设计的氨基色谱柱,研究开发了缩二脲液相色谱测定新方法,并以此为基础向国际标准化组织——肥料和土壤调理剂标准化技术委员会提出了建立缩二脲测定国际标准的工作提案,项目申请获得了投票批准。新的测定方法可有效地将缩二脲与其他脲基缩合物及干扰物质分离,并通过对标准物质和一系列有代表性的肥料样品的系统性试验分析,证实了该方法具有较宽的线性范围、较高的准确度和精密度。经国际标准化组织——肥料和土壤调理剂标准化技术委员会的推荐,由上海化工研究院有限公司牵头组织了国内外13家分析实验室进行了国际实验室间比对,统计结果表明该方法的适用性广且精密度高,被推荐作为新的国际标准。
1 试验部分
1.1 方法提要
利用液相色谱法测定各种固体和液体尿基肥料中的缩二脲含量,肥料中的缩二脲由乙腈-水溶液(流动相)提取,采用氨基(氨丙基)色谱柱的反相液相色谱进行分离、紫外检测器测定,外标法计算缩二脲含量。
1.2 主要试剂与溶液
乙腈,HPLC级,德国Merck公司;超纯水,三级,Millipore制备;缩二脲标准物质,质量分数>99%,美国Sigma-Aldrich公司;参考物质分析纯缩二脲,质量分数>97%,美国Alfa Aesar公司。
流动相:850 mL乙腈+150 mL超纯水,使用前用0.22 μm滤膜过滤并超声脱气。
缩二脲标准溶液(0.5 mg/mL):称取0.500 0 g缩二脲标准物质并溶解于流动相中,然后移入1 000 mL容量瓶中,用流动相稀释至刻度,摇匀,静置。
1.3 主要仪器
高效液相色谱仪(含紫外检测器),Waters 1525- 2489- 2707,美国Waters公司;针状过滤器(包括0.22 μm有机相滤膜),上海安谱科学仪器有限公司;超声波清洗器,SK2510HP,上海科导超声仪器有限公司;试验筛,筛孔直径0.5 mm,湖南省常德粒度分析仪器厂。液相色谱-三重四级杆质谱联用仪:液相色谱,Shimadzu 20AD XR+UV,日本岛津公司;质谱,AB SCIEX Triple TOF®4600,美国AB SCIEX公司。
1.4 试验样品
方法开发与研制阶段使用的样品种类做到了尽可能覆盖各种固体和液体尿基肥料,包括3种不同来源的尿素、5种不同生产工艺及组分的复混肥料、1种氮磷钾(NPK)复合肥料、1种脲醛复合肥料、1种尿素硝铵溶液(UAN)、1种脲醛缓释液体肥料(Trisert®)、1种树脂-硫复合包衣尿素(PSCU),具体的肥料试验样品信息见表1。

表1 肥料试验样品信息
注:1)声明养分级别按N- P2O5- K2O标注; 2)样品编号以IRT开头的是作为国际实验室间比对的样品
1.5 分析步骤
1.5.1 试样制备
对于尿素,取缩分后的500 g样品作为试样;对于复混肥料,取缩分后的100 g样品研磨至粒径小于0.50 mm,混匀,置于洁净、干燥的瓶中;液体肥料直接取分装后的500 mL样品作为试样。
1.5.2 试样溶液的制备
称取试样0.1~0.5 g(精确至0.000 1 g,以含缩二脲1~2 mg为宜)置于25 mL的烧杯中,加入10 mL流动相,超声辅助溶解10 min,待冷却后移入25 mL容量瓶中,用流动相稀释至刻度,摇匀,静置;用0.22 μm有机相滤膜过滤,得试样溶液。
1.5.3 缩二脲工作标准溶液配制
在5个25 mL容量瓶中分别移取0.50,1.00,3.00,5.00和10.00 mL缩二脲标准溶液,用流动相稀释至刻度,摇匀,静置,然后用0.22 μm有机相滤膜过滤,得到缩二脲质量浓度分别为10.0,20.0,60.0,100.0和200.0 mg/L的系列缩二脲工作标准溶液,备用。
1.5.4 液相色谱及液相色谱-三重四级杆质谱分析条件
方法开发及验证中采用的典型液相色谱分析条件见表2,液相色谱-三重四级杆质谱分析条件见表3。

表2 液相色谱分析条件
注:1)如ThermoFisher公司的APS- 2 Hypersil柱(Part # 30705- 254630)或Phenomenex公司的Spherex NH2柱(Part # 00G- 00051- E0);在国际实验室间比对中,能够达到相同分析效果的氨基色谱柱都可使用
1.5.5 测定
标准曲线的绘制:参照1.5.4中的仪器操作条件,将液相色谱仪调节至最佳测定状态;分别将缩二脲工作标准溶液进样10 μL,每个浓度重复测定2次,以测得的峰面积均值分别对应缩二脲质量或浓度绘制标准曲线,求得线性回归方程。
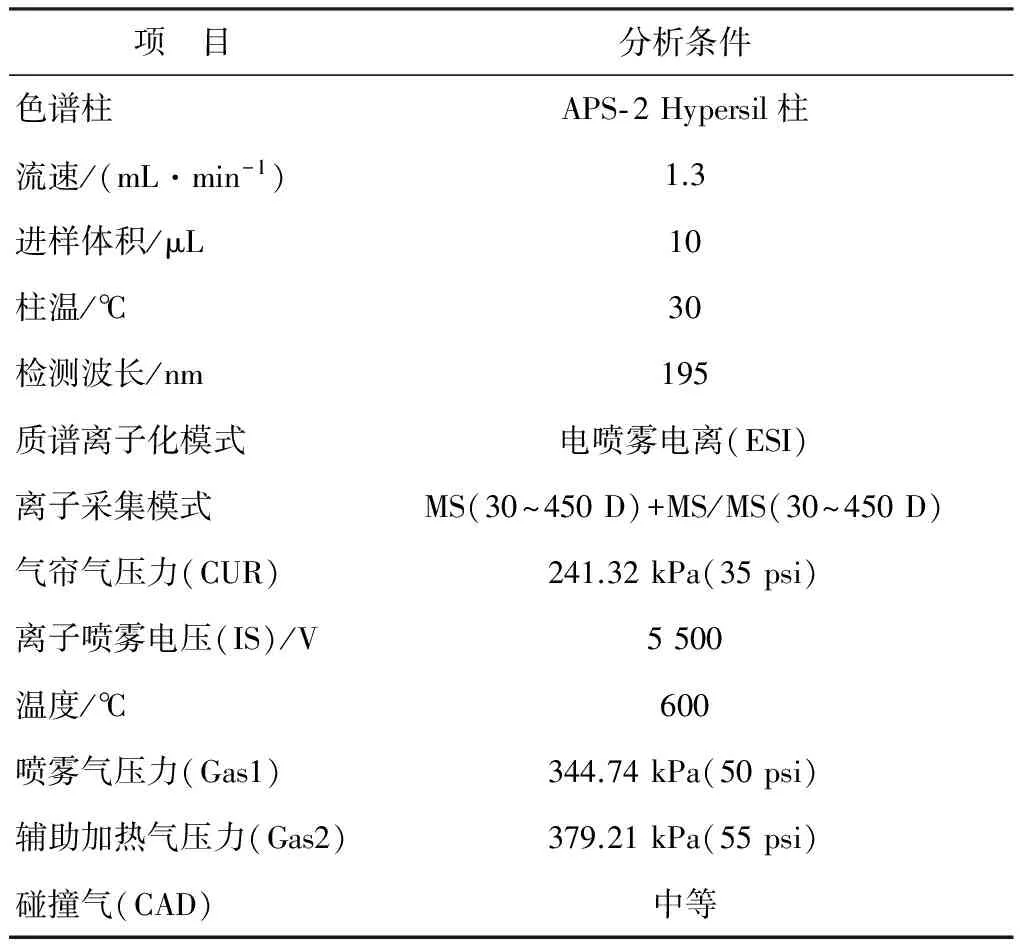
表3 液相色谱-三重四级杆质谱分析条件
试样溶液的测定:用测定工作标准溶液相同的操作条件对试样溶液进行测定,根据测得的峰面积,由标准曲线线性回归方程计算得到试样溶液中缩二脲的质量。
1.6 结果计算
缩二脲的质量分数w按式(1)计算:
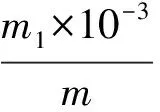
(1)
式中:m1——与试样溶液峰面积相对应的由标准曲线查得或由线性回归方程计算出的缩二脲质量,mg;
m——试样质量,g。
取平行测定结果的算术平均值为测定结果。
2 结果与讨论
2.1 色谱柱的选择试验
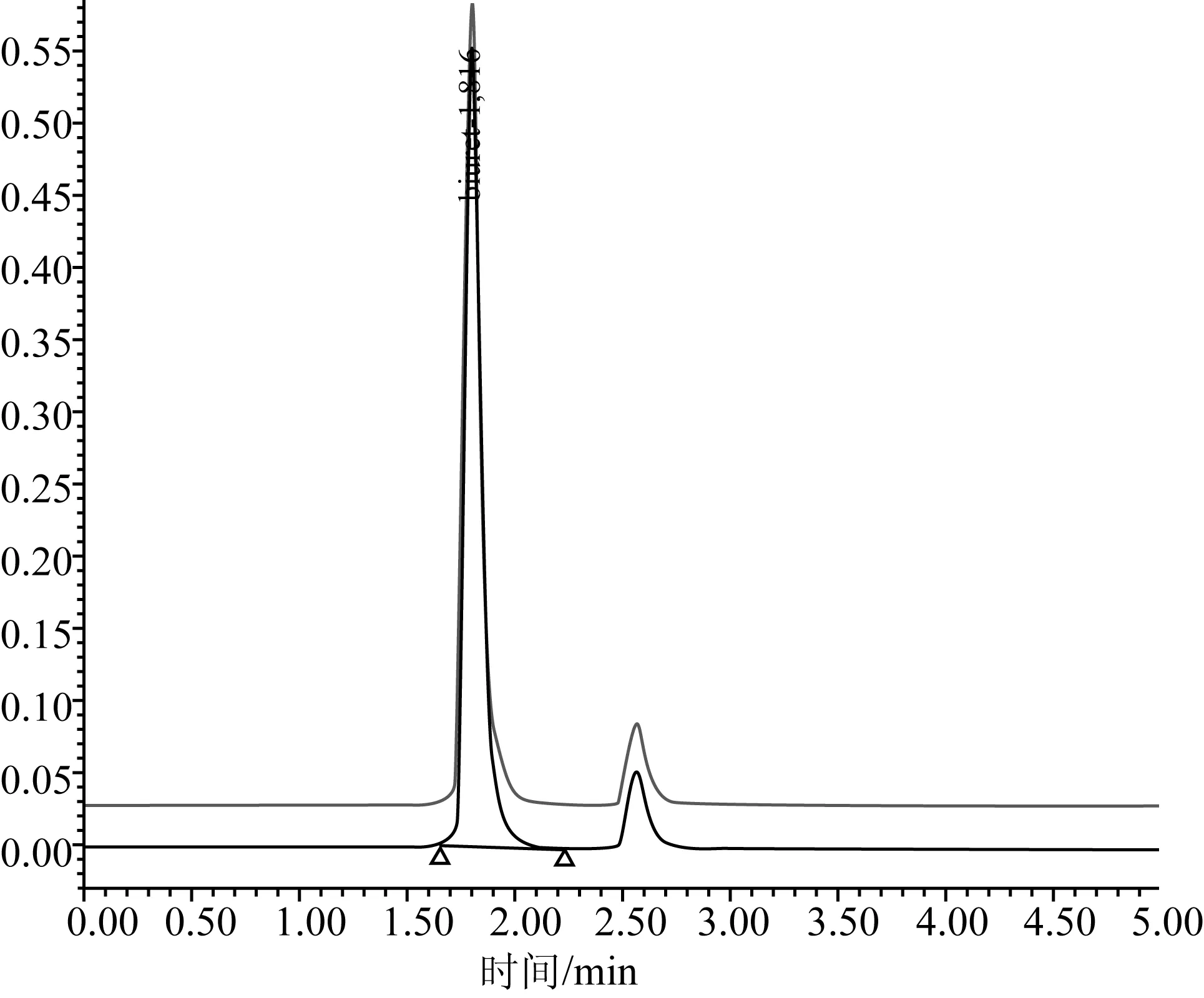
图1 C18色谱柱测定缩二脲参考物质的液相色谱图
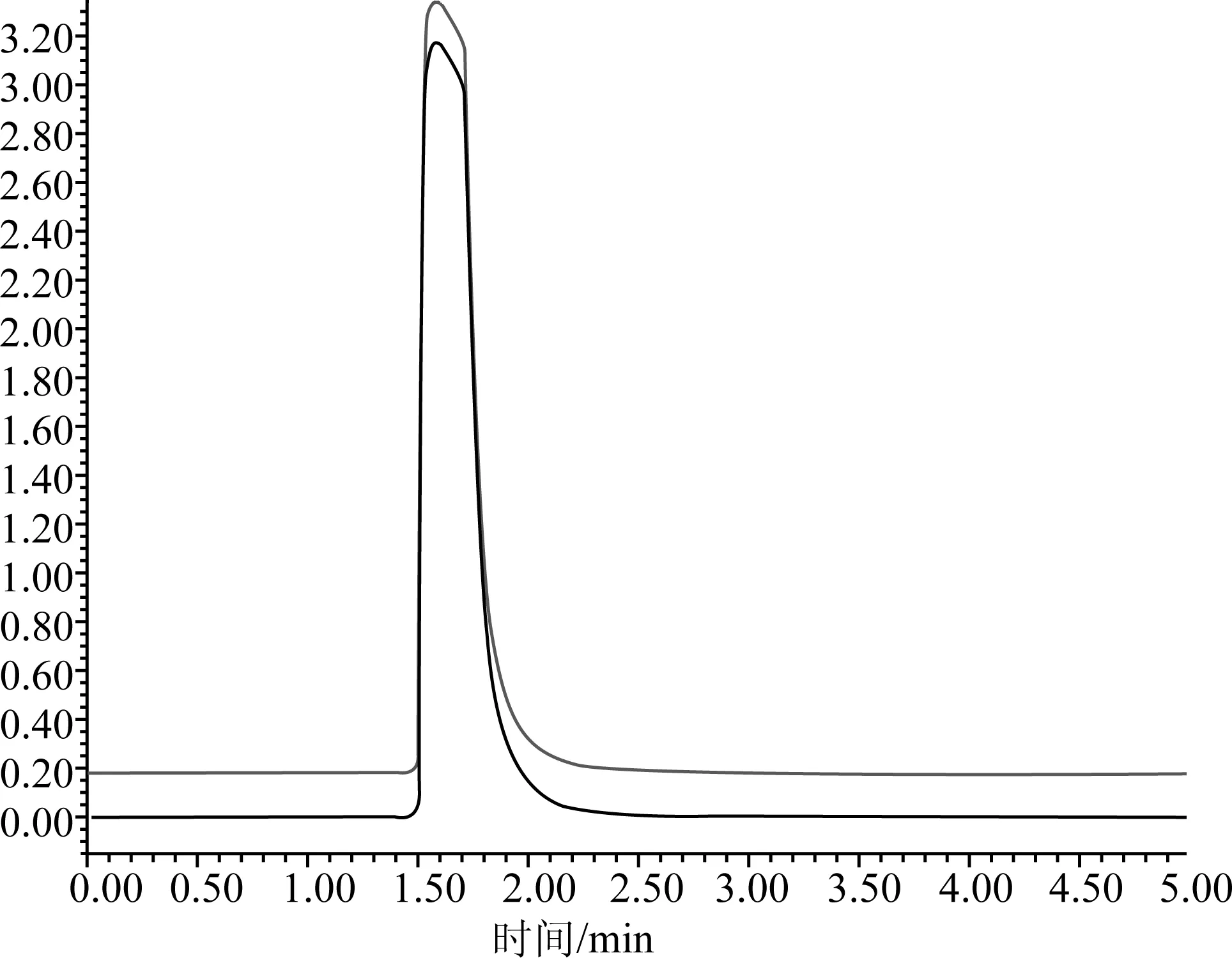
图2 C18色谱柱测定含有硝酸根肥料样品的液相色谱图
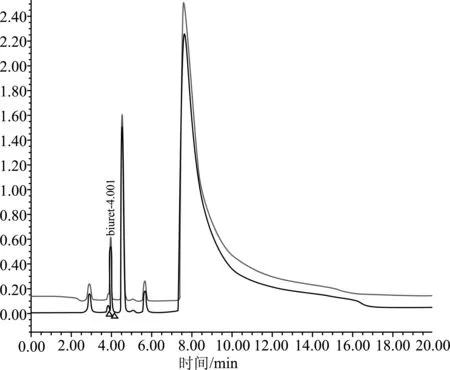
图3 氨基色谱柱测定含有硝酸根肥料样品的液相色谱图
在国家标准《复混肥料(复合肥料)中缩二脲含量的测定》(GB/T 22924—2008)实施过程中,发现标准中采用C18色谱柱在200 nm波长下检测含有硝酸根的肥料样品时,由于硝酸根在该波段有强烈的紫外吸收,导致硝酸根与缩二脲的分离效果不佳,出现硝酸根干扰缩二脲测定的现象,致使标准的适用性受到限制。如图1和图2所示,缩二脲的出峰时间在1.81 min左右,硝酸根在1.50~2.00 min有强吸收造成大的出峰包,缩二脲的出峰被包在其中,导致无法进行计算。试验选择了氨基色谱柱,其分离效果见图3,缩二脲的出峰时间在4.00 min左右,而硝酸根的出峰时间在8.00 min左右,缩二脲与硝酸根的出峰能有效分离,从而消除了硝酸根对缩二脲测定的干扰。同时与国外实验室进行了不同色谱柱测定肥料中缩二脲含量比对试验,结果见表4。
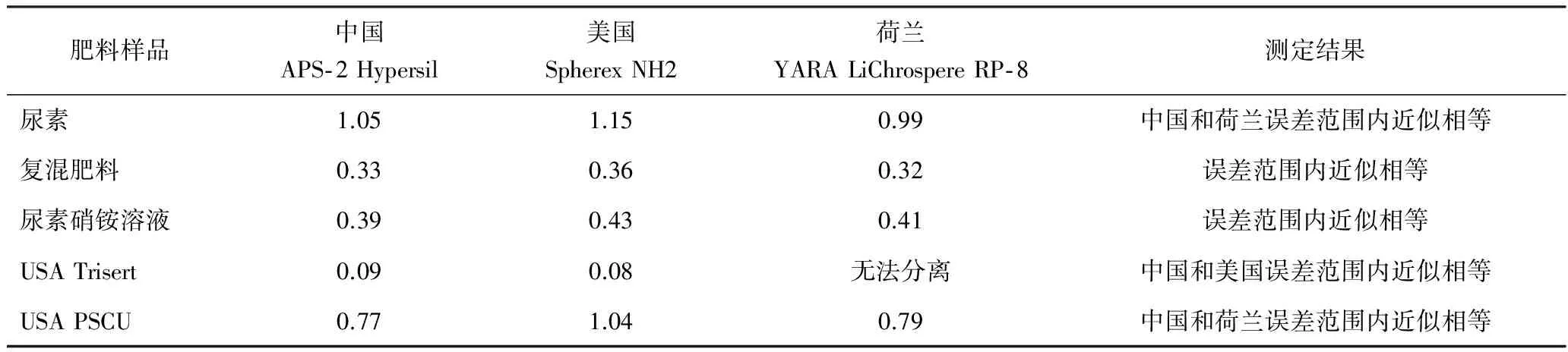
表4 国际实验室间不同色谱柱缩二脲质量分数测定比对试验 %
经综合比较,C18色谱柱无法检测含硝酸根肥料中的缩二脲含量,而氨基色谱柱可消除硝酸根对缩二脲测定的干扰,其中中国实验室选择的APS- 2 Hypersil色谱柱试验效果最理想。
2.2 液相色谱-质谱联用样品组分分析
为确认液相色谱对缩二脲、尿素及其他脲基缩合物的分离效果,采用液相色谱-质谱联用仪分析参考物质分析纯缩二脲及部分样品,试验结果如图4所示,其中:a为参考物质分析纯缩二脲;b为SLV- 054尿素样品;c为SLV- 114复混肥料样品;d显示了根据各谱峰的一级质谱(MS)和二级质谱(MS/MS)在正离子模式下拟合的化合物组成及其可能的裂分形式。
由图4中的谱图结果可知:保留时间(R.T.)为3.03~3.04 min的化合物在一级质谱中显示了母离子m/z=147,其二级质谱中出现了子离子m/z分别为130,104,87和61,对应化合物为缩三脲;保留时间(R.T.)为3.16~3.18 min的化合物在一级质谱中显示了母离子m/z=104,其二级质谱中出现了子离子m/z分别为87和61,对应化合物为缩二脲;保留时间(R.T.)为3.64~3.65 min的化合物在一级质谱中显示了母离子m/z=61,其二级质谱中未显示明显的子离子,根据已知结果推论对应化合物为尿素;保留时间(R.T.)为4.62~4.63 min的化合物在一级质谱中显示了母离子m/z=133,其二级质谱中出现了子离子m/z分别为73和61,对应化合物为N,N- 亚甲基二脲。试验结果表明,利用氨基柱可有效地分离尿素、缩二脲、缩三脲、N,N- 亚甲基二脲等组分,从而为采用该方法定量检测缩二脲,甚至在未来一次同时定量检测多种脲基缩合物提供了理论基础。
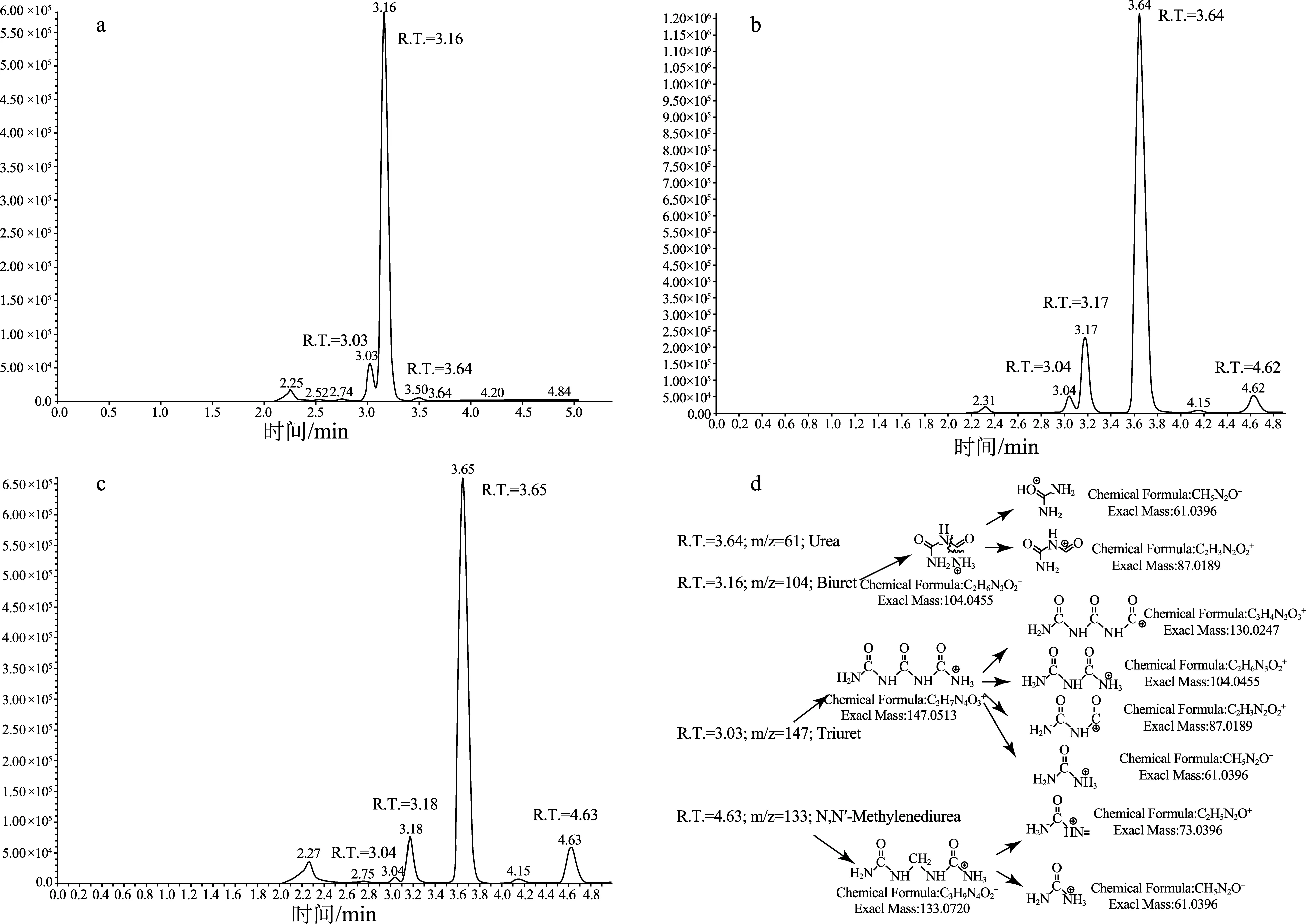
图4 参考物质分析纯缩二脲及部分试验样品的液相色谱图及质谱分析
2.3 标准曲线及线性范围
由缩二脲工作标准溶液进样所得的色谱图(图5内插图)可见,整个谱图仅见缩二脲的色谱峰,没有其他可见杂峰。由工作标准溶液进样所得标准曲线(图5)可知,缩二脲工作标准溶液在缩二脲质量浓度为0~200 mg/L范围内线性良好,相关系数R>0.999。
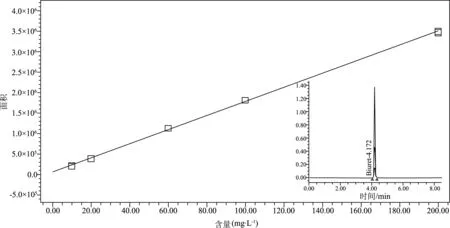
图5 缩二脲工作标准溶液色谱图及其标准曲线
2.4 方法准确度及适用性分析
为了验证本方法的准确度,选用1种尿素和2种复混肥料分别进行了加标回收率试验:将质量浓度分别为60,80和100 mg/L的缩二脲溶液加入3种试验样品中,检测加标样品中缩二脲的最终含量并计算回收率,试验结果见表5。
从表5可以看出:样品中不同浓度梯度的加标回收率在98.14%~107.24%范围内,符合美国公职分析化学家协会(AOAC)制定的关于方法准确度验证的相关要求,即测定样品的质量浓度在100 mg/L数量级时,回收率要求在85%~110%[10],表明该液相色谱方法的准确度较好。
为了验证硝酸根离子可以被有效分离,从而对该液相色谱法在195 nm波长下测定无干扰,在SLV- 114样品的加标回收率试验中额外加入了0.1 g硝酸铵,添加硝酸铵前后的SLV- 114样品的液相色谱图见图6。
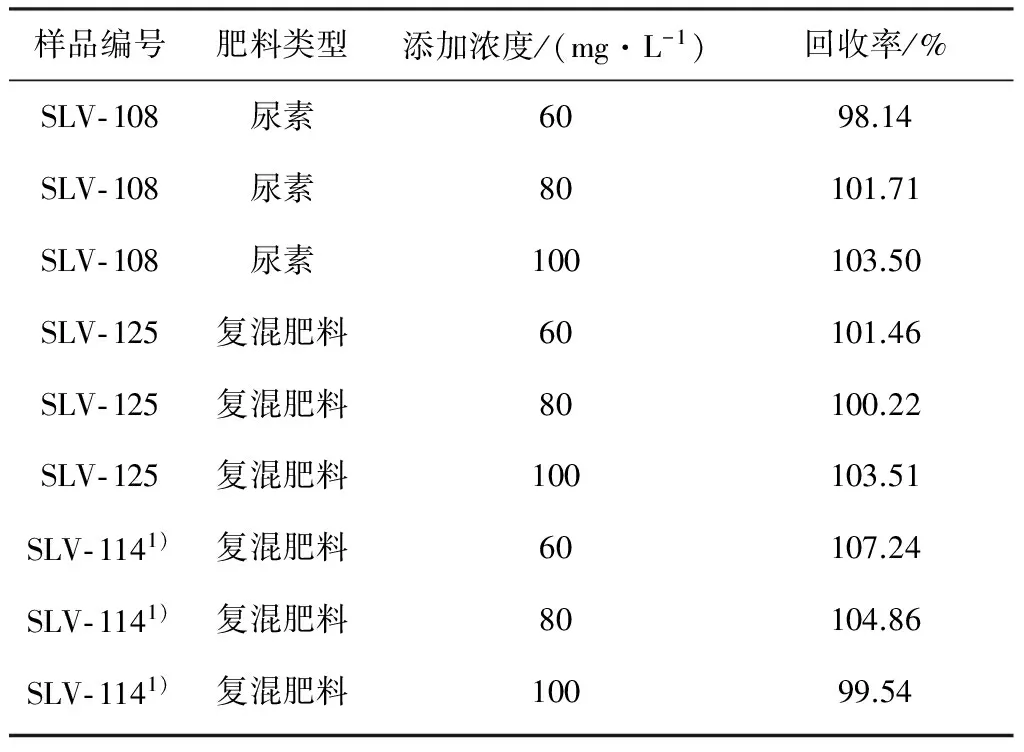
表5 试验样品加标回收率试验结果
注:1)额外加入了0.1 g硝酸铵
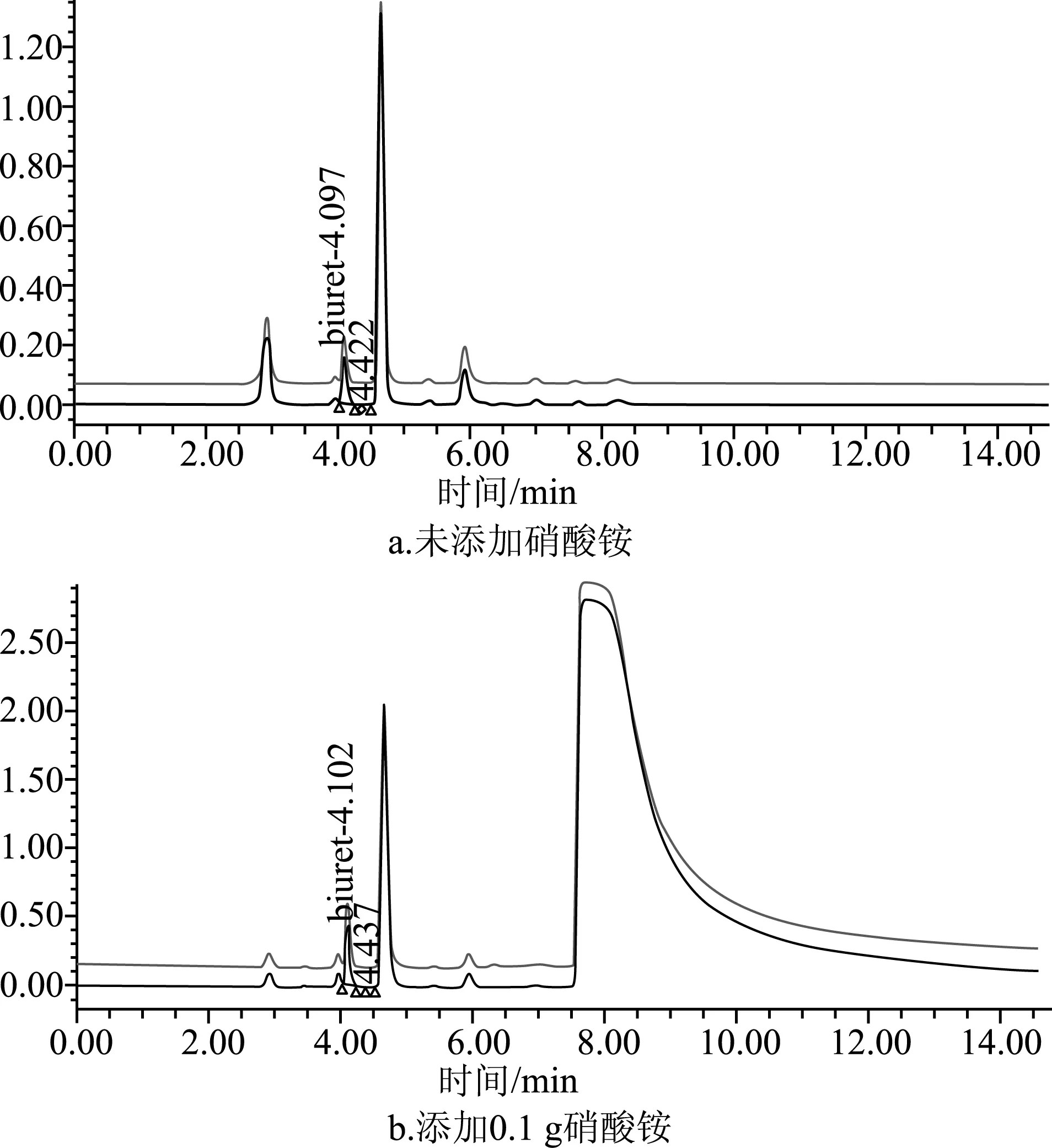
图6 添加硝酸铵前后的SLV- 114样品的液相色谱图
由图6可见,保留时间(R.T.)为4.10 min左右的化合物为缩二脲,添加的硝酸根在195 nm的紫外强吸收造成大的鼓包[9],但是硝酸根在7.80 min之后才出峰,完全不会影响缩二脲的定量测定。另外,图5所示在液相色谱-质谱联用仪上所得到的缩二脲保留时间与图6所示在液相色谱上有所不同,其原因是采用了不同的氨基柱和不同液相色谱仪死体积带来的,并不会影响定量分离和分析结论。
2.5 方法精密度分析
为验证该液相色谱法的精密度,选取了2种尿素和4种复混肥料样品,对每个肥料样品进行5次重复试验并计算平行试验结果的相对标准偏差,试验结果见表6。
从表6可看出:6个样品5次平行测定的相对标准偏差(RSD)在0.69%~1.85%,符合美国公职分析化学家协会(AOAC)制定的关于方法精密度验证的相关要求,即单个实验室验证中,对于1%浓度数量级的样品测定,要求方法精密度指标——相对标准偏差(RSD)不大于2%[10],表明该液相色谱法的精密度较好。
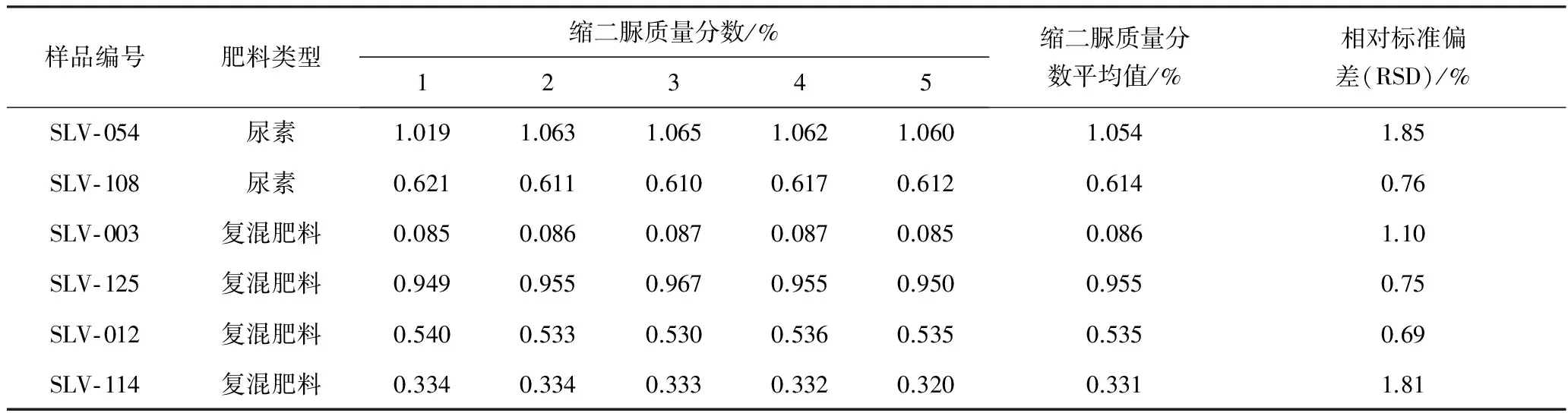
表6 方法精密度试验结果
2.6 国际实验室间比对研究
通过上述系统性的验证研究结果可以确认:新研究开发的液相色谱法采用氨基柱可有效地将缩二脲与其他脲基缩合物及干扰物质分离,并具有较宽的线性范围、较高的准确度和精密度。经国际标准化组织——肥料和土壤调理剂标准化技术委员会推荐,由上海化工研究院有限公司牵头组织了国内外13个实验室进行了实验室间比对活动,考察新方法的普适性和精密度(重复性与再现性),进而确认方法的有效性。试验样品包括NPK复混肥料(IRT- 001)、脲醛复合肥料(IRT- 002)、尿素(IRT- 003)、NPK复合肥料(IRT- 004)、尿素硝铵溶液(IRT- 005)、树脂-硫复合包衣尿素(IRT- 006)和脲醛缓释液体肥料(IRT- 007)共7个样品。
国际实验室间比对研究按国际标准项目制定程序进行,试验数据的统计分析依据ISO 5725- 2:1994《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》(以下简称ISO 5725- 2:1994第2部分)进行。13个实验室测定的7种肥料样品中的缩二脲质量分数原始数据见表7。
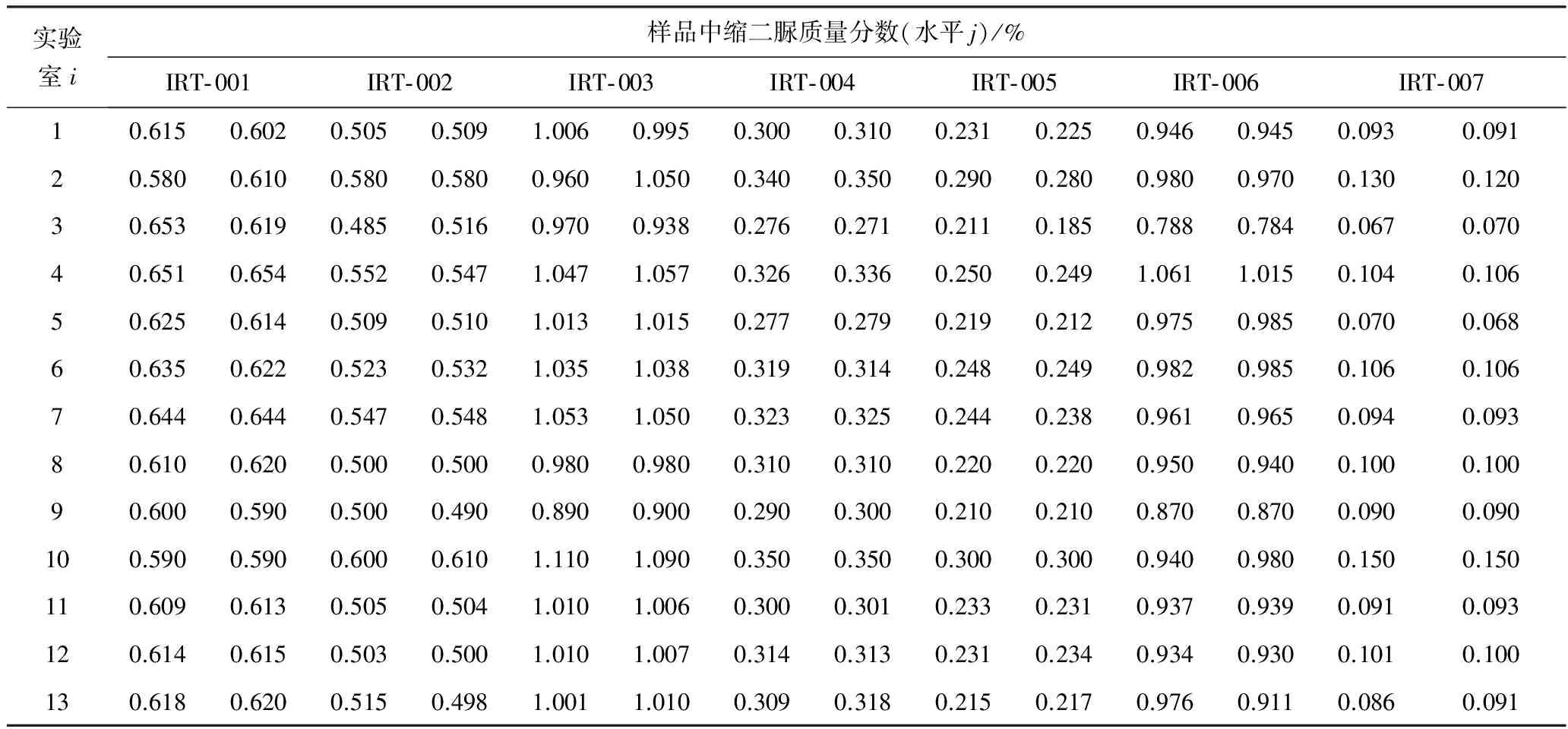
表7 13个实验室测定的7种肥料样品中的缩二脲质量分数原始数据
2.6.1 数据一致性和离群性检验
根据ISO 5725- 2:1994第2部分,在对采用实验室间比对所得到的测定数据进行平均值和精密度参数计算前,必须对数据的有效性(一致性)进行统计检验,剔除对结果可能造成干扰的离群值。
(1)Mandel检验
本研究首先采用Mandel的实验室间一致性统计量h和实验室内一致性统计量k来检验上述原始数据的一致性,即对每个实验室i的每个水平j计算实验室间的一致性统计量h和每个实验室内的一致性统计量k,以每个实验室的不同水平为一组(组内数据按缩二脲质量分数水平次序排列)进行描点作图,结果如图7和图8所示,图中水平虚线分别表示显著性水平为1%及5%时的Mandel统计量h与k的临界值。
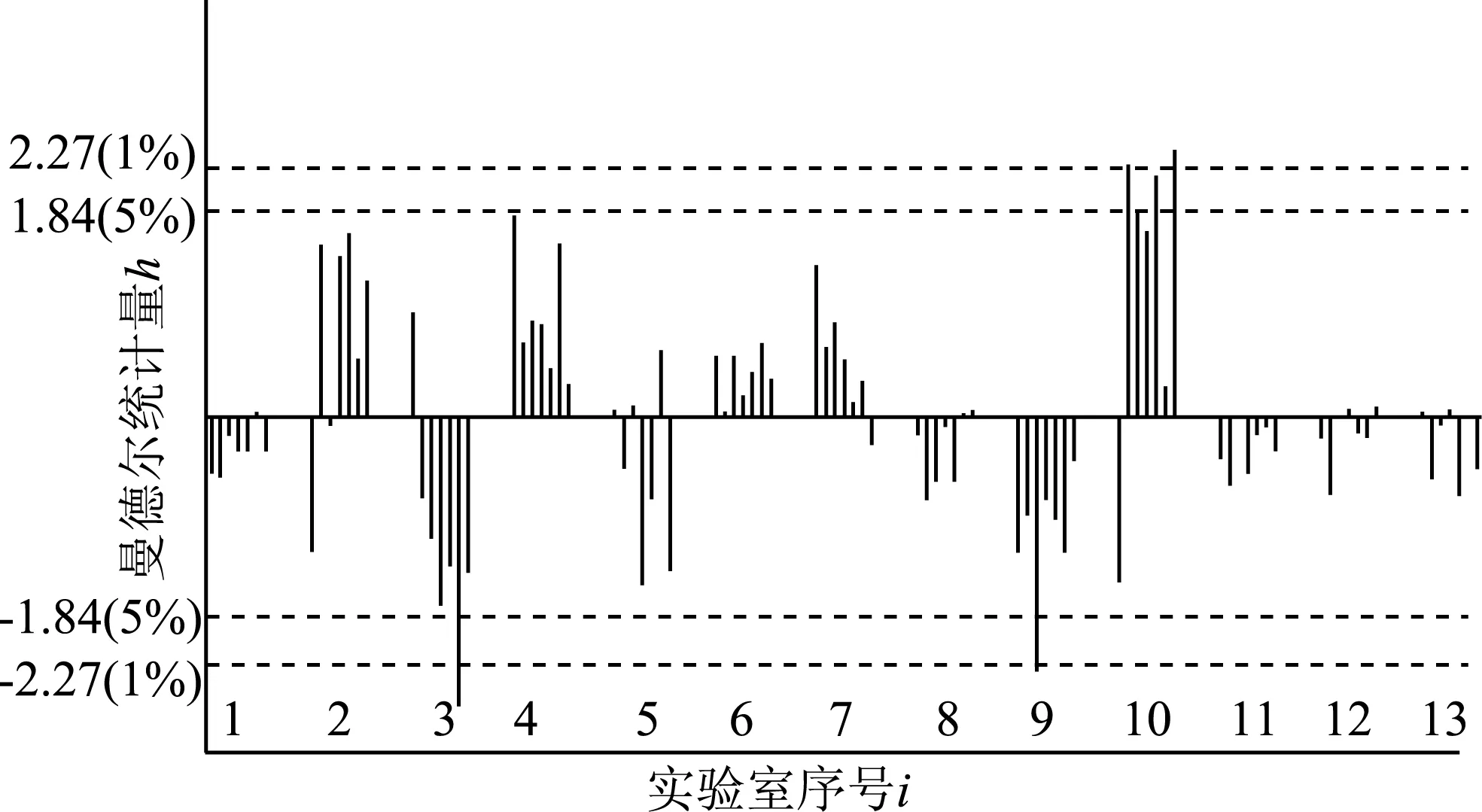
图7 按13个实验室进行分组的Mandel实验室间一致性统计量h
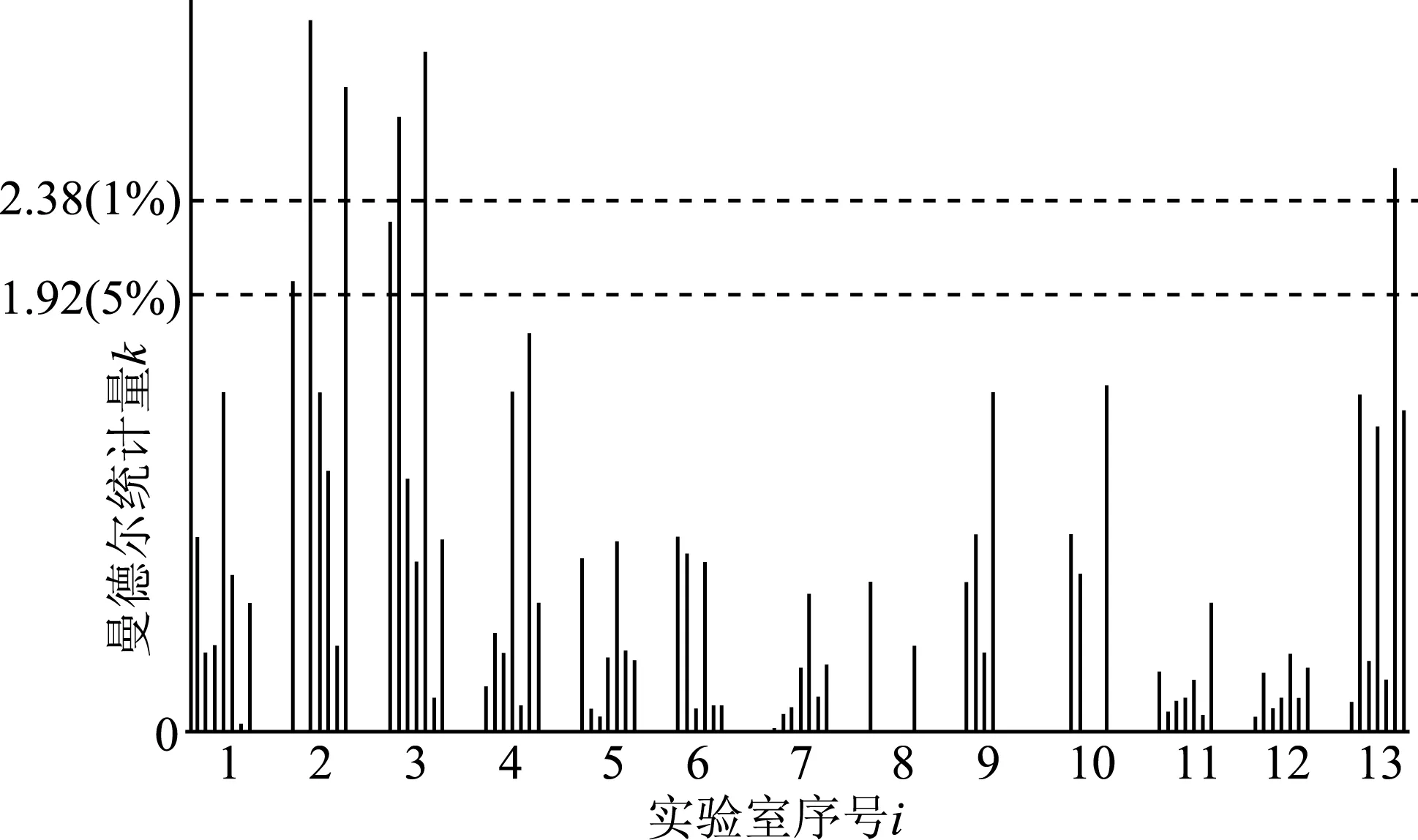
图8 按13个实验室进行分组的Mandel实验室内一致性统计量k
从图7可以看出,实验室10在样品水平IRT- 003和IRT- 005上出现岐离值;实验室3在样品水平IRT- 006、实验室9在样品水平IRT- 003、实验室10在样品水平IRT- 002和IRT- 007上分别出现了离群值。
从图8可看出:实验室2和实验室3在水平IRT- 001上的重复性测试结果有较大的变异;实验室2在水平IRT- 003和IRT- 007、实验室3在水平IRT- 002和IRT- 005、实验室13在水平IRT- 006上的重复性测试结果有很大的变异。
Mandel统计图提示需要采用数值离群检验法对上述数据作进一步分析。
(2)Cochran检验
实验室间比对数据有效性的一项重要假设是各参与实验室所提交数据的实验室内方差没有显著差异[11]。按ISO 5725- 2:1994第2部分的要求,首先采用针对实验室内一致性的Cochran检验法对各实验室的数据进行分析,如果计算所得Cochran统计量C大于置信水平5%临界值但小于等于置信水平1%临界值,则对应被检验项目为岐离值;若计算所得Cochran统计量C大于置信水平1%临界值,则对应被检验项目为离群值。针对13个实验室测定的缩二脲质量分数Cochran检验结果见表8。
从表8可发现,在水平IRT- 003,IRT- 005和IRT- 007上,Cochran统计量C的计算结果分别为0.812,0.741和0.670,超过了其离群临界值(0.624),表明针对这3个水平的样品测试中,有实验室的数据不能使用,此结果与从图8得到的直观结果基本符合。经进一步分析,实验室2在水平IRT- 003和IRT- 007以及验室3在水平IRT- 005所测数据的绝对差最大,应当拒绝这3个结果。
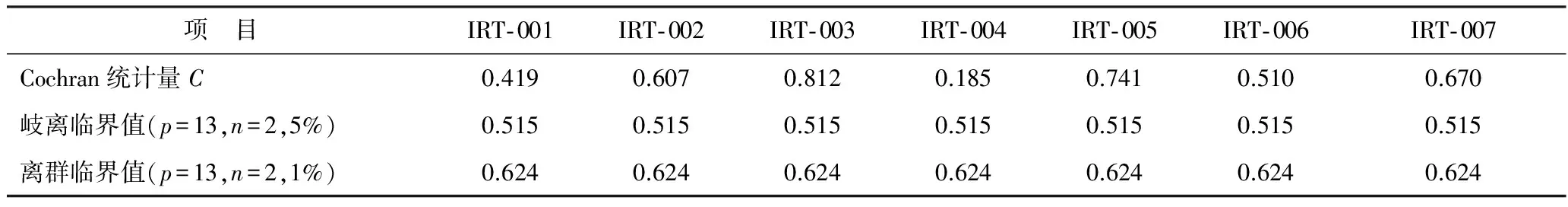
表8 针对13个实验室测定的缩二脲质量分数Cochran检验结果
舍弃3个离群数据后,对其余12个实验室在水平IRT- 003,IRT- 005和IRT- 007的测试值分别再次进行Cochran检验(p=12,n=2),计算得到的检验统计量分别为0.547,0.423和0.507,小于显著水平为1%时临界值0.653(p=12,n=2),故不再存在离群值。
(3)Grubbs检验
Grubbs检验是针对实验室间数据一致性进行的数理检验[12- 13],此处检验是针对通过Cochran检验后保留的数据,故其中在水平IRT- 003,IRT- 005和IRT- 007剩余12个数据。计算得到的Grubbs检验结果见表9。
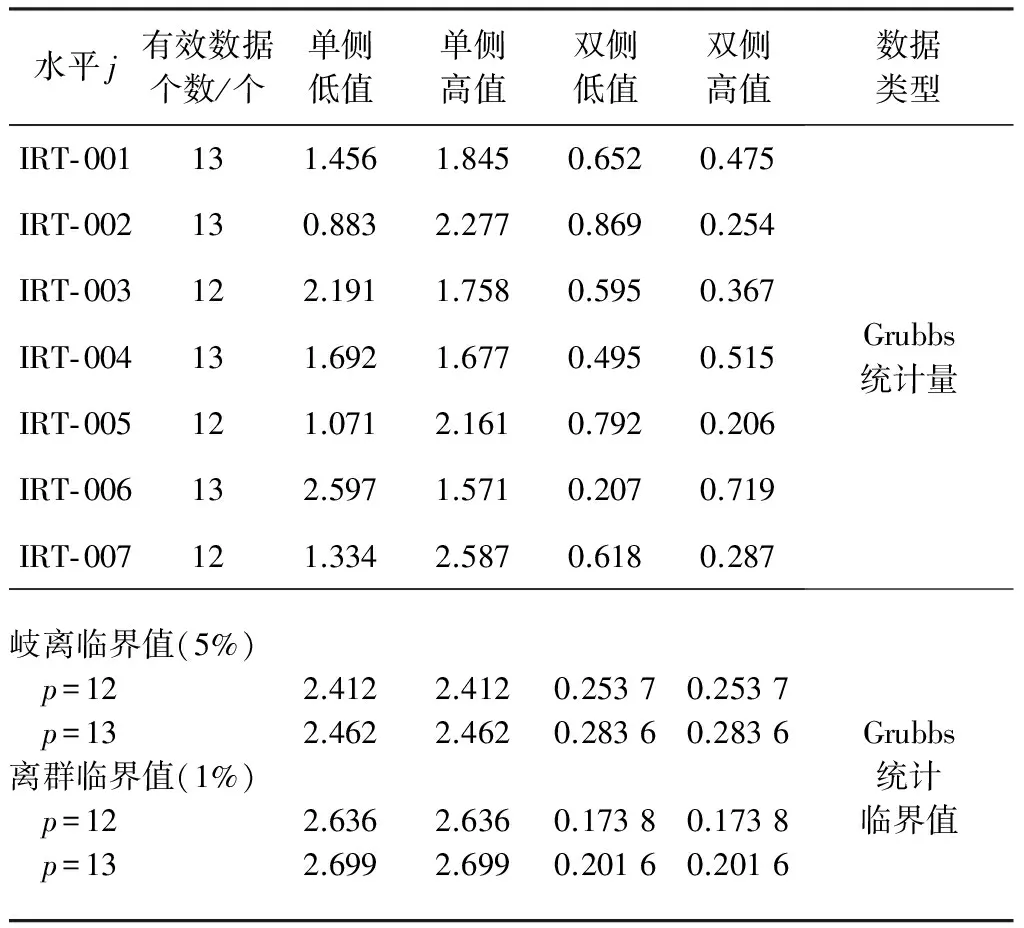
表9 针对13个实验室测定的缩二脲质量分数Grubbs检验结果
对于单侧离群值的Grubbs检验,如果计算所得Grubbs统计量G大于置信水平5%临界值为岐离值,大于置信水平1%临界值为离群值。对于双侧离群值的Grubbs检验,如果计算所得Grubbs统计量G小于置信水平5%临界值为岐离值,小于置信水平1%临界值为离群值。
表9表明,13个实验室的现存所有数据(经Cochran统计检验保留的有效数据)中不存在离群值,均为通过数理统计检验的有效数据。
2.6.2 平均值和标准差的计算分析
通过上述数据一致性和离群值的统计检验,将13个实验室采用研究开发的液相色谱法测定肥料中缩二脲质量分数的平均值(m)、重复性标准差(Sr)和再现性标准差(SR)进行了计算,结果如表10所示。
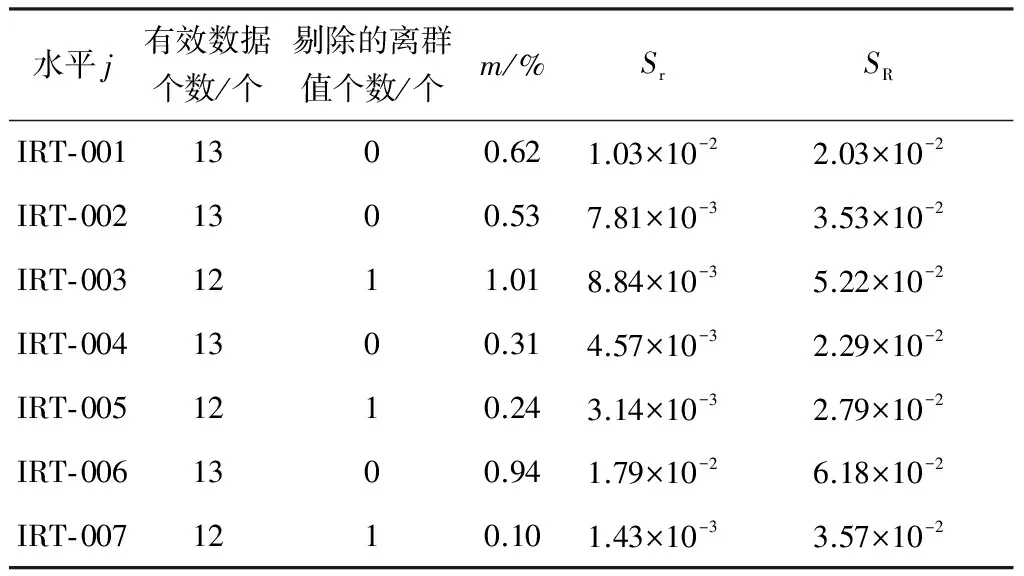
表10 13个实验室数据的平均值和标准差计算结果
考察表10中标准差与m的关系,发现标准差与m没有明显的线性或对数线性关系。根据ISO 5725- 2:1994第2部分的相关规定,可以采用所得各含量水平的Sr和SR的平均值来表征该方法的精密度,即对于试验缩二脲含量水平,该方法的重复性标准差Sr=7.71×10-3,再现性标准差SR=3.66×10-2。
2.6.3 参与比对实验室的反馈
通过国际实验室间比对活动,不仅考察了研究开发的液相色谱法的普适性及精密度,还在试验过程中得到了参与实验室的反馈意见,对该方法进一步规范化具有积极意义。
(1)部分参与实验室,如实验室12没有采用表2所推荐的氨基色谱柱,而是采用了GRACE(Alltima)Amino型氨基色谱柱,导致缩二脲等物质的保留时间与图5所示有差异。随后进行的统计表明,该实验室的数据通过了一致性检验,这进一步印证了表2中提及的能够达到相同分析效果的氨基色谱柱都可以使用。
(2)实验室7报告观测到样品IRT- 007树脂-硫复合包衣尿素的实测缩二脲含量随前处理过程中的超声时间不同有所差异,其原因可能是超声时间会影响样品中缩二脲的测定结果,这也是在标准中规定统一的超声时间为10 min的原因。
2.6.4 国际实验室间比对结论
为确定试验方法的精密度,对尿基肥料样品中的缩二脲含量开展国际间实验室比对试验,在试验方案实施过程中共征集到13个实验室并提供了试验结果。
对试验结果的精密度按ISO 5725- 2:1994第2部分进行统计,共发现有3个离群值,没有离群实验室,所产生的离群值是由随机误差引起的。精密度结果表明研究开发的高效液相色谱法测定肥料中缩二脲含量是可行的,各实验室间的测定值有较好的一致性,经统计得到的精密度结果能用来确定试验方法的重复性标准差和再现性标准差。
3 结语
通过对标准物质和一系列有代表性的肥料样品的系统性试验分析,验证了高效液相色谱法采用氨基色谱柱能有效地将缩二脲与其他脲基缩合物及干扰物质分离,具有较宽的线性范围、较高的准确度和精密度,从而建立了测定尿基肥料中缩二脲含量的新方法——高效液相色谱法。通过组织国内外13个分析实验室进行国际实验室间比对,统计结果表明该新方法适用性广且精密度高,因而被推荐作为新的国际标准。
[1] MIKKELSEN R L. Biuret in urea fertilizer[J]. Fertilizer Research,1990(1):311- 318.
[2] HOJJATIE M M, ABRAMS D. Validation for the determination of biuret in water- soluble, urea- based commercial inorganic fertilizer materials, urea solutions, and sulfur- coated urea products by reversed- phase liquid chromatography: single- laboratory validation of an extension of AOAC official method 2003.14.[J]. J AOAC Int,2014(3):712- 720.
[3] 奚振邦.现代化学肥料学[M].北京:中国农业出版社,2008.
[4] 李联铁,王正根,邹国纯.尿素和缩二脲含量对作物的双重毒害作用[J].西南农业大学学报(自然科学版),1993(6):546- 551.
[5] KHEMIRA H, SANCHEZ E, RIGHETTI T L, et al. Phytotoxicity of urea and biuret sprays to apple foliage[J]. Journal of Plant Nutrition,2000(1):35- 40.
[6] 邱娟,李海静,石念星,等.关于《复混肥料中缩二脲含量的测定》质量标准中液相色谱方法简介[J].山东化工,2010(3):46- 51.
[7] MACMAHON S, BEGLEY T H, DIACHENKO G W, et al. A liquid chromatography-tandem mass spectrometry method for the detection of economically motivated adulteration in protein- containing foods[J]. Journal of Chromatography A,2012(2):101- 107.
[8] MURRAY T P, AUSTIN E R, HOWARD R G, et al. Simultaneous determination of biuret, triuret, and methylenediurea in urea by reversed- phase liquid chromatography[J]. Analytical Chemistry,1982(9):1504- 1507.
[9] 赵晓煜,王洪涛.硝酸根离子在紫外区吸收光谱的研究[J].齐齐哈尔师范学院学报(自然科学版):1991(2):36- 38.
[10] Official Methods of Analysis of AOAC International: Appendix F: Guideline for Standard Method[M]. 19th ed. Gaithersburg:AOAC International,2012:1- 16.
[11] American Society for Testing and Materials. Standard Practice for Conducting an Interlaboratory Study to Determine the Precision of a Test Method: ASTM E691- 16[S]. Philadelphia: American Society for Testing and Materials,2016:1- 10.
[12] GRUBBS F E. Procedures for detecting outlying observations in samples[J]. Technometrics,1969(1):1- 21.
[13] GRUBBS F E, BECK G. Extension of sample sizes and percentage points for significance tests of outlying observations[J]. Technometrics,1972(4):847- 854.
DeterminationofBiuretContentinUrea-BasedFertilizersandtheDevelopmentofRelatedInternationalStandard
ZHANG Minghong, CHU Deren, LIU Gang
(Shanghai Research Institute of Chemical Industry Co., Ltd., National Center for Quality Supervision and Testing of Chemical Fertilizers 〔Shanghai〕, Shanghai 200062, China)
A new analytical method has been developed of determining the biuret content in urea- based fertilizers with high performance liquid chromatography. The new HPLC method utilizing amino column can effectively separate biuret from other urea- condensates and interfering substances, and thus can solve some practical problems encountered during the application of the national standard “GB/T 22924—2008 Determination of biuret content for compound fertilizers (complex fertilizers)”. Systematic experiments on both reference materials and a series of fertilizer samples have verified that the newly- developed method has good applicability, accuracy and precision. An international ring comparison test with 13 participating labs around the world has been conducted. Statistical analysis has revealed that the new method is both universal and precise, thus it is recommended as the next-generation international standard.
biuret; urea- based fertilizer; international standard; high performance liquid chro-matography
上海市科学技术委员会科研计划项目(15DZ0504700) 作者简介:章明洪(1968—),男,高级工程师,从事肥料质量监测及标准化工作;zmh@ghs.cn
O657.7+2
A
:1006- 7779(2017)03- 0001- 10
2017- 02- 15)
