具有相转移能力的PEG固载手性Salen Mn(Ⅲ)配合物及催化苯乙烯环氧化反应
2017-08-28周建波熊东路伏再辉邹帅崔小莹徐
周建波+熊东路+伏再辉+邹帅+崔小莹+徐超
摘 要 通过化学接枝或轴向配位将手性salen Mn (Ⅲ)配合物固载到具有溶剂控制相转移能力的PEG-400和PEG-800上.用UV-Vis, FT-IR, GPC和化学分析等表征手段对所得催化剂(PTC-1, PTCC-2, PTCC-3)的结构和性质进行表征.并以苯乙烯为反应底物,考察3种催化剂的催化性能.实验结果表明:3种催化剂能提供与传统均相手性salen Mn (Ⅲ)配合物相当的转化率和选择性,且对映体过量百分率(e.e.)略高;PTC-1和PTCC-2能重复使用3次,但PTCC-3重复使用性能不佳.
关键词 手性salen Mn(Ⅲ)配合物;溶剂相转移催化剂;环氧化反应;PEG
中图分类号 O614.81文献标识码 A文章编号 1000-2537(2017)04-0045-06
Abstract Salen Mn (Ⅲ) complexes were immobilzed onto PEG-400 and PEG-800 which had solvent controlled phase transfer capabilities by chemical grafting or axial coordination. The obtained catalysts (PTC-1, PTCC-2, PTCC-3) were characterized by UV-Vis, FT-IR, GPC and chemical analysis. Their catalytic activity was evaluated by asymmetric epoxidation of styrene. Our results showed that PTC-1, PTCC-2 and PTCC-3 offered similar conversion and selectivity, and slightly higher enantiomeric excess (e.e.) value compared to the traditional chiral salen Mn (Ⅲ). PTC-1 and PTCC-2 could be recycled for 3 times, but PTCC-3 is poor in reusability.
Key words chiral salen Mn(Ⅲ) complex; solvent controlled phase transfer catalyst; epoxidation; PEG
光學活性环氧化物是一类十分重要的有机化工中间体,通过开环反应和官能团转化反应可生成生物或药学上的重要化合物[1-2].催化非官能团烯烃的不对称环氧化反应是获得具有光学活性环氧化物的有效途径[3-5].其中Jacobsen报导的salen Mn(Ⅲ) 手性配合物[6]是催化非官能团烯烃环氧化反应的高效催化剂之一.均相salen Mn(Ⅲ) 配合物具有催化活性高、产物立体选择性好等优点,但是同时也具有稳定性差、回收使用困难、产物纯化难等缺点[7].为了解决这些问题,科学家们尝试利用化学接枝法或包络合法将salen Mn(Ⅲ) 配合物固载到无机载体或有机载体上制备多相催化剂[8-9].相比均相salen Mn(Ⅲ) 配合物,多相salen Mn(Ⅲ) 催化剂在反应过程中不能与反应底物混溶,显示出较低的催化活性.所以有必要开发更有效的salen Mn(Ⅲ)催化剂.
低分子量的聚乙二醇PEG-400和PEG-800是一类化学性质稳定、无色无臭、黏稠状液体[10-11],分子极性较大,易溶于水、醇、酮和CH2Cl2等极性溶剂,但是在烃类和醚类等弱极性溶剂中溶解性较差.笔者利用PEG-400和PEG-800作载体接枝手性salen Mn(Ⅲ)配合物,制备具有相转移能力(PTC)的环氧化催化剂.并用FT-IR,UV-Vis,GPC和化学分析法等表征手段对催化剂的结构和性质进行表征.以CH2Cl2为溶剂,苯乙烯为反应底物,考察所得催化剂的环氧化催化活性.再往反应体系中加入过量环己烷(调变溶液极性)以回收催化剂,即溶剂控制相转移,以实现催化剂的“一相反应,两相回收”的目标,并考察催化剂的回收使用性能.
1 实验部分
1.1 仪器和试剂
仪器:美国Nicolet公司生产的510P型FT-IR光谱仪,日本U-3310 Spectrophotometer紫外光谱仪,GPC液相色谱(Alltech, 美国),WZZ-2A自动旋光仪,美国Agilent-6890气相色谱仪.
试剂:PEG400,PEG800 (北京化工厂). 金属钠,乙酸锰(天津磊茂化学制剂厂). 水杨醛,氯化锂,多聚甲醛 (国药集团化学试剂有限公司). 3,5-二叔丁基水杨醛, 环己二胺,NaClO,Ph(IOAc)2 (Alpha公司).根据文献[12]合成4-氯甲基水杨醛.
1.2 催化剂的制备
1.2.1 PEG-S的制备 如图1,首先将PEG400 (4.0 g)和金属钠(0.46 g)加到100 mL三颈烧瓶中,混合物加热到60~70 ℃回流7~8 h,停止加热,冷却,过滤得到黑色粘稠状PEG400醇钠盐.再将所得的PEG400醇钠盐、4-氯甲基水杨醛(1.90 g )和无水THF(60 mL)加入到圆底烧瓶中常温搅拌反应3 h,黑色的PEG醇钠很快消失,并有淡黄色PEG-S生成,旋转蒸发掉溶剂,收集PEG-S,并用THF和水洗涤,真空干燥.
1.2.2 催化剂 PTC-1的制备 催化剂PTC-1的合成线路如图2所示. PEG-S(10 mmol) 和1,2-环己二胺(5 mmol) 在无水乙醇中加热回流6 h后形成配体L1.在氮气气氛中再将Mn(OAc)2·2H2O (8 mmol) 加入到反应体系中继续回流12 h,空气气氛下将LiCl (8 mmol) 加入混合物中继续加热回流4 h后,抽气过滤得棕色黏状物,THF洗涤,40 ℃温度下真空干燥即得催化剂PTC-1.
1.2.3 催化剂 PTCC-2的制备 催化剂PTCC-2的合成线路如图3所示[13].在0 ℃下将3,5-二叔丁基水杨醛的CH3Cl溶液(10 mmol, 10 mL) 逐滴加入到含有R,R-环己二胺的CHCl3溶液(12 mmol, 20 mL)中,混合物在0 ℃搅拌48 h后,旋转蒸发掉溶剂CHCl3得到黄色固体物,固体物用无水乙醇重结晶3次.再将所得固体和PEG-S(10 mmol)在无水乙醇下加热回流24 h即得配体L2,接下来L2与金属Mn配位得到催化剂PTCC-2,其具体过程与PTC-1制备过程一致,PTCC-2为棕色黏状物.
1.2.4 催化剂PTCC-3的制备 催化剂PTCC-3的合成线路如图4所示.首先按照PEG400醇钠盐的合成线路合成PEG800 醇钠盐,再根据文献[6]合成(R,R)-( N,N′)-双(3,5-二叔丁基水杨基)-1,2-环己二胺氯化锰(传统手性salen Mn催化剂).最后将PEG800 醇钠盐(1 mmol)和传统手性salen Mn催化剂(2 mmol)加入到60 mL无水THF中,加热回流反应4 h.所得产物旋摇蒸干得黑色蜡状固体催化剂PTCC-3.
1.3 催化剂的表征
配体和催化剂溶于乙醇中,在U-3310 Spectrophotometer紫外光谱仪(日本)上分析(扫描波长为200~800 nm).配体和催化剂用KBr压片,在美国Nicolet公司生产的Nicolet Nexus FT-IR红外光谱仪上摄取400~4 000 cm-1红外光谱图,分辨率为4 cm-1.样品溶于无水THF中,在美国Alltech 公司GPC液相色谱上测定相对分子质量(ELSD800检测器,Jordi Gel DVB10000A(300 mm×7.8 mm)色谱柱,THF为流动相,0.3 MPa氮气压力,40 ℃检测温度,流速为1 mL·min-1).样品溶于CH2Cl2中,用WZZ-2A自动旋光仪测定比旋光度.化学分析法测定各种催化剂的锰含量.
1.4 环氧化催化反应
将1 mmol苯乙烯,2.5 mmol氧化剂PhI(OAc)2,0.05 mmol 催化剂,5 mL CH2Cl2加入圆底烧瓶,室温下搅拌反应,定时取样检测.产品用Varian 3900 GC 和Saturn 2100 MS确定其结构(MS检测器,0.25 mm ×30 m型毛细管柱);产率和e.e值用Agilent-6890气相色谱仪检测(19091G-B213型手性柱(30 m×0.32 mm×0.25 μm),柱温为140 ℃,汽化室温度为250 ℃,FID检测器,N2为载气,流速为30 mL·min-1).
2 结果与讨论
2.1 催化剂表征
2.1.1 配体和催化剂的UV-vis表征 图5为各种催化剂和配体的UV-Vis图.很明显各种配体在330 nm附近有吸收峰,而催化剂在此处的吸收峰蓝移到320 nm附近.另外催化剂在440 nm附近出现了新的吸收峰,这可归属于金属-配体之间的电子转移吸收峰(MLCT)[14],从而证明配体和锰离子形成配位.
2.1.2 催化剂的FT-IR表征 各种相转移催化剂和传统手性salen Mn(Ⅲ)配合物的红外谱图如图6所示.催化剂PTC-1, PTCC-2和传统手性salen Mn(Ⅲ)配合物的红外谱图分别在1 612, 1 534, 544和425 cm-1显示出吸收峰,这些吸收峰分别归属于υ(CN),υ(C—O), υ(Mn—O)和υ(Mn—N).催化剂PTCC-3的红外谱图在1 612和1 534 cm-1附近同样显示出υ(CN)和υ(C—O),但是找不到明显的υ(Mn—O) 和υ(Mn—N).另外催化剂PTC-1, PTCC-2和PTCC-3在1 110 cm-1附近出现了强的吸收峰,这是PEG分子链中的C—O—C振动峰.从红外谱图结果可以看出: Salen Mn配合物成功接枝到了PEG400 和PEG800上;而且通过化学接枝合成的催化剂PTC-1和PTCC-2比轴向配位合成的催化剂PTCC-3可能更稳定[15].
2.1.3 催化剂的锰含量、平均分子量(GPC)和比旋光度([α]20D)的表征结果 表1列出了各种催化剂的Mn含量,平均分子量和比旋光度的测定结果,从测定结果可以看出Mn含量的实际测定结果与理论计算值很吻合.另外催化剂PTC-1, PTCC-2 和PTCC-3的相对平均分子质量的实际测定结果(1 228, 920和1 380 g·mol-1)与理论推算值(1 234.5, 934.5和1 398 g·mol-1)也很接近.催化剂PTCC-2和PTCC-3的比旋光度分别为+260° 和+325°.这些表征结果都进一步证实了salen Mn (Ⅲ) 配合物被成功接枝到PEG400 和PEG800上.
2.2 催化环氧化结果
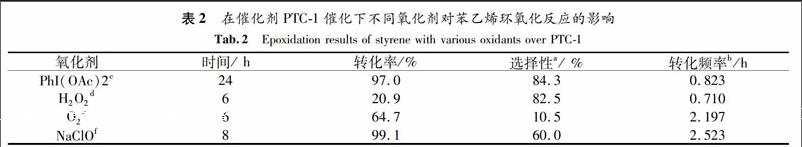
2.2.1 各类氧化剂的影响 以PTC-1为催化剂,考察了几种常见氧化剂对苯乙烯环氧化反应的影响(见表2).O2/牺牲醛-异丁醛和NaClO给出的转化频率(2.197/h和2.523/h )远远高于PhI(OAc)2 和H2O2 (0.823/h和0.710/h ).但是O2/牺牲醛-异丁醛给出了最低的选择性(主要产物为苯甲醛),而PhI(OAc)2却显示出最高的选择性(84.3%)和第二高的转化率(97.0%).所以综合考虑转化频率、转化率和选择性,笔者选择PhI(OAc)2为氧化剂来评价其他催化剂的环氧化催化性能.
a 通过GC-MS检测苯甲醛和苯乙醛为主要副产物.
b转化频率=(n苯乙烯×轉化率) /(n催化剂×相对平均分子质量× Mn含量× 时间 (h)).
c反应条件: 苯乙烯:0.5 mmol, PhI(OAc)2:1 mmol, 溴苯:0.5 mmol, PTC-1: 0.025 mmol, CH2Cl2:5 mL,温度 25 ℃.
d反应条件: 苯乙烯:0.5 mmol, 30% H2O2:1.2 mmol, NaHCO3:0.05 mmol, PTC-1: 0.025 mmol, 温度:0 ℃.
e反应条件: 苯乙烯:0.5 mmol, 异丁醛:1.25 mmol, PTC-1:0.025 mmol, CH2Cl2:5 mL, 温度:25 ℃.
f反应条件: 苯乙烯:0.5 mmol, NaClO: 1.2 mmol, PTC-1:0.025 mmol, CH2Cl2: 5 mL, pH=11.3, 温度: 0 ℃.
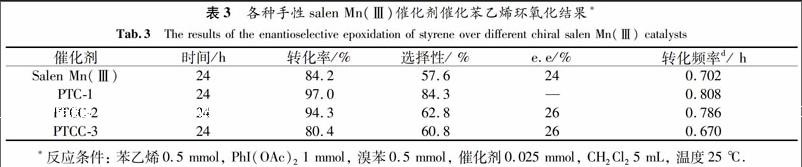
2.2.2 各种催化剂催化苯乙烯环氧化反应结果 以PhI(OAc)2为氧化剂,考察PTC-1, PTCC-2, PTCC-3和传统均相手性Salen-Mn配合物的催化活性,其催化结果如表3所示.在相同条件下, PTC-1和PTCC-2显示出比传统催化剂更高的转化率(高出12.8%和10.1%)和选择性(高出26.7%和5.2%).PTCC-3给出稍低的转化率(低于3.8%)和稍高的选择性(高出3.2%).另外,PTCC-2和PTCC-3给出比传统手性催化剂略高的e.e.值(高出2%).从催化结果可以看出salen Mn (Ⅲ)配合物通过化学接枝或轴向配位已成功接枝到了PEG400和PEG800上,而且PTC-1, PTCC-2和PTCC-3在环氧化反应中起到了均相催化剂作用.
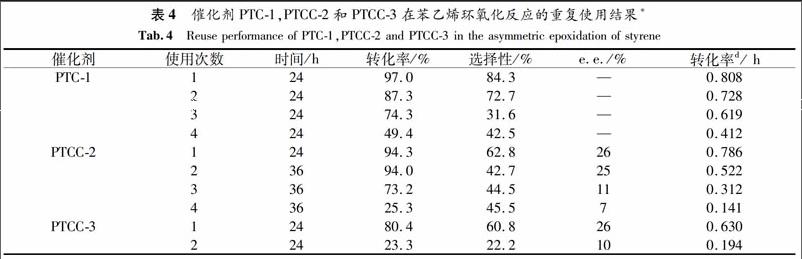
2.3 催化剂的重复使用性
往环氧化反应后的反应体系中加入过量的环己烷,隔夜后,有棕色的催化剂沉淀于容器底部或者粘附于瓶壁上.倾倒出溶剂,洗涤,回收催化剂,再真空干燥.称出催化剂的量,按比例加入苯乙烯、氧化剂、溶剂进行下一轮反应.表4 列出了3种催化剂的重复使用结果.催化剂PTC-1和PTCC-2在第一、第二次催化剂回收实验中转化率下降不多,但选择性急剧下降 (分别下降53.9%和18.3%),在第三次回收中转化率也下降很多(分别下降24.9%和48.2%).催化剂活性下降的原因可能是苯乙烯和醋酸碘苯反应后会产生PhI,PhI中I的配位能力很强,所以它有可能与催化剂活性中心Mn配位从而破坏催化剂结构[17].使用4次后催化剂PTCC-2的红外光谱的υ(Mn—O) 和υ(Mn—N)比没使用过的弱一些.另外催化剂PTCC-3 的重复使用性能比PTC-1和PTCC-2差.重复使用结果证明PTCC-3 的稳定性比PTC-1和PTCC-2弱,这与它们的结构也相符.因为PTCC-3中的salen Mn(Ⅲ)通过轴向配位与PEG键合,比较容易破坏,而PTC-1 和PTCC-2中的Salen Mn(Ⅲ)通过共价键接枝到PEG上,比较难被破坏[18-19].
3 结论
通过化学接枝和轴向配位分别将salen Mn(Ⅲ) 配合物固载到PEG400和PEG800上,合成了相转移催化剂PTC-1,PTCC-2和PTCC-3.采用UV-Vis, FT-IR,GPC和化学分析法等表征手段对所得相转移催化剂进行了表征.3种催化剂在苯乙烯的环氧化反应中具有与传统均相手性salen Mn (Ⅲ)配合物相当的催化活性,而且PTC-1和PTCC-2能重复使用3次,催化活性变化不大,但是PTCC-3的重复使用性不理想,这也说明通过化学接枝合成的催化剂PTC-1和PTCC-2比通过轴向配位合成的催化剂PTCC-3性能更稳定.
参考文献:
[1] CARITA A, BURTOLOSO A C B. An epoxide ring-opening approach for a short and stereoselective synthesis of icetexane diterpenoids[J].Tetrahedron Lett, 2010,51(1):99-101.
[2] YANG H, ZHANG L, SU W, et al. Asymmetric ring-opening of epoxides on chiral Co(Salen) catalyst synthesized in SBA-16 through the “ship in a bottle” strategy[J]. J Catal, 2007,248(2):204-212.
[3] BOGAERTS T, WOUTERS S, VOORT P V D. The enantioselectivity of the manganese-salen complex in the epoxidation of unfunctionalized olefins and the influence of grafting[J]. J Mol Catal A-Chem, 2015,406:106-113.
[4] JIA Z, DONG Y, ZHAO H, et al. Mesoporous material AlPS-BrPPAS derivatives supported chiral Mn(III) salen complex and highly efficient epoxidation of olefins as a recoverable catalyst[J]. Res Chem Intermediat, 2015,41(9):6169-6183.
[5] 謝 芳,伏再辉,衷 晟. 8-羟基喹啉双核钛配合物催化苯乙烯与双氧水的环氧化(英文)[J]. 湖南师范大学自然科学学报, 2009,32(1):83-87.
[6] JACOBSEN E N, ZHANG W, MUCI A R. Highly enantioselective epoxidation catalysts derived from 1,2-diaminocyclohexane[J]. J Am Chem Soc, 1991,113(18):7063-7064.
[7] LANG X D, YU Y C, HE L N. Zn-salen complexes with multiple hydrogen bonding donor and protic ammonium bromide: Bifunctional catalysts for CO2 fixation with epoxides at atmospheric[J]. J Mol Catal A-Chem, 2016,420:208-215.
[8] HUANG J, QI D W, CAI J L. Olefin epoxidation with chiral salen Mn(Ⅲ) immobilized on ZnPS-PVPA upon alkyldiamine[J]. RSC Adv, 2016,6(23):19507-19514.
[9] CHOUDARY B M, CHOWDARI N S, KANTAM M L. Silica gel anchored chiral Mn(Ⅲ) salen complexes for enantioselective epoxidation of unfunctionalised olefins[J]. Catal Lett, 2001,76 (3):213-218.
[10] MAO J, GUO J, FANG F. Highly efficient copper(0)-catalyzed Suzuki—Miyaura cross-coupling reactions in reusable PEG-400[J]. Tetrahedron, 2008,64(18):3905-3911.
[11] LI J H, HU X C, LIANG Y. PEG-400 Promoted Pd(OAc)2/DABCO-catalyzed cross-coupling reactions in aqueous media[J]. Tetrahedron, 2006,62(1):31-38.
[12] MINUTOLO F, PINI D, SALVADORI P. Polymer-bound chiral (salen) Mn(Ⅲ) complex as heterogeneous catalyst in rapid and clean enantioselective epoxidation of unfunctionalised olefins[J]. Tetrahedron Lett, 1996,37(19):3375-3378.
[13] KURESHY R I, KHAN NUH, ABDI SHR. Enantioselective epoxidation of non-functionalized alkenes using an urea—hydrogen peroxide oxidant and a dimeric homochiral Mn(Ⅲ)-Schiff base complex catalyst[J].Tetrahedron Asymm, 2001,12 (3):433-437.
[14] CHEN Y G, WANG M, JIN K. Synthesis and property of a chiral salen Mn(Ⅲ) complex covalently linked to an Ru(Ⅱ) tris(bipyridyl) photosensitizer[J]. Inorg Chem Commun, 2005,8(7):606-609.
[15] ZHANG H, ZHANG Y, LI C. Enantioselective epoxidation of unfunctionalized olefins catalyzed by the Mn(salen) catalysts immobilized in the nanopores of mesoporous materials[J]. J Catal, 2006,238(2):369-381.
[16] GIANLUCA P, MARCO C, FLAVIO C.Enantioselective catalysis in fluorinated media-synthesis and properties of chiral perfluoroalkylated (salen) manganese complexes[J]. Eur J Org Chem,1999,8:1947-1955.
[17] XIANG S, ZHANG Y, XIN Q. Enantioselective epoxidation of olefins catalyzed by Mn (salen)/MCM-41 synthesized with a new anchoring method[J]. Chem Commun, 2002,34(12):2696-2697.
[18] ZHANG H, XIANG S, LI C. Enantioselective epoxidation of unfunctionalised olefins catalyzed by Mn(salen) complexes immobilized in porous materials via phenyl sulfonic group[J]. Chem Commun, 2005,36(9):1209-1211.
