大果紫檀水浸液的荧光光谱研究
2017-08-07朱续娜张耀丽王翔
朱续娜,张耀丽,王翔
(南京林业大学材料科学与工程学院,南京210037)
大果紫檀水浸液的荧光光谱研究
朱续娜,张耀丽*,王翔
(南京林业大学材料科学与工程学院,南京210037)
为探究大果紫檀水浸液的荧光性质,以蓝色荧光现象为切入点,分别在自然光和黑色紫外光源下观察大果紫檀水浸液,测量大果紫檀水浸液的三维荧光图谱和二维荧光图谱并进行分析。结果表明:在三维荧光图谱中呈现一个强荧光峰和一个弱荧光峰,最佳激发波长分别位于275和430 nm,最佳发射波长相同,均是467 nm,主要含有一类荧光组分,可能为含取代基的芳香族化合物。二维光谱图中,当pH在3~13之间时,荧光光谱的荧光峰不变,最佳激发波长、最佳发射波长不变,但荧光强度出现明显变化;当pH<8时,荧光强度与pH成正比;在pH 8~9之间荧光强度达到最大;pH>9时,荧光强度反而与pH成反比,表明pH的改变使荧光组分的分子结构产生质子离解作用。大果紫檀水浸液质量浓度较低(0.010~0.100 mg/mL)时,荧光强度与水浸液质量浓度之间高度线性相关,可为荧光组分提取分离提供依据。
大果紫檀;荧光光谱;pH;质量浓度
大果紫檀(PterocarpusmacarocarpusKurz)俗称缅甸花梨,为豆科紫檀属木材,主产于缅甸、老挝、泰国等中南半岛地区。木材结构细匀,纹理美观,香气醇厚,主要用作高级家具及工艺品。大果紫檀的水溶液呈现荧光性,大果紫檀木材在干燥过程中会产生大量的蓝色荧光液体,而关于木材水溶液荧光的记录最早可以追溯到1565年,西班牙医生Nicolás Monardes记录了一种被用来治疗肝脏和肾脏疾病的木材Lignumnephriticum,当水接触到这种木材时会呈现蓝色荧光[1]。在16和17世纪的欧洲,Lignumnephriticum因为被做成杯子被大家熟知,放置在这种杯子里的水的表面也会出现蓝色荧光[2]。几个世纪以来,科学家们对此荧光现象进行了研究[3-8],1664年Robert Boyle提出蓝色荧光与pH有关,1672年Newton建立了这种荧光现象的光与色的理论,1915年Safford通过研究发现narra和Mexican kidneywood这两种木材的水浸液表现出相同的荧光现象。目前为止,关于大果紫檀不同有机溶剂的提取物,国内外已有一些研究,已经分离检测出几十种化合物[9-14],但是其水浸液的荧光性质依然是未知的,也未见有其水浸液荧光光谱研究的相关报道。笔者通过对大果紫檀水浸液二维和三维光谱的研究,以期为大果紫檀水浸液中荧光组分的进一步分离检测奠定基础。
1 材料与方法
1.1 仪器与材料
试验仪器:Perkin Elmer LS-55荧光分光光度计;Hitachi F-7000荧光分光光度计;WTW inolab pH7110 pH测试仪。
大果紫檀来源于南京林业大学材料科学与工程学院木材学标本室;盐酸(分析纯),NaOH(分析纯),均为南京化学制剂有限公司产品;实验用水均为去离子水。
1.2 试验方法
准确称取大果紫檀刨花10.000 0 g,置于500 mL烧杯中,加入300 mL 100℃水,室温下冷却并浸泡90 h,过滤,取滤液稀释40倍后得到大果紫檀水浸液,质量浓度表示为1 mg/mL。
不同pH条件下大果紫檀水浸液荧光现象的观察及二维荧光光谱的测定:分别取5 mL大果紫檀水浸液于试管和离心管中,使用1.00,0.10,0.01 mol/L的HCl和NaOH溶液调节样品pH,使其在3~13的范围内,试管中样品pH间隔为1,离心管中样品pH间隔为0.4~0.6,每个样品中加入的HCl或NaOH溶液小于200 μL,因此可以忽略酸碱试剂对溶液质量浓度的稀释作用。在自然光和黑色紫外光下观察试管中大果紫檀水浸液的荧光现象,测试离心管中样品pH并扫描荧光光谱,Ex和Em扫描的狭缝宽度分别为10.0和2.5 nm。
不同质量浓度条件下大果紫檀水浸液荧光现象的观察及二维荧光光谱的测定:在试管和离心管中分别加入一定量的大果紫檀水浸液,以水定容至5 mL,得到质量浓度为10.000,5.000,1.000,0.670,0.500,0.400,0.330,0.290,0.250,0.200,0.125,0.100 mg/mL的大果紫檀水浸液,在自然光和黑色紫外光下观察荧光现象,测试荧光光谱,Ex和Em扫描的狭缝宽度分别为10和3 nm。
三维荧光光谱的测定:将质量浓度为0.29 mg/mL的大果紫檀水浸液置于Hitachi F-7000荧光分光光度计上测试,Ex和Em扫描的狭缝宽度均为5 nm。
2 结果与分析
2.1 大果紫檀水浸液荧光现象
2.1.1 不同pH的大果紫檀水浸液的荧光现象
用自来水浸泡大果紫檀刨花,液体出现明显的蓝色荧光。但在相同时间内,用去离子水浸泡同质量的大果紫檀刨花,其蓝色荧光没前者明显,不过只要向后者溶液中滴加一滴NaOH溶液,蓝色荧光就会显著增强,说明大果紫檀水浸液的荧光强弱与其溶液pH有关。这是因为木材中的水溶性成分会降低去离子水的pH,自来水则具有一定的缓冲能力来减弱pH的变化;实验室所用自来水的pH大于去离子水,呈现弱碱性,荧光组分在自来水中表现出较强荧光,而适量NaOH溶液的加入在提高pH的同时有助于提高荧光强度。图1A为在自然光源下不同pH的大果紫檀去离子水水浸液,在pH 2~13之间,溶液颜色由透明,浅黄色逐渐变为暗黄色,但其蓝色荧光较弱。为了更好地观察荧光现象,对水浸液采用黑色紫外光源照射(图1B),可以看到明显的蓝色荧光,在pH 2~8之间,水浸液由非荧光逐步转变为荧光,在pH 9~13之间,水浸液从荧光过渡为非荧光。因此,pH是决定荧光强度的关键因素。

图1 自然光(A)和黑色紫外光源(B)下不同pH的大果紫檀水浸液Fig. 1 Solutions of various pH under natural light(A) and black light ultraviolet(B)
2.1.2 不同质量浓度的大果紫檀水浸液的荧光现象
自然光照射下的不同质量浓度的大果紫檀水浸液见图2A,可以看出随着质量浓度的减小,水浸液由暗黄色逐渐变为无色,但在肉眼下较难观察到荧光。在黑色紫外光源照射下大果紫檀水浸液荧光现象较明显(图2B),在质量浓度0.29~1.00 mg/mL的范围内,荧光强度与溶液质量浓度成正比,而当质量浓度>1 mg/mL时,荧光强度与溶液质量浓度成反比。对于大果紫檀水浸液,在特定强度及波长的激发光照射下,溶液的质量浓度较小,对激发光的吸光度偏低时,溶液的荧光强度才随质量浓度的增加而增强。而随着溶液质量浓度的逐步增大,由于内滤效应和溶质间的相互作用,反而出现荧光强度与溶液质量浓度成反比的现象。当溶液质量浓度过高时,溶液中杂质含量增多,对入射光的吸收作用增大,相当于降低了激发光的强度;同时在质量浓度过高的溶液中,溶质间发生相互作用的概率增加,荧光物质的激发态分子与其基态分子形成二聚体,或与其他溶质分子形成混合物,当质量浓度更大时,甚至会形成荧光物质的基态分子聚集体,从而降低荧光强度。

图2 自然光(A)和黑色紫外光源(B)下不同质量浓度的大果紫檀水浸液Fig. 2 Solutions of various concentrations under natural light(A) and black light ultraviolet(B)
2.2 大果紫檀水浸液三维荧光光谱
大果紫檀水浸液三维荧光等高线光谱见图3,荧光强度相同的点相连构成等高线,相邻等高线间各点的荧光强度用不同颜色表示。图中出现两个荧光峰,最佳激发波长分别位于275和430 nm,最佳发射波长均为467 nm,其中430 nm/467 nm处的荧光峰较为明显,两处荧光峰的最佳发射波长相同,根据荧光光谱的特征,可推测主要含有一类荧光组分。
校准后荧光物质的激发光谱与其吸收光谱非常相近,在紫外吸收光谱中,苯的特征吸收带位于B带(254 nm),当苯环上存在一个或多个取代基时,其B带会有不同程度的红移,尤其是在连有多羟基、酮羰基、羧基和碳碳不饱和键等取代基时,苯的吸收带会移到280 nm附近[15],取代苯类在这个位置有荧光峰。大果紫檀水浸液的发射波长为467 nm,位于绿区。因此,该荧光组分可能为含取代基的芳香族化合物。
由图3可见,三维荧光等高线光谱图在表示荧光强度的同时,还能反映其随激发波长和发射波长变化的情况,能提供比二维荧光光谱更全面物质组成和含量的信息[16]。每种荧光物质都有特定的分子结构,有独立吸收和发射的特定光谱区,因此通过对三维荧光光谱的形状、荧光强度和荧光峰位置的对比,可以对大果紫檀的品质优劣或真伪作出评价。

注:Cpm=0.29 mg/mL;Slit:5/5 nm。图3 大果紫檀水浸液的三维荧光等高线光谱图Fig. 3 Three-dimensional fluorescence spectra of Pterocarpus macarocarpus Kurz aqueous extraction
2.3 不同pH的大果紫檀水浸液的二维荧光光谱及荧光强度分析
根据图3选择最佳的测量波长可以得到荧光组分的二维荧光光谱(图4),当发射波长为465 nm时,激发光谱图中出现分别位于275和430 nm的两个荧光峰,其中430 nm处的荧光峰较强,275 nm处的峰较弱,与图3结果一致。因此,在大果紫檀水浸液荧光光谱的测量时,应选用430 nm的激发波长为测量波长。
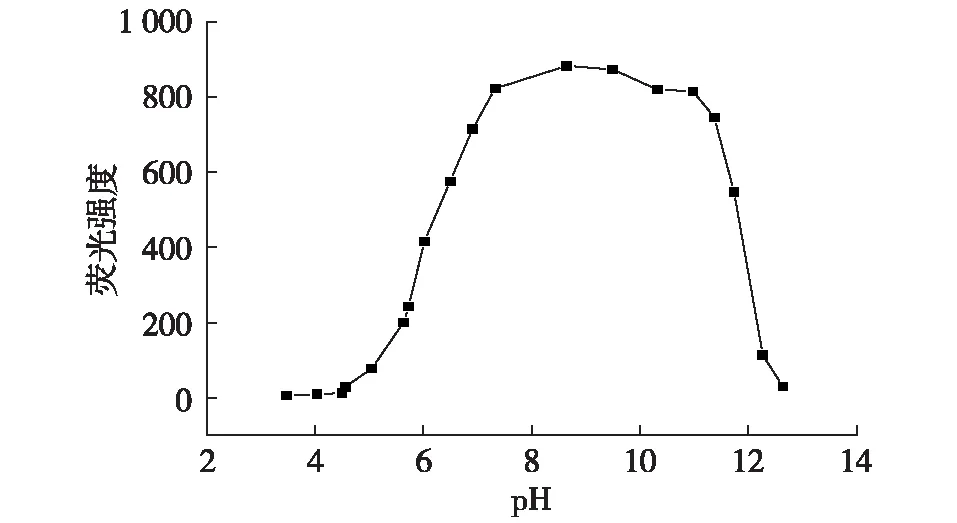
荧光物质的荧光强度和光谱受诸多因素影响,如pH、溶液质量浓度、溶剂体系、其他溶质等。图4为不同pH的大果紫檀水浸液荧光光谱,当4 注:Сpm=0.2 mg/mL;λex/λem:428 nm/465 nm;Slit:10/2.5 nm。图4 不同pH的大果紫檀水浸液二维荧光光谱Fig. 4 Fluorescence spectra of Pterocarpus macarocarpus Kurz in various pH solutions 在λex/λem=428 nm/465 nm下,荧光强度与pH的关系曲线如图5所示,当pH<8时,荧光强度与pH成正比,在pH 8~9之间荧光强度达到最大,pH>9时,荧光强度反而与pH成反比。依据荧光物质光谱特征与分子结构的关系[17-20],可推测大果紫檀水浸液pH变化使荧光组分产生质子化程度不同的荧光型体,不同荧光型体具有不同的荧光特性,从而改变荧光强度、荧光峰、荧光光谱等特征。pH 8~9之间的荧光型体多为荧光量子产率较高的强荧光型体。pH<5和pH>12时多为弱荧光型体。pH变化使得强荧光型体逐步质子离解为弱荧光型体,且不同荧光型体的比例产生变化,造成荧光强度降低。根据荧光性质与分子结构的一般规律可以判断pH 8~9之间的强荧光型体的平面性和刚性高于强酸强碱条件下的弱荧光型体。 图5 不同pH大果紫檀水浸液荧光强度Fig. 5 Fluorescence intensity of Pterocarpus macarocarpus Kurz in various pH 2.4 不同质量浓度的大果紫檀水浸液二维荧光光谱及与荧光强度的相关性分析 由图5可知,在对大果紫檀水浸液中荧光组分的含量进行对比时,应调节pH在8~10之间,此时灵敏度较高;但荧光强度的稳定性较差,因此本实验选择采用中性条件下的水浸液进行测试。中性条件下不同质量浓度大果紫檀水浸液的荧光光谱见图6,可以看出随质量浓度的增大,光谱形状不变,最佳激发波长、最佳发射波长不变,荧光强度增强,其荧光强度与质量浓度密切相关。 注:λex/λem:428 nm/465 nm;Slit:10/3 nm。图6 不同质量浓度的大果紫檀水浸液荧光光谱Fig. 6 Fluorescence spectra of Pterocarpus macarocarpus Kurz in various concentrations 图7 大果紫檀水浸液质量浓度与荧光强度的相关性Fig. 7 Correlation between fluorescence intensity and concentrations of Pterocarpus macarocarpus Kurz 在质量浓度0.010~0.100 mg/mL的范围内,对数据进行相关性分析,所得回归方程为F=94.2+1 001.5C,相关系数达到0.952(图7)。在稀溶液条件下,荧光强度与质量浓度之间线性关系系数较高,可为荧光组分的提取分离奠定基础。 1)大果紫檀水浸液表现出良好的荧光性质,三维荧光等高线光谱图中出现两个荧光峰,弱峰λex/λem=275 nm/467 nm,强峰λex/λem=430 nm/467 nm,相同的发射波长表明主要含有一类荧光组分,可能为含取代基的芳香族化合物。 2)大果紫檀水浸液中荧光组分的荧光性质和结构形态与溶液pH密切相关,当溶液pH在3~13之间变化时,荧光光谱的荧光峰基本没有变化,最佳激发波长、最佳发射波长保持不变,但荧光强度先增强后减弱,表明pH的变化使荧光组分发生质子离解作用,产生不同荧光的荧光型体,从而改变了荧光光谱、荧光峰的强度等特征。 3)在大果紫檀水浸液低质量浓度(0.010~0.100 mg/mL)条件下,其荧光强度与质量浓度之间线性相关程度较高,可为荧光组分的提取分离奠定基础。 [ 1 ] PARTINGTON J R.Lignumnephriticum[J]. Annals of Science, 1955, 11(1):1-26. [ 2 ]MUYSKENS M, VITZ E. The fluorescence ofLignumnephriticum:a flash back to the past and a simple demonstration of natural substance fluorescence[J]. Journal of Chemical Education, 2006, 83(5):765. [ 3 ]HARVEY E N. A history of luminescence from the earliest times until 1900[M]. Philadelphia:The American Philosophical Society Press, 1957. [ 4 ]BURNS D T, DALGARNO B G, GARGAN P E, et al. An isoflavone and a coumestan from eysenhardtia polystachya-Robert Boyle’s fluorescent acid-base indicator[J]. Phytochemistry, 1984, 23(1):167-169. [ 5 ]ACHARI B, DUTTA P K, ROY S K, et al. Fluorescent pigment and phenol glucosides from the heartwood ofPterocarpusmarsupium[J]. Journal of Natural Products, 2012, 75(4):655-660. [ 7 ]SELVAM A B D, BANDYOPADHYAY S. Fluorescence analysis of the heartwood ofPterocarpussantalinusL. f.[J]. Nelumbo, 2008, 50(1/2/3/4):187-189. [ 8 ]CHU N T, CLYDESDALE F M, FRANCIS F J. Isolation and identification of some fluorescent phenolic compounds in cranberries[J]. Journal of Food Science, 1973, 38(6):1038-1042. [ 9 ]张洁, 夏兆鹏, 袁鹏飞, 等. 大果紫檀和奥氏黄檀乙醇低毒微损鉴别[J]. 西南林业大学学报, 2015, 35(4):75-80. ZHANG J, XIA Z P, YUAN P F, et al. Low toxicity and micro damage identification ofPterocarpusmacarocarousandDalbergiaoliveriby ethanol solvent [J]. Journal of Southwest Forestry University, 2015, 35(4):75-80. [10]王增, 吴翠蓉, 于海霞, 等. 基于GC/MS鉴别真伪檀香紫檀的研究[J]. 林业科技开发, 2015, 29(2):86-89. WANG Z, WU C R, YU H X, et al. Research on identification ofPterocarpussantalinusby GC-MS[J]. China Forestry Science and Technology, 2015, 29(2):86-89. [11]COOKE R G, RAE I D. Isoflavonoids I. Some new constituents ofPterocarpusindicusheartwood[J]. Australian Journal of Chemistry, 1964, 17(3):379-384. [12]张蓉, 徐魁梧, 张丽沙, 等. 基于红外光谱的5种红木树种识别探讨[J]. 林业科技开发, 2014, 28(2):95-99. ZHANG R, XU K W, ZHANG L S, et al. Identification of five rosewood species by infrared spectrum characteristics[J]. China Forestry Science and Technology, 2014, 28(2):95-99. [13]刘顺治, 李清芸, 林金国, 等. 基于抽提液成分分析的黄檀属和紫檀属红木的鉴别[J]. 西北林学院学报, 2016, 31(2):264-267. LIU S Z, LI Q Y, LIN J G, et al. Identification of six rosewoods inDalbergiagenus andPterocarpusgenus based on the composition analysis of their extractives[J]. Journal of Northwest Forestry University, 2016, 31(2):264-267. [14]陈辉. 几种紫檀属木材内含物的比较研究[D]. 南京:南京林业大学, 2015. CHEN H. The comparison and research of severalPterocarpuswood’s extracts[D]. Nanjing:Nanjing Forestry University, 2015. [15]黄量, 于德泉. 紫外光谱在有机化学中的应用(上册)[M]. 北京:科学出版社, 1988:48. [16]许金钩, 王尊本. 荧光分析法[M]. 北京:科学出版社, 2006:154-160. [17]刘翠格, 徐怡庄, 魏永巨, 等. 氧氟沙星的荧光光谱与质子化作用研究[J]. 光谱学与光谱分析, 2005, 25(4):584-587. LIU C G, XU Y Z, WEI Y J, et al. Fluorescence spectra and protonation of ofloxacin[J]. Spectroscopy and Spectral Analysis, 2005, 25(4):584-587. [18]刘翠格, 徐怡庄, 魏永巨, 等. 环丙沙星的光谱性质、质子化作用与荧光量子产率[J]. 光谱学与光谱分析, 2005, 25(9):1446-1450. LIU C G, XU Y Z, WEI Y J, et al. Spectral properties, protonation and fluorescence quantum yield of ciprofloxacin[J]. Spectroscopy and Spectral Analysis, 2005, 25(9):1446-1450. [19]张英华, 史训立, 刘雅兰, 等. 中药常山水浸液的荧光光谱研究[J]. 光谱学与光谱分析, 2007, 27(2):342-345. ZHANG Y H, SHI X L, LIU Y L, et al. Fluorescence spectra ofDichroafebrifugaaqueous extraction[J]. Spectroscopy and Spectral Analysis, 2007, 27(2):342-345. [20]史训立, 魏永巨, 张英华, 等. 中药白芨水浸液的荧光光谱研究[J]. 光谱学与光谱分析, 2007, 27(4):769-772. SHI X L, WEI Y J, ZHANG Y H, et al. Fluorescence spectra ofBletillastriataaqueous extraction[J]. Spectroscopy and Spectral Analysis, 2007, 27(4):769-772. Fluorescence spectra ofPterocarpusmacarocarpusKurz aqueous extraction solution ZHU Xuna,ZHANG Yaoli*,WANG Xiang (CollegeofMaterialsScienceandEngineering,NanjingForestryUniversity,Nanjing210037,China) The fluorescence properties ofPterocarpusmacarocarpusKurz aqueous extraction solution was studied by investigating the blue fluorescence phenomenon of the solution. It was found that the fluorescence intensity ofP.macarocarpusKurz aqueous extraction solution depends on the pH and mass concentrations when the aqueous extraction solution was observed under natural light and black ultraviolet light. Three-dimensional and two-dimensional fluorescence spectra ofP.macarocarpusKurz aqueous extraction at various pH and mass concentrations were measured by fluorescence spectrophotometer. Two apparent fluorescence peaks were observed in the three-dimensional fluorescence contour spectrum. The excitation wavelength of the two peaks was 275 nm and 430 nm and the emission wavelength of two peaks was 467 nm. These results confirmed that it should contain fluorescent components, and it could probably be some aromatic compounds containing substituted groups. In the pH ranging from 3 to 13, the peaks in the fluorescence spectra, the maximum excitation and emission wavelengths remained unchanged while the fluorescence intensity of the fluorescence component changed significantly. When the pH was lower than 8, the fluorescence intensity of the solution increased with the increase of pH and reached the maximum when pH was between 8 and 9. The fluorescence intensity reduced with the increase of pH when pH was higher than 9, indicating that dissociation of protons existed in the moleculars of the fluorescence component was related to the changes of the pH of the solution. For low mass concentrations (0.010-0.100 mg/mL) ofP.macarocarpusKurz aqueous extraction solution, highly linear correlation between the fluorescence intensity and mass concentration of the fluorescence component were obtained. PterocarpusmacarocarpusKurz; fluorescence spectrum; pH; mass concentration 2016-11-10 2017-02-28 国家自然科学基金(31670558);江苏高校优势学科建设工程资助项目(PAPD)。 朱续娜,女,研究方向为木材学。通信作者:张耀丽,女,教授。E-mail:zhangyaoli@126.com S781.4 A 2096-1359(2017)04-0046-05


3 结 论
