铜绿假单胞菌脂多糖对白色念珠菌生物膜的影响
2017-08-02马立艳苏建荣
邓 娟 孙 伟 马立艳 苏建荣
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
铜绿假单胞菌脂多糖对白色念珠菌生物膜的影响
邓 娟 孙 伟 马立艳 苏建荣*
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
目的 研究铜绿假单胞菌脂多糖(lipopolysaccharide,LPS)对白色念珠菌生物膜形成的抑制作用。 方法 甲基四氮盐[(2,3-bis-(2-methoxy-4-nitro-5-sulphophenyl)-2H-tetrazolium-5-carboxanilide,XTT]减低法用于检测铜绿假单胞菌LPS对白色念珠菌生物膜形成不同阶段生成量的影响,同时,利用倒置显微镜观察生物膜形态学改变;实时定量聚合酶链式反应(quantitative real time polymerase chain reaction,qRT-PCR)法检测铜绿假单胞菌LPS对白色念珠菌生物膜菌丝特异基因(hypha specific genes,HSGs)表达的影响。结果 铜绿假单胞菌LPS可以抑制白色念珠菌生物膜的形成,以及使菌丝特异基因HWP1、ALS1、ALS3、ECE1和SAP4的表达分别下调8.3~12.8、1.1~3.0、2.0~4.6、1.3~3.8和6.2~7.6倍。结论 铜绿假单胞菌LPS可以通过抑制白色念珠菌菌丝的形成从而抑制其生物膜的形成。
铜绿假单胞菌;脂多糖;白色念珠菌;生物膜;基因
白色念珠菌能够黏附在导尿管、心脏支架、静脉插管、人工关节等人体植入物上形成生物膜,从而对机体造成损害及对抗真菌药物产生明显耐药性[1]。因此,减少或阻断生物膜的形成可以有效提高抗真菌治疗效果,提高病人生存率。
铜绿假单胞菌是人体常见的机会致病菌,也是医院获得性血流感染的常见致病菌,而脂多糖是铜绿假单胞菌的主要致病成分之一。脂多糖(lipopolysaccharide,LPS)是革兰阴性杆菌细胞壁的特有结构,又名内毒素,其可通过促炎反应和免疫调节机制引起发热、糖代谢紊乱、内毒素休克等[2]。
本研究通过构建体外白色念珠菌生物膜模型,采用甲基四氮盐[(2,3-bis-(2-methoxy-4-nitro-5-sulphophenyl)-2H-tetrazolium-5-carboxanilide,XTT]法检测不同浓度铜绿假单胞菌脂多糖对白色念珠菌生物膜形成的影响,期望能为临床治疗革兰阴性菌和白色念珠菌混合感染提供一定帮助,也期望能为研发新型抗真菌药物提供一定的实验室依据。
1 材料与方法
1.1 材料
1)菌株:白色念珠菌标准菌株SC 5314 1株,白色念珠菌 ATCC 90028 1株,临床血培养阳性标本分离的白色念珠菌37株,均来自首都医科大学附属北京友谊医院临床检验中心细菌室,使用前脱脂牛奶-70 ℃保存。
2)培养基:沙保弱(Sabouraud’s Dextrose Agar, SDA)培养基购自英国Oxiod公司;RPMI-1640培养液购自美国Gibco公司;酵母氮源培养基(Yeast Nitrogen Medium,YNB)购自美国Difco公司,称取YNB 3.35 g、葡萄糖10 g,加蒸馏水定容至500 mL,0.45 μm微孔滤器过滤除菌,4 ℃保存。
3)主要试剂:铜绿假单胞菌LPS、XTT、甲萘醌均购自美国Sigma公司:LPS用RPMI-1640溶液调整成100 μg/mL~1 ng/mL浓度;XTT用无菌PBS缓冲液(Solarbio公司,中国)稀释配成0.5 mg/mL饱和溶液,0.22 μm微孔滤器过滤除菌,分装后-20 ℃冰箱冻存;甲萘醌用丙酮(北京化学试剂厂,分析纯)新鲜配制成浓度为10 mmol/L溶液。qRT-PCR试剂购自日本Takara公司。
4)仪器:恒温摇床(中国杭州奥盛科技有限公司),酶标仪(伯乐生命科技公司,美国),细胞计数板(NanoEnTek公司,韩国),倒置显微镜(Olympus公司,日本),ABI 7500型荧光定量PCR仪(ABI公司,美国)。
1.2 方法
1)念珠菌生物膜的制备:将从-70 ℃冰箱保存的待测菌株接种于SDA培养基上,37 ℃、5%(体积分数)CO2培养18 h。取一接种环菌量至YNB培养液中,37 ℃摇床(75 r/min)培养过夜,离心,弃上清,PBS液离心洗涤2次(4 000 r/min,5 min)。用含或不含有不同浓度LPS(100 μg/mL~1 ng/mL)RPMI-1640液体培养基稀释菌液,显微镜下用细胞计数板将菌液浓度调整至5×106细胞/mL。取100 μL上述菌液接种至无菌96孔板中,37 ℃摇床(75 r/min)培养90 min,然后用PBS轻轻洗涤2次,以洗掉未黏附的念珠菌细胞,再加入含或不含不同浓度LPS(100 μg/mL~1 ng/mL)RPMI-1640液体培养基200 μL,继续培养24 h和48 h,每隔24 h换液1次。阴性对照孔为不含LPS的RPMI-1640培养基。实验在不同时间重复3遍。
2)XTT减低法进行生物膜定量分析:在24、48 h时刻点,弃去96孔板中培养液,每孔用200 μL PBS缓冲液洗2遍,然后每孔加入40 μL XTT、2 μL甲萘醌、158 μL PBS缓冲液,37 ℃避光孵育3 h后,用酶标仪测定念珠菌生物膜在490 nm处的吸光度值(A值)。
3)倒置相差显微镜观察生物膜形态:按1.2中1)的步骤进行念珠菌SC 5314生物被膜的制备,24 h和48 h时刻点在倒置显微镜下观察念珠菌生物膜形态并拍摄照片。
4)实时荧光定量PCR :①提取总RNA及cDNA反转录:选取白色念珠菌SC 5314和随机抽取的2株临床菌株,用含100 μg/mL铜绿假单胞菌脂多糖的RPMI-1640液调整菌液浓度为5×106个细胞/mL,实验对照组为不含铜绿假单胞菌脂多糖的菌液,同时设置空白对照组。取3 mL上述菌液加入到6孔无菌孔板中,37 ℃进行生物膜培养24 h,收集生物膜细胞后进行总RNA提取。反转录反应条件:5×gDNA Eraser Buffer 2 μL+gDNA Eraser 1 μL+总RNA 3 μL+PrimeScript RT Enzyme MixⅠ1 μL+RT Primer Mix 1 μL+5×PrimeScript Buffer 24 μL+RNase-free H2O 8 μL,混匀后按37 ℃ 15 min,85 ℃ 5 s,4 ℃ 2 min进行反转录。②引物设计与合成:根据相关文献选定白色念珠菌菌丝特异基因包括:HWP1、ALS1、ALS3、ECE1、SAP4,内参基因为ACT1,委托北京天一辉远公司合成引物,各引物序列详见表1。③qRT-PCR反应体系如下:2×SYBR Mixture 10 μL+上、下游引物各0.8 μL+Rox reference DyeⅡ 0.4 μL+cDNA模板 2 μL+ddH2O水6 μL,总体系为20 μL,95 ℃ 30 s预变性后,反应条件为:95 ℃ 5 s→60 ℃ 30 s,共40循环。每个样本重复3次,每次检测均3个试验管,3个内参管,最终检测结果取平均值,采用2-△△Ct法进行数据的相对定量分析。

表1 RT-PCR 实验所用的引物及其序列
PR-PCR:real time polymerase chain reaction.
1.3 统计学方法

2 结果
2.1 不同浓度铜绿假单胞菌LPS对念珠菌生物膜形成的影响
与对照组相比,在生物膜形成阶段(24 h)和生物膜成熟阶段(48 h),铜绿假单胞菌脂多糖100 μg/mL浓度对白色念珠菌生物膜形成抑制率最高,分别为82.05%(32/39)和71.79%(28/39)(表2)。不同浓度铜绿假单胞菌LPS对白色念珠菌生物膜的影响可从XTT结果分析中得出,每株白色念珠菌的XTT值均有所差异,本实验中列出白色念珠菌标准菌株 SC 5314菌株的XTT结果(表3)。
2.2 铜绿假单胞菌脂多糖对白色念珠菌生物膜形态的影响
白色念珠菌在含100 μg/mL浓度铜绿假单胞菌脂多糖的RPMI-1640液体培养基中培养24 h和48 h,通过倒置显微镜观察发现,白色念珠菌对照组形成的生物膜中含有大量呈交织状态的菌丝,而实验抑制组生物膜多数为酵母相,偶见少量菌丝形成(图1)。

表2 不同浓度铜绿假单胞菌LPS抑制白色念珠菌生物膜形成的菌株数

表3 不同浓度的铜绿假单胞菌LPS对白色念珠菌生物膜影响的XTT结果分析
2.3 铜绿假单胞菌脂多糖对白色念珠菌菌丝特异基因表达量的影响
为了探究铜绿假单胞菌脂多糖抑制白色念珠菌菌丝形成进而影响生物膜形成的分子机制,选取了以往文献[3]中证实与白色念珠菌菌丝形成密切相关的基因(HWP1、ALS1、ALS3、ECE1、SAP4)进行检测。结果显示,在100 μg/mL铜绿假单胞菌脂多糖作用下,通过相对基因表达量的比较,可见3株受试菌株的菌丝特异基因在24 h时刻点均受到不同程度的影响,且其变化总趋势具有一致性(表4)。菌丝特异基因HWP1、ALS1、ALS3、ECE1和SAP4分别下调8.3~12.8、1.1~3.0、2.0~4.6、1.31~3.8和6.2~7.6倍,以HWP1和SAP4下调最明显(图2)。
3 讨论

图1 100 μg/mL铜绿假单胞菌脂多糖对白色念珠菌SC 5314菌株生物膜形成的影响
C.albicanscells were grown in RPMI-1640 medium at the 100 μg/mL concentration ofPseudomonasaeruginosaLPS at 37 ℃ for 24 h and 48 h.At the end of incubation an aliquot was withdrawn from each sample and photographed at 40×magnification.LPS:lipopolysaccharide.
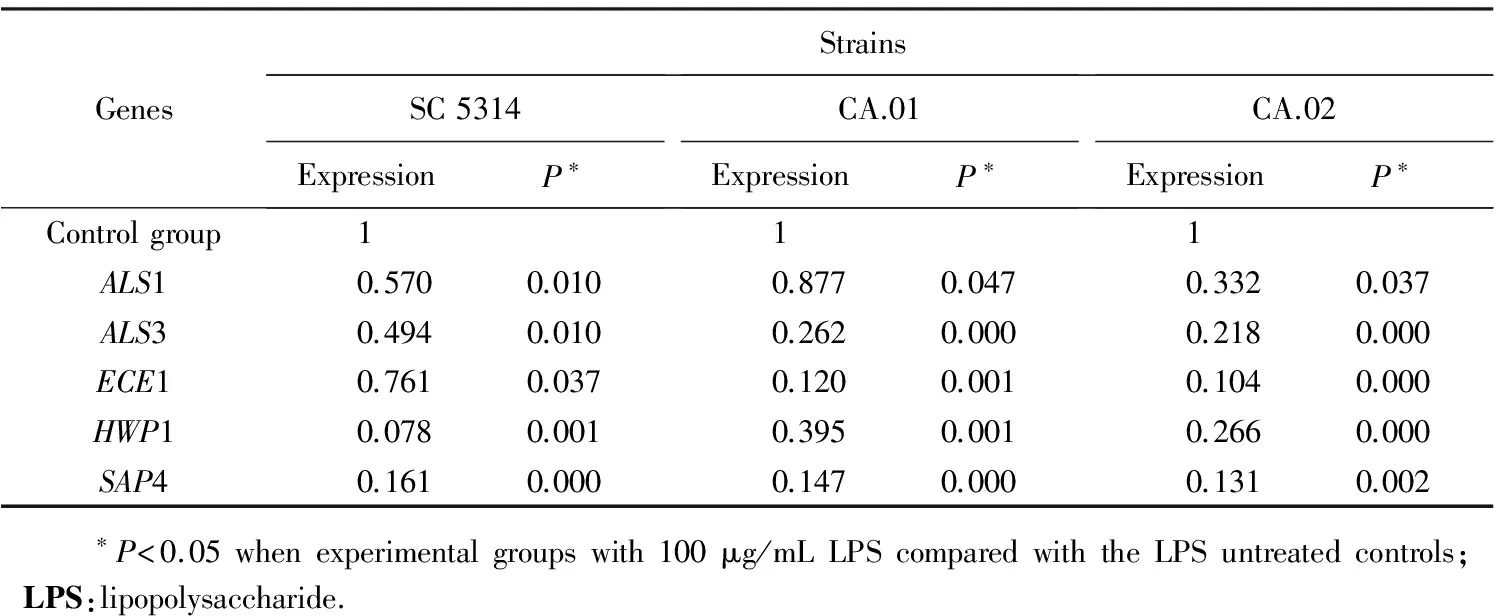
表4 100 μg/mL铜绿假单胞菌LPS对白色念珠菌菌丝特异基因相对表达量

图2 铜绿假单胞菌脂多糖对白色念珠菌菌丝特异基因的表达
*P<0.05vscontrols; LPS:lipopolysaccharide.
白色念珠菌是一种二相型真菌,可在孢子相和菌丝相间进行形态学转换。临床上,大部分白色念珠菌感染以生物膜形态发生,成熟的白色念珠菌生物膜是一个由孢子、假菌丝及菌丝形成的致密网状结构,可使得白色念珠菌致病性增强[1],导致生物膜状态白色念珠菌血症成为临床治疗的难点。Perumal等[4]研究发现白色念珠菌的药物易感性与菌体密度存在着显著关系,当菌体密度越大时,其药物易感性越低。
Fourie等[5]揭示了铜绿假单胞菌和白色念珠菌生物膜产生不同花生四烯酸类物质及其对彼此代谢活性的影响。秦金喜等[6]通过交叉条带法测定铜绿假单胞菌对念珠菌的抑制活性,结果证明铜绿假单胞菌可产生抗念珠菌活性的抗菌物质。 Keçeli Özcan 等[7]发现铜绿假单胞菌通过分泌绿脓素抑制发挥抗白色念珠菌活性。Bandara等[8]报告了通过共聚焦荧光显微镜和扫描电镜观察到铜绿假单胞菌脂多糖抑制白色念珠菌菌丝的形成从而影响白色念珠菌生物膜的形成。Burd等[9]在小鼠体内注射白色念珠菌和大肠杆菌脂多糖,发现大肠杆菌脂多糖可增加白色念珠菌的毒力。Akagawa等[10]发现,当给感染白色念珠菌的小鼠注射脂多糖后,其肾脏的菌落数明显高于对照组。Sabra等[11]阐述了2种不同化学类型的铜绿假单胞菌脂多糖在一定生存条件下,脂多糖表型的改变可能在细菌黏附和存活过程中起着重要作用。
念珠菌生物膜的形成,可人为地划分为3个阶段:黏附阶段(1~2 h)、生物膜形成阶段(12~24 h)和生物膜成熟阶段(30~72 h)[12]。本实验用XTT减低法验证了白色念珠菌脂多糖对白色念珠菌生物膜的代谢活性,结果显示铜绿假单胞菌脂多糖对白色念珠菌生物膜的形成具有抑制作用。倒置显微镜下观察其形态学改变发现铜绿假单胞菌脂多糖抑制白色念珠菌菌丝形成,且发现脂多糖抑制组在48 h白色念珠菌生物膜菌丝量多于24 h,可能与脂多糖药物半衰期有关,随着药物作用时间的延长,药物对菌丝的抑制作用有所下降。
白色念珠菌菌丝的形成是其主要致病特点,HWP1、ALS1和ALS3具有编码白色念珠菌细胞壁糖蛋白成分,促进菌丝形成的作用[13-15];ECE1是菌丝诱导基因,可刺激菌丝的形成和延长[16];SAP4可编码分泌型天冬氨酸蛋白酶4,调节白色念珠菌从酵母相转换成菌丝相的过程[17]。本实验用qRT-PCR方法检测了铜绿假单胞菌脂多糖对上述基因的转录水平,结果表明,铜绿假单胞菌脂多糖能显著下调上述菌丝特异基因的表达,从而影响相应蛋白的表达。
综上所述,铜绿假单胞菌脂多糖具有一定的抗真菌效果,铜绿假单胞菌脂多糖可通过下调白色念珠菌菌丝特异基因的转录水平,抑制白色念珠菌菌丝的形成,从而减弱白色念珠菌的致病性,发挥抗白色念珠菌生物膜形成的作用。
[1] Cuéllar-Cruz M, Vega-González A, Mendoza-Novelo B,et al.The effect of biomaterials andantifungals onbiofilm formation by candida species:a review.[J].Eur J Clin Microbiol Infect Dis,2012,31(10):2513-2527.
[2] Michalek S M,Moore R N,McGhee J R,et al. The primary role of lymphoreticular cells in the mediation of host responses to bacterial endotoxim. [J].J Infect Dis,1980,141(1):55-63.
[3] Haque F, Alfatah M, Ganesan K, et al. Inhibitory effect of sophorolipid on candida albicans biofilm formation and hyphal growth[J]. Sci Rep,2016, 6:23575.
[4] Perumal P,Mekala S,Chaffin W L. Role for cell density in antifungal drug resistance in candida albicans biofilms. [J].Antimicrob Agents Chemother,2007,51(7):2454-2463.
[5] Fourie R, Ells R, Kemp G, et al.Pseudomonasaeruginosaproduces aspirin insensitive eicosanoids and contributes to the eicosanoid profile of polymicrobial biofilms with Candida albicans.[J]Prostaglandins Leukot Essent Fatty Acids,2017, 117:36-46.
[6] 秦金喜,李仲兴,杨永昌,等.铜绿假单胞菌代谢产物体外对白假丝酵母菌等的抑菌活性研究[J].中国感染控制杂志,2012,11(4):257-260,256.
[7] Keçeli özcan S, Dündar D, Sönmez Tamer G. Anti-candidal activity of clinicalpseudomonasaeruginosastrains and in vitro inhibition of Candida biofilm formation[J]. Mikrobiyol Bul,2012, 46(1):39-46.
[8] Bandara H M, K Cheung B P,Watt R M,et al.Pseudomonasaeruginosalipopolysaccharide inhibits Candida albicans hyphae formation andalters gene expression during biofilm development[J].Mol Oral Microbiol,2013,28(1):54-69.
[9] Burd R S,Raymond C S,Dunn D L. Endotoxin promotes synergistic lethality during concurrent escherichia coli and Candida albicans infection[J].J Surg Res,1992,52(6):537-542.
[10] Akagawa G,Abe S,Yamaguchi H. Mortality of Candida albicans-infected mice is facilitated by superinfection of Escherichia coli or administration of its lipopolysaccharide[J]. J Infect Dis,1995,171(6):1539-1544.
[11] Sabra W,Lünsdorf H,Zeng A P. Alterations in the formation oflipopolysaccharide and membrane vesicles on the surface ofPseudomonasaeruginosaPAO1 under oxygen stressconditions. [J].Microbiology,2003,149(Pt 10):2789-2795.
[12] Xia J, Qian F, Xu W, et al. In vitro inhibitory effects of farnesol and interactions between farnesol and antifungals against biofilms of Candida albicans resistant strains[J].Biofouling, 2017, 33(4):283-293.
[13] Desai J V,Mitchell A P. Candida albicans biofilm development and its genetic control[J].Microbiol Spectr,2015, 3(3).doi:10.1128/microbiolspec.MB-0005-2014.
[14]马贤德, 张威,关洪全.白色念珠菌感染对脾虚模型小鼠T细胞亚群的影响[J].中国医科大学学报,2015,44(12):1070-1074.
[15]贺政新,侯天文,李玮,等.白念珠菌烯醇化酶1的原核表达及多克隆抗体制备[J].解放军医药杂志,2016,28(1):35-39.
[16] Sudbery P E. Growth of candida albicans hyphae[J].Nat Rev Microbiol,2011, 9(10):737-748.
[17] Nas T,Kalkanci A,Fidan I,et al. Expression of ALS1, HWP1 and SAP4 genes in Candida albicans strains isolated from women with vaginitis[J].Folia Microbiol (Praha),2008,53(2):179-183.
编辑 陈瑞芳
Effects ofPseudomonasaeruginosalipopolysaccharide on biofilm ofCandidaalbicans
Deng Juan,Sun Wei, Ma Liyan, Su Jianrong*
(ClinicalLaboratoryCenter,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective To explore the inhibitory effects ofPseudomonasaeruginosalipopolysaccharide onCandidasalbicansbiofilms. Methods [(2,3-bis-(2-methoxy-4-nitro-5-sulphophenyl)-2H-tetrazolium-5-carboxanilide,XTT] reduction assay was used to elucidate the effect ofPseudomonasaeruginosalipopolysaccharide on biofilm formation ofCandidaalbicans,and inverted microscope was used to observe the morphological changes ofCandidaalbicansbiofilms; expression analysis ofCandidaalbicanshypha specific genes was done by quantitative real time polymerase chain reaction(PCR). Results The data showed thatPseudomonasaeruginosalipopolysaccharide inhibitsCandidasbiofilm formation,and the expressions ofHWP1,ALS1,ALS3,ECE1,SAP4 were downregulated 8.3 to 12.8 times,1.1 to 3.0 times,2.0 to 4.6 times,1.3 to 3.8 times and 6.2 to 7.6 times. ConclusionPseudomonasaeruginosalipopolysaccharide modulatedCandidaalbicansbiofilm formation by inhibiting the hyphal development.
Pseudomonasaeruginosa;lipopolysaccharide;Candidasalbicans;biofilm;genes
时间:2017-07-16 17∶16 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170716.1716.018.html
10.3969/j.issn.1006-7795.2017.04.019]
R379.4
2016-11-21)
*Corresponding author, E-mail:youyilab@163.com
