曲酸对飞蝗酚氧化酶以及其他生化酶活性的影响
2017-08-02李一波曹广春纪明山
李一波,曹广春,贾 苗,纪明山
曲酸对飞蝗酚氧化酶以及其他生化酶活性的影响
李一波1,2,曹广春2,贾 苗2,纪明山1*
(1.沈阳农业大学植物保护学院,沈阳 110866;2.中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
酚氧化酶(Phenoloxidase)可以催化黑色素中间体多巴胺的形成,是昆虫黑化作用中的关键酶,在昆虫细胞免疫和体液免疫过程中发挥着重要的作用。近年来,酚氧化酶成为新型杀虫剂靶标的研究对象之一,而酚氧化酶的抑制剂曲酸(Kojic acid)对昆虫解毒酶和保护酶的影响的研究却很少。为了探索酚氧化酶与昆虫其他解毒酶或保护酶类的关系,本文利用含不同剂量曲酸的麦麸饲喂飞蝗,检测飞蝗存活率以及虫体酚氧化酶(PO)、乙酰胆碱酯酶(AChE)、解毒酶(ESTs和GSTs)和保护酶(POD、SOD和CAT)的活性。结果发现,曲酸对飞蝗无明显毒力;在曲酸处理1 d和3 d后,曲酸处理组飞蝗PO二酚酶活性显著低于对照,5 d和7 d后飞蝗PO活性与对照相比差异不大;处理3 d后,飞蝗AChE活性显著低于对照,而5 d后AChE相比于对照显著升高;偏高浓度的曲酸在1 d和3 d后对飞蝗ESTS和GSTs有显著的抑制,5 d和7 d后飞蝗ESTs和GSTs活性上升;曲酸在1 d和3 d后引起了飞蝗保护酶的升高,5 d后飞蝗保护酶有一定的下降。以上结果表明,曲酸对飞蝗PO有明显抑制作用,同时也干扰了昆虫其它生化酶的活性。由此推测,曲酸可以作为杀虫剂或者杀虫真菌的增效剂。
曲酸;飞蝗;酚氧化酶;解毒酶;保护酶
飞蝗LocustamigratoriaL.是我国分布最广,危害最大的直翅目Orthoptera飞蝗属LocustaLinnaeus害虫(李春选和马恩波,2003)。2002年飞蝗危害面积218万hm2,2003-2006年危害面积都在100多万公顷左右,造成巨大的经济损失(冯晓东,2007)。近几年,飞蝗在山西永济市、河北黄骅市、辽宁葫芦岛兴城和海南都有不同程度大发生(宋国华等,2009;唐小村和卢芙萍,2009;刘浩升和李耀发,2010)。飞蝗的防治主要分为化学防治和生物防治。化学防治主要是一些高毒低残留的农药,比如马拉硫磷和高效氯氰菊酯(张志武和马楠,2012)。但是,化学防治的主要问题是害虫对农药产生的抗药性,已有报道山西和天津等地由于马拉硫磷的长期使用,飞蝗对马拉硫磷的敏感性降低(杨红军等,2002;杨美玲,2008)。生物防治中利用杀虫真菌绿僵菌的高毒力菌株防治飞蝗取得了较大的进展(董辉等,2011)。但是,绿僵菌对飞蝗的防治效果受环境影响大,并且由于昆虫自身免疫反应,筛选高毒力菌株也十分的不易(高松,1996)。
酚氧化酶(Phenoloxidase)和保护酶(POD、SOD和CAT)是昆虫抵抗绿僵菌侵染时启动细胞免疫和体液免疫反应中重要的酶类(Leclerc and Reichhart, 2004)。酚氧化酶(PO)可以催化黑色素中间体多巴胺的形成,是昆虫免疫反应黑化作用中的关键酶(Lee and Anstee, 1995; Söderhäll and Cerenius, 1998)。PO平常在昆虫体内以无活性的酚氧化酶原(proPO)存在,必要时proPO就会被激活变成有活性的PO(Cerenius and Söderhäll, 2004)。另外,杀虫真菌还会引起昆虫活性氧等毒性分子(O2-和H2O2)的生成,这些毒性分子对昆虫本身也有毒害,所以昆虫利用自身的保护酶(POD、SOD和CAT)来清除这些毒性分子(Kohchietal., 2009)。如超氧化物歧化酶(SOD)可以清除O2-,过氧化物酶(POD)和过氧化氢酶(CAT)可以使H2O2变为无毒的H2O(Robinson and Badwey, 1994)。在昆虫抵抗绿僵菌的过程中发现,沙漠蝗Schistocercagregaria在被绿僵菌侵染的过程中,沙漠蝗体内PO活性降低,而proPO活性升高(Gillespieetal., 2000);而在绿僵菌侵染飞蝗后,可以引起飞蝗体内PO活性的升高(Mullen and Goldsworthy, 2006);绿僵菌还会引起大蜡螟GalleriamellonellaL.体内全脂酶(ESTs)和谷胱甘肽-S-转移酶(GSTs)的升高(Serebrovetal., 2006);同时在绿僵菌侵染昆虫中,昆虫体内氧化压力的增加也会导致保护酶(POD、SOD和CAT)活性的升高(Sree and Padmaja, 2008)。
乙酰胆碱酯酶(AChE)和解毒酶是昆虫对有机磷等农药产生抗药性的关键酶类。有机磷农药的作用靶标是AChE,昆虫对此类农药抗药性的产生,AChE的修饰或者改变是关键的考虑因素(Fournier and Mutero, 1994)。研究发现,飞蝗对有机磷农药的抗药性是因为飞蝗体内AChE对有机磷农药的敏感性降低(Maetal., 2004;Yangetal., 2008)。另外,昆虫抗药性的产生还与昆虫体内解毒酶有关。谷胱甘肽-S-转移酶(GSTs)可以把还原型谷胱甘肽(GSH)结合到农药的亲电子中心,它介导的抗药性农药种类主要是有机磷类、有机氯类和拟除虫菊酯类(Lietal., 2007)。全脂酶(ESTs)可以催化脂健水解,它针对的农药种类主要是有机磷类、氨基甲酸酯类和拟除虫菊酯类(Terriere, 1984)。研究发现,飞蝗对马拉硫磷的抗药性与飞蝗GSTs和ESTs活性有关(Heetal., 2004;Qinetal., 2011)。
曲酸(Kojic acid)是PO的抑制剂,它是一种从杀虫真菌提取的一种真菌毒素(Sarunoetal., 1979)。研究发现,曲酸可以抑制鳞翅目昆虫PO活性(Dowd, 1999),如小菜蛾Plutellaxylostella(Wangetal., 2003)、甜菜夜蛾SpodopteraexiguaHübner(Gaoetal., 2003)和海灰翅夜蛾Spodopteralittoralis(Lee and Anstee, 1995)。但是,曲酸对其他昆虫PO的影响,以及曲酸对昆虫其他生化酶影响的研究较少。本文利用PO的抑制剂曲酸处理飞蝗,并检测1、3、5和7 d后飞蝗存活率以及体内PO、解毒酶(ESTs和GSTs)和保护酶(POD、SOD和CAT)等生化酶活性的变化,明确曲酸对飞蝗免疫相关酶的影响,为曲酸可能作为化学农药或杀虫真菌的增效剂提供理论依据。
1 材料与方法
1.1 供试昆虫
飞蝗最初的蝗卵卵囊采集于河北沧州,之后在室内条件下纯化传代培养,扩大种群,期间未接触任何化学和生物药剂。蝗卵的孵化是在人工气候培养箱中,孵化温度和湿度分别为30℃±2℃、60%±5% RH。7 d左右,将孵化出的蝗蝻置于长宽高分别为60 cm、50 cm、70 cm的养虫笼中以麦麸和新鲜的小麦苗饲养,饲养温度为30℃±2℃,光照时间为14 h。
1.2 供试试剂与仪器
曲酸(Kojic acid)购自东京化成工业株式会社;邻苯二酚、CDNB(1-氯-2,4-二硝基苯)、DTNB(5,5-二硫双(2-硝基苯甲酸))、DCNB(1,2-二氯-4-硝基苯)、ATChI(碘化硫代乙酰胆碱)、和考马斯亮蓝G-250购自sigma公司;α-NA(乙酸-1-萘酯)购自Amresco公司;牛血清蛋白、固蓝RR盐、GSH(还原型谷胱甘肽)购自Solarbio公司。保护酶(POD、SOD和CAT)测定试剂盒购自于南京建成生物科技公司。
主要仪器有3K15型冷冻离心机(Sigma)、VERSAmax型酶标仪(MDC)。
1.3 试验方法
1.3.1 药剂处理
本试验所用试虫为3龄蝗蝻,分别设1个对照和5个处理,8次重复(其中5个重复用于记录死亡率,另外3个重复用于酶活取样),每个重复所用蝗蝻15头。所用试剂(曲酸)溶于无菌水,然后与麦麸拌匀,称为“含药麦麸”,用于饲喂处理组蝗蝻。无菌水与麦麸质量比1∶1混匀,称为“无药麦麸”,用于饲喂对照组蝗蝻。浓度参考相关文献(Chenetal., 1991),与麦麸混匀后的含量为8%、4%、2%、1%、0.5%、0.1%和0.01%。试验前一天,分别把蝗蝻置于塑料筐(长×宽×高:27×16×12 cm)内,用玻璃板盖住,并饥饿处理。在试验的第一天,对照组的蝗蝻被饲喂“无药麦麸”,处理组的蝗蝻被饲喂“含药麦麸”,1 d后,对照和处理组的蝗蝻都分别饲喂新鲜的麦苗。之后,记录每天的死亡率,并分别在1 d、3 d、5 d和7 d后取样,用于酶活测定。
1.3.2 酶液制备
取不同处理的试虫置于匀浆器中,加入适量的0.1 mol/L磷酸盐缓冲液(1头3龄蝗蝻用缓冲液约1.5 mL),冰浴匀浆2-3 min。测定不同酶所用匀浆缓冲液pH不同(全脂酶:1.5 mL PBS(含0.1% TritonX-100),pH7;乙酰胆碱酯酶和酚氧化酶:1.5 mL PBS,pH7;保护酶(SOD、POD和CAT):1.5 mL PBS,pH7.3;谷胱甘肽-S-转移酶:1.5 mL PBS,pH7.5)。然后,取匀浆液1 mL,在4℃、15000 rpm条件下离心10 min。之后,取上清液置于新的离心管中,再次以4℃、15000 rpm离心20 min。最后取上清液用于酶活和蛋白含量测定。
1.3.3 酶活性测定
全脂酶(ESTs)活性测定方法(Hanetal., 1998):此方法中与酶液反应底物为α-NA,显色剂为固蓝RR盐。在加样之前,分别把10 mg α-NA 和20 mg的固蓝RR溶于1 mL丙酮,然后分别取200 μL加入0.1 mol/L pH=7.0磷酸盐缓(PBS)冲液,并定容至8 mL,过滤后备用。加样时,依次加入90 μL PBS,200 μL底物与显色剂的混合液和10 μL 酶液,然后置于酶标仪中,在450 nm 波长下,每25 s记录一次光密度值,记录10 min,反应温度37℃。
谷胱甘肽-S-转移酶(GSTs)活性测定方法(Oppenoorth and Welling,1976):此方法中与酶液反应底物有两种,分别为CDNB和DCNB。当CDNB为底物时,依次在酶标板中加入90 μL PBS,10 μL酶液,100 μL 1.2 mmol/L CDNB和100 μL 6 mmol/L GSH;当DCNB为底物时,依次在酶标板中加入50 μL酶液,100 μL 1.2 mmol/L DCNB和100 μL 6 mmol/L GSH。最后,分别置于340 nm波长下,每25 s记录一次光密度值,记录10 min,反应温度27℃。
乙酰胆碱酯酶(AChE)活性测定方法(Hanetal., 1998):此方法中与酶液反应底物为ATChI。加样过程中,依次为50 μL 0.1 mol/L PBS、50 μL酶液、100 μL 45 μmol/L DTNB和100 μL 1.5 mmol/L ATChI。最后置于405 nm波长下,每30 s记录一次光密度值,记录40个值,重复3次,反应温度27℃。
酚氧化酶(PO)活性测定方法(Luo and Xue, 2010):此方法与酶液反应底物为邻苯二酚。在酶标板孔中依次加入180 μL 10 mmol/L邻苯二酚溶液与20 μL酶液,在420 nm波长下,记录1 h内OD值变化。
保护酶(SOD、POD和CAT)测定按试剂盒说明书测定。上述数据使用酶标仪自带的Softmax Pro 6.1软件处理。
1.3.4 蛋白含量测定
蛋白含量用Bradford方法测定(Bradford, 1976),牛血清白蛋白(BSA)作为标准蛋白。
1.4 数据统计与分析
对不同浓度处理飞蝗的存活率和各种生化酶活性进行单因素方差分析,利用SPASS中One-way ANOVA进行差异显著性检验。
2 结果与分析
2.1 曲酸对飞蝗存活率的影响
试验表明(图1),曲酸对飞蝗毒力很低,飞蝗的存活率在85%以上,与对照无显著差异(P<0.05)。
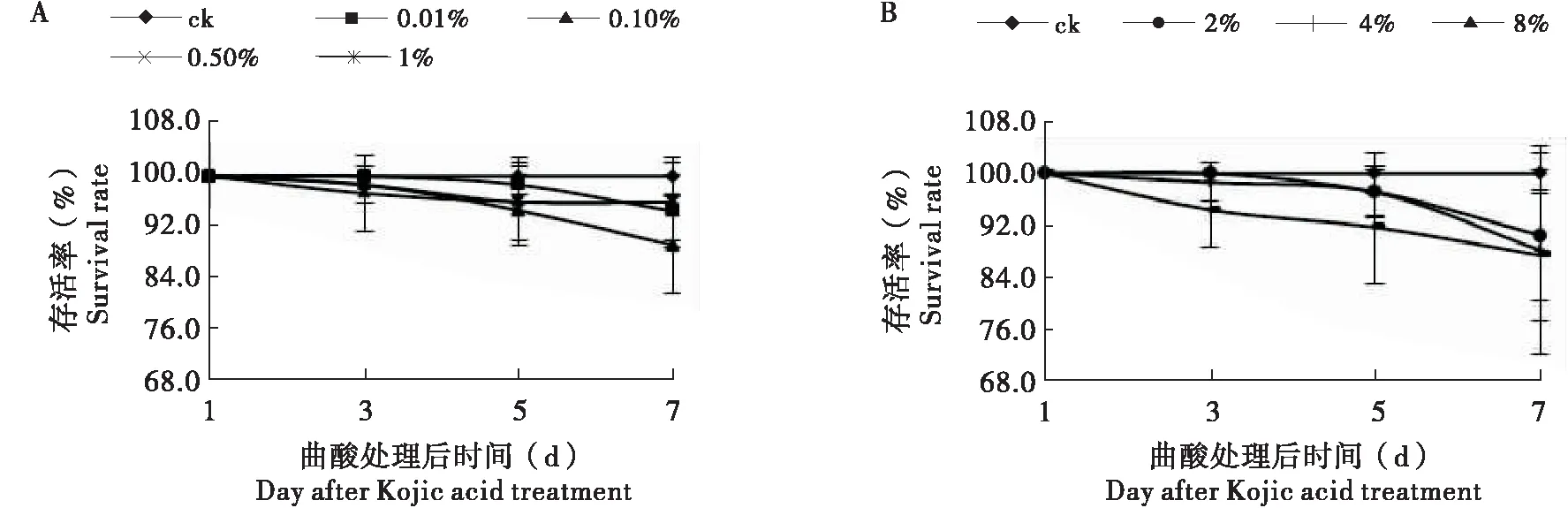
图1 不同浓度曲酸对飞蝗存活率的影响Fig.1 The survival rate of Locusta migratoria after Kojic acid treatment
2.2 曲酸对飞蝗酚氧化酶的影响
曲酸处理飞蝗1 d后,浓度为0.1%、4%和8%曲酸处理后的飞蝗体内PO活性相对于对照显著下降(P<0.05),其他处理组与对照无显著差异;3 d后,浓度为0.1%、1%、2%、4%和8%处理后的PO活性显著低于对照(P<0.05);5 d后,除0.01%、0.1%、0.5%和2%相比对照无显著差异以外,其他处理的PO相比于对照活性增高(P<0.05);7 d后,除0.5%的PO活性显著高于对照,1% PO活性显著低于对照外,其他处理的PO活性与对照无显著差异(P<0.05)(表1)。总的来说,曲酸处理后,飞蝗在前期(1、3 d)的活性受到很强的抑制,5 d后PO活性升高并在7 d后趋于平稳。

表1 不同浓度曲酸对飞蝗体内酚氧化酶的影响Table 1 The activity of PO in Locusta migratoria after Kojic acid treatment
注:表中数据均是平均值±标准差,不同字母表示差异显著性(P<0.05),小写字母代表纵向比。Note: Means within a vertical column indicated by different lowercase letters are significantly difference (P<0.05).
2.3 曲酸对飞蝗乙酰胆碱酯酶的影响
曲酸处理飞蝗1 d后,0.01%、0.5%和1%处理组飞蝗体内AChE活性相比于对照显著升高,而0.1%和2%处理组的AChE活性相比于对照显著下降(P<0.05);3 d后,除0.5%处理组飞蝗AChE活性显著高于对照外,0.1%、1%、2%和4%处理组的飞蝗体内AChE活性显著低于对照(P<0.05);特别是5 d后,所有处理组飞蝗体内AChE活性相比于对照均显著升高(P<0.05),而7 d后,0.01%、0.5%、4%和8%处理组飞蝗体内AChE的活性显著高于对照(P<0.05),其他处理组飞蝗AChE的活性与对照无显著差异。总的来说,曲酸处理飞蝗后,飞蝗体内AChE的活性呈现先降低后上升的趋势。
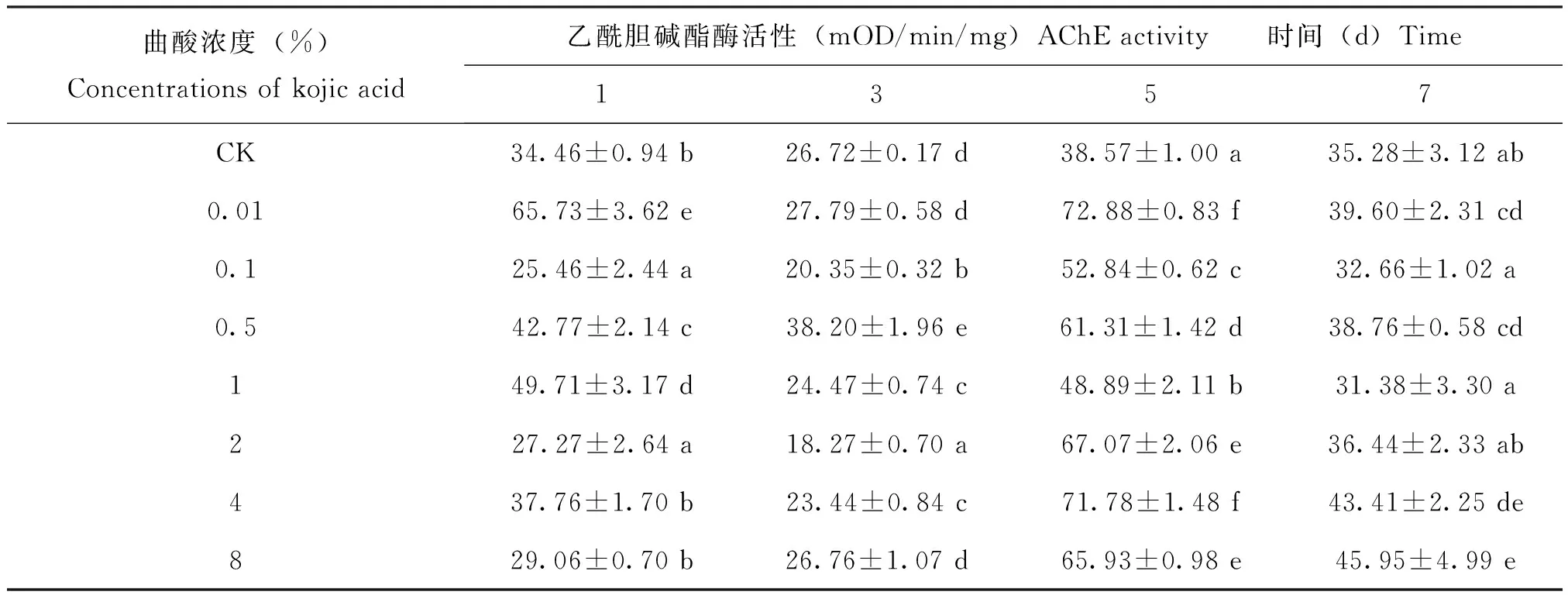
表2 不同浓度曲酸对飞蝗体内乙酰胆碱酯酶的影响Table 2 The activity of AChE in Locusta migratoria L.after Kojic acid treatment
注:表中数据均是平均值±标准差,不同字母表示差异显著性(P<0.05),小写字母代表纵向比。Note: Means within a vertical column indicated by different lowercase letters are significantly difference (P<0.05).
2.4 曲酸对飞蝗解毒酶的影响
不同浓度的曲酸处理飞蝗1 d后,除0.5%处理组ESTs活性与对照无显著差异外,其他处理组飞蝗ESTs活性均显著低于对照(P<0.05);3 d后,除0.5%处理组ESTs活性显著高于对照外,其他组处理组飞蝗ESTs活性相比于对照显著下降(P<0.05);5 d后,处理组(0.01%、0.1%和0.5%)的ESTs活性显著升高,其他与对照无显著差异(P<0.05);7 d后,处理组(0.01%、0.5%和4%)的ESTs活性相比于对照显著升高,而1%和8%处理组ESTs活性显著低于对照,其他处理组与对照无显著差异(P<0.05)(图2(A))。
由图2(B)所示的是飞蝗体内底物为CDNB的谷胱甘肽-S-转移酶(GSTs)的活性变化。在曲酸处理飞蝗1 d后,0.1%、2%和8%处理组的飞蝗GSTs/CDNB的活性显著低于对照,而4%处理的飞蝗GSTs/CDNB活性显著高于对照,其他处理的GSTs/CDNB活性与对照无显著差异(P<0.05);3 d后,只有2%处理组的飞蝗GSTs/CDNB活性显著低于对照,0.01%、0.1%和0.5%处理组飞蝗的GSTs/CDNB活性相比于对照显著升高;5 d后,除4%处理组GSTs/CDNB活性高于对照,0.1%处理与对照无显著差异外,其他处理组飞蝗GSTs/CDNB活性均显著低于对照(P<0.05);7 d后,除2%处理飞蝗的GSTs/CDNB活性显著低于对照,0.1%和0.05%处理的GSTs/CDNB活性与对照无差异外,其他处理组的GSTs/CDNB活性均显著高于对照(P<0.05)。
由图2(C)所示的是飞蝗体内底物为DCNB的GSTs的活性变化。在曲酸处理飞蝗1 d后,0.01%处理飞蝗的GSTs/DCNB活性显著高于对照,0.1%、0.5%、2%和8%处理组飞蝗GSTs/DCNB活性显著低于对照,其他处理无显著差异(P<0.05);3 d后,0.01%和0.5%处理飞蝗的GSTs/DCNB活性显著高于对照,而2%、4%和8%处理组的GSTs/DCNB活性显著低于对照,其他处理无显著差异(P<0.05);5 d后,只有2%处理飞蝗的GSTs/DCNB活性显著低于对照,0.01%、0.1%和4%处理组的GSTs/DCNB活性显著高于对照(P<0.05);7 d后,只有2%处理飞蝗的GSTs/DCNB活性显著低于对照,4% GSTs/DCNB活性显著高于对照,其他处理与对照相比无显著差异(P<0.05)。
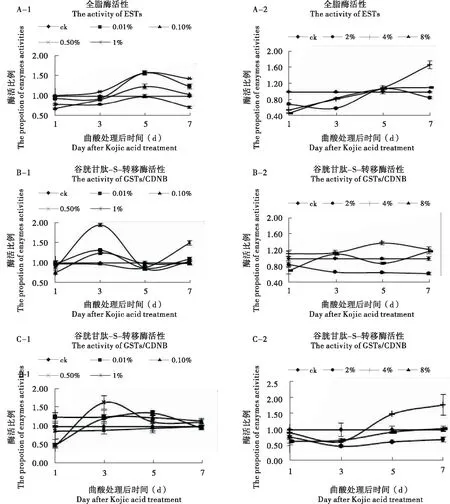
图2 不同浓度曲酸对飞蝗解毒酶的影响Fig.2 The activities of detoxification enzymes in Locusta migratoria L.after Kojic acid treatment注:解毒酶活性是处理组酶活与对照组酶活的比值。其中CDNB和DCNB代表的是测定GSTs时所用的底物。Note: The value of ordinate represents the enzymes activities of treatment group divided by control group.CDNB and DCNB are the substrates of GSTs, respectively.
2.5 曲酸对飞蝗保护酶的影响
不同浓度曲酸处理飞蝗后,保护酶的活性变化如图3所示。
由图3(A)所示,0.1%、2%、4%和8%曲酸在处理飞蝗1 d后,体内POD活性显著低于对照,0.01%和1%处理飞蝗的POD活性显著高于对照(P<0.05);3 d后,除1%和2%的POD活性与对照无差异,0.1%处理的飞蝗POD活性显著低于对照外,其他处理组的飞蝗POD活性均显著高于对照(P<0.05);5 d后,除4%和0.01%以外,其他处理组POD活性均显著低于对照(P<0.05);7 d后,除0.01%的POD高于对照外,其他处理组POD活性与对照组无显著差异(P<0.05)。
由图3(B)所示,0.1%、4%和8%曲酸处理飞蝗1 d后,体内SOD活性显著下降,而0.01%、0.5%和1%处理的SOD活性显著高于对照(P<0.05);3 d后,0.1%和2%处理的飞蝗SOD活性显著低于对照,0.5%和1%处理的SOD活性显著高于对照,其他处理与对照无显著差异(P<0.05);5 d后,除8%处理的SOD与对照无差异,0.01%和4%处理组SOD活性显著高于对照外,其他处理组飞蝗SOD均显著低于对照(P<0.05);7 d后,除0.1%的SOD活性显著对照,0.01%和1%无差异外,其他处理组SOD均显著高于对照(P<0.05)。
由图3(C)所示,不同浓度处理飞蝗后,体内CAT的活性在1、3和7 d后与对照差异不大;第5 d,0.1%、2%和8%处理的飞蝗CAT活性显著低于对照,而0.01%和0.5%处理的CAT活性显著高于对照,其他处理与对照无显著差异(P<0.05)。
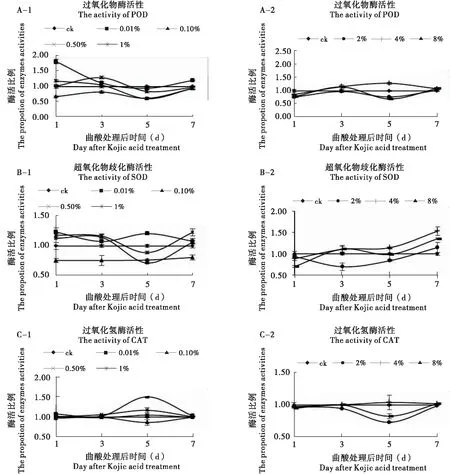
图3 不同浓度曲酸对飞蝗保护酶的影响Fig.3 The activity of antioxidant enzymes in Locusta migratoria L.after Kojic acid treatment注:保护酶活性是处理组酶活与对照组酶活的比值。Note: The value of ordinate represents the enzymes activities of treatment group divided by control group.
3 结论与讨论
曲酸(Kojic acid)是一种真菌毒素,它是许多杀虫真菌如曲霉菌Aspergillus和青霉菌Penicillium的代谢产物(Sarunoetal., 1979)。最初人们期望这种真菌毒素可以发展成为杀虫剂,但是之后证明它对臭虫、果蝇、蚊子等急性毒力很低,无法满足杀虫剂的标准(Beard and Walton, 1969)。在对豆荚草盲蝽Lygushesperus的试验中发现,每天对豆荚草盲蝽饲喂含500 mg/L、1000 mg/L和1500 mg/L曲酸的饲料,直到26 d之后,成虫的存活率分别为94%、77%和81%(Alverson, 2003)。而在对草地贪夜蛾和玉米夜蛾的试验中发现,25 mg/L的曲酸对它们的毒力为零(Dowd, 1988a)。从本试验也可以看出,仅饲喂一天含曲酸的饲料,曲酸对飞蝗无明显的毒力,这与上述研究结果类似。由此可见,曲酸对昆虫的毒杀作用很弱,其本身并不适合直接作为杀虫剂进行应用。
曲酸(Kojic acid)是一种酚氧化酶(PO)的抑制剂。曲酸可以抑制从植物、甲壳类动物和昆虫提取出的酶液中的酚氧化酶活性(Chenetal., 1991; Dowd, 1999)。对于昆虫来说,曲酸对PO的抑制作用的研究在鳞翅目中较多。离体条件下,从小菜蛾P.xylostella和甜菜夜蛾S.exigua整个虫体粗提取的酚氧化酶在测定时加入曲酸后,明显看出酚氧化酶的单酚酶和二酚酶活性下降(Gaoetal., 2003; Wangetal., 2003);海灰翅夜蛾S.littoralis的血淋巴内的PO活性也受到曲酸的抑制作用(Lee and Anstee, 1995)。在本试验中发现,飞蝗取食含曲酸的麦麸后,虫体内PO的二酚酶活性在1 d和3 d后显著下降,这与鳞翅目昆虫中结果相似。不同的是本试验证明了在活体饲喂条件下,曲酸对飞蝗PO活性也有抑制作用。
乙酰胆碱酯酶(AChE)是生物体神经传导中的关键酶(Toutant, 1989),它同时又是有机磷农药的作用靶标,昆虫对此类农药抗药性的产生,乙酰胆碱酯酶的修饰或者改变是关键的考虑因素(Fournier and Mutero, 1994)。有研究表明,曲酸可以抑制哺乳动物的胆碱酯酶(Giroiretal., 1991)。本实验中也发现曲酸处理后的1 d和3 d飞蝗体内AChE活性降低。乙酰胆碱酯酶的活性可以被铜离子螯合物抑制(Mario, 1965),而王树栋等人发现曲酸抑制PO的作用机制可能是因为曲酸与PO内铜集团的结合(王树栋等,2004)。因此,我们推测飞蝗体内AChE活性被曲酸抑制也可能是由于曲酸与铜离子结合的缘故。
昆虫解毒酶(GSTs、ESTs)可以代谢对昆虫有害的外源性物质,昆虫对农药的抗药性的产生也与解毒酶相关(Oppenoorth and Welling, 1976; Hanetal., 1998)。曲酸可以作为拟除虫菊酯类和氨基甲酸酯类杀虫剂防治玉米夜蛾Heliothiszea和草地贪夜蛾Spodopterafrugiperda的增效剂,因为它影响昆虫氧化酶活性(Dowd, 1990);另外研究发现曲酸可以阻止CDNB结合到谷胱甘肽上(Dowd, 1988b)。本试验发现,高浓度曲酸对飞蝗ESTs和GSTs在前期都有很强的抑制作用。这可能与曲酸本身与酶活底物的作用有关。昆虫保护酶(POD、SOD和CAT)可以清除昆虫体内氧化毒性分子,如超氧根离子(O2-)和过氧化氢(H2O2),昆虫保护酶活性的升高代表昆虫所受到了氧化压力(Kohchietal., 2009)。本试验中,偏低浓度的曲酸引起了飞蝗POD和SOD活性的升高可能是由于曲酸造成了飞蝗的氧化压力。而偏高浓度曲酸在对飞蝗POD和SOD还有一定的抑制作用,可能是因为曲酸本身可以阻止生物体的氧化解毒作用(Mullin and Scott, 1992)。
近年来,酚氧化酶(PO)成为新型杀虫剂靶标的研究对象之一。而它的抑制剂曲酸对昆虫其他生化酶的研究却很少。本文研究表明,曲酸本身对飞蝗毒力不高。但是,曲酸可以抑制飞蝗PO的活性,并且还对飞蝗AChE、解毒酶和保护酶有一定的抑制作用,这说明曲酸可能干扰昆虫的免疫系统。曲酸对飞蝗AChE、和解毒酶的抑制作用,可作为有机磷类杀虫剂防治飞蝗的增效剂;另外,曲酸对飞蝗免疫系统中酚氧化酶和保护酶的抑制作用,推测其可以作为杀虫真菌的增效剂。所以,本研究为曲酸可能成为杀虫真菌的一种增效剂提供理论基础。
References)
Alverson J.Effects of mycotoxins, kojic acid and oxalic acid, on biological fitness ofLygushesperus(Heteroptera: Miridae) [J].JournalofInvertebratePathology, 2003, 83 (1): 60-62.
Beard RL, Walton GS.Kojic acid as an insecticidal mycotoxin [J].JournalofInvertebratePathology, 1969, 14 (1): 53-59.
Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].AnalyticalBiochemistry, 1976, 72 (1-2): 248-254.
Cerenius L, Söderhäll K.The prophenoloxidase-activating system in invertebrates [J].ImmunologicalReviews, 2004, 198 (1): 116-126.
Chen JS, Wei C, Rolle RS,etal.Inhibitory effect of kojic acid on some plant and crustacean polyphenol oxidases [J].JournalofAgriculturalandFoodChemistry, 1991, 39 (8): 1396-1401.
Dong H, Gao S, Nong XQ,etal.The control efficiency ofMetarhiziumanisopliaeand Regent to grasshopper [J].HubeiAgriculturalSciences, 2011, 50 (17): 3543-3545.[董辉, 高松, 农向群, 等.应用绿僵菌与锐劲特防治蝗虫的效果[J].湖北农业科学, 2011, 50 (17): 3543-3545]
Dowd PF.Pyrethroid and carbamate insecticides:U.S.Patent 4, 956, 353 [P].1990-9-11.
Dowd PF.Relative inhibition of insect phenoloxidase by cyclic fungal metabolites from insect and plant pathogens[J].NaturalToxins, 1999, 7 (6): 337-341.
Dowd PF.Synergism of aflatoxin B1 toxicity with the co-occurring fungal metabolite kojic acid to two caterpillars [J].EntomologiaExperimentalisetApplicata, 1988, 47 (1): 69-71.
Dowd PF.Toxicological and biochemical interactions of the fungal metabolites fusaric acid and kojic acid with xenobiotics inHeliothiszea(F.) andSpodopterafrugiperda(JE Smith) [J].PesticideBiochemistryandPhysiology, 1988, 32 (2): 123-134.
Feng XD.The analysis of reason and characteristics ofLocustamigratoriaL.outbreak in recent years in China [J].ChinaPlantProtection, 2007, 27 (10): 34-35.[冯晓东.近年我国飞蝗发生特点及原因分析[J].中国植保导刊, 2007, 27 (10): 34-35]
Fournier D, Mutero A.Modification of acetylcholinesterase as a mechanism of resistance to insecticides [J].ComparativeBiochemistryandPhysiologyPartC:Pharmacology,ToxicologyandEndocrinology, 1994, 108 (1): 19-31.
Gao XX, Luo WC, Xie GY,etal.Effects of apigenin, vanillic acid and kojic acid on the phenoloxidase activity inSpodopteraexiguaHübner [J].JournalofPlantResourcesandEnvironment, 2003, 12 (3): 16-19.
Gillespie JP, Burnett C, Charnley AK.The immune response of the desert locustSchistocercagregariaduring mycosis of the entomopathogenic fungus,Metarhiziumanisopliaevaracridum[J].JournalofInsectPhysiology, 2000, 46 (4): 429-437.
Giroir LE, Huff WE, Kubena LF,etal.The individual and combined toxicity of kojic acid and aflatoxin in broiler chickens [J].PoultryScience, 1991, 70 (6): 1351-1356.
Han Z, Moores GD, Denholm I,etal.Association between biochemical markers and insecticide resistance in the Cotton Aphid,AphisgossypiiGlover [J].PesticideBiochemistryandPhysiology, 1998, 62 (3): 164-171.
He YP, Ma EB, Zhu KY.Characterizations of general esterases in relation to malathion susceptibility in two field populations of the oriental migratory locust,Locustamigratoriamanilensis(Meyen) [J].PesticideBiochemistryandPhysiology, 2004, 78 (2): 103-113.
Kohchi C, Inagawa H, Nishizawa T,etal.ROS and innate immunity [J].AnticancerResearch, 2009, 29 (3): 817-821.
Leclerc V, Reichhart JM.The immune response ofDrosophilamelanogaster[J].ImmunologicalReviews, 2004, 198 (1): 59-71.
Lee MJ, Anstee JH.Phenoloxidase and its zymogen from the haemolymph of larvae of the lepidopteranSpodopteralittoralis(Lepidoptera: Noctuidae) [J].ComparativeBiochemistryandPhysiologyPartB:BiochemistryandMolecularBiology, 1995, 110 (2): 379-384.
Li CX, Ma EB.Research progress on migrateory locust,Locustamigratoria[J].EntomologicalKnowledge, 2003, 40(1):24-30.[李春选, 马恩波.飞蝗研究进展[J].昆虫知识, 2003, 40(1):24-30]
Li X, Schuler MA, Berenbaum MR.Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics [J].Annu.Rev.Entomol., 2007, 52: 231-253.
Liu HS, Li YF.The reason and control of outbreak ofLocustamigratoriaL.in Huanghua [J].HebeiAgriculturalSciences, 2010, 8: 89-92.[刘浩升, 李耀发.黄骅市飞蝗大发生原因分析与治理对策[J].河北农业科学, 2010, 8: 89-92]
Luo WC.Phenoloxidase of Insects and its Inhibitors [M].Beijing: Science Press, 2010.[罗万春.昆虫酚氧化酶及其抑制剂[M].北京:科学出版社, 2010]
Ma EB, He YP, Zhu KY.Comparative studies of acetylcholinesterases purified from two field populations of the oriental migratory locust (Locustamigratoriamanilensis): Implications of insecticide resistance [J].PesticideBiochemistryandPhysiology, 2004, 78 (1): 67-77.
Mario E.Inhibition ofAcetylcholinesterase by Copper Chelates [D].Kingston: University of Rhode Island, 1965.
Mullen LM, Goldsworthy GJ.Immune responses of locusts to challenge with the pathogenic fungusMetarhiziumor high doses of laminarin [J].JournalofInsectPhysiology, 2006, 52 (4): 389-398.
Mullin CA, Scott JG.Molecular Mechanisms of Insecticide Resistance [C].New York: ACS Symposium Series, 1992, 505.
Oppenoorth FJ, Welling W.Biochemistry and physiology of resistance.In: Wilkinson CF.Insecticide Biochemistry and Physiology [M].New York: Springer US,1976: 507-551.
Qin G, Jia M, Liu T,etal.Identification and characterisation of ten glutathione-S-transferase genes from oriental migratory locust,Locustamigratoriamanilensis(Meyen) [J].PestManagementScience, 2011, 67 (6): 697-704.
Robinson JM, Badwey JA.Production of active oxygen species by phagocytic leukocytes [J].ImmunologySeries, 1994, 60: 159.
Säderhöll K, Cerenius L.Role of the prophenoloxidase-activating system in invertebrate immunity [J].CurrentOpinioninImmunology, 1998, 10 (1): 23-28.
Saruno R, Kato F, Ikeno T.Kojic acid, a tyrosinase inhibitor fromAspergillusalbus[J].AgriculturalandBiologicalChemistry, 1979, 43 (6): 1337-1338.
Serebrov VV, Gerber ON, Malyarchuk AA,etal.Effect of entomopathogenic fungi on detoxification enzyme activity in greater wax mothGalleriamellonellaL.(Lepidoptera, Pyralidae) and role of detoxification enzymes in development of insect resistance to entomopathogenic fungi [J].BiologyBulletin, 2006, 33 (6): 581-586.
Song GH, Wu WW, Zhi DM.The control and outbreak ofLocustamigratoriaL.in Xingcheng [J].Mod.Agric.Sci.Technol., 2009, 7: 109.[宋国华, 吴微微, 智冬梅.兴城地区飞蝗的发生及防治[J].现代农业科技,2009, 7: 109]
Sree KS, Padmaja V.Destruxin fromMetarhiziumanisopliaeinduces oxidative stress effecting larval mortality of the polyphagous pestSpodopteralitura[J].JournalofAppliedEntomology, 2008, 132 (1): 68-78.
Tang XC, Lu FP.The control and outbreak ofLocustamigratoriaL.in Hainan [J].AnhuiAgriculturalSciences, 2009, 27: 13129-13130.[唐小村, 卢芙萍.海南飞蝗的发生与防治[J].安徽农业科学, 2009, 27: 13129-13130]
Terriere LC.Induction of detoxication enzymes in insects [J].AnnualReviewofEntomology, 1984, 29 (1): 71-88.
Toutant JP.Insect acetylcholinesterase:catalytic properties, tissue distribution and molecular forms [J].ProgressinNeurobiology, 1989, 32 (5): 423-446.
Wang SD, Luo WC, Gao XX,etal.Inhibitory effects of kojic acid on phenoloxidase of diamondback mothPlutellaxylostella[J].ScientiaAgriculturaSinica, 2004, 37 (9): 1316-1321.[王树栋, 罗万春, 高兴祥, 等.曲酸对小菜蛾酚氧化酶抑制作用的研究[J].中国农业科学, 2004, 37 (9): 1316-1321]
Yang HJ, Wang DS, Zhang LS,etal.Preliminary study on the resistance ofLocustamigratoriamanilensis(Meyen) to malathion [J].PlantProtectionTechnologyandExtension, 2002, 22 (8): 11-12.[杨红军, 王东升, 张立顺, 等.飞蝗对马拉硫磷抗性研究初报[J].植保技术与推广, 2002, 22 (8): 11-12]
Yang M, Zhang J, Zhu KY,etal.Increased activity and reduced sensitivity of acetylcholinesterase associated with malathion resistance in a field population of the oriental migratory locust,Locustamigratoriamanilensis(Meyen) [J].PesticideBiochemistryandPhysiology, 2008, 91 (1): 32-38.
Yang ML.Organophosphorus Resistance Mechanisms of Oriental Migratory Locust,Locustamigratoriamanilensis(Meyen) [D].Taiyuan: Shanxi University, 2008.[杨美玲.飞蝗对有机磷杀虫剂的抗性及其机理研究[D].太原: 山西大学, 2008]
Zhang ZW, Ma N.The occurrence regularity and comprehensive treatment technology ofLocustamigratoriamanilensis(Meyen) in Tianjin [J].ScienceandTechnologyofTianjinAgricultureandForestry, 2012, 4: 29-31.[张志武, 马楠.天津飞蝗发生规律及综合治理技术[J].天津农林科技, 2012, 4: 29-31]
The effects of kojic acid on the activities of phenoloxidase and other biochemical enzymes ofLocustmigratoriaL.
LI Yi-Bo1,2, CAO Guang-Chun2, JIA Miao2, JI Ming-Shan1*
(1.College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China; 2.State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China.)
Phenoloxidase (PO) catalyses the oxidation of phenols to quinones, which then will polymerize nonenzymatically to melanin.Therefore PO plays a pivotal role in melanisation reactions in the innate immune system of insects.In recent years, PO has been studied as a new target of insecticides.But few researches have looked at the effects of kojic acid which is an inhibitor of PO on detoxification enzymes and antioxidant enzymes in insects.To investigate the relationship between PO and other biological enzymes of insects, the activities of PO, acetylcholinesterase (AChE), general esterases (ESTs), glutathione-S-transferases (GSTs), peroxidase (POD), superoxide dismutase (SOD) and catalase (CAT) were assayed afterLocustamigratoriaL.were treated with kojic acid.PO, AChE, ESTs and GSTs activities decreased in the kojic acid-treatedL.migratoriain comparison with control after 1, 3 d.POD, SOD and CAT activities increased after 3 d and decreased after 5 d in comparison with control.The results indicated that kojic acid showed inhibitory effects on PO and other biochemical enzymes ofL.migratoriaand kojic acid may be a synergist for chemical and biological insecticides.
Kojic acid;LocustamigratoriaL.; phenoloxidase; detoxification enzymes; antioxidant enzymes
李一波,曹广春,贾苗,等.曲酸对飞蝗酚氧化酶以及其他生化酶活性的影响[J].环境昆虫学报,2017,39(3):640-649.
国家自然科学基金(31471824)
李一波,男,1990年生,山西晋城人,硕士研究生,研究方向为农药毒理学,E-mail: liyibo373@163.com
*通讯作者Author for correspondence,E-mail: jimingshan@163.com
Received: 2016-04-05; 接受日期Accepted: 2016-05-12
Q965;S433.2
A
1674-0858(2017)03-0640-10
