滞育及不同虫态下亚洲玉米螟内参基因的筛选
2017-08-02张统书李忠洲段立佳李帅强
刘 宁,张统书,李忠洲,段立佳,李帅强,董 辉*,丛 斌*
滞育及不同虫态下亚洲玉米螟内参基因的筛选
刘 宁1,张统书1,李忠洲2,段立佳1,李帅强1,董 辉1*,丛 斌1*
(1.沈阳农业大学植物保护学院,沈阳 110161;2.抚顺出入境检验检疫局,抚顺113006)
筛选出滞育状态下以及不同虫态下亚洲玉米螟Ostriniafurnacalis(Guenée)的实时荧光定量PCR(RT-qPCR)最稳定内参基因,本结果为研究不同虫态及滞育1个月,滞育2个月,滞育3个月和滞育4个月的亚洲玉米螟目的基因表达水平提供参考依据。本文以不同虫态及滞育状态下的亚洲玉米螟为试验材料,应用RT-qPCR技术检测β-actin,18SrRNA,EF1-α和RPS3共4个候选内参基因的表达稳定性水平,结合geNorm,Normfinder,BestKeeper和RefFinder软件分析各候选内参基因在不同处理下的表达稳定性。结果表明,在亚洲玉米螟不同虫态中,4个候选内参基因的稳定性大小排序为18SrRNA>EF1-α>β-actin>RPS3;滞育1个月,滞育2个月,滞育3个月和滞育4个月的亚洲玉米螟,稳定性大小排序为β-actin>EF1-α>18SrRNA>RPS3。18SrRNA和β-actin可分别作为不同虫态和滞育状态下的亚洲玉米螟基因表达水平分析试验中的内参基因。
亚洲玉米螟;内参基因;RT-qPCR;18SrRNA;β-actin
实时荧光定量逆转录聚合酶链式反应(real-time quantitative reverse transcription-PCR,RT-qPCR)是一种检测mRNA表达丰度的可靠技术,该技术凭借其高灵敏度,运算精度与适用范围广等特点而被广泛应用(Iktenetal., 2016;Normannetal., 2016)。然而,RNA的产量,完整性及其质量,酶的活性和PCR扩增效率等方面的差异性变化均可对目的基因特异性表达的真实CT值造成影响(崔淼等,2014;Yangetal., 2016)。因此,进行RT-qPCR试验时选择较为稳定表达的管家基因作为内参基因对目的基因表达量进行标准化与校正是至关重要的(Lordetal., 2010;Silvaetal., 2016)。在很多研究中,参与基本细胞流过程的传统管家基因通常作为内参基因,例如肌动蛋白(Actin)、微管蛋白(Tubulin)、延伸因子(EF1-a)和3-磷酸甘油醛脱氢酶(GAPDH)等(王佳等,2014;潘畅等,2016)。一个理想的内参基因在不同试验条件下,不同组织类型和各发育阶段中均稳定表达(Lietal., 2016; Youetal., 2016)。然而,大量研究结果表明,这些被广泛使用的管家基因在不同试验条件下,其表达量具有显著差异性(Sunetal., 2016;Wrzesińskaetal., 2016)。故选择内参基因时,需要对其进行严格的分析与评估(Wieczoreketal., 2013)。近几年来,geNorm(Vandesompeleetal., 2002),BestKeeper(Pfaffletal., 2004),NormFinder(Andersenetal., 2004)和RefFinder(Xieetal., 2011)软件广泛应用于内参基因的筛选与评估分析中(肖翠等,2012)。geNorm对所有内参基因进行表达稳定性评估(M值),其中M<1.5的内参基因被认为较稳定(Ongetal., 2016)。NormFinder与geNorm工作原理相同,根据稳定度筛选出最优的一个内参基因。BestKeeper在变异分析的基础之上对内参基因进行稳定性评估,标准误(SD)或者变异系数(CV)越小,则认为该基因稳定性越强。RefFinder是一个在线综合分析软件,整合了geNorm,BestKeeper,NormFinder和Delta CT方法,计算出稳定性等级的平均值,稳定性平均等级指数越小越稳定。近来,国内外研究学者均用上述分析方法对多种昆虫的内参基因稳定性进行评估与筛选(陈芳等,2014),例如二斑叶螨Tetranychusurticae(周兴隆等,2015),丝光绿蝇Luciliasericata(Bagnalletal., 2010),褐飞虱Nilaparvatalugens(Yuanetal., 2014),棉铃虫Helicoverpaarmigera(Zhangetal., 2015)等。
亚洲玉米螟是我国玉米种植上的常发性害虫,以老熟幼虫形态滞育越冬,在翌年作为虫源造成严重危害。结合分子、基因等研究方法,探索亚洲玉米螟发生发展机制具有良好的研究前景,利用RT-qPCR技术对亚洲玉米螟基因表达(郭建青,2013;陈鹏等,2014)分析研究已有报道,但对内参基因的筛选仍未空白。为确保目的基因表达水平的准确性,需引入内参基因作为参照。本研究选取了不同虫态(卵、幼虫、蛹和成虫)及不同滞育状态下(滞育1个月,滞育2个月,滞育3个月和滞育4个月)的亚洲玉米螟共8份试验材料,利用RT-qPCR技术检测了β-actin,18SrRNA,EF1-α和RPS3共4个内参基因在不同虫态以及不同滞育状态下的亚洲玉米螟中表达水平,并应用geNorm,Normfinder,BestKeeper和RefFinder软件分析了各候选内参基因的表达稳定性,筛选出最适的内参基因,在亚洲玉米螟后续的相关基因表达的研究中,为其选择合适的内参基因提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 供试虫源
不同滞育状态下试虫:于2016年10月至2017年1月期间滞育1个月,滞育2个月,滞育3个月和滞育4个月的亚洲玉米螟,从沈阳农业大学试验田剖杆采集,每次试验选择3头大小一致的幼虫,用于分析不同滞育状态下候选内参基因的稳定性(3次生物学重复)。
不同虫态试虫:沈阳农业大学植物保护学院实验室内饲养,温度为26℃±1℃,相对湿度为75%±5%,光周期为16 L∶8 D。分别收集亚洲玉米螟卵(产卵后12 h)、幼虫(5th)、蛹(化蛹后1 d)及成虫(羽化后3 d)用于分析不同虫态候选内参基因的稳定性(3次生物学重复)。
1.2 试验方法
1.2.1 亚洲玉米螟总RNA的提取及检测
按照Trizol说明书提取各个处理的亚洲玉米螟总RNA。利用1%琼脂糖凝胶电泳检测总RNA完整性,并用Thermo公司的核酸蛋白检测仪NanoDrop2000检测总RNA浓度与纯度(所有样本RNA均满足条件:A260/230>2.0,2.0>A280/260>1.8)。参照PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明反转录合成cDNA第一链。
1.2.2 亚洲玉米螟候选内参基因表达引物设计
根据Gene bank(http:∥www.ncbi.nlm.nih.gov/)数据库内亚洲玉米螟相关信息,筛选出4个候选内参基因β-actin(KT366041.1),18SrRNA(GU205787.1),EF1-α(KC966937.1),RPS3(EU275206.2)。通过Primer Premier 5.0软件设了计实时荧光定量PCR(Quantitative Real-Time PCR,RT-qPCR)特异性引物,引物均由上海生物工程有限公司合成(表1)。

表1 RT-qPCR引物序列Table 1 Primer pairs used for PCR
1.2.3 候选内参基因的表达量检测
利用实时荧光定量PCR技术,采用SYBR GreenⅡ染料法,在Bio-Rad CFX96 PCR仪上进行扩增、熔解曲线的分析,总反应体系20 μL,包括2×SYBR Premix Ex TaqⅡ10 μL,上下游引物各0.8 μL,去除RNA酶ddH2O 7.6 μL,cDNA模板0.8 μL。每个反应设3个复孔,扩增程序采用两步法:95℃预变性30 s;然后95℃变性10 s,60℃退火延伸40 s,共40个循环。
1.2.4 标准曲线绘制
将cDNA原液依次稀释5、52、53、54、55、56倍作为模板。按照1.2.4反映体系及程序进行RT-qPCR反应。并根据标准曲线对各引物的扩增效率进行分析。
1.2.5 数据统计分析
利用软件geNorm(Vandesompeleetal., 2002),BestKeeper(Pfaffletal., 2004),Normfinder(Andersenetal., 2004)软件及在线软件RefFinder评估与分析亚洲玉米螟各候选内参基因表达稳定性。
2 结果与分析
2.1 亚洲玉米螟内参基因引物特异性验证
以亚洲玉米螟cDNA为模板进行普通PCR扩增,所得扩增产物长度与预期一致。进一步对4个内参基因进行RT-qPCR反应,所有内参基因的溶解曲线均为单一峰,表明引物无非特异性扩增现象,故RT-qPCR的结果真实可靠。
2.2 亚洲玉米螟内参基因的CT值分析
比较不同虫态及滞育状态下亚洲玉米螟4个内参基因的CT值,它们的表达水平均存在一定的变化(图1),该结果说明,不同虫态及不同滞育状态可能影响这些候选内参基因的表达量。不同虫态的亚洲玉米螟四个候选内参基因β-actin、18SrRNA、RPS3和EF1-α的CT值变化范围分别为22.11-25.95、12.11-16.46、22.44-28.51和30.35-33.39,EF1-α的CT值变异程度最小(ΔCT=3.04;CV=0.030),RPS3的CT值变异程度最大(ΔCT=6.03;CV=0.081)(图1 A);不同滞育状态下的亚洲玉米螟中4个候选内参基因β-actin、18SrRNA、RPS3和EF1-α的Ct值变化范围分别为26.03-26.80、15.41-16.33、24.59-28.63和31.18-33.18,β-actin的CT值变异程度最小(ΔCT=0.77;CV=0.011),RPS3的Ct值变异程度最大(ΔCT=2.00;CV=0.067)(图1 B)。
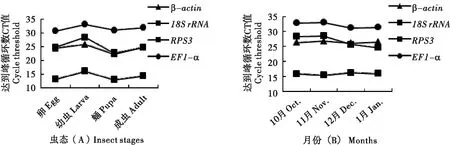
图1 不同虫态(A)及滞育状态下(B)亚洲玉米螟4个候选内参基因CT值的比较 Fig.1 CT values of four candidate reference genes in different stages (A) and different diapause stages,i.e.,collected from October to January (B) of Ostrina furnacalis
2.3 候选内参基因的稳定性评估
2.3.1 geNorm软件评估结果
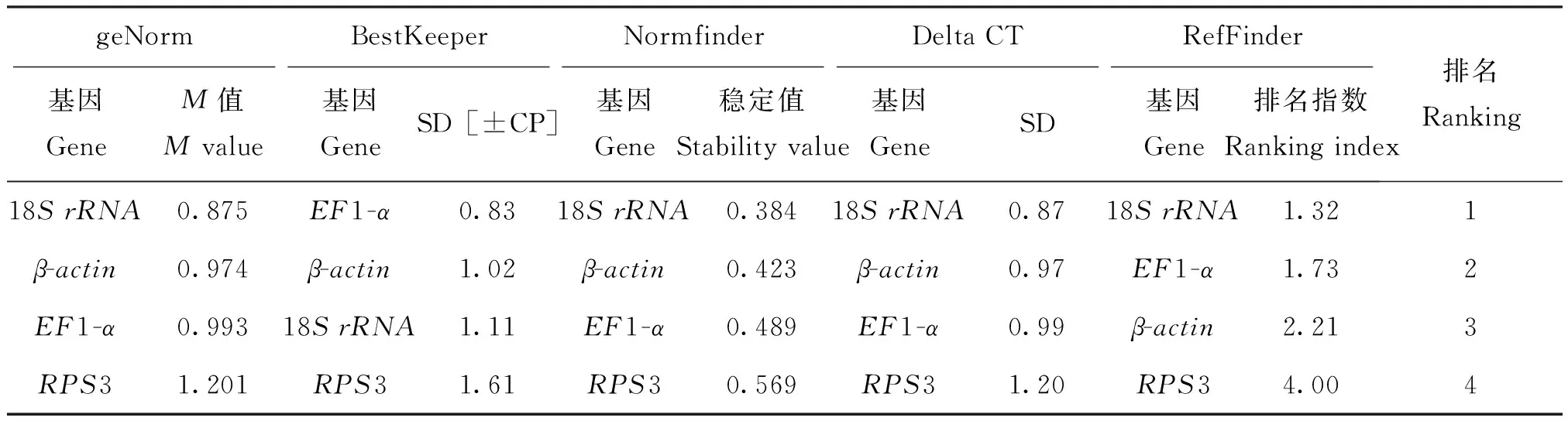
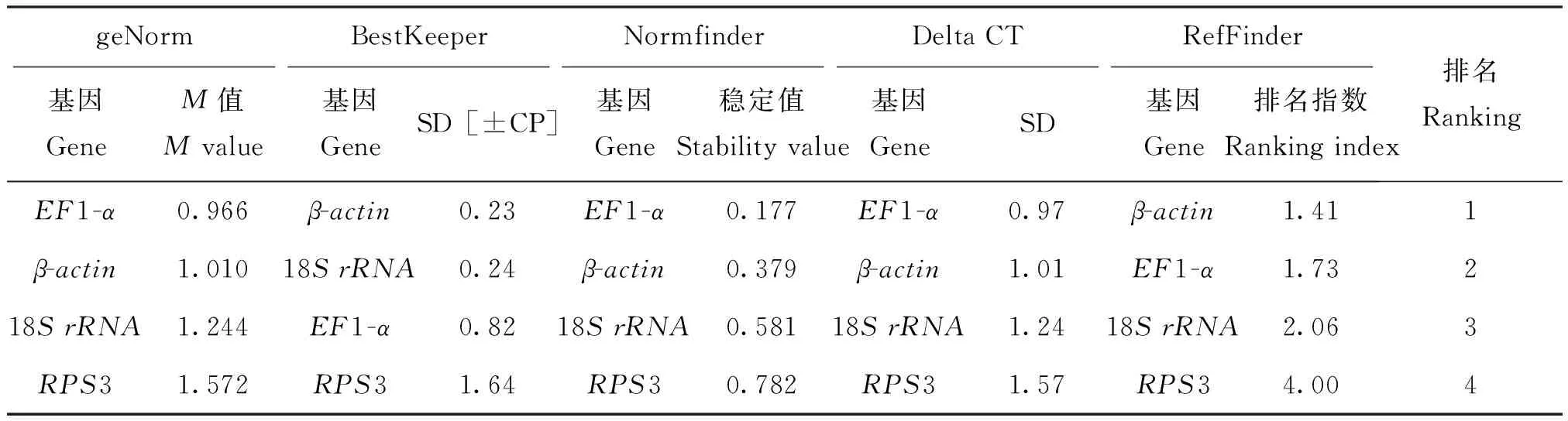
应用genorm软件评估4个候选内参基因β-actin、18SrRNA、RPS3和EF1-α的表达稳定度M值,并由大到小进行排序,亚洲玉米螟不同虫态为RPS3(1.201)>EF1-α(0.993)>β-actin(0.974)>18SrRNA(0.875)(图2 A);不同滞育状态的亚洲玉米螟为RPS3(1.572)>18SrRNA(1.244)>β-actin(1.010)>EF1-α(0.966)(图2 B),该结果表明,18SrRNA在不同虫态中表达最稳定,EF1-α在不同滞育状态下表达最稳定。
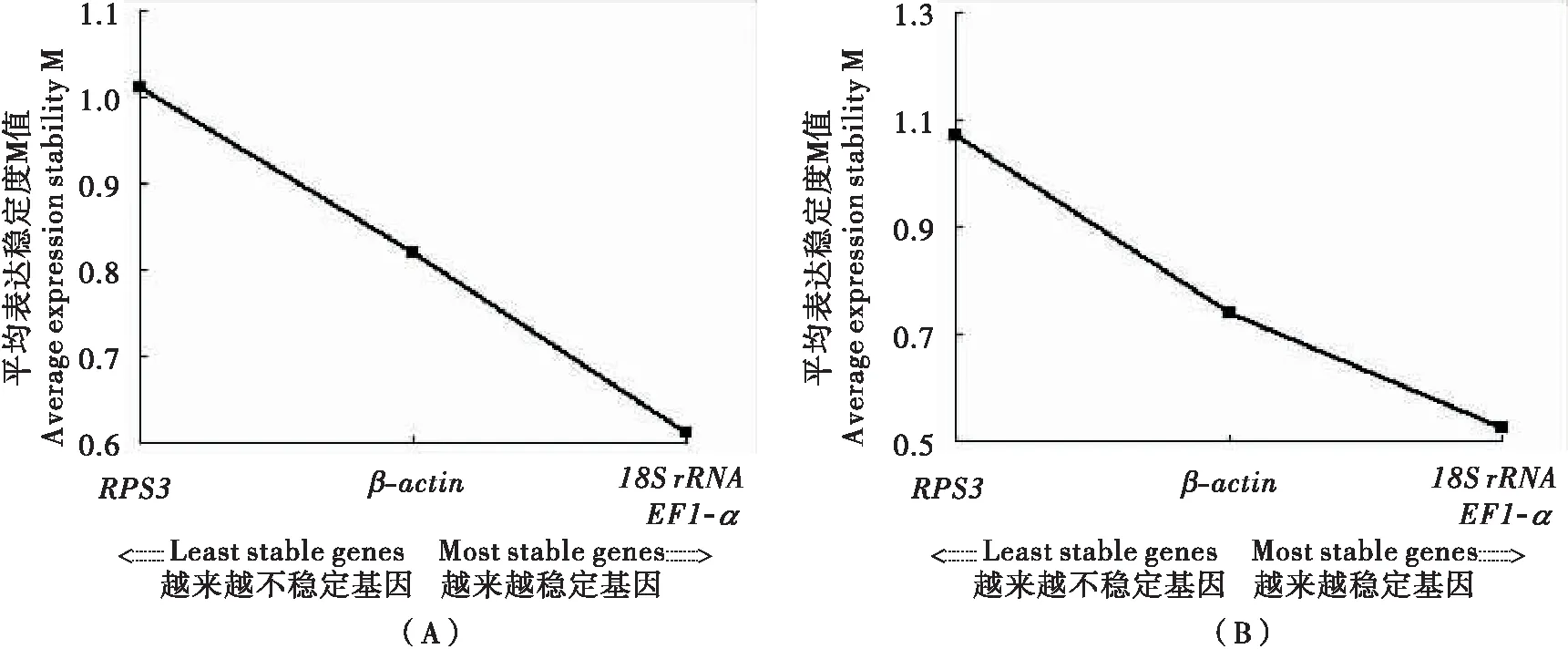
图2 应用geNorm软件分析不同虫态(A)及不同滞育状态亚洲玉米螟(B)各内参的表达稳定度值(M)Fig.2 Expression stability values (M) of reference genes in different stages (A) and different diapause stages,i.e.,collected from October to January (B) of Ostrina furnacalis analyzed by geNorm
2.3.2 Normfinder软件评估结果
应用Normfinder软件评估4个候选内参基因β-actin、18SrRNA、RPS3和EF1-α的表达稳定度,候选内参基因在亚洲不同虫态玉米螟中的稳定度排序为:18SrRNA(0.348)>β-actin(0.423)>EF1-α(0.489)>RPS3(0.569);不同滞育状态的亚洲玉米螟为:EF1-α(0.177)>β-actin(0.379)>18SrRNA(0.581)>RPS3(0.782)。在不同虫态中,18SrRNA表达最稳定,在不同月份下,EF1-a为最优内参基因,与geNorm软件分析结果一致(表2)。
2.3.3 BestKeeper软件评估结果
应用BestKeeper软件评估4个候选内参基因结果显示SD值(表3),亚洲玉米螟不同虫态,EF1-α<β-actin<18SrRNA 2.3.4 综合评估结果 综合上述3种软件及在线软件RefFinder的评估结果表明,不同虫态中选择18SrRNA为最优内参基因(表4),不同月份滞育下选择β-actin为最优内参基因(表5)。 表2 应用NormFinder软件分析亚洲玉米螟内参基因的表达稳定性Table 2 Expression stability of reference genes of Ostrinia furnacalis by NormFinder 亚洲玉米螟Ostriniafurnacalis(Guenée)做为玉米上的主要害虫,多年来一直有大量报道,RT-qPCR技术在亚洲玉米螟目的基因表达分析研究中得到了广泛应用(郭建青,2013;陈鹏等,2014)。为了明确亚洲玉米螟目的基因的表达水平,必须引入内参基因对目的基因进行标准化,由于,目的基因表达量会受内外界的多种因素影响,如RNA完整性及反转录效率等(Pfaffletal., 2004;Wrzesińskaetal., 2016)。也有研究表明,在柑橘大实蝇中,RPL32在不同发育阶段和不同温度处理中表达最稳定,在不同温度下和一个γ辐射处理下理想表达的基因是GAPDH,G6PDH和RPL32(Lüetal., 2014);β-actin在感染细菌的蜜蜂中表达稳定,而在感染真菌的赤拟谷盗中不稳定表达(Lordetal., 2010);β-actin和18SrRNA在蝗虫发育阶段中稳定表达,然而,在抵低压缺氧条件下表达水平发生改变(Zhaoetal., 2012)。周晓慧(2014)研究表明,在碦西茄干旱和盐胁迫条件下EF1-α和GAPDH表达稳定性最好,TUA和18SrRNA在碦西茄不同组织中表达最稳定。因此筛选出在特定试验条件下表达稳定性好的内参基因是非常关键的。 表3 应用BestKeeper软件分析亚洲玉米螟内参基因的表达稳定性Table 3 Expression stability of reference genes of Ostrinia furnacalis by BsetKeeper 表4 4个候选内参基因不同虫态的稳定性等级排序Table 4 Overall stability rank of four candidate reference genes of different stages 表5 4个内参基因不同滞育状态的表达稳定性Table 5 Overall stability rank of four candidate reference genes of different diapause stages 在本试验中,选择了4个亚洲玉米螟候选内参基因。根据geNorm、NormFinder、BestKeeper及RefFinder软件综合评估了4个候选内参基因的稳定性。在不同虫态的亚洲玉米螟试验中,4个候选内参基因稳定性等级综合排名为,18SrRNA(rank=1.32)>EF1-α(rank=1.73)>β-actin(rank=2.21)>RPS3(rank=4.00),18SrRNA是表达稳定性最好的基因,其次是EF1-α,RPS3被认为稳定性最差。然而,geNorm和Normfinder软件分析均显示18SrRNA是表达稳定性最好的基因,M值最小,BestKeeper分析表明EF1-α的SD=0.83<1,其它3个候选内参基因的SD值均大于1,EF1-α稳定性最好。在不同滞育状态下的亚洲玉米螟试验中,4个候选内参基因稳定性等级综合排名为β-actin(rank=1.41)>EF1-α(rank=1.73)>18SrRNA(rank=2.06)>RPS3(rank=4.00),β-actin表达稳定性最好,18SrRNA和EF1-α稳定性次之,RPS3最不稳定。然而,geNorm和Normfinder软件分析均显示EF1-α表达最稳定,M值最小,BestKeeper软件分析仅RPS3的SD值大于1,其余3个候选内参基因SD值均小于1,但β-actin的SD值最小,表达最稳定。geNorm与NormFinder程序算法需要将数据CT值转化为Q=2ΔCT值方法,然而BestKeeper软件直接输入CT值进行计算分析。3种软件分析结果之间的差异可能是由于应用不同数据分析导致。因此,本文研究结果需要通过RefFinder软件进行综合评估,从而得到综合排名指数,排名指数越小,说明该基因越稳定。 本文研究结果表明,亚洲玉米螟不同虫态中,18SrRNA表达稳定性最好,RPS3稳定性最差;在不同滞育状态下,β-actin表达稳定性最好,RPS3稳定性最差。这些结果依据上述3种不同软件及在线软件RefFinder综合分析得到。因此,在亚洲玉米螟不同虫态试验中选择18SrRNA作内参基因;在不同滞育状态下,可选择β-actin作最适内参基因。本研究结果可为亚洲玉米螟生长发育及滞育等过程的分子机理研究提供参考依据。 References) Andersen CL, Jensen JL, Ørntoft TF.Normalization of real-time quantitative reverse transcription-PCR data: A model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets [J].CancerResearch, 2004, 64 (15): 5245-5250. Bagnall NH, Kotze AC.Evaluation of reference genes for real-time PCR quantification of gene expression in theAustraliansheepblowfly, Lucilia cuprina [J].MedicalandVeterinaryEntomology, 2010, 24 (2): 176-181. Chen F, Lu YY.Selection of reference genes inPhenacoccussolenopsis(Hemiptera:Pseudococcidae) under heat stress [J].ActaEntomologicaSinica, 2014, 57 (10): 1146-1154.[陈芳, 陆永跃.热胁迫下棉花粉蚧内参基因的筛选[J].昆虫学报, 2014, 57 (10): 1146-1154] Chen P, Qu MB, Yang J.Cloning and expression of two laccase genesOfLac1 andOfLac2 from the insectOstriniafurnacalis[J].ScientiaAgriculturaSinica, 2014, 47 (7): 1341-1350.[陈鹏, 屈明博, 杨君.亚洲玉米螟两种漆酶基因OfLac1和OfLac2 cDNA的克隆及基因表达[J].中国农业科学, 2014, 47 (7): 1341-1350] Cui M, Liu XJ, Li T,etal.Selection of reference genes on different days during the development of the fifth-instar nymph ofLocustamigratoriawith quantitative real-time PCR [J].ChineseJournalofAppliedEntomology, 2014, 51 (3): 733-740.[崔淼, 刘晓健, 李涛, 等.五龄飞蝗不同发育时间实时荧光定量PCR内参基因的筛选[J].应用昆虫学报, 2014, 51 (3): 733-740] Guo JQ.Cloning and Expression Analysis of Glycogen Phosphorylase Gene inOstriniafurnacalis(Guenée) (Lepidoptera: Crambidae) [D].Beijing: Chinese Academy of Agricultural Sciences Master Dissertation, 2013.[郭建青.亚洲玉米螟糖原磷酸化酶基因的克隆及表达分析[D].北京: 中国农业科学院, 2013]Ikten C, Ustun R, Catal M,etal.Multiplex real-time qPCR assay for simultaneous and sensitive detection of phytoplasmas in sesame plants and insect vectors [J].PLoSONE, 2016, 11 (5): e0155891. Li J, Jia H, Han X,etal.Selection of reliable reference genes for gene expression analysis under abiotic stresses in the Desert Biomass Willow,Salixpsammophila[J].FrontiersinPlantScience, 2016, 7 (131): 1505. Lord JC, Hartzer K, Toutges M,etal.Evaluation of quantitative PCR reference genes for gene expression studies inTriboliumcastaneumafter fungal challenge [J].JournalofMicrobiologicalMethods, 2010, 80 (2): 219-221. Lü ZC, Wang LH, Dai RL,etal.Evaluation of endogenous reference genes ofBactrocera(Tetradacus)minaxby gene expression profiling under various experimental conditions [J].FloridaEntomologicalSociety, 2014, 97 (2): 597-604. Normann KR, Berland Øystese KA, Berg JP,etal.Selection and validation of reliable reference genes for RT-qPCR analysis in a large cohort of pituitary adenomas [J].MolecularandCelluarEndocrinonogy, 2016, 437 (C): 183-189. Ong OTW,Young LJ,Old JM.Valuation of reference genes for gene expression in red-tailed Phascogale (Phascogalecalura) liver, lung, small intestine and spleen [J].PeerJ., 2016, 4: e2552. Pan C, Zhang YH, Pang H,etal.Selection of the reference genes for gene expression studies inCryptolaemusmontrouzieriMulsant by qRT-PCR [J].JouranlofEnviromentalEntomology, 2016, 38 (2): 261-270.[潘畅, 张宇宏, 庞虹.孟氏隐唇瓢虫qRT-PCR分析中内参基因的筛选[J].环境昆虫学报, 2016, 38 (2): 261-270] Pfaffl MW, Tichopad A, Prgomet C,etal.Determination of stable housekeeping genes,differentially regulated target genes and sample integrity: Bestkeeper-excel-based tool using pair-wise correlations [J].Biotechnol.Lett., 2004, 26 (6): 509-515. Silva PRAD, Vidal MS, Soares CDP,etal.Selection and evaluation of reference genes for RT-qPCR expression studies onBurkholderiatropicastrain Ppe8, a sugarcane-associated diazotrophic bacterium grown with different carbon sources or sugarcane juice [J].AntonievanLeeuwenhoek, 2016, 109 (11): 1493-1502. Sun HP, Li F, Ruan QM,etal.Identification and validation of reference genes for quantitative real-time PCR studies inHederahelixL [J].PlantPhysiologyandBiochemistry, 2016, 108: 286-294. Vandesompele J, De Preter K, Pattyn F,etal.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes [J].GenomeBiology, 2002, 3 (7): 1-12. Wang J, Zhao J,Liu YH.Evaluation of endogenous reference genes inBactroceraminax(Diptera:Tephritidae) [J].ActaEntomologicaSinica, 2014, 57 (12): 1375-1380.[王佳, 赵静, 刘映红.柑橘大实蝇内参基因的评估[J].昆虫学报, 2014, 57 (12): 1375-1380] Wieczorek P, Wrzesińska B,Obrępalska-Stęplowska A.Assessment of reference gene stability influenced by extremely divergent disease symptoms inSolanumycopersicumL [J] .JournalofVirologicalMethods, 2013, 194 (1-2): 161-168. Wrzesińska B,Kierzek R,Obrępalska-Stęplowska A.Evaluation of six commonly used reference genes for gene expression studies in herbicide-resistantAvenafatuabiotypes [J].WeedResearch, 2016, 56 (4): 284-292. Xiao C, Yan JW, Long GY,etal.Stability evaluation of reference genes in citrus [J].JournalofFruitScience, 2012, 29 (6): 978-984.[肖翠, 严佳文, 龙桂友, 等.柑橘内参基因的稳定性评价[J] .果树学报, 2012, 29 (6): 978-984] Xie F, Sun G, Stiller JW,etal.Genome-wide functional analysis of the cotton transcriptome by creating an integrated EST database [J].PLoSONE, 2011, 6 (11): e26980. Yang CX, Preisser E, Zhang HJ,etal.Selection of reference genes for RT-qPCR analysis inCoccinellaseptempunctatato assess un-intended effects of RNAi transgenic plants [J] .FrontiersinPlantScience, 2016, 7: e53006. You YH, Zhang L, Li PM,etal.Selection of reliable reference genes for quantitative real-time PCR analysis in plum (PrunussalicinaLindl) under different postharvest treatments [J].ScientiaHorticulturae, 2016, 210: 285-293. Yuan M, Lu YH, Zhu X,etal.Selection and evaluation of potential reference genes for gene expression analysis in the brown planthopper,Nilaparvatalugens(Hemiptera:Delphacidae) using reverse-transcription quantitative PCR [J].PLoSONE, 2014, 9 (1): e86503. Zhang SD, An SH, Li Z,etal.Identification and validation of reference genes for normalization of gene expression analysis using qRT-PCR inHelicoverpaarmigera(Lepidoptera:Nocidae) [J].Gene, 2015, 555 (2): 393-402. Zhao DJ, Guo K, Kang L.Identification of condition-specific reference genes from microarray data for locusts exposed to hypobaric hypoxia [J].FederationofEuropeanBiochemicalSocieties, 2012, 8 (1): 235-240. Zhou XH, Liu J, Zhuang Y.Selection of appropriate reference genes inSolanumaculeatissimumfor quantitative gene expression studies under different experimental conditions [J].ActaHorticulturaeSinica, 2014, 41 (8): 1731-1738.[周晓慧, 刘军, 庄勇.喀西茄内参基因实时荧光定量PCR表达稳定性评价[J].园艺学报, 2014, 41 (8): 1731-1738] Zhou XL, Yang SY, Hao Y,etal.Selection of the most suitable reference genes and expression profiling ofCYP392Asubfamily genes in the multi-pesticide resisitant strain ofTetranychusurticae(Acari: Tetranychidae) [J].ActaEntomologicaSinica, 2015, 58 (11): 1229-1236.[周兴隆, 杨顺义, 郝雨,等.二斑叶螨多重抗性品系最优内参基因的筛选及CYP392A亚家族基因的表达分析[J].昆虫学报, 2015, 58 (11): 1229-1236] Selection of the reference genes inOstriniafurnacalis(Guenée) under diapause and different insect states LIU Ning1, ZHANG Tong-Shu1, LI Zhong-Zhou2,DUAN Li-Jia1, LI Shuai-Qiang1, DONG Hui1*, CONG Bin1* (College of Plant Protection, Shenyang Agricultural University, Shenyang 110161, China;2.Entering/Leaving Country Examination Quarantine Bareau of Funshun City,Fushun 113006,Liaoning Province, China) Selecting the suitable reference genes inOstriniafurnacalis(Guenée) under different diapause stages and different stages, this result provides an accurate reference for future study of the different diapause stages, i.e., collected from October to January, and different stages ofOstriniafurnacalis(Guenée) in the experiment of the level of gene expression.In the study, by the method of RT-qPCR,Ostriniafurnacalis(Guenée) as experimental material, the mRNA levels of four candidate reference genes such asβ-actin, 18SrRNA,EF1-aandRPS3 were assessed; Three software-based approaches (geNorm, Normfinder and BestKeeper) and one web-based comprehensive tool (RefFinder) were used to analyze the expression stability of these genes under different treatments.According to the comprehensive rank of RefFinder, the expression stability of above four candidate reference genes were 18SrRNA>EF1-a>β-actin>RPS3 from different stages ofOstriniafurnacalis(Guenée); the expression stability of above four candidate reference genes wereβ-actin>EF1-a>18SrRNA>RPS3 from different diapause stages, i.e., collected from October to January ofOstriniafurnacalis(Guenée).18SrRNAandβ-actincan be respectively uesd as a reference gene for different stages and different diapause stages ofOstriniafurnacalis(Guenée) in the experiment of the level of gene expression. Ostriniafurnacalis; reference genes; RT-qPCR; 18SrRNA;β-actin 刘宁,张统书,李忠洲,等.滞育及不同虫态下亚洲玉米螟内参基因的筛选[J].环境昆虫学报,2017,39(3):611-617. 农业部公益性行业科研专项(201303026);国家重点研发计划(2016YFD0300704) 刘宁,女,1991年生,辽宁人,硕士研究生,研究方向为害虫生物防治与昆虫分子生态学,E-mail:13940434836@139.com *通讯作者Author for correspondence,E-mail: biocontrol@163.com; bin1956@163.com Received: 2017-01-22;接受日期Accepted: 2017-03-19 Q963;S433.4 A 1674-0858(2017)03-0611-07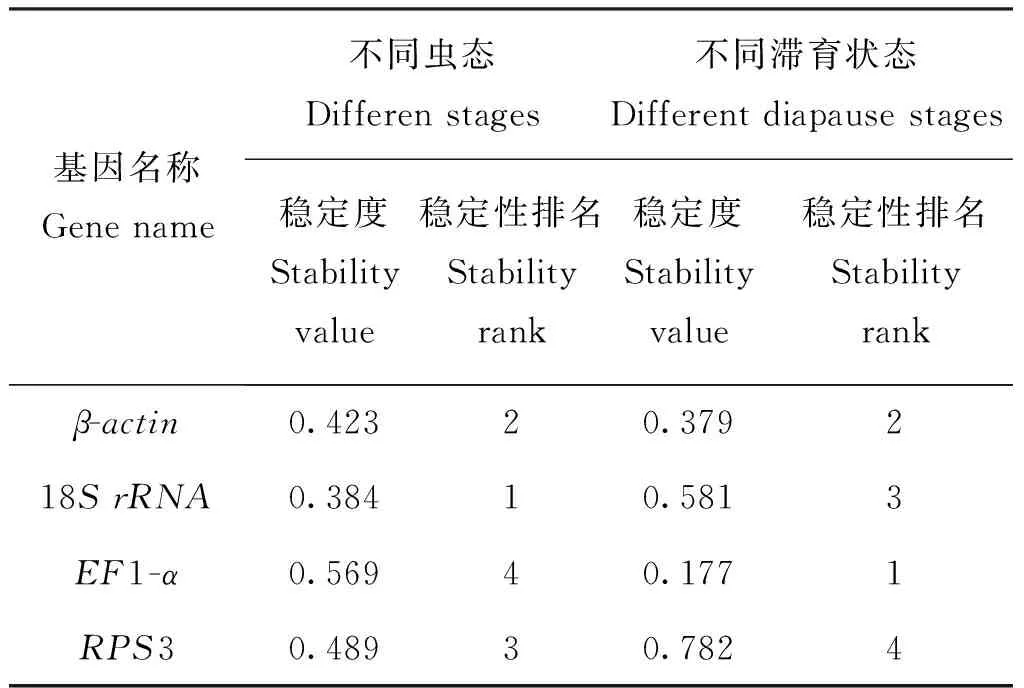
3 结论与讨论