联合第2版前列腺影像报告与数据系统评分与前列腺特异性抗原的Logistic回归预测模型诊断移行区前列腺癌
2017-07-31雷李智许乙凯侯美蓉何梦琪南方医科大学南方医院影像中心广东广州510515
雷李智,许乙凯,侯美蓉,何梦琪(南方医科大学南方医院影像中心,广东 广州 510515)
联合第2版前列腺影像报告与数据系统评分与前列腺特异性抗原的Logistic回归预测模型诊断移行区前列腺癌
雷李智,许乙凯*,侯美蓉,何梦琪
(南方医科大学南方医院影像中心,广东 广州 510515)
目的 建立第2版前列腺影像报告和数据系统(PI-RADS v2)评分联合前列腺特异性抗原(PSA)的Logistic回归预测模型,评价其对移行区前列腺癌(PCa)的诊断价值。方法 回顾性分析经病理证实的移行区前列腺腺癌(PCa组,n=33)和良性前列腺增生或前列腺炎(非PCa组,n=54)患者的术前MRI及PSA资料。采用PI-RADS v2对2组进行评分(由低至高评为1~5分)。分析2组的PI-RADS v2评分、总PSA(t-PSA)、游离PSA(f-PSA)与t-PSA比值(f-PSA/t-PSA)及PSA密度(PSAD)的差异,选择有统计学意义的指标为自变量,以病理结果是否为PCa为因变量,建立3项Logistic回归模型:PI-RADS v2+t-PSA(A);PI-RADS v2+f-PSA/t-PSA(B);PI-RADS v2+PSAD(C)。建立Logistic回归模型产生的Logit(P)和PI-RADS v2评分的ROC曲线,评估其诊断效能。结果 2组t-PSA、f-PSA/t-PSA、PSAD及PI-RADS v2评分差异均有统计学意义(P均<0.01)。A、B、CLogistic回归预测模型分别为:Logit(P)=-8.682+1.507 PI-RADS v2+0.234 t-PSA(χ2=65.993,P<0.01);Logit(P)=-5.425+1.906 PI-RADS v2-13.921 f-PSA/t-PSA(χ2=65.993,P<0.01);Logit(P)=-7.534+1.045 PI-RADS v2+13.318 PSAD(χ2=74.036,P<0.01)。以A、B、C模型产生的Logit(P)预测病理结果,其ROC曲线下面积分别为0.945、0.919、0.960,均高于单独使用PI-RADS v2评分(AUC为0.861),差异有统计学意义(P均<0.01)。其中C模型诊断效能最佳,其敏感度、特异度分别为87.88%、92.59%。单独使用PI-RADS v2评分的敏感度、特异度分别为87.88%、77.78%。结论 联合PI-RADS v2评分和PSA指标的Logistic回归预测模型对移行区PCa的诊断效能优于单独使用PI-RADS v2评分,为可疑移行区PCa患者行穿刺活检提供了可靠的依据。
前列腺影像报告和数据系统第2版;Logistic回归模型;前列腺肿瘤;前列腺特异性抗原
近年来我国前列腺癌(prostate cancer, PCa)发病率呈逐年上升趋势[1],已成为严重威胁老年男性健康的恶性肿瘤之一,25%~30%的PCa发生于移行区[2]。多参数MRI是目前认为诊断PCa最好的影像方法[3-5],基于多参数MRI的第2版前列腺影像报告与数据系统(prostate imaging reporting and date system version 2, PI-RADS v2)可为诊断移行区PCa提供半定量标准[6]。移行区组织成分复杂,常含有大量良性前列腺增生(benign prostate hyperplasia, BPH)结节,使移行区PCa与BPH影像鉴别困难[7-8]。临床常采用前列腺特异性抗原(prostate specific antigen, PSA)检测与筛查PCa,方法简便,但其敏感度及特异度相对较差[9]。本研究旨在建立联合PI-RADSv2评分与PSA的Logistic回归预测模型,评价其对移行区PCa的诊断效能。
1 资料与方法
1.1 一般资料 收集2014年9月—2016年9月间因PSA升高(>4 μg/L)、于本院行MR检查的259例患者。所有患者均接受穿刺活检,部分患者接受经尿道前列腺电切术,根据病理结果分为PCa组和非PCa组。纳入标准:①PCa组患者均接受经尿道前列腺电切术,术中见肿瘤体积的70%以上位于移行区[10];②非PCa组患者病理结果为BPH或前列腺炎;③活检与之后的MR检查间隔≥6周。排除标准:①患者于MR检查前接受过激素、放疗等治疗;②患者存在极值变量(PSA>50 μg/L);③PCa罕见病理类型,如前列腺肉瘤及前列腺内分泌癌;③图像质量不佳,影响分析评价。最终纳入87例患者,年龄48~84岁,平均 (67.2±8.10)岁。PCa组33例,年龄51~84岁,平均 (68.2±8.7)岁;非PCa组54例,年龄48~80岁,平均(66.6±7.8)岁,其中BPH 49例,前列腺炎2例,BPH合并前列腺炎3例。
1.2仪器与方法 采用Philips Achieva 3.0T MR扫描仪,以体线圈为射频发射线圈,腹部相控阵线圈为接收线圈。检查前患者适量饮水,以耻骨联合上缘为扫描中心,轴位扫描包括前列腺及精囊腺。轴位T2WI采用SE序列,TR 2 900 ms,TE 90 ms,回波链长度13,层厚4 mm,层间隔0.4 mm,FOV 260 mm×260 mm,NSA 4,层数28。DWI采用单次激发自旋平面回波序列,b值为0、1 000 s/mm2,TR 2 000 ms,TE 67 ms,层厚 3.5 mm,层间隔0.35 mm,FOV 240 mm×240 mm,NSA 4,层数28。
1.3 PSA及前列腺特异性抗原密度(prostate specific antigen density, PSAD)测量 患者于经直肠指诊、前列腺按摩、导尿等检查前抽取静脉血,测定总前列腺特异性抗原(total prostate specific antige, t-PSA)及游离前列腺特异性抗原(free prostate specific antige, f-PSA)。于MRI轴位、矢状位及冠状位图像测量前列腺横径、上下径、前后径,计算前列腺体积(cm3)=横径(cm)×前后径(cm)×纵径(cm)×0.52、获得PSAD:PSAD=t-PSA/前列腺体积;并计算f-PSA与t-PSA的比值(f-PSA/t-PSA)。
1.4 PI-RADS v2评分 由2名专科医师采用盲法独立阅片,意见不同时经协商达成一致。移行带病灶以T2WI评分为主[11],当T2WI评分为1、2、4、5分时,为病灶的最终评分。当T2WI评分为3分时,需进行DWI评分:只有DWI评分为5分时,总分才改为4分,否则总分仍为3分。T2WI评分标准:1分,均匀中等信号强度;2分,局限性低信号或不均匀有包膜的结节(BPH);3分,边缘模糊,信号强度不均匀,或其他不符合2、4或5分标准者;4分,呈透镜状或边界不清,均匀中度低信号,最大径<1.5 cm;5分,影像表现同4分,但最大径≥1.5 cm,或有明确向前列腺外延伸或侵犯。DWI评分标准:1分,于ADC图和高b值图像上无异常;2分,ADC图模糊低信号;3分,于ADC图局灶性轻或中度低信号,且高b值DWI等信号或轻度高信号;4分,ADC图明显局灶性低信号,高b值DWI显著高信号,且最大层面径线<1.5 cm;5分,表现同4分,但最大层面径线≥1.5cm,或有明确向前列腺外延伸或侵犯。以PI-RADS v2最终评分>3分为PCa的诊断界值。
1.5统计学分析 采用SPSS 21.0统计分析软件。2组的t-PSA、f-PSA/t-PSA及PSAD比较采用两独立样本t检验,PI-RADS v2评分采用Mann-WhitneyU检验。以差异有统计学意义的指标为自变量,前列腺穿刺活检或术后病理结果为因变量,分为PCa组与非PCa组(Y=1,0),进行BinaryLogistic多因素回归分析,建立Logistic回归预测模型。PI-RADS v2与其他3个指标分别组合并建立回归方程,即回归模型包括3种模式:PI-RADS v2+t-PSA(A);PI-RADS v2+f-PSA/t-PSA(B);PI-RADS v2+PSAD(C)。对3个回归方程获得的Logit(P)预测概率和PI-RADS v2评分建立ROC曲线,计算曲线下面积(area under the curve, AUC),评价诊断效能,AUC的差异的比较采用MedCalc 15.2.2软件进行Z检验,P<0.05为差异有统计学意义。
2 结果
2组间年龄差异无统计学意义(t=-0.896,P>0.05)。
2.12组各指标统计结果 2组PI-RADS v2评分差异有统计学意义(Z=-5.84,P<0.01),见表1。PCa组t-PSA、f-PSA/t-PSA、PSAD分别为(23.79±13.25)μg/L、0.10±0.07、(0.60±0.36)μg/(L·cm3);非PCa组分别为(8.23±3.18)μg/L、0.18±0.09、(0.13±0.08)μg/(L·cm3),2组比较差异均有统计学意义(t=-8.27、4.44、-9.30,P均<0.01)。
2.2Logistic回归方程 将上述有统计学意义的指标纳入参考变量,PI-RADS v2与其他3个指标分别组合,分别建立回归方程,Logistic回归预测模型建立如下:
A:Logit(P)=-8.682+1.507 PI-RADS v2+ 0.234 t-PSA (χ2=65.993,P<0.01)
B:Logit(P)=-5.425+1.906 PI-RADS v2-13.921 f-PSA/t-PSA (χ2=65.993,P<0.01)
C:Logit(P)=-7.534+1.045 PI-RADS v2+13.318 PSAD (χ2=74.036,P<0.01)
2.3ROC曲线 回归预测模型A、B、C的AUC分别为0.945、0.919、0.960(P均<0.01),PI-RADS v2评分的AUC为0.861(P<0.01),3种回归模型与单独使用PI-RADS v2的AUC差异均有统计学意义(Z=2.81、2.75、2.68,P均<0.01,图1),其诊断效能见表2,以C回归预测模型为最佳。非PCa组PI-RADS v2误诊的12例患者中,采用A模型正确诊断其中4例,B模型正确诊断9例,C模型正确诊断8例。见图2、3。
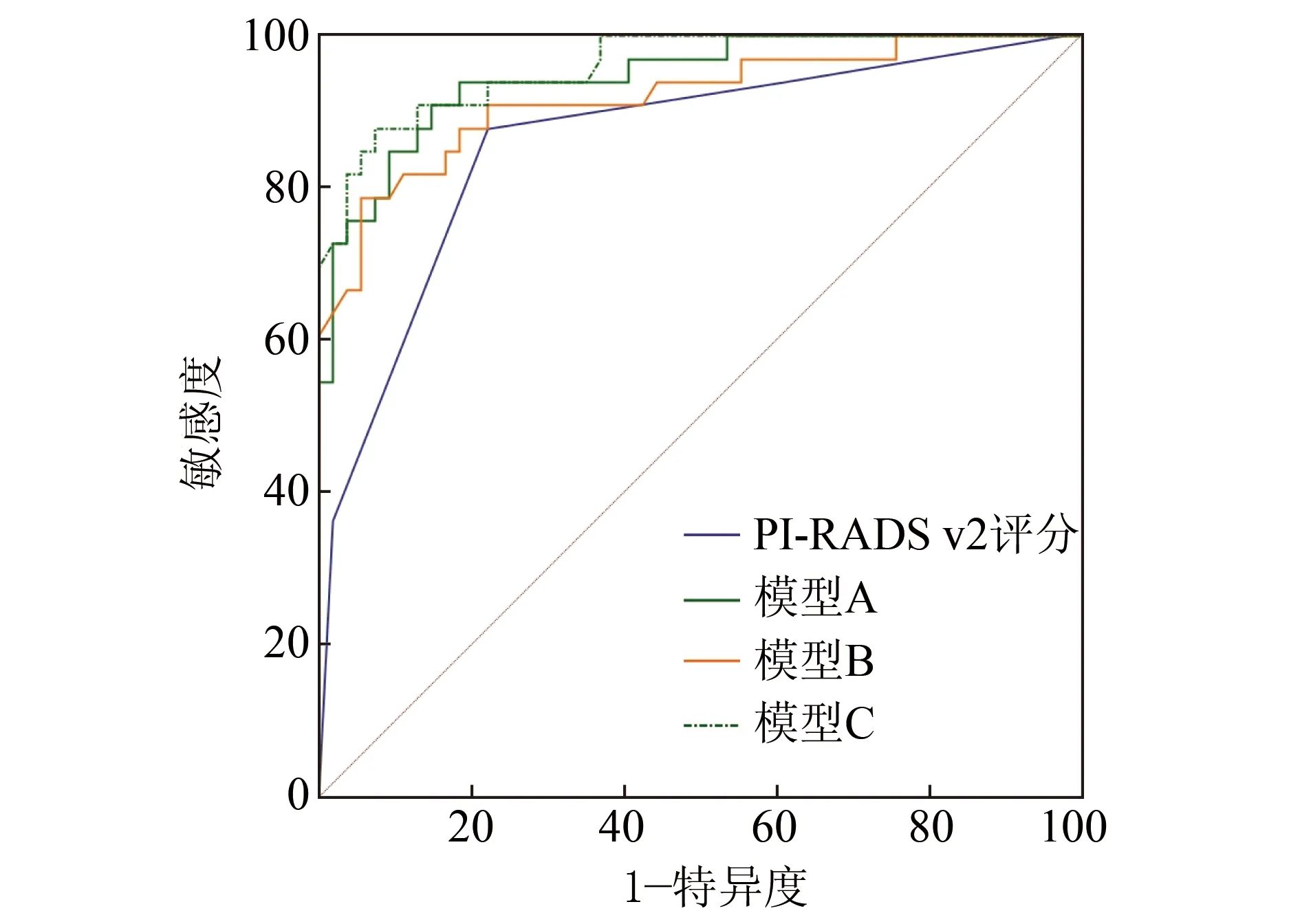
图1 3种回归模型与单独使用PI-RADS v2的ROC曲线

组别PI⁃RADSv2评分12345PCa组(n=33)0221712非PCa组(n=54)12021111
3 讨论
移行区PCa虽然发生率较低,但其多局限于包膜内,发现时体积往往较大,且术后早期还具有高度侵袭性[12],故早期诊断对患者的预后至关重要。随着多参数MRI的应用,MRI对移行区PCa的检测及描述能力均有提高[13],MRI引导下穿刺活检能够提高移行区PCa诊断与分级的准确率[14]。
本研究单独使用PI-RADS v2评分对移行区PCa进行诊断,PCa组33例中29例诊断正确,4例误诊,非PCa组54例中42诊断正确,12例误诊,其敏感度与特异度分别为87.88%与77.78%,与姬广海等[15]报道的敏感度(90.9%)与特异度(77.5%)相近,提示PI-RADS v2对移行区PCa的敏感度尚可,但特异度相对较差。笔者认为其原因为PI-RADS v2诊断移行区病变以T2WI为主导序列,DWI为补充序列[16]。移行区也是BPH的好发部位,BPH通常分为腺体型(glandular BPH, gBPH)和基质型(stromal BPH, sBPH),sBPH在T2WI表现为低信号,与移行区PCa表现相似[17],鉴别困难。当其伴发前列腺炎时更难以与移行区PCa鉴别[18]。移行区PCa的DWI图像因水分子扩散明显受限而呈高信号,而sBPH含有大量基质细胞和胶原,使细胞密度升高、细胞外组织间隙减小,水分子扩散受限而导致DWI亦呈高信号[19],进一步增加了与移行区PCa的鉴别难度。因此PI-RADS v2诊断移行区PCa的特异度相对较差。

表2 PI-RADSv2与PSA结合的Logistic回归预测模型及单独使用PI-RADS v2的诊断效能比较
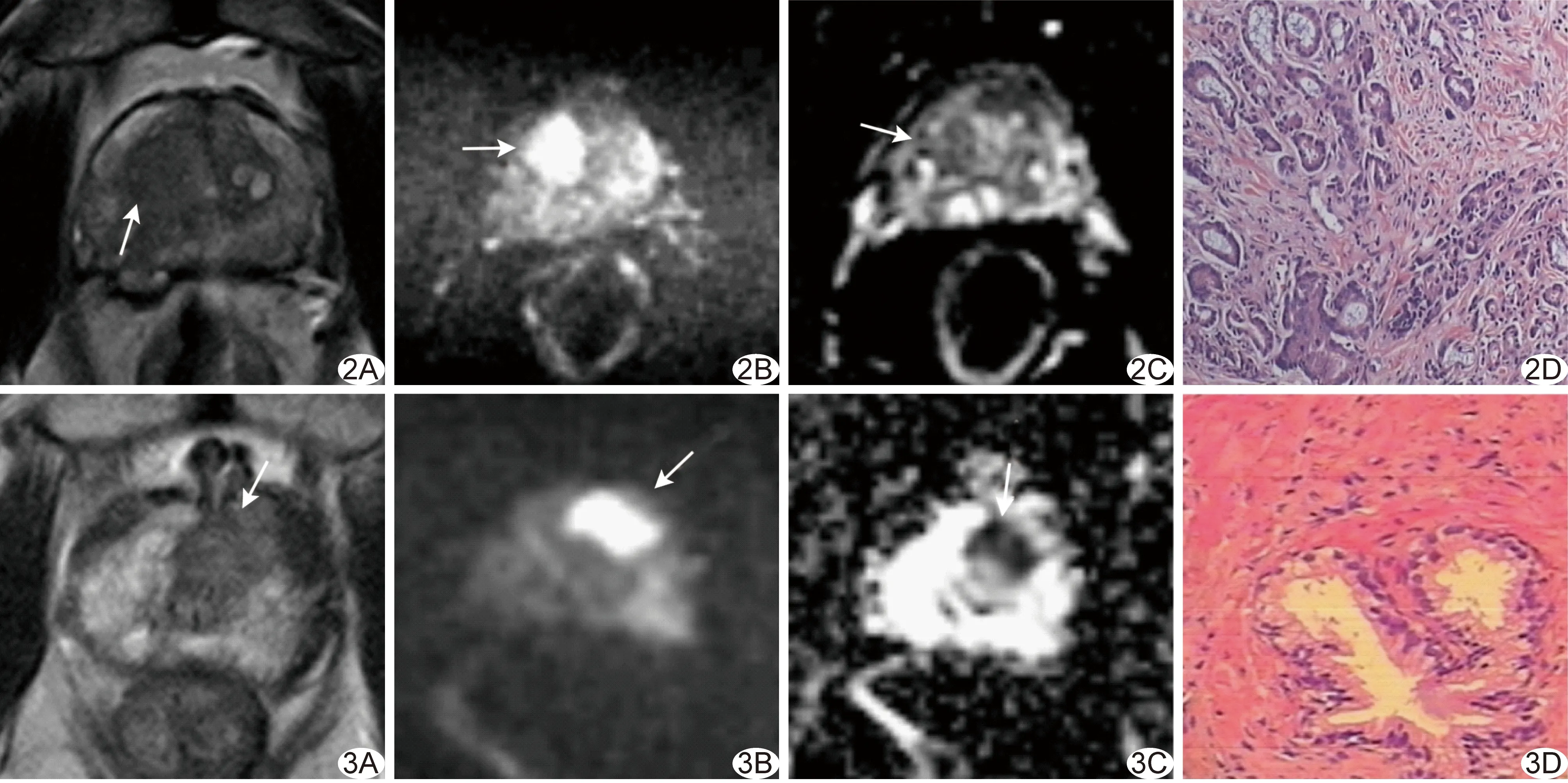
图2 患者男,60岁,前列腺腺泡腺癌,PSAD 0.97 μg/(L·cm3),PI-RADS v2最终评分5分,C模型预测概率为0.99,均诊断正确 A.T2WI示右侧移行带中后部均匀低信号结节,边界模糊不清(箭),最大径>1.5 cm,T2WI评分5分; B.DWI示病变呈局灶性高信号(箭); C.ADC图呈局限性低信号(箭); D.病理图(HE,×100) 图3 患者男,80岁,前列腺增生并炎症细胞浸润,PSAD 0.13 μg/(L·cm3),PI-RADS v2最终评分4分; C模型预测概率为0.16,PI-RADS v2误诊而C模型诊断正确 A.T2WI示左侧移行带前部均匀中等低信号结节,边界稍模糊不清(箭),最大径>1.5 cm,T2WI评分3分; B.DWI示病灶呈局灶性高信号(箭); C.ADC图呈局限性减低信号(箭); D.病理图(HE,×100)
本研究结果显示联合PI-RADS v2评分与PSA指标,其诊断效能高于单独使用PI-RADSv2评分(P均<0.01),特异度有不同程度的升高。在3种回归预测模型中,C模型的诊断价值最高(AUC为0.960),C模型中加入了PSAD指标,而癌组织的PSAD明显高于BPH,PSAD可用来消除BPH对PSA升高的影响,客观地反映前列腺疾病的性质和破坏程度[20]。当PSAD与PI-RADS v2评分构成C模型并以0.33为C模型预测概率的界值时,其特异度(92.59%)明显高于单独使用PI-RADS v2评分时的特异度(77.78%),而C模型的敏感度(87.88%)与单独使用PI-RADS v2时的敏感度(87.88%)一致。临床PSAD获取容易、方法简单,为C模型的临床应用提供了可行性。
本研究的不足;①样本量较小,可能会影响良恶性鉴别诊断价值的评价;②部分病例以TRUS引导性穿刺活检作为病理结果,可能存在假阴性。
总之,联合PI-RADS v2评分与PSA指标的Logistic回归预测模型对移行区PCa的诊断效能优于单独使用PI-RADS v2评分,尤其以PI-RADS v2联合PSAD最佳,可明显提高特异度,为可疑移行区PCa患者行穿刺提供可靠的依据。
[1] 韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析.临床肿瘤学杂志,2013,18(4):330-334.
[2] 张学琴,王霄英,陆健,等.扩散加权成像诊断前列腺中央腺体癌.中国医学影像技术,2012,28(4):765-768.
[3] Rouviere O, Papillard M, Girouin N, et al. Is it possible to model the risk of malignancy of focal abnormalities found at prostate multiparametric MRI?. Eur Radiol, 2012,22(5):1149-1157.
[4] Schimmoller L, Quentin M, Arsov C, et al. Predictive power of the ESUR scoring system for prostate cancer diagnosis verified with targeted MR-guided in-bore biopsy. Eur J Radiol, 2014,83(12):2103-2108.
[5] Quon JS, Moosavi B, Khanna M, et al. False positive and false negative diagnoses of prostate cancer at multi-parametric prostate MRI in active surveillance. Insights Imaging, 2015,6(4):449-463.
[6] Purysko AS, Rosenkrantz AB, Barentsz JO, et al. PI-RADS version 2: A pictorial update. Radiographics, 2016,36(5):1354-1372.
[7] 李鹏,杨文君,陈志强,等.动态增强MRI诊断前列腺中央腺体癌和不同类型前列腺增生.中国医学影像技术,2013,29(6):962-966..
[8] Kitzing YX, Prando A, Varol C, et al. Benign conditions that mimic prostate carcinoma: MR imaging features with histopathologic correlation. Radiographics, 2016,36(1):162-175.
[9] 陈汉民,蔡联明,刘联斌,等.血清PSA联合PSAD检测对前列腺癌的诊断价值.现代肿瘤医学,2014,22(7):1640-1643.
[10] Bouyé S, Potiron E, Puech P, et al. Transition zone and anterior stromal prostate cancers: Zone of origin and intraprostatic patterns of spread at histopathology. Prostate, 2009,69(1):105-113.
[11] Barrett T, Turkbey B, Choyke PL. PI-RADS version 2: What you need to know. Clin Radiol, 2015,70(11):1165-1176.
[12] Park SY, Kim CK, Park BK, et al. Diffusion-tensor MRI at 3T: Differentiation of central gland prostate cancer from benign prostatic hyperplasia. AJR Am J Roentgenol,2014,202(3):W254-W262.
[13] Pokharel SS, Patel NU, Garg K, et al. Multi-parametric MRI findings of transitional zone prostate cancers: Correlation with 3-dimensional transperineal mapping biopsy Abdom Imaging, 2015,40(1):143-150.
[14] Radtke JP, Boxler S, Kuru TH, et al. Improved detection of anterior fibromuscular stroma and transition zone prostate cancer using biparametric and multiparametric MRI with MRI-targeted biopsy and MRI-US fusion guidance. Prostate Cancer Prostatic Dis, 2015,18(3):288-296.
[15] 姬广海,郑义,孛茹婷,等.多参数MRI对中央腺体前列腺癌的诊断价值.中国医学影像学杂志,2016,24(8):591-595.
[16] Rosenkrantz AB, Babb JS, Taneja SS, et al. Proposed adjustments to PI-RADS Version 2 decision rules: Impact on prostate cancer detection. Radiology, 2017,283(1):119-129.
[17] Rosenkrantz AB, Taneja SS. Radiologist, be aware: Ten pitfalls that confound the interpretation of multiparametric prostate MRI. AJR Am J Roentgenol,2014,202(1):109-120.
[18] Hoeks CM, Vos EK, Bomers JG, et al. Diffusion-weighted magnetic resonance imaging in the prostate transition zone: Histopathological validation using magnetic resonance-guided biopsy specimens. Inves Radiol, 2013,48(10):693-701.
[19] 冷晓明,韩晓蕊,赵曼,等.单指数DWI和IVIM-DWI对前列腺中央腺体疾病的诊断效能.中国医学影像技术,2016,32(10):1560-1564.
[20] Sfoungaristos S, Perimenis P. PSA density is superior than PSA and Gleason score for adverse pathologic features prediction in patients with clinically localized prostate cancer. Can Urol Assoc J, 2012,6(1):46-50.
Evaluation of transition zone prostate cancer byLogisticregression of prostate imaging reporting and data system version 2 combined with prostate specific antigen
LEILizhi,XUYikai*,HOUMeirong,HEMengqi
(MedicalImagingCenter,NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
Objective To establish theLogisticregression model by reporting and data system version 2 (PI-RADS v2) and prostate specific antigen (PSA), and to evaluate the diagnostic efficiency in transition zone prostate cancer (PCa). Methods MRI and PSA data of 33 patients with PCa and 54 patients with non-PCa confirmed by pathology were analyzed retrospectively. The PI-RADS v2 was used to evaluate the risk of 2 groups (from low to high as 1 to 5 points). Total PSA(t-PSA), free to total PSA ratio (f-PSA/t-PSA), PSA density (PSAD) and PI-RADS v2 scores were compared between 2 groups. TheLogisticregression models were established with parameters which were significantly different between 2 groups. TheLogisticregression was divide into three protocols: PI-RADS v2+t-PSA (A), PI-RADS v2+f-PSA/t-PSA (B), PI-RADS v2+PSAD (C). The ROC curves were constructed by the new parameters Logit (P) and PI-RADS v2 scores for assessing the diagnostic efficiency. Results The t-PSA, f-PSA/t-PSA, PSAD and PI-RADS v2 scores had significant differences between the 2 groups (allP<0.01). Predictive multivariate model of A, B, C was established as Logit(P)=-8.682+1.507 PI-RADS v2+0.234 t-PSA (χ2=65.993,P<0.01), Logit(P)=-5.425+1.906 PI-RADS v2-13.921 f-PSA/t-PSA (χ2=65.993,P<0.01), Logit(P)=-7.534+1.045 PI-RADS v2+13.318 PSAD (χ2=74.036,P<0.01), their area underthe curve (0.945, 0.919, 0.960) were all higher than that of PI-RADS v2 score (0.861, allP<0.01). The protocol C had the best diagnostic efficiency, and the sensitivity and specificity were 87.88% and 92.59%. The sensitivity and specificity of PI-RADS v2 score were 87.88% and 77.78%. Conclusion The diagnostic efficiency of theLogisticregression model which includes the PI-RADS v2 score and PSA are superior to the PI-RADS v2 score alone for transition zone PCa, which can provide a reliable basis for patients whether need biopsy or not.
Prostate imaging reporting and data system version 2;Logisticregression models; Prostatic neoplasms; Prostate-specific antigen
雷李智(1990—),男,湖南郴州人,在读硕士。研究方向:腹部CT与MRI。E-mail: 631071248@qq.com
许乙凯,南方医科大学南方医院影像中心,510515。E-mail: yikaivip@163.com
2016-11-23
2017-05-17
10.13929/j.1003-3289.201611121
R737.25; R445.2
A
1003-3289(2017)07-1047-05
