沾3内源微生物驱的生物特征变化及其对驱油效果的影响
2017-07-31曹功泽王文杰吴晓玲曹嫣镔汪卫东唐存知
胡 婧, 曹功泽, 王文杰, 吴晓玲, 曹嫣镔, 汪卫东, 唐存知
(1. 中国石化胜利油田分公司石油工程技术研究院,山东东营 257067; 2.青岛市黄岛区致远中学,山东青岛 266510;3.中国石化胜利油田分公司河口采油厂工艺研究所,山东东营 257200)
沾3内源微生物驱的生物特征变化及其对驱油效果的影响
胡 婧1, 曹功泽1, 王文杰2, 吴晓玲1, 曹嫣镔1, 汪卫东1, 唐存知3
(1. 中国石化胜利油田分公司石油工程技术研究院,山东东营 257067; 2.青岛市黄岛区致远中学,山东青岛 266510;3.中国石化胜利油田分公司河口采油厂工艺研究所,山东东营 257200)
内源微生物驱油通过激活油藏中特定的微生物群落提高原油采收率。分析胜利油田沾3区块内源微生物驱现场试验产出液中微生物群落结构以及优势菌的动态变化,考察油藏生物特征与现场开发动态之间的对应关系。结果表明:生物多样性、优势菌含量与现场生产动态之间存在明显的相关性,其中菌群多样性与原油产量之间呈明显负相关关系;4类优势菌的交替协同作用直接影响了原油产量,优势菌总量的变化与原油产量之间呈明显正相关关系,而且油井产量的变化滞后于生物特征的变化。
内源微生物驱;生物特征;优势菌
微生物驱油(MEOR)分为内源微生物驱油和外源微生物驱油,前者直接利用油藏中的微生物群落,只须向油藏内添加必要的激活剂,工艺简单。内源微生物驱油技术虽然具有很大的潜力和优势,但在现场应用时,存在无法对开发效果进行准确预测,也无法针对性调整实施方案的问题[1-2],阻碍了内源微生物驱油技术在现场的大规模应用,其关键问题是明确内源微生物驱油技术实施过程中增产效果与油藏生物特征之间的对应关系[3-5]。笔者跟踪分析胜利油田沾3内源微生物试验区块的油藏微生物数量、群落多样性及优势菌含量的变化,考察开发过程中微生物特征与现场开发动态之间的内在联系。
1 现场试验概况
沾3试验区块位于山东省河口区境内,为湖泊相沉积,整体近南北向展布,有效厚度2~25.1 m,平均10.9 m,含油面积0.69 km2,地质储量202×103t,油藏深度1 240~1 360 m,油层温度63 ℃,渗透率0.628 μm2,原油黏度1 885 mPa·s,地层水矿化度8~10 g/L。1985年投入开发,1989年开始注水开发,在实施内源微生物驱油之前该区块已进入高含水开发、产量递减阶段,采出程度28.2%,综合含水率93.8%,水驱效果差,稳产难度大。
沾3块内源微生物驱油先导试验于2011年11月开展现场实施,采用三阶段实施,逐步推进的方式,室内试验确定激活剂配方,激活剂采用段塞式注入,注入周期20 d。先导试验区已完成单井试注和3口井注入激活剂阶段,目前扩大到5口水井注入激活剂阶段。三阶段具体实施方案如下(图1),2011年11月至2013年5月实施第一阶段现场试验,该阶段为试注阶段,在中心水井沾3-N12井注入,共注入6轮激活剂,激活剂注入3%,共注入激活剂总量450 t。该阶段实施6个月后,区块的5口油井见到明显效果,对应油井产量由26.3 t/d上升至51.8 t/d,含水率由96.1%下降至92.8%。2013年5月至2014年3月为第二阶段现场试验,激活剂注入3%,试验区注入井扩大为沾3-N12、义古1和义古14三口井。注入方式结合现场实施条件,采用周期注入,每轮集中2~3 d注入激活剂(激活剂固含量18%),其余18 d注水,阶段累积注入激活剂2 895 t,该阶段实施后生产井生产动态得到进一步改善,见效井增加到11口,试验区产油量进一步升至80.4 t/d,综合含水率进一步下降至89.1%。2014年4月开始第三阶段现场试验,该阶段扩大注入范围,增加两口注入井(3-X28及3-X30),降低激活剂质量分数为1.4%,配注方式为每井每周期(20 d),集中3 d注入激活剂(激活剂固含量为18%),其余17 d注水,该阶段产油量最高升至86.9 t/d,内含水率最低降至89.3%。截至2014年12月,该区块累积注入激活剂5 717 t。试验区14口油井中12口油井见效,累计增油27 500 t,平均单井增油2 291 t。

图1 沾3块内源微生物驱实施方案图Fig.1 Implementing scheme of indigenous microbial enhanced oil recovery in Zhan3 block
2 材料与方法
2.1 样品采集及预处理
实施微生物驱油前(2011年9月)以及实施微生物驱后的2013年1月至2014年10月,每个季度对试验区块中的注入水(Z3-N12)及5口见效油井(Z3-13、15、23、26、X31)产出液水样中的细菌浓度、细菌群落结构进行跟踪检测。油水井产出液直接从油井井口收集到一个无菌的容器中,每个样品采集10 L油水样, 2 h内进行分子生物学检测。
油藏水样中的微生物浓度很低,而且存在原油污染,所以首先在样品溶液中加入石油醚,搅拌静置,去除上层有机相,下层水样采用Mediakap中空纤维膜过滤器(仕必纯贸易上海有限公司)进行菌体收集,每个样品收集6 L液体。截留在膜上的菌体用液体进行充分反复震荡洗脱后进行高速离心(12 000 g,4 ℃,15 min),收集到的底部菌体沉淀置于-70 ℃冰箱冷冻保存。
2.2 样品DNA提取及高通量测序
样品菌体DNA的提取利用AxyPrep基因组提取试剂盒。提取后的DNA利用Nanodrop进行浓度检测后用于细菌16S扩增[6-7],所有样品送至华大基因进行样品的16S rDNA V4区高通量测序及后续生物信息学分析,解析其中的微生物群落结构信息。
2.3 生物动态与生产动态对应关系分析
基于现场样品的跟踪检测结果,分析实施内源微生物驱油前后细菌浓度、微生物群落多样性以及优势菌的种类及数量的变化,进而建立微生物特征与现场生产动态之间的对应关系[8-11]。
3 结果分析
3.1 产出液微生物浓度及生物多样性的变化
在沾3试验区块共采集9批次样品用于生物特征的动态分析(图2)。油井产出液样品镜检总细菌浓度结果表明,和2011年9月份的基础数据相比,油水井产出液中的细菌总量明显升高,从最初的2×102上升到3×106个/mL。微生物群落的多样性指数计算结果表明,实施微生物驱油后,整个区块微生物种群的多样性呈现下降的趋势,平均shannon指数从最初的1.8下降到了0.9。细菌浓度和菌群多样性之间呈现负相关。细菌浓度和种群多样性在注入激活剂后的变化,说明激活剂在进入地层后,只选择激活了地层中的部分内源菌,这些激活的内源菌利用营养大量繁殖细菌浓度逐渐增加,最终成为地层中的优势菌。

图2 实施微生物驱前后微生物浓度及生物多样性的变化Fig.2 Changes in concentration and diversity of microorganisms before and after MEOR
3.2 微生物群落结构的变化及激活的优势菌
在注入激活剂前,油藏中存在稳定的微生物群落结构,激活剂的持续注入,对该生态环境中的微生物群落结构产生了明显的影响。从图3看出,在门分类阶元上,油井产出液在未实施微生物驱油时,细菌种类丰富,包含7个门的细菌,占主要优势的有:变形菌门(82.8%)、硬壁菌门(12.8%)和硝化螺旋菌门(2.8%),剩下1.6%的细菌主要属于脱铁杆菌门、热脱硫杆菌门、放线菌门、拟杆菌门以及一些未鉴定的细菌门。

图3 沾3区块细菌群落结构变化Fig.3 Changes of bacterial community structure in Zhan3 block
实施微生物驱后在2014年10月取样分析发现,沾3地层中的细菌种类明显减少,除0.6%的未鉴定细菌门外,只存在2个门的细菌,分别是95.1%的变形菌门和4.3%的硬壁菌门。在属分类阶元上,沾3区块实施微生物驱后百分含量>10%优势菌分别为弓形杆菌(表1,Arcobacte,21%)、沙雷氏菌(Serratia,20%)、假单胞菌属(Pseudomonas,13%)和无色杆菌属(Achromobacter,11%),这4种菌也是油藏中普遍存在的细菌种类[12]。其中弓形杆菌具有氧化硫化物、还原硝酸盐以及参与S、N循环的作用,而且该细菌在油藏中可以通过产生生物聚合物以及生物膜对油藏高渗透区具有堵调作用[13-14];沙雷氏菌具有耐盐以及产酸产气的作用,也具有一定的驱油功能;假单胞菌属是报道最多的微生物采油功能菌,该属中的大部分细菌种类可以产生对微生物驱油有重要作用的生物类表面活性剂,如脂肽类生物表面活性剂和糖脂类生物表面活性剂,还具有一定的嗜烃作用,以上假单胞菌的代谢作用和代谢产物均有助于原油的驱动[15-20];无色杆菌属隶属于肠杆菌科,具有耐盐、硝酸盐还原和降解烷烃的功能[21-22]。在后面的分析中将针对这4种优势微生物,分析它们的动态变化与现场原油产量之间的对应关系。

表1 沾3试验区块中的优势微生物Table 1 Advantage bacteria in Zhan3 block
3.3 生产动态与油藏生物特征的对应关系
3.3.1 菌群多样性与生产动态之间的相关性
在实施微生物驱油后,试验区块油井的原油产量逐渐上升。截至2014年12月增油27 500 t,含水率从93.4%降到了89.3%。将油藏微生物群落多样性shannon指数与相对应时间点的原油日产量和综合含水率数据进行对比分析,结果见图4,表明实施微生物驱油后试验区块油水井样品中的微生物多样性明显降低,shannon指数的动态变化趋势与综合含水趋势呈现明显的正关联,而与原油日产量数据呈现负相关。这说明油藏内源微生物在注入激活剂后菌群结构发生了明显改变,从最初复杂多样的微生物群落结构转变为简单的群落结构,大部分细菌的生长和繁殖被抑制,被激活的少数优势菌在后期微生物驱油过程中起到了关键作用。以上分析结果表明,多样性指数的降低有利于内源微生物驱油。
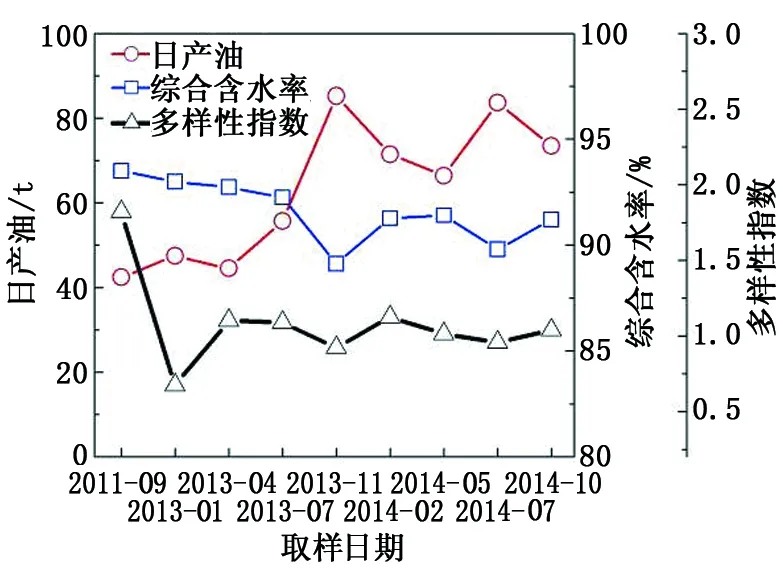
图4 微生物shannon多样性指数与日油和 含水之间的关系Fig.4 Relationship between shannon index and daily oil or water production
3.3.2 优势功能菌与生产动态之间的对应性
实施微生物内源驱油后,4种优势菌的含量变化趋势明显(图4),不同优势菌含量的峰值依次交替出现,在2013年4月和7月沙雷氏菌和弓形杆菌首先被激活,2013年11月无色杆菌和假单胞杆菌被激活,2014年5月假单胞杆菌和沙雷氏菌被激活,到2014年10月,弓形杆菌再次被激活。4种优势菌含量峰值交替出现的原因可能与微生物之间的代谢竞争有关。
将优势菌的动态变化与日油产量变化进行综合分析,结果表明优势菌含量的变化与日油产量变化之间存在一定的时间差,产量的变化要滞后于菌的变化,这是因为细菌主要通过代谢产物的积累产生明显的驱油的效果。同时优势菌与日油产量之间也存在明显的相关性(图5)。2013年11月之前原油产量的增加与激活沙雷氏菌、弓形杆菌以及无色杆菌有关;2013年11月份之后的原油产量降低与上述3种菌的含量降低有关;2014年5月份随着假单胞菌以及沙雷氏菌含量的增加,原油产量在2014年7月又有所增加;后期假单胞菌和沙雷氏菌的含量逐渐降低,原油产量在2014年10月份出现小幅度的下降。
4种优势菌总量变化趋势(图6)表明,菌总含量变化趋势与日产油的变化趋势吻合,同样日产油的动态变化滞后于优势菌总量的变化,以上分析结果可证实沾3内源微生物试验区块开发效果的改善来自于内源激活后4种优势菌的交替及协同作用。
研究还发现,优势菌的含量变化与现场激活剂注入量有明显对应关系,由于现场流程改造,2013年11月、12月及2014年6月激活剂注入剂量分别从计划的每月200 t降至85、65和25 t。激活剂注入量的降低造成2014年2月和7月产出液中4种优势菌含量随之明显降低,继而对后期区块的原油产量产生影响。激活剂注入量恢复后,优势菌的含量升高,原油产量随之上升。

图5 优势菌含量动态变化与现场生产动态之间的关系Fig.5 Relationship between dominant bacteria changes and field production performance

图6 4种优势菌总含量的变化与现场生产动态 之间的关系Fig.6 Relationship between changes of total content of dominant bacteria and field production performance
以上分析表明,沾3内源微生物驱油试验区块从2011年实施开始后,对油藏地层水原有的细菌群落结构产生了明显的影响,从原始菌群结构过渡形成一套新的相对稳定的微生物群落结构。重建后的微生物群落结构与现场原油产量之间存在明显的对应关系,随着菌群结构的简单化、细菌浓度的增加以及优势菌含量的增加,沾3现场开发动态效果随之改善。以上生物特征的动态变化可以作为内源微生物驱油现场试验的量化检测指标,实现内源微生物驱油现场生产动态的准确预测和实施方案的针对性调控,进一步提高该技术的现场应用效果。
4 结 论
(1)油藏内最初复杂多样的微生物群落在激活剂的作用下发生了明显的变化,细菌浓度明显增加,菌群多样性明显降低,微生物群落多样性与现场原油产量之间明显负相关。
(2)沾3区块在实施内源微生物驱油后,4种具有驱油功能的优势菌被激活。优势菌的含量升高后,原油产量随之升高,原油产量的变化滞后于优势菌的动态变化。
(3)在内源微生物驱油现场试验过程中,激活剂注入、油藏细菌群落结构与现场生产动态之间可以进行有效的调控。
[1] ANN M, ANDREW C, KEVIN W. et al. Recovery rates, enhanced oil recovery and technological limits[J]. Philos Trans A Math Phys Eng Sci, 2013,372(2006):1-25.
[2] 程明明,夏添,雷光伦,等.低渗透油藏多段塞微生物驱开发指标预测[J].中国石油大学学报(自然科学版),2014,38(6):113-120. CHENG Mingming, XIA Tian, LEI Guanglun, et al. Development index prediction of multi-slug microbial flooding in low permeability reservoir[J]. Journal of China University of Petroleum (Edition of Natural Science), 2014,38(6):113-120.
[3] 杨振宇,石梅,王大威,等.大庆油田本源微生物群落分布及采油机理研究[J].石油学报,2006,27(3):95-105. YANG Zhenyu, SHI Mei, WANG Dawei, et al. Study on authigenous microorannism community distribution and oil recovery mechanism in Daqing Oilfield[J]. Acta Petrolei Sinica, 2006,27(3):95-105.
[4] 雷光伦.微生物采油技术的研究与应用[J].石油学报,2001,22(2):56-61. LEI Guanglun. The research and application of microbial enhanced oil recovery [J]. Acta Petrolei Sinica, 2001,22(2):56-61.
[5] GAO C H. Microbial enhanced oil recovery in carbonate reservoir:an experimental study[R].SPE 143161, 2011.
[6] 王慧,宋智勇,郝滨,等.微生物驱产出液群落结构与现场生产动态的关系[J].石油学报,2013,34(3):535-538. WANG Hui, SONG Zhiyong, HAO Bin, et al. Relationship between structures of microbial colony in produced fluids and oil production performance in microbial flooding oil field[J]. Acta Petrolei Sinica, 2013,34(3):535-538.
[7] BAO Mutai, LIU Tao, CHEN Zhi, et al. A laboratory study for assessing microbial enhanced oil recovery[J]. Energy Sources, 2013,35(22):2141-2148.
[8] HONGBO Z, HAN K C, JOHN D. Applicability of anaerobic nitrate-dependent Fe(II) oxidation to microbial enhanced oil recovery (MEOR)[J]. Environmental Science & Technology, 2013,47(15):8970-8977.
[9] 王大威,杨振宇,石梅,等.分子生物学在石油微生物多样性研究中的应用[J].生物技术,2005,15(5):86-89. WANG Dawei, YANG Zhenyu, SHI Mei, et al. The application of molecular biology in the research of petroleum microbes diversity[J]. Biotechnology, 2005,15(5):86-89.
[10] 程海鹰,肖生科,马光东,等.营养注入后油藏微生物群落16S rRNA基因的T-RFLP对比分析[J].石油勘探与开发,2006,33(3):356-359. CHENG Haiying, XIAO Shengke, MA Guangdong, et al. 16S rRNA genes comparative analysis of microbial community in nutrient injected oil reservoir by the T-RFLP method[J]. Petroleum Exploration and Development, 2006,33(3):356-359.
[11] HOSSEIN G, FARZANEH V, ALIREZA K S. Enhanced oil recovery from low permeability dolomite cores using biosurfactantproduced by a Bacillus mojavensis (PTCC 1696) isolated from Masjed-I Soleyman field[J]. Journal of Petroleum Science and Engineering, 2012,81(1):24-30.
[12] 张凡.不同油藏采油功能微生物菌群表征[D].北京:中国地质大学(北京), 2014. ZHANG Fan. Contributing microbial communities for microbial enhanced oil recovery in different oil reservoirs[D]. Beijing: China University of Geosciences(Beijing), 2014.
[13] HAJIME K, HIDEO K, KEITA E, et al. Analysis of methane production by microorganisms indigenous to a depleted oil reservoir for application in microbial enhanced oil recovery[J]. Journal of Bioscience and Bioengineering, 2012,113(1):84-87.
[14] ROSS N R, VILLEMUR L, DESCHENES, et.al. Clogging of a limestone fracture by stimulating groundwater microbes. water res[J]. 2001,35(8):2029-2037.
[15] 田永娥,黄建新.一株假单胞菌对高黏原油的乳化降解作用[J].环境科学与技术,2009,32(6):29-33. TIAN Yonge, HUANG Jianxin. Emulsification and degradation of hyper-viscous crude oil byPseudomonas[J]. Environmental Science and Technology, 2009,32(6):29-33.
[16] 汤晓,张国亮,孟琴.铜绿假单胞菌分泌鼠李糖脂能力对原油降解影响的研究[J].高校化学工程学报,2008,22(1):88-93. TANG Xiao, ZHANG Guoliang, MENG Qin. The effect of rhamnolipid production on crude oil biodegradation[J]. Journal of Chemical Engineering of Chinese Universities, 2008,22(1):88-93.
[17] 梁凤来,张心平,刁虎欣,等.假单胞菌GD-23原油发酵液乳化物质的提取和分析[J].南开大学学报(自然科学版),2001,34(1):13-16. LIANG Fenglai, ZHANG Xinping, DIAO Huxin, et al. Analysis of an emulsifier extracted from crude oil culture fluid byPseudomonasspGD-23[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis, 2001,34(1):13-16.
[18] 唐玉斌,孙常宇,陈芳艳,等.木糖氧化无色杆菌及混合菌群对多环芳烃的降解特性[J].环境工程学报,2010,7(4):1664-1668. TANG Yubin, SUN Changyu, CHEN Fangyan, et al. Degradation characteristics of polycyclic aromatic hydrocarbons by achromobacter xylosoxidans and different strains mixtures[J]. Techniques and Equipment for Environmental, 2010,7(4):1664-1668.
[19] 马鑫,高卉,张俊会,等.3株原油降解细菌鉴定及其降解和驱油特性研究[J].中国石油大学学报(自然科学版),2017,41(2):163-174. MA Xin, GAO Hui, ZHANG Junhui, et al. Identification of 3 strains of crude oil degradation bacteria and its characteristics of degradation and oil-displacement[J]. Journal of China University of Petroleum (Edition of Natural Science), 2017,41(2):163-174.
[20] 雷光伦,马继业,汪卫东,等.微生物提高采收率微观机制[J].中国石油大学学报(自然科学版),2009,33(3):108-113. LEI Guanglun, MA Jiye, WANG Weidong, et al. Micromechanism of microbial enhanced oil recovery[J]. Journal of China University of Petroleum (Edition of Natural Science), 2009,33(3):108-113.
[21] 司美茹,赵云峰,苏涛.高效降解烷烃的无色杆菌X_L株的分离鉴定及其降解特性[J].土壤通报,2011,4(3):562-567. SI Meiru, ZHAO Yunfeng, SU Tao. Isolation, identification and characterization of high-efficiency alkane-degrading bacterium[J]. Chinese Joural of Soil Science, 2011,4(3):562-567.
[22] 杨茜,吴蔓莉,曹碧霄,等.石油降解菌的筛选、降解特性及其与基因的相关性研究[J]. 安全与环境学报, 2014,14(1):187-192. YANG Qian, WU Manli, CAO Bixiao. Isolation of petroleum degrading strains and determination their degrading and gene characteristics[J]. Journal of Safety and Environment. 2014,14(1):187-192.
(编辑 刘为清)
Change of biological features and its impact on flooding effect of indigenous MEOR in Zhan3 block
HU Jing1, CAO Gongze1, WANG Wenjie2, WU Xiaoling1, CAO Yanbin1, WANG Weidong1, TANG Cunzhi3
(1.PetroleumEngineeringTechnologyResearchInstitute,ShengliOilfieldCompany,SINOPEC,Dongying257067,China;2.HuangdaoZhiyuanMiddleSchoolofQingdao,Qingdao266510,China;3.ResearchInstituteofProductionTechnology,HekouOilProductionFactory,ShengliOilfieldCompany,SINOPEC,Dongying257200,China)
The oil recovery is increased using the indigenous microorganism flooding through specific indigenous microorganisms by injecting nutrients. The microbial community structure and the dynamic changes of the dominant bacterium in the production liquid of microbial flooding in Zhan3 block of Shengli Oilfield were analyzed, through which the relationship between the biological features and the dynamic changes of production performance was studied. It is found that there exits clear correlation between microbial diversity, dominant bacteria content and the oil production performance. A significant negative correlation is observed between the microbial diversity and the oil production. And the oil production is affected directly by the alternative synergism of 4 dominant bacteria. It is also found that a significant positive correlation exists between the content of dominant bacteria and oil production. And the change of oil production lags behind the change of the biological features.Keywords: indigenous microorganism flooding; biological features; dominant bacteria
2016-11-23
国家“863”计划项目(2013AA064401)
胡婧(1980-),女,博士,研究方向为微生物采油过程的分子生态学。E-mail: tomatohu@163.com。
1673-5005(2017)04-0174-06
10.3969/j.issn.1673-5005.2017.04.023
TE 357.9
A
胡婧,曹功泽,王文杰,等.沾3内源微生物驱的生物特征变化及其对驱油效果的影响[J].中国石油大学学报(自然科学版),2017,41(4):174-179.
HU Jing, CAO Gongze, WANG Wenjie, et al. Change of biological features and its impact on flooding effect of indigenous MEOR in Zhan3 block[J].Journal of China University of Petroleum(Edition of Natural Science),2017,41(4):174-179.
