四川盆地9000 kg hm-2 产量潜力小麦品种的花后冠层结构、生理及同化物分配特性
2017-07-25吴晓丽李朝苏汤永禄俊马孝玲李式昭黄明波
吴晓丽李朝苏汤永禄,*李 俊马孝玲李式昭黄明波
1四川省农业科学院作物研究所, 四川成都 610066;2四川广汉市生产力促进中心, 四川广汉 618300
四川盆地9000 kg hm-2 产量潜力小麦品种的花后冠层结构、生理及同化物分配特性
吴晓丽1李朝苏1汤永禄1,*李 俊1马孝玲1李式昭1黄明波2
1四川省农业科学院作物研究所, 四川成都 610066;2四川广汉市生产力促进中心, 四川广汉 618300
四川盆地小麦高产育种取得了突破性进展, 但高产生理研究相对滞后。本研究以2011—2015连续5年的田间试验, 比较了高产和一般产量潜力品种花后群体冠层结构、主要生理指标和同化物的转运分配特性, 旨在揭示四川小麦9000 kg hm-2高产品种的生理基础。选择代表性高产潜力品种和一般产量潜力品种各3个, 高产潜力品种产量平均 9422 kg hm–2, 比一般产量潜力品种高 14.3%, 增产原因是生物量或收获指数的提高。相比一般产量潜力品种,高产潜力品种旗叶短且宽, 长宽比低于10, 开花初期至灌浆中期叶基角和开角增加明显。开花至灌浆后期, 高产潜力品种顶三叶的SPAD值及花后0 d和20 d的群体光合速率显著高于一般产量潜力品种, 群体光合速率以10:00–12:00的差异最大。此外, 高产潜力品种在开花期茎鞘生物量所占比例较高, 而成熟期籽粒所占比例较一般产量潜力品种高1~4个百分点。籽粒产量与小麦形态、生理参数关系密切, 与灌浆期旗叶基角(r = 0.947, P < 0.01)和倒二叶基角(r = 0.963, P < 0.01)呈正相关, 与旗叶长宽比(r = -0.913, P < 0.01)和倒二叶长宽比(r = -0.911, P < 0.01)呈负相关; 与开花期顶三叶SPAD值呈正相关, r值分别为0.75、0.90和0.82 (P < 0.01); 与成熟期穗轴干重比例呈负相关(r = -0.956, P< 0.01)。本研究表明, 株高适中、株型紧凑, 花后冠层叶绿素含量和群体光合速率较高, 以及合理的物质分配, 是高产潜力品种获得高产的生理基础。
小麦; 冠层结构; 群体光合速率; 干物质分配; 籽粒产量
禾谷类作物的籽粒产量是生物产量和收获指数的乘积, 前者与作物光合效率有关, 后者与同化产物分配有关。开花前后是决定单位面积粒数和籽粒产量的关键时期, 而花后光合产物积累量对籽粒产量的贡献超过70%[1-2]。株高、叶形叶姿、叶绿素含量等因素相互联系, 共同影响光合效率, 而植株形态结构和“源–库”关系又影响花后同化产物的分配[3-4]。
近几十年的育种经验表明, 小麦产量的提高与植株矮化、增强库容和提高花后光能利用效率有密切关系, 同时株高降低相应地提高了收获指数[5-8]。随着产量潜力的上升, 小麦品种上部叶片呈变短、变宽的趋势[8-10], 直立型株型更利于提高单位面积穗数和粒数[11], 通过改善中下部光照条件和叶片叶绿素含量可间接提高产量[12]。研究发现, 高产小麦品种的旗叶具有“直→平→垂”的动态变化特征, 即抽穗开花时呈“直立”态, 之后随灌浆进程而变成“水平”态, 灌浆后期变成“倒垂”态[8,13-14], 这类品种的群体光合速率和光能转化效率都高于其他类型品种。Long等[15]认为, 比较理想的株型是上部叶小而直立、中下部叶片大而平展。Rajaram和van Ginkel[13]则指出, “理想株型”不应绝对化, 应根据不同需要设计多元化类型。直立型于良好生产环境优势明显,对于干旱、寡日照等不利环境, 较高的植株和披散型叶片似乎更具优势[16]。
一般认为, 小麦产量潜力与单个叶片或旗叶的光合速率(Pn)缺乏密切相关[17-18], Sharma-Natu和Ghildiyal[19]发现某些现代品种的 Pn甚至比其野生祖先种还低。然而, 产量的高低不仅仅取决于光合速率, 而且单一叶片的Pn也不能代表群体的光合速率[18,20]。提高非饱和状态下的光合速率和整个冠层的光合速率是进一步提高产量潜力的关键[21], 因此,群体光合速率与最终产量更具相关性[22-23]。提高叶片叶绿素含量利于提升光合能力, 花后叶片叶绿素含量与产量潜力有密切关系, 尤其在高温、干旱等逆境环境中[10,20,24-25]。
光合生产是物质积累的基础, 而光合产物的分配则决定最终籽粒产量。研究表明, 开花期幼穗干重与籽粒产量密切相关[1], 叶片过大、植株过高, 会使幼穗比例下降[1,19]。开花期各器官干重占地上部总干重的比例, 因生态区域、基因型的不同而异[26], 但开花期穗干重比例在品种之间差别并非很大, 且同单位面积粒数和最终产量之间也无显著相关[27]。小麦生物产量基本稳定, 近几十年来产量潜力的巨大提升主要源自收获指数的显著提高[5,17,28-29]。Austin等[30]提出收获指数的理论最高值为 62%, 而目前高产品种和高产田的收获指数与此还有很大差异, 因此有学者认为通过改造株叶型, 尤其是成熟期的株叶型, 以及优化同化产物在各器官的分配, 最终可以达到提高收获指数的目的[17]。
四川盆地是西南冬麦区的主体部分, 常年种植小麦110万公顷。该区小麦属冬播春性小麦, 由于冬暖春旱, 温度较高, 全生育期一般仅180~190 d; 日照少, 中后期空气湿度大, 病虫危害较重, 长期以来选择形成了叶片宽大披垂的大穗型品种, 常常不到350穗 m-2, 20世纪70年代至21世纪前10年, 品种产量潜力仅4000~5000 kg hm–2[31]。21世纪初首次育成了平均区试产量突破6000 kg hm–2的川麦42,高产验收获得9000 kg hm–2以上的高产[23]。之后,利用川麦42又育成了川麦104和绵麦367等高产新品种和品系, 使该地区小麦产量潜力达到一个新高度[32]。相对育种取得的突出进展, 针对高产潜力品种的高产机制还缺乏系统研究, 高产的生理基础还不清楚。本研究利用3个典型高产潜力品种和3个一般产量潜力品种, 在单株和群体水平上进行了生理指标的比较, 旨在揭示花后冠层结构、光合功能、物质分配等生理参数与产量之间的关系, 为四川盆地生态区小麦高产育种和栽培技术改进提供理论基础。
1 材料与方法
1.1 自然条件与试验设计
自2010年10月至2015年6月连续5年进行田间试验, 本文中试验年度指收获年份。试验地位于四川盆地西部的广汉市连山镇(31°00′N, 104°39′E,海拔 450 m)。试验地质地黏壤, 前作水稻, pH 7.1, 0~20 cm 土层土壤养分含量 5年平均值为有机质4.87 g kg–1、全氮2.6 g kg–1、全磷1.0 g kg–1、全钾17.8 g kg–1、有效氮234.2 mg kg–1、有效磷11.8 mg kg–1、有效钾125.1 mg kg–1。气温和降水量数据(图1)从距试验田30 m的气象站获取。2012年和2014年开花期和成熟期与常年相近; 2013年和2015年冬春温度偏高, 开花期和成熟期较常年提早; 2011年两度出现持续低温, 导致开花期和成熟期较常年推迟约10 d。
参试品种6个(表1), 其中典型高产潜力品种3个(川麦42、川麦104和绵麦367, 均多年多点次验收超过9000 kg hm–2), 一般产量潜力品种3个(川麦55、西科麦5号、绵麦37)。3个高产潜力品种均为农业部确定的主推品种。川麦42、绵麦37分别是当前国家区试长江中上游组和四川省区试的对照品种。5年均在10月播种, 具体日期分别为30日、26日、28日、29日和29日; 开花期分别为4月14日至19日、4月3日至7日、3月22日至24日、4月2日至6日和3月26日至30日; 成熟期分别为5月18日至23日、5月10日至15日、5月6日至8日、5月12日至17日和5月6日至9日。随机区组设计, 3次重复, 小区面积3 m × 4 m, 行距20 cm,基本苗 225~266株 m-2, 各品种在同一年份种植密度一致。全年育期施N、P2O5和K2O分别为160、75和75 kg hm-2, 氮肥基施60%, 拔节期追施40%,磷、钾肥全部作基肥一次性施用。全生育期仅在拔节初期(1月 10日左右)灌水一次。喷施杀虫剂和杀菌剂控制病虫害。
1.2 小麦群体形态和生理指标测定方法
于2013年3月20日至24日、2014年3月31日至4月7日、2015年3月23日至28日的开花期,以及花后20 d, 从每个小区取5株代表性植株, 自然竖立状态下测定主茎顶三叶的基角(茎秆向上方向与叶鞘直立部分的夹角)和开张角(茎秆向上方向与叶耳至叶尖连线的夹角)。

图1 小麦生育期间(11月至翌年5月12日)的月均气温和月降水量Fig. 1 Monthly mean temperature and rainfall amount during wheat growing period (from November to May 12 of the next year)

表1 参试品种信息Table 1 Information of wheat cultivars
在测定叶基角和开张角的当天, 选每个小区 2个点, 采用CI-110冠层分析仪(CID公司, 美国)测定植株 2/3位置的冠层结构参数, 包括叶面积指数(LAI)、平均叶倾角(MLA, 叶片与水平线的夹角)、散射辐射透过系数(TCDP)、直接辐射透过系数(TCRP)、冠层截获有效辐射量(PAR)、消光系数(K)和叶片分布(LD)。
2013年于抽穗期(3月11日至18日)、开花期及花后20 d、40 d, 2014年和2015年于开花当天和花后20 d, 选每小区一点, 用同RR-8320移动式群体光合自动测定系统(北京雨根科技有限公司)测定群体光合速率, 同化箱长、宽、高分别为50、50和100 cm, 顶部加装混合风扇, 保证箱内气体混合均匀。先确定同化箱底座, 然后将同化箱放置在底座上,在保持箱内空气与外界无任何交换的情况下, 每隔1 min对箱内待测气体的浓度测定一次。根据被测气体浓度随时间的变化, 计算群体光合速率。

式中, F为群体光合速率(μmol m–2s–1); V为同化箱(包括进出气管)的总体积(m3); A为同化箱底面积(m2); P0和P为标准和样品大气压(kPa); T0和T为样品温度和绝对温度( ); ℃ Ct为t时段箱内气体浓度差(μmol mol–1); t为时间间隔(s)。2013—2015年花后20 d测定时间为10:00–12:00, 环境气温25.0°C, 光照强度635 W m–2; 2014年和2015年上述参数分别为21.8°C、280 W m–2和19.5°C、197 W m–2。
2011—2015年, 于开花期每个小区标记开花时间、长势基本一致的15个茎, 按花后0、12、22和32 d测定顶三叶的叶绿素含量 SPAD 值(Konica Minolta Sensing, Osaka, Japan), 测定每个叶片上、中、下3个部位, 取平均值。
1.3 小麦生物量和籽粒产量测定方法
2011—2015年, 开花期从每个小区取40 cm段植株, 剪掉根系, 记录成穗茎数, 之后随机取 15个成穗茎, 测定旗叶的长、宽, 分叶片、茎鞘、幼穗三部分烘干称重。生理成熟后从每个小区取40 cm段植株, 剪去根系, 记录有效茎数, 并随机取 30个有效茎测定株高、各节间长度、穗粒数; 考种结束后,将无效茎蘖以及有效茎数的籽粒、穗轴+颖壳、茎鞘、叶片分开包扎, 于 80℃下烘干至恒重称重, 计算收获指数、生物产量、千粒重(调整至 13%含水量)。节间构成指数, 按魏燮中和吴兆苏[33]的规定, 为任一节间长度与该节间加下一节间长度之和的比值。
于成熟期收获中间6行计产, 计产面积4.8 m2,籽粒水分含量统一调至13%。
1.4 统计分析
采用 Microsoft Excel作图, Statistical Analysis System (SAS version 8.0)软件进行方差分析和Pearson线性相关分析; 用最少极差法(least significant difference, LSD)进行多重比较(α = 0.05)。冠层结构指标为 2014年和2015年数据, 光合特性参数为2013—2015年数据, 其他指标均为5年数据。
2 结果与分析
2.1 不同品种的籽粒产量、产量构成和生物产量
参试品种的籽粒产量7617~9845 kg hm–2, 极差2228 kg hm–2, 高产潜力品种平均9422 kg hm–2, 比一般产量潜力品种高14.3%。产量构成上, 川麦42、川麦104大于450穗 m-2, 而川麦55不足400穗 m-2;绵麦367、川麦55的穗粒数达到50粒左右, 而川麦42不足40粒; 单位面积粒数以绵麦367最高, 超过22 000粒 m-2, 而川麦42和绵麦37最低, 为20 000粒m-2左右; 川麦42、川麦104的千粒重高达48 g以上, 其余品种42.2~44.8 g; 生物产量以川麦104、川麦42、绵麦367、川麦55较高, 彼此之间无显著差异, 但都显著高于绵麦37和西科麦5号(表2)。收获指数以绵麦367、川麦104较高, 达到0.47以上,一般产量潜力品种都低于 0.45; 年份间差异较大, 2012年仅0.436, 而2015年达到0.471。
2.2 不同品种的株高、节间构成及倒伏情况
参试品种株高差异显著, 川麦42最高(98.2 cm)、绵麦37最低(84.7 cm), 高产潜力品种显著高于一般产量潜力品种(表3)。上部3个节间的节间构成指数品种间差异较小, 穗颈节以川麦104最小、川麦55最大; 从穗颈节至倒三节, 节间构成指数呈显著减小趋势。
2011年和2013年个别品种轻微倒伏; 2012年和2014年倒伏严重, 尤其是2014年; 2015年未发生倒伏(表3)。以川麦55倒伏最轻, 川麦42倒伏最重。川麦104植株较高, 但倒伏少而轻; 绵麦37虽矮, 但倒伏明显。
2.3 不同品种的叶片大小、姿态和冠层光照分布
2.3.1 叶片大小及基角和开角 开花期旗叶的长、宽及长宽比在品种之间均存在显著差异, 高产潜力品种的旗叶短而宽, 长宽比均小于 10; 倒二叶变化规律相似, 以川麦42最短、最宽、长宽比最小;倒三叶叶宽品种间相近。顶三叶的叶长、长宽比同穗数呈显著负相关(表4)。
开花期叶片基角、开角在品种间的差异因叶位不同而不同。旗叶基角, 川麦42和西科麦5号达30°以上, 川麦 55不足 20°, 而旗叶开角在品种间无显著差异; 倒二叶基角和开角品种间差异显著, 仍以川麦55最小, 与旗叶相比, 倒二叶的基角绝对值变化不大, 而开角明显增大; 倒三叶基角和开角, 除川麦55较低之外, 其他品种无显著差异。基角、开角与穗数之间存在一定程度的正相关, 其中倒二叶和倒三叶的相关度稍高(表4)。
从开花至灌浆期, 叶片基角变化明显。高产潜力品种的旗叶从较直立变成水平, 即基角从 20°左右变成 90°以上, 而一般产量潜力品种保持在17~50°; 倒二叶基角变化与旗叶趋势相近; 倒三叶基角变化则有很大不同, 川麦 55依然不到 50°, 但西科麦5号和绵麦37超过100°。灌浆期品种叶片开角的差别主要体现在旗叶, 川麦 55和绵麦 37的开角不足50°, 其余品种都达到100°以上。灌浆期旗叶和倒二叶的基角、开角与穗数之间都呈极显著正相关, 与产量有较高的正相关(表4)。
2.3.2 冠层分析仪参数 开花期川麦104的冠层叶面积指数较小, 其余品种之间无显著差异, 与群体光合速率和籽粒产量均呈负相关; 平均叶倾角无显著差异; 散射辐射和 27°的直接辐射均无显著的基因型差异, 但二者与群体光合、籽粒产量均呈不同程度的正相关, 高产潜力品种的辐射量总体高于一般产量潜力品种。消光系数没有显著的基因型差异, 与群体光合、籽粒产量呈一定程度的负相关。灌浆中期, 冠层叶面积指数急剧减小, 品种以川麦42最小, 其余品种间无显著差异, 与群体光合、籽粒产量之间也无相关性; 平均叶倾角与散射辐射均无显著的基因型差异, 但平均叶倾角与群体光合、籽粒产量呈显著负相关。直接辐射和消光系数在品种间的差异、以及同群体光合、籽粒产量之间的关系, 都因测量角的不同而异; 45~81°的消光系数与籽粒之间呈极显著正相关, 高产潜力品种的消光系数明显高于一般产量潜力品种(表5)。
2.4 叶绿素含量、群体光合速率
花后0~22 d, 顶三叶SPAD值趋势一致, 高产潜力品种都显著高于一般产量潜力品种, 川麦104表现尤为突出, 旗叶及倒二叶的 SPAD值一直保持最高。川麦42和川麦104在开花至灌浆中后期叶片一直保持浓绿, 而到成熟期前 5 d左右, 叶片迅速落黄。花后 32 d, SPAD值呈相反趋势, 2014年旗叶SPAD值高产潜力品种明显低于一般产量潜力品种,倒二叶和倒三叶则无显著差异; 2015年, 高产潜力品种上三叶SPAD值高于一般产量潜力品种(表6)。

表2 参试品种的籽粒产量、产量构成及生物产量Table 2 Grain yield, yield components, and biomass yield of cultivars

表3 参试品种的株高、节间构成指数和倒伏情况Table 3 Differences in plant height, internode index, and lodging amongst genotypes across years
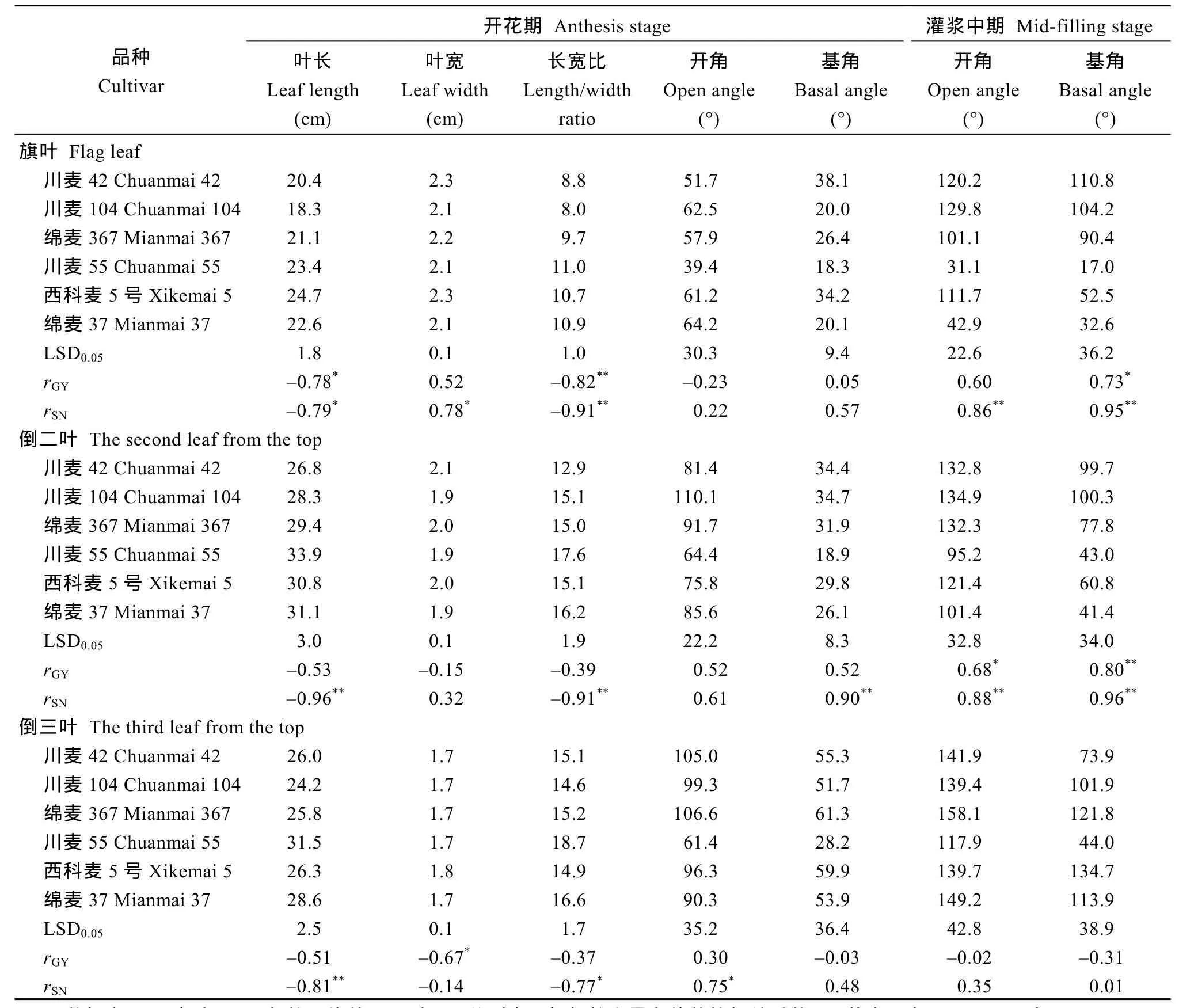
表4 开花期和灌浆中期上三叶的叶长、叶宽、开角、基角Table 4 Leaf length, width, open, and basal angles for the top three leaves at anthesis and mid-filling stage


表6 花后0~32 d不同小麦品种顶三叶SPAD值变化Table 6 Dynamic SPAD values in the top three leaves of different wheat cultivars at 0–32 days after anthesis (DAA)
顶三叶在花后不同时段的 SPAD值与籽粒产量正相关, 其中旗叶和倒二叶花后0、12和22 d的相关系数达极显著水平(旗叶相关系数 0.70~0.75, 倒二叶相关系数0.71~0.90), 而倒三叶SPAD值只在花后0 d和12 d与籽粒产量的相关性达极显著水平(P< 0.01), 相关系数分别为0.82和0.70。
抽穗期(开花前15 d左右), 3个高产潜力品种的群体光合速率明显较低, 可能是此期的叶绿素含量较低所致。大田抽穗时, 高产潜力品种尤其是川麦42的叶片呈淡绿色, 至开花时则变成浓绿。花后0 d和20 d的群体光合速率则以川麦104最高, 西科麦5号、绵麦37最低; 花后40 d 群体光合速率均为负值(图2)。
基于2013年测定结果, 2014年和2015年继续测定花后0 d和20 d的群体光合速率的日变化。两年结果一致表明, 花后 0 d群体光合速率显著高于花后20 d, 且花后0 d的群体光合基因型差异更加显著(图3)。2014年15:00和17:00时的CAP, 品种之间差异不显著, 而上午测定 3次差异均显著, 尤以12:00时3个高产潜力品种测定值显著高于一般产量潜力品种; 8:00时虽然光照较弱, 川麦104仍有较明显的优势。2015年花后0 d的CAP, 除15:00外的其他时间点, 品种间差异均显著, 川麦104、绵麦367在8:00时的群体光合速率大于零, 其余品种均为负值, 至 10:00时达到峰值, 且高产潜力品种优势明显。花后0 d、20 d群体光合速率与籽粒产量之间显著正相关, 其相关系数分别为 0.889 (P < 0.01)和0.903 (P < 0.01)。
2.5 不同品种开花期、成熟期地上部干物质分配2.5.1 开花期各器官干重及所占比例 开花期地上部各器官干重及其比例在品种间均存在显著差异。绵麦367、川麦55的单茎幼穗干重较高, 而川麦42、川麦104较低; 川麦55的叶片干重远高于其余品种; 茎鞘、单茎总干重与幼穗趋势相近, 都以川麦55和绵麦367为高。至于各器官所占比例, 茎鞘与株高保持一致, 即植株越高则所占比例越高, 而叶片较长的品种(如川麦 55)其叶片所占比例自然也高; 幼穗所占比例以川麦42、川麦104较低。单茎幼穗干重、总干重与每穗粒数关系密切, 幼穗所占比例与每穗粒数也显著相关, 间接影响单位面积粒数; 各器官干重及其所占比例与籽粒产量之间没有直接的相关性(表7)。

图2 开花前及花后各品种的群体光合速率(2013)Fig. 2 Canopy apparent photosynthesis (CAP) before and after anthesis in different cultivars (2013)

图3 花后0 d和20 d各品种群体光合速率(CAP)的日变化Fig. 3 Daily changes in canopy apparent photosynthesis (CAP) in different cultivars at 0 and 20 days after anthesis*P<0.05,**P<0.01.

2.5.2 成熟期各器官干重及所占比例 成熟期川麦55的叶片干重达0.50 g, 而其余品种低于0.45 g;茎鞘仍以川麦55最高; 穗轴&颖壳以川麦104最低,每茎0.41 g, 而绵麦367、西科麦5号等达0.48 g以上; 单茎粒重呈现3个层级, 绵麦367、川麦55达到2.0 g以上, 川麦42、川麦104次之, 约1.75 g, 而西科麦5号、绵麦37只有1.6 g左右。各器官所占总干重比例可分成 2个层级, 高产潜力品种的叶片所占比例不到10%, 以绵麦367最低, 而一般产量潜力品种都超过了10%; 高产潜力品种的穗轴所占比例都低于12%, 以川麦104最低, 一般产量潜力品种中有2个达13%以上(2015年西科麦5号和绵麦37);茎鞘所占比例以川麦42最高, 超过30%, 其余品种差异不显著; 高产潜力品种的籽粒所占比例47.19%~50.48%, 显著高于一般产量潜力品种。叶片、穗轴+颖壳所占比例与籽粒产量呈显著负相关, 而籽粒所占比例与产量呈显著正相关(表7)。
3 讨论
3.1 冠层结构、生理与籽粒产量
研究结果显示, 3个高产潜力品种的籽粒产量显著高于 3个一般产量潜力品种, 原因之一是生物产量的显著提升(表 2), 进一步说明通过提高光合效率,进而提高产量的重要性[15,22,34]。普遍反映, 近几十年来单产的提升并未伴随单个叶片光合速率的提升, 主要原因在于单叶光合速率并不能反映群体的全貌[15,19],加之最终产量还涉及光合产物的分配问题[21]。多数时候, 群体光合速率与生物产量、籽粒产量之间具有紧密关系[22-23]。群体光合涉及诸多外在因素(温度、光强等)、内在因素(相关酶活性、叶绿素含量等)和形态结构因素。株高、叶姿及空间布局等形态结构因素主要影响自然光在群体内的分配, 进而影响群体对光的截获、光合效能、能量消耗。小麦上部叶片直立、中下部叶片平展的群体构造利于最大限度利用光能资源, 促进生物产量和籽粒产量的增长[12,14-15,21]。Aliyev等[35]系统监测结果表明, 上部叶片小而直立的品种类型更易塑造理想的冠层结构, 促进灌浆期间各层叶片的光合效能; Hu等[36]的试验发现, 株型紧凑的鲁麦22下层光强更大、荫蔽减弱, 进而使呼吸消耗减小、光合能力更强。本研究中 3个高产潜力品种的旗叶、倒二叶在抽穗开花时较直立, 到灌浆中后期又变得水平、最后完全下垂; 开花期冠层分析仪的叶面积指数与群体光合、籽粒产量呈负相关, 而间接辐射、直接辐射与群体光合呈正相关, 说明此期上层叶面积指数不宜过大、叶片相对直立,更利于光照下移; 灌浆中后期旗叶的基角、开角与群体光合和籽粒产量呈显著正相关。这些结果进一步证明“半紧凑+动态型”的特征更利于提高光合效率和产量[13-14,37]。Rajaram等[13]指出, 没有一种标准株型具有普遍的实用意义, 不同生态区域、不同生产环境应有相应的理想形态, 并基于株高、熟期、粒色和冠层结构特点提出了16种组合株型, 就冠层而言, 认为以Kauz为代表的中间型、动态型最佳; Li等[37]也总结提出了旱地环境的小麦株叶型。四川盆地日照少, 冬干春旱, 缺乏灌溉条件, 中后期空气湿度大、温度高, 结合本研究结果, 该生态区植株不宜过矮, 以85~90 cm为宜, 株叶型属半紧凑(上部叶片上挺而非完全直立)且呈动态型变化(孕穗开花阶段较直立, 灌浆中后期转为水平、灌浆末期下垂),更利于高湿环境下群体内通风透光, 降低呼吸消耗、病虫威胁和倒伏。
叶片作为光合作用的主要器官, 其叶绿素含量的必然与光合效率、花后物质生产和籽粒产量有密切联系[10,12,38]。本研究中, 开花至灌浆中后期, 高产潜力品种顶三叶的叶绿素含量都显著高于一般产量潜力品种, 所有年份表现一致。花后20 d的群体光合速率2013年测定值明显高于2014年和2015年,除了叶绿素因素(r = 0.70, P < 0.01, n = 24)外, 还因为2013年测定时的环境温度较高、光强较大, 而温度、光强与群体光合速率存在极显著正相关(r温度= 0.95, P < 0.01; r光强= 0.84, P < 0.01, n = 18)。2014年和 2015年旗叶叶绿素含量较低, 而群体又更大(茎蘖数与群体光合速率呈一定程度的负相关), 造成中下部通风透光不良, 呼吸消耗加剧。在抽穗期, 3个高产潜力品种的群体光合速率都一致低于一般产量潜力品种, 可能也跟叶绿素含量有关, 因为孕穗抽穗阶段, 川麦42等品种叶色较淡, 但在抽穗至开花的一小段时间内叶绿素合成迅速, 到开花时叶绿素含量显著高于一般产量潜力品种。究其原因, 可能与人工合成小麦种质有关, 3个高产潜力品种都是人工合成小麦衍生品种。人工合成小麦的叶绿素a/b值显著高于面包小麦、硬粒小麦及其杂种[39]。作者测定了一套人工合成小麦衍生重组近交系的上部叶片叶绿素含量, 高产系的叶绿素含量同样显著高于低产系(数据略)。同时, 参试高产潜力品种上部叶片变得短而小, 也可能导致叶片变厚, 从而提高叶绿素含量。除了叶绿素含量, 更大的库强也利于增强光合性能[21,33,40], 本文中川麦104、绵麦367的单位面积粒数也显著高于其余品种, 可能也是其群体光合较高的原因之一。
3.2 干物质分配及其与产量的关系
通过提高光合能力以增加同化产物是基础, 而增加的同化产物必须更多地分配到发育中的穗子和籽粒中, 才能最终提高籽粒产量。株叶型乃是物质分配最重要的影响因子, 绿色革命的本质即是株型变化导致的物质分配变化、进而提升产量的典型[5-6]。现实情况是, 很多生物产量已提升至很高的水平, 却因收获指数较低而不能获得很高的产量。Xiao等[6]研究山东省 1969—2006年小麦遗传改良进展时发现,几个高产品种的生物产量达到 17 000~19 000 kg hm–2, 但收获指数只有 0.39~0.44, 以致籽粒产量仅有 8500 kg hm–2左右, 说明物质转化分配依然存在较大问题。研究表明, 产量与单位面积粒数呈显著正相关, 而粒数又与花期穗干重紧密联系[1,6,23,29]。因此认为, 提高开花期同化产物分配至发育中的幼穗十分重要, 从本研究结果看, 开花期单茎幼穗干重品种之间差异很大, 大穗型品种很高, 占总干重的比例也较大, 但因受单位面积穗数的影响, 花期单茎幼穗干重与籽粒产量并无直接的相关性。川麦42、川麦 104尽管单茎幼穗干重不高、干重所占比例也较低, 但其成穗数多, 相应地单位面积粒数也高。当然, 开花期各器官干重及所占比例, 也受环境因素影响, 如 2013—2015年, 幼穗所占比例都在18%以上, 显著高于2011—2012年, 2011年尤其低,同化物分配至茎鞘的比重较高, 导致这一年穗粒数、单位面积粒数和籽粒产量都最低。随着灌浆进程及籽粒成熟, 同化物在器官间再分配。理论上讲,只要不倒伏, 分配至籽粒中的比例越高越好, 也就是收获指数越高越利于高产。Austi等[30]提出小麦收获指数理论上可以提高至 62%, 此时颖壳、叶片、茎鞘所占比例分别为13%、10%和15%; Foulkes等[26]认为, 可以在提高生物产量的同时, 进一步将颖壳所占比例降至 11%, 进而将籽粒所占比例提高至64%。本研究中, 叶片所占比例除了川麦55以外都低于11%, 尤其是3个高产潜力品种已将至10%以下, 达到了Foulkes等[26]提出的理想值; 颖壳所占比例较理想值高0.5~2.0个百分点, 3个高产潜力品种总体都较低, 其中川麦104的年份均值为11.27%。然而, 6个参试品种的茎鞘所占比例依然高达30%左右, 同大多数现代品种相近[2,26,30]。在已有报道中,成熟期籽粒所占比例多为40%~50%, 茎鞘所占比例还没有低于20%的情况, 9000 kg hm–2以上的高产主要还靠高生物产量, 收获指数较少突破45%[2-3]。因为无论植株高低, 茎鞘所占比例过低都将冒倒伏的风险。Berry等[41]研究指出, 支撑8000 kg hm–2以上产量的株型是株高 70 cm 左右, 基部节间直径4.0~5.9 mm、壁厚0.65 mm。Underdahl等[42]对North Dakota 1968—2006年春小麦农艺性状改良进展研究表明, 产量提升并未伴随株高的显著下降(参试品种平均达 98.3 cm), 但抗倒性提升和物质分配得到了显著改善。在本研究中, 川麦104植株超过90 cm,多年平均单穗重2.06 g, 但倒伏很少, 大面积生产也如此, 其抗倒机制值得进一步深入研究。值得注意的是, 3个高产潜力品种尤其是川麦104的穗轴所占比例明显低于其他品种, 且其抗穗发芽力也较强[43],表明降低穗轴所占比例以提高籽粒所占比例的潜力较大, 也不会造成负面影响。综合认为, 叶片 9%、穗轴 11%、再将茎鞘降至 25%, 从而使籽粒比例达到 55%以上, 是比较现实可行的。除了形态结构影响物质分配之外, 库强也影响花前贮藏物质的转运分配。川麦42、川麦104籽粒很大, 绵麦367籽粒虽中等, 但粒数达 22 000粒 m-2以上, 显著高于其他品种, 成为促进物质转移的强大库强。从实际观察看, 高产潜力品种落黄很好, 而川麦55落黄不佳,反映了物质转运不畅。
以上研究进一步印证了Reynolds等[40]提出的观点, 即要想较大程度提高小麦产量潜力, 必须协同改进多重目标性状——构建适宜的冠层结构、具备强大的源(高叶绿素含量、较长持续期)、提高群体光合和生物产量; 构建强大的库, 并协调源-库关系, 促进同化物最大限度转移至籽粒; 保持良好的植株结构, 提高抗倒力, 确保高产潜力和高品质得以实现。
4 结论
5年试验的参试品种在花后冠层结构、群体光合速率、上三叶叶绿素含量、物质分配和籽粒产量等方面均存在显著差异。3个高产潜力品种的植株较高, 顶三叶尤其是旗叶较短而宽, 长宽比较小; 旗叶从开花至灌浆中后期具“相对直立→水平→下垂”的动态变化特征。高产潜力品种花后0~22 d顶三叶的叶绿素含量显著高于一般产量潜力品种, 加之旗叶动态的叶姿特征, 使冠层微环境得到改善, 群体光合速率显著高于一般产量潜力品种。高产潜力品种开花时茎鞘干重所占比例较大, 与株高变化相一致, 而叶片所占比例有高有低; 成熟时参试品种的茎鞘干重所占比例差异不大, 而高产潜力品种的穗轴+颖壳所占比例低于12%、叶片所占比例低于10%,相应地籽粒所占比例较一般产量潜力品种高1~4个百分点。提出适应四川盆地暖湿、寡照生态区的9000 kg hm–2产量潜力小麦品种的形态生理指标, 即株高85~90 cm, 株型相对紧凑, 开花至灌浆期旗叶SPAD值50以上, 群体光合速率25~30 μmol CO2m–2s–1,成熟期茎鞘干重所占比例约30%、叶片10%以下、麸壳11%以下。
[1] Fischer R A. Wheat physiology: a review of recent developments. Crop Pasture Sci, 2011, 62: 95–114
[2] 张法全, 王小燕, 于振文, 王西芝, 白洪立. 公顷产 10000 kg小麦氮素和干物质积累与分配特性. 作物学报, 2009, 35: 1086-1096
Zhang F Q, Wang X Y, Yu Z W, Wang X Z, Bai H L. Characteristics of accumulation and distribution of nitrogen and dry matter in wheat at yield level of ten thousand kilograms per hectare. Acta Agron Sin, 2009, 35: 1086–1096 (in Chinese with English abstract)
[3] Jaradat A A. Modeling biomass allocation and grain yield in bread and durum wheat under abiotic stress. Aust J Crop Sci, 2009, 3: 237–248
[4] Madani A, Rad A S, Pazoki A, Nourmohammadi G, Zarghami R. Wheat (Triticum aestrivum) grain filling and dry matter partitioning responses to source: sink modifications under post anthesis water and nitrogen deficiency. Acta Sci Agron, 2010, 32: 145–151
[5] Tian Z W, Jing Q, Dai T B, Jiang D, Cao W X. Effects of genetic improvements on grain yield and agronomic traits of winter wheat in the Yangtze River Basin of China. Field Crops Res, 2011, 124: 417–425
[6] Xiao Y G, Qian ZG, Wu K, Liu J J, Xia X C, Ji W Q, He Z H. Genetic gains in grain yield and physiological traits of winter wheat in Shandong province, China, from 1969 to 2006. Crop Sci, 2012, 52: 44–56
[7] Miralles D J, Slafer G A. Radiation interception and radiation use efficiency of near-isogenic wheat lines with different height. Euphytica, 1997, 97: 201–208
[8] 雷振生, 林作揖. 黄淮麦区冬小麦合理株型结构研究. 华北农学报, 1994, 9(4): 27–32
Lei Z S, Lin Z J. Studies on ideotype characters of winter wheat in Huang-Huai wheat region. Acta Agric Boreal-Sin, 1994, 9(4): 27–32 (in Chinese with English abstract)
[9] Hansen K A, Martin J M, Lanning S P, Talbert L E. Correlation of genotype for agronomic and physiological traits in space-planted versus densely seeded conditions. Crop Sci, 2005, 45: 1023–1028
[10] Blake N K, Lanning S P, Martin J M, Sherman J D, Talbert L E. Relationship of flag characteristics to economically important traits in two spring wheat crosses. Crop Sci, 2007, 47: 491–496
[11] Araus J L, Reynolds M P, Acevedo E. Leaf posture, grain yield, growth, leaf structure, and carbon isotope discrimination in wheat. Crop Sci, 1993, 33: 1273–1279
[12] Zhao C J, Wang J H, Huang W J, Zhou Q F. Spectral indices sensitively discriminating wheat genotypes of different canopy architectures. Precis Agric, 2010, 11, 557–567
[13] Rajaram S, van Ginkel M. Yield potential debate: germplasm vs. methodology, or both. In: Reynolds M P, Rajaram S, McNab A, eds. Increasing Yield Potential in Wheat: Breaking the Barriers. Mexico D.F.: CIMMYT, 1996. pp 101–133
[14] Liu Y K, Li M J, Li J Y, Li X J, Yang X H, Tong Y P, Zhang A M, Li B, Lin J X, Kuang T Y, Li Z S . Dynamic changes in flag leaf angle contribute to high photosynthetic capacity. Chin Sci Bull, 2009, 54: 3045–3052
[15] Long S P, Zhu X G, Naidu S L, Ort D R. Can improvement in photosynthesis increase crop yields? Plant Cell Environ, 2006, 29: 315–330
[16] 魏燮中. 小麦株型结构分析法与消光系数分布的基因型间差异. 南京农业大学学报, 1987, (3): 21–28
Wei X Z. Plant type architecture analysis (PTAA) and the differences of K vertical distribution in canopy among wheat genotypes. J Nanjing Agric Univ, 1987, (3): 21–28 (in Chinese with English abstract)
[17] Leihner D E, Guillermo O F. Improvement of durum wheat-plant type, yield potential, and adaptation. Euphytica, 1978, 27: 785–799
[18] Fischer R A. Understanding the physiological basis of yield potential in wheat. J Agric Sci, 2007, 2007, 145: 99–113
[19] Sharma-Natu P, Ghildiyal M C. Potential targets for improving photosynthesis and crop yield. Curr Sci India, 2005, 88: 1918–1928
[20] Evans L T, Dunstone R L. Some physiological aspects of evolution in wheat. Aust J Biol Sci, 1970, 23: 725–741
[21] Reynolds M P, Delgado B M I, Gutiérrez-Rodríguez, Larqué-Saavedra A. Photosynthesis of wheat in warm, irrigated environment: I. Genetic diversity and crop productivity. Field Crops Res, 2000, 66: 37–50
[22] 董树亭. 高产冬小麦群体光合能力与产量关系的研究. 作物学报, 1991, 17: 461–469
Dong S T. Studies on the relationship between canopy apparent photosynthesis and grain yield in high-yielding winter wheat. Acta Agron Sin, 1991, 17: 461–469 (in Chinese with English abstract)
[23] Tang Y L, Rosewarne G M, Li C S, Wu X L, Yang W Y, Wu C. Physiological factors underpinning grain yield improvements of synthetic-derived wheat in southwestern China. Crop Sci, 2015, 55: 98–112
[24] Hafsi M, Hadji A, Guendouz A, Maamari K. Relationship between flag leaf senescence and grain yield in durum wheat growth under drought conditions. J Agron, 2013, 12: 69–77
[25] Kumari M, Pudake R N, Singh V P, Joshi A K. Association of staygreen trait with canopy temperature depression and yield traits under terminal heat stress in wheat (Triticum aestrivum L.). Euphytica, 2013, 190: 87–97
[26] Foulkes M J, Slafer G A, Davies W J, Berry P M, Sylvester-Bradley R, Martre P, Callerini D F, Griffiths S, Reynolds M P. Raising yield potential of wheat: III. Optimizing partitioning to grain while maintaining lodging resistance. J Exp Bot, 2011, 62: 469–486
[27] Abbate P E, Andrade F H, Lázaro L, Bariffi J H, Berardocco H G, Inza V H, Marturano F. Grain yield increase in recent argentine wheat cultivars. Crop Sci, 1998, 38: 1203–1209
[28] Giunta F, Motzo R, Pruneddu G. Has long-term selection for yield in durum wheat also induced changes in leaf and canopy traits? Field Crops Res, 2008, 106: 68–76
[29] Acreche M M, Briceńo-Félix G, Sánchez J A M, Slafer G A.Physiological bases of genetic gains in Mediterranean bread wheat yield in Spain. Eur J Agron, 2008, 28: 162–170
[30] Austin R B, Bingham J, Blackwell R D, Evans L T, Ford M A, Morgan C L, Taylor M. Genetic improvement in winter wheat yield since 1900 and associated physiological changes. J Agric Sci (Camb), 1980, 94: 675–689
[31] Zhou Y, Zhu H Z, Cai S B, He Z H, Zhang X K, Xia X C, Zhang G S. Genetic improvement of grain yield and associated traits in the southern China winter wheat region: 1949–2000. Euphitica, 2007, 157: 465–473
[32] Li J, Wan H S, Yang W Y. Synthetic hexaploid wheat enhances variation and adaptive evolution of bread wheat in breeding processes. J Syst Evol, 2014, 52: 735–742
[33] 魏燮中, 吴兆苏. 小麦植株高度的结构分析. 南京农学院学报, 1983, (1): 14–21
Wei X Z, Wu Z S. Analysis of plant height and structure. J Nanjing Agric Coll, 1983, (1): 14–21 (in Chinese with English abstract)
[34] Parry M A J, Reynolds M, Salvucci M E, Raines C, Andralojc P J, Zhu X G, Price G D, Condon A G, Furbank R T. Raising yield potential of wheat: II. Increasing photosynthetic capacity and efficiency. J Exp Bot, 2011, 62: 453–467
[35] Aliyev J A. Photosynthesis, photorespiration and productivity of wheat and soybean genotypes. Physiol Plant, 2012, 145: 369–383
[36] 胡延吉, 兰进好, 赵坦方, 高法振. 不同穗型的两个冬小麦品种冠层结构及光合特性的研究. 作物学报, 2000, 26: 905–912
Hu Y J, Lan J H, Zhao T F, Gao F Z. Canopy architecture and photosynthetic characteristics in two winter wheat cultivars with different spike type. Acta Agron Sin, 2000, 26: 905–912 (in Chinese with English abstract)
[37] 李朴芳, 程正国, 赵鸿, 张小丰, 李冀南, 王绍明, 熊友才. 旱地小麦理想株型研究进展. 生态学报, 2011, 31: 2631–2640
Li P F, Cheng Z G, Zhao H, Zhang X F, Li J N, Wang S M, Xiong Y C. Current progress in plant ideotype research of dry land wheat (Triticum aestivum L.). Acta Ecol Sin, 2011, 31: 2631–2640 (in Chinese with English abstract)
[38] Yildirim M, Koç M, Akinci C, Barutçular C. Variations in morphological and physiological traits of bread wheat diallel crosses under timely and late sowing conditions. Field Crops Res, 2013, 140: 9–17
[39] Rees D, Ibarra L R, Acevedo E, Mujeeb-Kazi A, Villareal R L. Photosynthetic Characteristics of Synthetic Bread Wheats. Wheat Special Report No. 28. Mexico, D.F.: CIMMYT, 1994
[40] Reynolds M P, Pellegrineschi A, Skovmand B. Sink-limitation to yield and biomass: a summary of some investigations in spring wheat. Ann Appl Biol, 2005, 146: 39–49
[41] Berry P M, Sylvester-Bradley R, Berry S. Ideotype design for lodging-resistant wheat. Euphytica, 2007, 154: 165–179
[42] Underdahl J L, Mergoum M, Ransom J K, Schatz B G. Agronomic traits improvement and associations in hard red spring wheat cultivars released in North Dakota from 1968 to 2006. Crop Sci, 2008, 48: 158–166
[43] Tang Y L, Li C S, Yang W Y, Wu Y Q, Wu X L, Wu C, Ma X L, Li S Z, Rosewarne G M. Quality potential of synthetic-derived commercial wheat cultivars in southwestern China. Crop Pasture Sci, 2016, 67: 583–593
Canopy Architecture, Physiological Characteristics and Assimilate Partitioning in Wheat Cultivars with 9000 kg ha-1Yield Potential in Sichuan Basin
WU Xiao-Li1, LI Chao-Su1, TANG Yong-Lu1,*, LI Jun1, MA Xiao-Ling1, LI Shi-Zhao1, and HUANG Ming-Bo21Crop Research Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China;2Guanghan Productivity Promotion Center, Guanghan 618300, China
In contrast to the outstanding breeding progress of high-yield wheat in Sichuan Basin of China, the physiological basis of high-yield-potential cultivars is unclear due to seldom studies. In this study, a five-year field experiment (2011–2015) was carried out to compare the differences of canopy structure after anthesis, canopy apparent photosynthesis (CAP), chlorophyll content (SPAD), and dry matter partitioning between high-yield and normal-yield potential cultivars. Three typical high-yield and three normal-yield potential cultivars were selected, and the average yield of the high-yield potential cultivars (9422 kg ha-1) was 14.3% higher than that of the normal-yield potential cultivars owing to higher biomass or harvest index. Compared with the normalyield potential cultivars, the high-yield potential cultivars had shorter and wider flag leaves (length-to-width ratio lower than 10) and showed obvious increases of basal and open angles of the topmost three leaves from early anthesis to mid-filling stage. From anthesis to late-filling stage, SPAD values of the topmost three leaves and CAP values at 0 and 20 days after anthesis were significantly higher in the high-yield potential cultivars than in the normal-yield potential cultivars, with the largest difference ofCAP between 10:00 and 12:00 a.m. In addition, the high-yield potential cultivars showed higher biomass proportion of stem and sheath at anthesis and higher (1–4 percentage points) biomass proportion of grain at maturity than the normal-yield potential cultivars. Grain yield was closely related to morphological and physiological parameters in wheat. For example, grain yield was positively correlated with basal angles of flag leaf (r = 0.947, P < 0.01) and the second leaf from top (r = 0.963, P < 0.01) at grain-filling stage and negatively correlated with leaf length-to-width ratios of flag leaf (r = -0.913, P < 0.01) and the second leaf from top (r = -0.911, P < 0.01). Grain yield was also positively correlated (P < 0.01) with SPAD values of the topmost three leaves (r = 0.75, 0.90, and 0.82), but negatively correlated with the proportion of spike rachis at maturity (r = -0.956, P < 0.01). Our results indicate that moderate plant height, compact plant type, high SPAD and CAP values after anthesis, and proper dry matter partitioning are important factors in high-yielding physiology of wheat.
Wheat; Canopy architecture; Canopy apparent photosynthesis; Dry matter partitioning; Grain yield
(
): 2016-02-23; Accepted(接受日期): 2017-03-01; Published online(网络出版日期): 2017-04-19.
10.3724/SP.J.1006.2017.01043
本研究由国家现代农业产业技术体系建设专项(CARS-3-1-23)和国家自然科学基金项目(31571590)资助。
This study was supported by the China Agriculture Research System (CARS-3-1-23) and the National Natural Science Foundation of China (31571590).
*通讯作者(Corresponding author): 汤永禄, E-mail: ttyycc88@163.com, Tel: 028-84504601
联系方式: E-mail: wuxiaolicjq@126.com
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170419.0852.002.html
