咪唑类离子液体对酶法醇解制备脂肪酸酯的影响研究
2017-07-25邹孝强金青哲王兴国
秦 杰,孙 聪,邹孝强,金青哲,王兴国
(江南大学 食品学院,食品科学与技术国家重点实验室,食品营养与安全协同创新中心,江苏 无锡 214122)
油脂化工
咪唑类离子液体对酶法醇解制备脂肪酸酯的影响研究
秦 杰,孙 聪,邹孝强,金青哲,王兴国
(江南大学 食品学院,食品科学与技术国家重点实验室,食品营养与安全协同创新中心,江苏 无锡 214122)
在不同阴离子组成的咪唑类离子液体体系中,以含有不同脂肪酸组成的油脂与醇类为反应原料,酶法醇解制备脂肪酸酯,考察了离子液体种类对制备脂肪酸酯的影响,并探索离子液体的主要性质对脂肪酸酯制备的影响规律。结果表明:在疏水阴离子组成的离子液体中,脂肪酸酯的生成量较高,且阴离子的影响较为明显。离子液体的性质与脂肪酸酯的生成量有一定的相关性,且是共同作用的结果,除某些特例外,随着离子液体极性值和氢键碱度的增加,脂肪酸酯的生成量整体呈现下降趋势;随着离子液体疏水性值的增加,脂肪酸酯的生成量增加;离子液体黏度与脂肪酸酯没有明显的相关性,但高黏度会影响脂肪酸酯的生成量。另外,此结论适用于各种脂肪酸组成的油脂。
离子液体;脂肪酸酯;极性;疏水性;氢键碱度;黏度
传统的有机溶剂由于熔点低,作为反应介质时存在挥发,会伤害人体和污染环境;并且有机溶剂对脂肪酶有一定的破坏作用。而离子液体被认为可以弥补有机溶剂的缺点,成为新型的反应介质。在离子液体作为介质时,脂肪酶的活性、稳定性都有提升,且产物的得率和原料的转化率也有提高。离子液体是指由特定的有机阳离子与无机或有机阴离子构成的,在室温或近室温下呈液态的熔盐体系[1-2]。离子液体具有一定的可设计性,通过不同阴阳离子的组合,离子液体可以被设计成环境友好型、可持续发展的溶剂[3],从而较大范围地改变离子液体的物理化学性质。
脂肪酸酯是由甘油酯与醇类反应生成的产物之一。脂肪酸酯的应用领域广泛,如大豆油、桐油的脂肪酸甲酯可作为锅炉、涡轮机、柴油机等的燃料,俗称生物柴油。亚油酸乙酯是一种多烯不饱和脂肪酸酯,具有增强机体的免疫力、抗癌、降低人体胆固醇和血脂含量、预防或减轻动脉粥样硬化症、调解控制代谢、促进动物生长发育等诸多生理功能[4]。深海鱼油中的多不饱和脂肪酸,在产品的实际生产过程中,通常需要将其转化为乙酯形态,以适应不同人群的需要[5]。脂肪酸酯的制备研究可分为酶法和化学法,常采用油脂的醇解反应来制备[6-7]。在有机溶剂体系中利用固定化脂肪酶催化制备生物柴油时,为了提高固定化酶的操作稳定性,甲醇需要分批次加入[8-9]。而在离子液体中,李颖[10]使用价格低廉的脂肪酶Lipozyme TL IM在[BMIM][PF6]中可以有效催化大豆油转酯制备生物柴油,一次加入甲醇进行反应,最终得到生物柴油的产率98.3%。由此可见,离子液体中酶法制备脂肪酸酯反应过程简单,有一定的优势。虽然离子液体成本较有机溶剂高,但是离子液体作为介质,分离简单,可重复使用,更主要的是,离子液体可以减少反应过程中原料和副产物对脂肪酶的破坏作用。
本文旨在分析不同的离子液体中油脂醇解制备脂肪酸酯的规律,同时将离子液体的主要性质与脂肪酸酯的生成量做相关分析,并探索了不同脂肪酸组成的油脂为原料制备脂肪酸酯是否具有普遍的规律,可成为离子液体为介质制备各类脂肪酸酯的理论基础,若后续研究纯化方法,即可获得较纯的某一种脂肪酸酯。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
鱼油甘三酯:挪亚圣诺生物科技有限公司;玉米油:中粮东海粮油工业(张家港)有限公司;亚麻籽油:实验室合作企业提供;高油酸葵花籽油:上海良友海狮油脂实业有限公司;2,6-二苯基-4-(2,4,6-三苯基吡啶),十七碳酸甲酯标品:Sigma公司;离子液体[BMIM][PF6],[OMIM][PF6],[HMIM][Tf2N],[OMIM][Tf2N],[OMMIM][Tf2N],[BMIM][BF4],[OMIM][BF4]:上海成捷化学有限公司;Lipozyme TL IM:诺维信(中国)生物技术有限公司提供;无水甲醇为分析纯,正己烷、异丙醇为色谱纯。
1.1.2 仪器与设备
超高级恒温循环水浴锅;多点磁力搅拌器,德国IKA集团;分析天平、紫外可见分光光度计,梅特勒-托利多仪器(上海)有限公司;离心机;ZK-82BB型电热真空干燥箱;高效液相色谱仪带示差折光检测器,美国Agilent公司。
1.2 实验方法
1.2.1 离子液体性质的测定
1.2.1.1 离子液体的极性
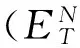
(1)
(2)
1.2.1.2 离子液体的黏度
所有离子液体在25℃下使用芬氏黏度计测定黏度。
1.2.1.3 离子液体的疏水性
离子液体的疏水性数据参见文献[11-14]。
1.2.1.4 离子液体的氢键碱度
离子液体的氢键碱度数据参见文献[15-19]。
1.2.2 甘油三酯的醇解反应
分别将一定量的鱼油甘三酯、玉米油、亚麻籽油、高油酸葵花籽油与甲醇共同放置于夹层反应器中,加入一定量的离子液体和脂肪酶Lipozyme TL IM,在40℃条件下搅拌反应一定时间后取样。
1.2.3 脂肪酸酯的测定
采用气相色谱-内标法分析脂肪酸甲酯的含量。色谱条件:DB-FFAP毛细管气相色谱柱(30 m×0.53 mm×0.25 mm);FID检测器;采用程序升温,初始柱温180℃,保持1 min,以15℃/min的速率升温到230℃,保持10 min;检测器温度250℃,进样口温度250℃;分流比100∶1。
2 结果与讨论
2.1 离子液体的性质
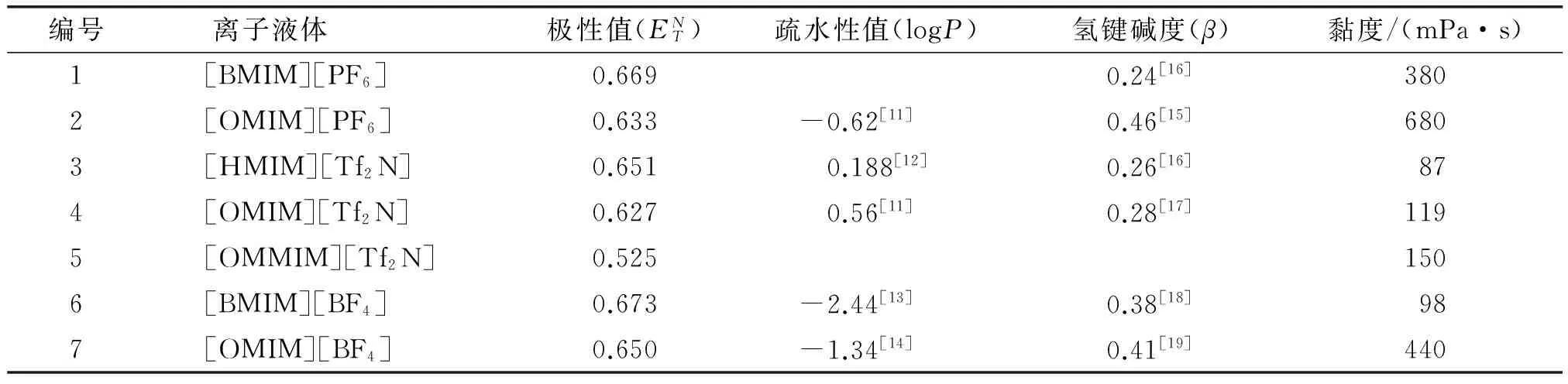
表1 离子液体的性质
由表1可见,离子液体的极性值普遍比水小(水的极性值为1)且大多不溶于水。在所选用的离子液体中,[BF4]-类的离子液体极性值较[PF6]-和[Tf2N]-类的离子液体大,而离子液体[BMIM][PF6](1号)是一个特例,它的极性值较大,与[BF4]-类的离子液体极性值接近。由[Tf2N]-类的离子液体(3~5号)的极性值发现,在阳离子吡啶环上多一个取代基,整体离子液体的极性值会下降([OMMIM][Tf2N]的极性值仅有0.525)。而从3种阴离子组成的离子液体的极性值可以发现,离子液体阳离子烷基碳链越长,离子液体的极性越低。
疏水性指的是一个分子与水互相排斥的物理性质,常常被人们与极性相联系,但其实两者有本质的区别。疏水性用logP(辛醇-水分配系数)来表征,即离子液体在水饱和的正辛醇与正辛醇饱和的水中浓度比的对数值,离子溶液虽然都有较高的极性,但通常是疏水性的。观察离子液体的疏水性值可发现,[BF4]-类的离子液体疏水性较小,而[PF6]-和[Tf2N]-类的离子液体的疏水性较高,主要是因为阴离子[BF4]-较其他两种阴离子较为亲水。
离子液体的黏度普遍高于有机溶剂,其黏度与乙二醇相近,远远高于甲醇和甲苯等常用的有机溶剂。由表1可以发现,[PF6]-类离子液体的黏度大于其他两类离子液体,而离子液体[OMIM][BF4]是一个特例,它的黏度也较大。
离子液体的氢键碱度指的是接受氢键的能力。Zhao等[14]认为,酶的活性与阴离子接受氢键的能力有关,在氢键碱度低的离子液体中,酶更加稳定。
2.2 离子液体种类对油脂醇解制备脂肪酸酯的影响
4种富含不同脂肪酸的油脂分别在7种不同离子液体中制备脂肪酸酯的结果见图1。
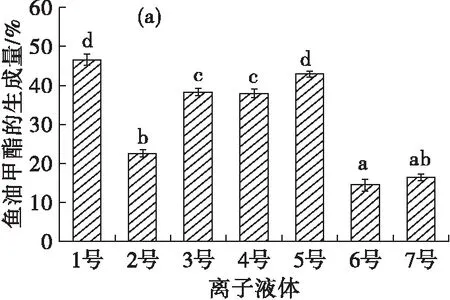
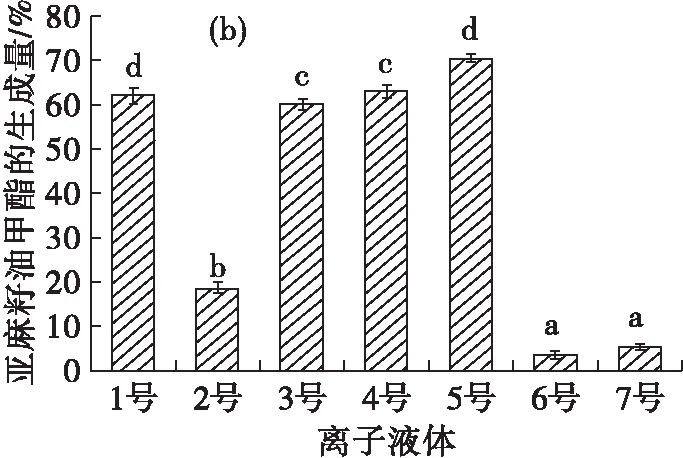
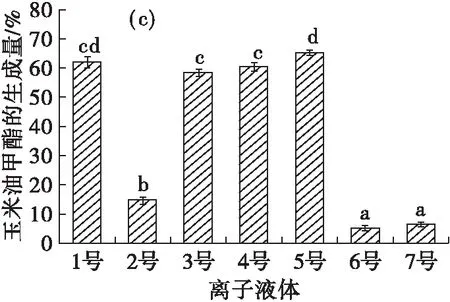
由图1(a)可见,在[Tf2N]-(3~5号)和[PF6]-(1~2号)两种阴离子组成的离子液体中,鱼油甲酯的生成量较高,而在[BF4]-类的离子液体中,鱼油甲酯的生成量较低。主要是由于阴离子[BF4]-相对[Tf2N]-和[PF6]-来说更为亲核,对脂肪酶中带正电位点的调整作用更强烈,从而更易引起脂肪酶构象发生变化,导致脂肪酶活力降低[20],进而对脂肪酶的催化作用有较大的影响[21]。而2号虽然是由[PF6]-组成的离子液体,但其黏度较大,一定程度上会影响反应速率,因此鱼油甲酯的生成量较低,却也均高于[BF4]-类的离子液体中的鱼油甲酯生成量。由此可见,疏水阴离子组成的离子液体中鱼油甲酯生成量较高。由图1(b)(c)(d)可见,在其他不同油脂制备脂肪酸甲酯的结果中,也可以发现类似的规律。
由此可以说明,在以离子液体为介质酶法制备脂肪酸酯的过程中,脂肪酸酯生成量与离子液体的阴离子有关,在疏水阴离子组成的离子液体中脂肪酸酯生成量较高,阴离子的影响较为明显,且以不同脂肪酸组成的油脂为原料制备脂肪酸酯的结果并无明显差异。
2.3 离子液体性质对油脂醇解制备脂肪酸酯的影响
2.3.1 离子液体的极性对油脂醇解制备脂肪酸酯的影响
图2是脂肪酸酯生成量与离子液体极性值的关系。
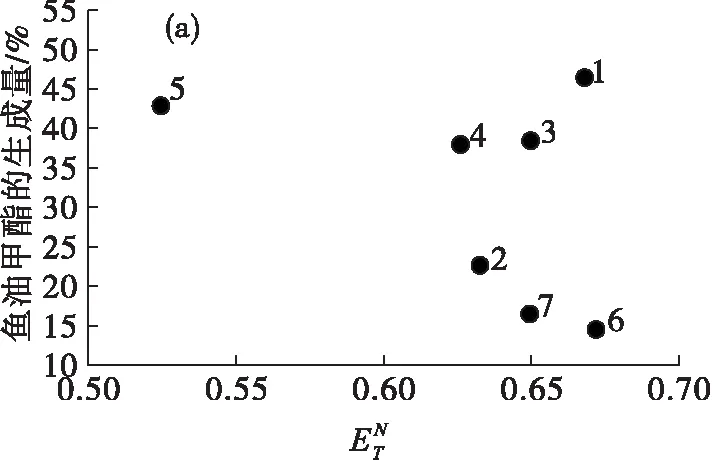
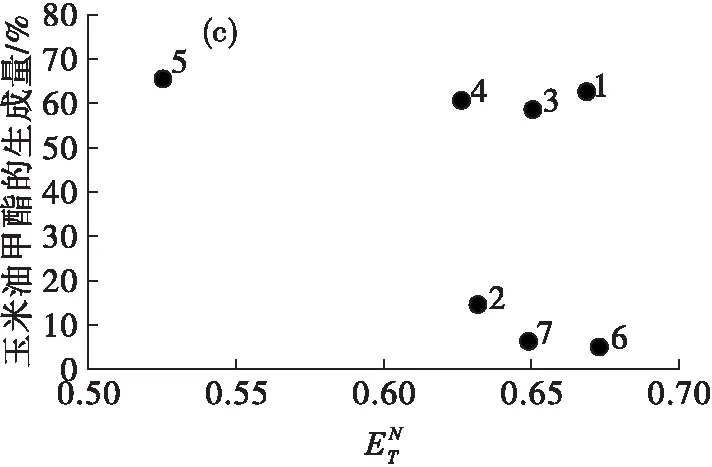
由图2(a)可见,随着离子液体极性值的增大,除1号离子液体外,鱼油甲酯的生成量大体呈现下降趋势,主要是因为高极性的离子液体会剥夺脂肪酶的必需水,降低脂肪酶的催化作用[14]。1号离子液体出现了明显的偏离,一方面是由于组成1号离子液体的阴离子是疏水的[PF6]-,相对[BF4]-类离子液体会生成更多的鱼油甲酯;另一方面,1号离子液体的极性较大,可能会降低脂肪酶的位置选择性,因此会生成更多的鱼油甲酯。在图2(b)(c)(d)中,玉米油甲酯、亚麻籽油甲酯和葵花籽油甲酯的生成量与鱼油甲酯的规律大致相似。
在葵花籽油甲酯和鱼油甲酯中,3号离子液体的甲酯生成量较高,而在玉米油甲酯和亚麻籽油甲酯中,4号离子液体的甲酯生成量较高。可能的原因是离子液体性质间共同作用的结果,3号离子液体和4号离子液体都是由[Tf2N]-阴离子组成的离子液体,3号离子液体的极性值大于4号,疏水性值、氢键碱度和黏度均小于4号,无法准确判断哪一种离子液体中脂肪酸酯生成量较多,因此在所选的4种不同油脂中也出现了不同的结果。
总的来说,在以离子液体中为介质酶法制备脂肪酸酯的过程中,随着离子液体极性值的增大,脂肪酸酯的生成量大体呈现下降趋势,而对于阴离子为疏水性且极性较大的离子液体,会出现偏离趋势的现象(1号),且以不同脂肪酸组成的油脂为原料制备脂肪酸酯的结果并无明显差异。
2.3.2 离子液体的疏水性对油脂醇解制备脂肪酸酯的影响
图3是脂肪酸酯生成量与离子液体疏水性值的关系。
由图3(a)可见,鱼油甲酯的生成量随着离子液体疏水性值的增加而增加。疏水性较小的离子液体会剥夺脂肪酶中的水分子层,从而降低脂肪酶的催化作用[14]。图3(b)(c)(d)中,玉米油甲酯、亚麻籽油甲酯的生成量也随着疏水性值的增加呈现上升的趋势,但是在葵花籽油甲酯的制备过程中,4号离子液体出现了微小的偏离,主要原因与2.3.1中讨论一致。
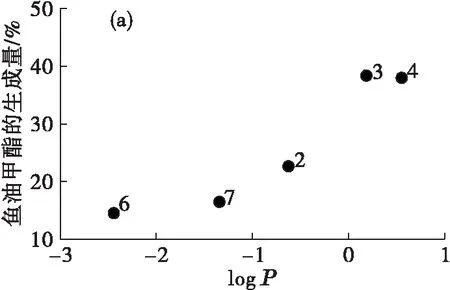
总的来说,在以离子液体中为介质酶法制备脂肪酸酯的过程中,随着离子液体的疏水性的增大,脂肪酸酯的生成量增加,且以不同脂肪酸组成的油脂为原料制备脂肪酸酯的结果并无明显差异。
2.3.3 离子液体的氢键碱度对油脂醇解制备脂肪酸酯的影响
图4是脂肪酸酯生成量与离子液体氢键碱度的关系。
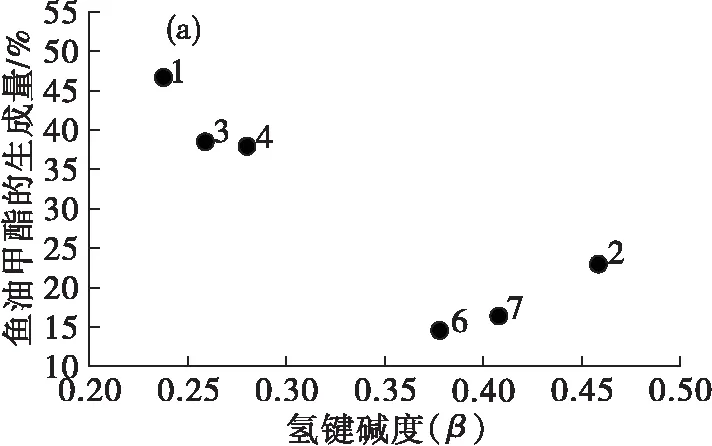
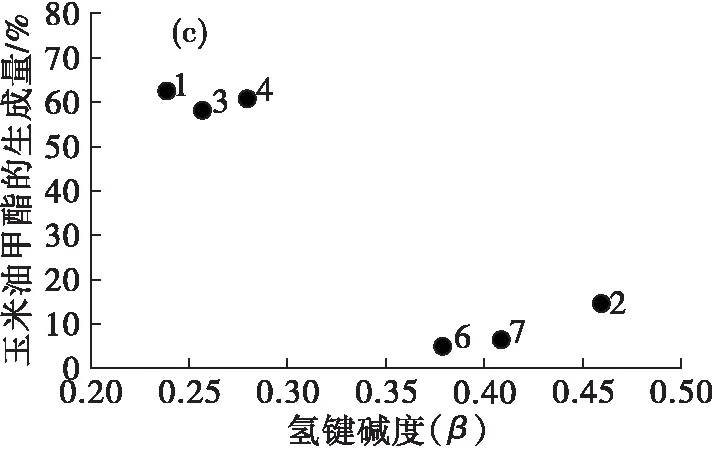
由图4(a)可见,鱼油甲酯的生成量随着离子液体氢键碱度的增加呈现下降的趋势,主要是由于高氢键碱度的离子液体会更容易与脂肪酶形成氢键[22],破坏脂肪酶结构,从而降低脂肪酶的催化作用。2号离子液体的鱼油甲酯生成量高于6号和7号,是因为2号离子液体的阴离子为疏水的[PF6]-,而阴离子的影响更为显著。图4(b)(c)(d)中,玉米油甲酯、亚麻籽油甲酯和葵花籽油甲酯的生成量与鱼油甲酯的规律大致相似。
由此可见,在以离子液体中为介质酶法制备脂肪酸酯的过程中,随着离子液体的氢键碱度的增大,脂肪酸酯的生成量大体呈现降低的趋势,但是影响作用没有阴离子显著,且以不同脂肪酸组成的油脂为原料制备脂肪酸酯的结果并无明显差异。
2.3.4 离子液体的黏度对油脂醇解制备脂肪酸酯的影响
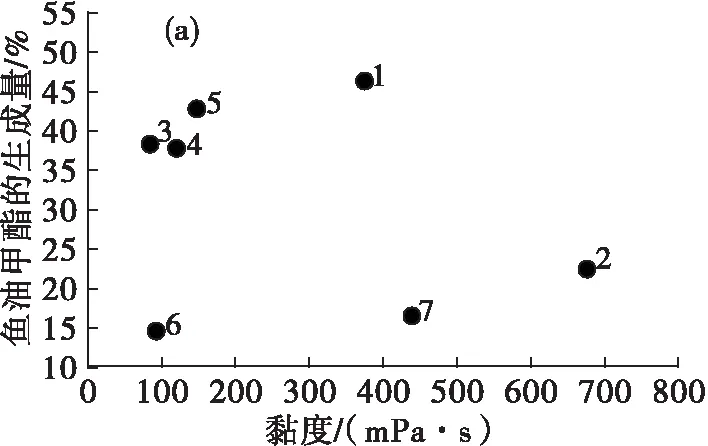
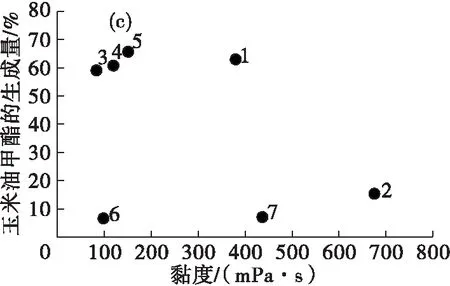
图5是脂肪酸酯生成量与离子液体黏度的关系。
由图5(a)可见,黏度对鱼油甲酯的生成量没有明显的影响。而在[PF6]-类离子液体(1~2号)中可发现,黏度较大的2号离子液体中鱼油甲酯生成量较低,主要是因为高黏度影响了反应中的质量传递,从而降低了鱼油甲酯的生成量;图5(b)(c)(d)中,玉米油甲酯、亚麻籽油甲酯和葵花籽油甲酯的生成量与黏度也没有明显的相关性。
由此可见,在以离子液体中为介质酶法制备脂肪酸酯的过程中,离子液体的黏度与脂肪酸酯的生成量没有明显的相关性,但高黏度的离子液体会阻碍反应物之间的传递而使脂肪酸酯的生成量降低。
3 结 论
在不同阴离子组成的咪唑类离子液体体系中,以不同脂肪酸组成的油脂与醇类为反应原料酶法制备脂肪酸酯,反应结果表明:在疏水阴离子[Tf2N]-和[PF6]-组成的离子液体中,脂肪酸酯的生成量较高,且阴离子的影响较为明显。离子液体的性质与脂肪酸酯的生成量有一定的相关性,且是共同作用的结果,除某些特例外,随着离子液体极性值和氢键碱度的增加,脂肪酸酯的生成量大体呈现下降趋势;随着离子液体疏水性的增加,脂肪酸酯的生成量增加;离子液体黏度与脂肪酸酯没有明显的相关性,但高黏度会影响脂肪酸酯的生成量。上述结论在以不同脂肪酸组成的油脂为原料制备脂肪酸酯中均适用。
[1] 李汝雄, 王建基. 离子液体的合成与应用[J]. 化学试剂, 2001, 23(4): 211-215.
[2] YANG Z, PAN W. Ionic liquids: green solvents for nonaqueous biocatalysis[J]. Enzyme Microb Technol, 2005, 37(1): 19-28.
[3] ROGERS R D, SEDDON K R. Ionic liquids-solvents of the future?[J]. Science, 2003, 302(5646): 792-793.
[4] 康建波. 玉米油合成亚油酸乙酯试验研究[D]. 长春:吉林大学, 2013.
[5] 程楠. 鱼油脂肪酸乙酯制备及分离纯化研究[D]. 天津:天津大学, 2013.
[6] 汪勇, 欧仕益, 温勇, 等. 酶法催化合成生物柴油的研究进展[J]. 中国油脂, 2006, 31(1): 65-68.
[7] 茅燕勇, 李文谦, 王朝宇, 等. 固定化脂肪酶催化桐油制备生物柴油的研究[J]. 中国油脂, 2017, 42(1): 52-55.
[8] 赵希岳, 陈巧丽, 蔡志强, 等. 有机溶剂体系固定化脂肪酶催化合成生物柴油[J]. 中国粮油学报, 2010, 25(2): 74-77.
[9] DOSSAT V, COMBES D, MARTY A. Continuous enzymatic transesterification of high oleic sunflower oil in a packed bed reactor: influence of the glycerol production[J]. Enzyme Microb Technol, 1999, 25(3): 194-200.
[10] 李颖. 离子液体在生物柴油合成中的应用[D]. 广州:华南理工大学, 2013.
[11] ANTONIA P, HERNNDEZ-FERNNDEZ F J, TOMS-ALONSO F, et al. On the importance of the nature of the ionic liquids in the selective simultaneous separation of the substrates and products of a transesterification reaction through supported ionic liquid membranes[J]. J Membr Sci, 2008, 307(2): 233-238.
[12] ROPEL L, AKI S N V K, STADTHERR M A, et al. Octanol-water partition coefficients of imidazolium-based ionic liquids[J]. Green Chem, 2005, 7(2): 83-90.
[13] ULBERT O, FRTER T, BÉLAFI-BAKK, et al. Enhanced enantioselectivity ofCandidarugosalipase in ionic liquids as compared to organic solvents[J]. J Mol Catal B: Enzym, 2004, 31(1): 39-45.
[14] ZHAO H, BAKER G A, SONG Z, et al. Effect of ionic liquid properties on lipase stabilization under microwave irradiation[J]. J Mol Catal B: Enzym, 2009, 57(1): 149-157.
[15] ROGERS R D, SEDDON K R. Ionic liquids: industrial applications for green chemistry[M]. USA: OUP USA, 2002: 207.
[16] CHIAPPE C, PIERACCINI D. Determination of ionic liquids solvent properties using an unusual probe: the electron donor-acceptor complex between 4,4′-bis(Dimethylamino)-benzophenone and tetracyanoethene[J]. J Phys Chem A, 2006, 110(14): 4937-4941.
[17] BERLYN R M, SUDHIR N V K A, REBECCA L L, et al. Solvatochromic studies of ionic liquid/organic mixtures[J]. J Phys Chem B, 2007, 111(1): 131-138.
[18] MULDOON M J, GORDON C M, DUNKIN I R. Investigations of solvent-solute interactions in room temperature ionic liquids using solvatochromic dyes[J]. J Chem Soc Perkin Trans 2, 2001(4): 433-435.
[20] QIN J, ZOU X Q, LÜ S, et al. Influence of ionic liquids on lipase activity and stability in alcoholysis reactions[J]. RSC Adv, 2016, 6(90): 87703-87709.
[21] KAAR J L, JESIONOWSKI A M, BERBERICH J A, et al. Impact of ionic liquid physical properties on lipase activity and stability[J]. J Am Chem Soc, 2003, 125(14): 4125-4131.
[22] GUO Z, XU X. New opportunity for enzymatic modification of fats and oils with industrial potentials[J]. Org Biomol Chem, 2005, 3(14): 2615-2619.
Influence of imidazolium based ionic liquids on enzymatic alcoholysis preparation of fatty acid ester
QIN Jie, SUN Cong, ZOU Xiaoqiang, JIN Qingzhe, WANG Xingguo
(Synergetic Innovation Center of Food Safety and Nutrition, State Key Laboratory of Food Science and Technology, School of Food Science and Technology,Jiangnan University, Wuxi 214122, Jiangsu, China)
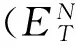
ionic liquids; fatty acid ester; polarity; hydrophobicity; hydrogen-bond basicity; viscosity
2016-10-13;
2017-03-08
国家自然科学基金(31601433);江苏省自然科学基金(BK20140149)
秦 杰(1992),男,在读硕士,研究方向为脂质科学与技术(E-mail)qinjie_qj@163.com。
邹孝强,副教授 (E-mail)xiaoqiangzou@163.com。
TQ645; TQ426
A
1003-7969(2017)06-0050-07
