基于核酸酶的新型阻抗传感器检测纺织品中的铅*
2017-07-24洪华袁琪张爱平王红卫申晓萍张瑞萍
洪华,袁琪,张爱平,王红卫,申晓萍,张瑞萍
(1.南通出入境检验检疫局,江苏南通 226004; 2.吴江出入境检验检疫局,江苏吴江 215200; 3.南通大学,江苏南通 226007)
基于核酸酶的新型阻抗传感器检测纺织品中的铅*
洪华1,袁琪2,张爱平1,王红卫1,申晓萍1,张瑞萍3
(1.南通出入境检验检疫局,江苏南通 226004; 2.吴江出入境检验检疫局,江苏吴江 215200; 3.南通大学,江苏南通 226007)
建立一种基于核酸酶的电化学阻抗传感器检测纺织品中铅含量的方法。采用金纳米粒子修饰的金电极作为基底电极,以一种新型的核酸酶17E DNAzyme体系作为铅离子的生物识别元件,构建了一种新型的电化学阻抗传感器用于高灵敏选择性检测铅离子。在最佳实验条件下,传感器对溶液中铅离子的线性检测范围为1.0 μg/L~10 mg/L,检出限为0.6 μg/L。测定结果的相对标准偏差小于5.4%(n=6),加标回收率在93.5%~106.0%之间。采用该法对实际纺织品样品进行测试,并与国标方法测定值进行对比,实验结果表明两种方法的测定值无显著性差异。该方法操作简便,对铅离子的检测具有良好的选择性,可用于现场样品的在线、快速测定。
铅离子检测;纺织品;核酸酶;电化学阻抗传感器
AbstractA novel electrochemical impedance sensor based on DNAzyme was developed for highly sensitive detection of lead in textiles. Gold electrode modi fied by gold nanoparticles was used as substrate electrode and a novel DNAzyme was used as biological recognition element of lead ions,a new electrochemical impedance sensor for selective detection of lead ions with high sensitivity was built. Under the optimized conditions,the sensor could detect lead ions in solution with good linearty in the range of 1.0 μg/L-10 mg/L with a low detection limit of 0.6 μg/L. The recovery was 93.5%-106.0%,and relative standard deviation was not more than 5.4%(n=6). No signi ficant difference was obtained between the results of the proposed method and the national standard method. The method was suitable for rapid determination of lead content in textiles on site with good selection.
Keywordslead ions detection; textiles; DNAzyme; electrochemical impedance sensor
随着近年来绿色消费观念的普及,重金属限量控制已成为生态化生产工艺安全性能评价要素之一,对纺织品进行重金属残留分析也越来越受到重视。其中,纺织品中的铅由于对人类健康危害巨大而广受关注。纺织品中含铅的主要原因是采用含铅染化料、助剂和附件饰品。我国个别企业的油墨印花中采用的铅系颜料和含铅干燥剂,PVC涂层采用铅作稳定剂,服装加工时采用含铅金属附件或饰品等,容易导致纺织品含铅超标,形成铅暴露和危害,导致部分出口纺织品被召回,因此含铅纺织品问题日益得到人们的关注。很多国家和地区,例如美国、欧盟均对服装中铅离子的限值作了明确规定。如2009版的OEKO-TEX Standard 100新增了对总铅和总镉含量的限定[1],2008年美国《消费品安全改进法案》对儿童产品中总铅含量作出严格规定[2]。我国国家强制性标准GB 20814-2014 《染料产品中重金属元素的限量及测定》对各类染料产品中铅含量的限值也作了明确规定[3]。
目前,纺织品中铅离子残留量检测主要采用原子吸收法和等离子发射光谱法[4-6]。其中,火焰原子吸收法对于高含量的铅离子残留有很好的检测效果;石墨炉原子吸收法原子化效率高,检测限低,但重现性和准确性不足,容易受到杂质的干扰;电感耦合等离子发射光谱法是目前用于检测纺织品中重金属最有效的方法之一,但在仪器操作要求等方面也存在不足。近年来,通过基因文库筛选,研究人员发现了大量具有金属离子结合特异性的DNA分子片段[7-9],其中一种对铅离子具有特异性识别功能的核酸酶17E DNAzyme受到研究者们的广泛关注,并被作为新型的生物识别元件被用于高选择性铅离子生物传感器的研发[10-12]。
笔者采用17E DNAzyme体系作为铅离子的生物识别元件,通过特定的功能性修饰,与电化学电极结合,构建了一种阻抗型铅离子电化学生物传感器,实现了纺织品中铅含量的高灵敏电化学检测。这种电化学适配体传感器制作简单,检测过程灵敏快速,无需使用复杂昂贵的仪器,因而有望替代传统检测方法用于纺织品中铅含量的快速分析,并且该方法具有普适性,通过改变功能核酸识别分子,可衍生用于纺织品中其它重金属离子检测的适配体传感器。
1 实验部分
1.1 主要仪器与试剂
电化学阻抗(EIS)测定仪:Autolab PGSTAT30型,荷兰Eco Chemie公司;
氯金酸:1 g,Au含量不小于47.5%,上海化学试剂公司;
柠檬酸钠、氯化钠、乙酸铅、乙酸锌、氯化钴、氯化镁、氯化锰、氯化钙和硫酸铜:分析纯,北京化学试剂公司;
实验所用其它试剂均为分析纯;
实验所用缓冲溶液为含0.1 mol/L NaCl浓度为 50 mmol/L 的 Tris-HCl (pH 7.4)和Tris-HAc (pH 7.4)缓冲溶液;
寡聚核苷酸片段:大连TaKaRa生物工程有限公司;
巯 基 功 能化的 17E DNAzyme序列:5,-HS-(CH2)6-TTT CAT CTC TTC TCC GAG CCG GTC GAA ATA GTG AGT 3’,记作 17E ;
底物链序列:5’ACT CAC TAT rA GGA AGA GAT G 3’,记作 17DS ;
寡聚核苷酸片段的浓度利用紫外吸收法标定,即测定样品在260 nm处的吸收值,由相应的摩尔消光系数计算其浓度,寡聚核苷酸片段的摩尔消光系数为所含各碱基摩尔消光系数之和,这里 ε(dA)=15 400 L/(mol·cm),ε(dG)=11 500 L/(mol·cm),ε(dC)=7 400 L/(mol·cm),ε(dT)=8 700 L/(mol·cm);
实验用水为超纯水(电阻率为18.2 MΩ·cm)。
1.2 仪器工作条件
电化学阻抗(EIS)测定均在室温下进行,采用传统的三电极体系:工作电极为修饰的Au电极,螺旋铂丝为对电极,Ag/AgCl(饱和KCl溶液)为参比电极。
EIS测量条件:扰动电压振幅为5 mV,频率范围在1 Hz~10 kHz之间,EIS测定所用的电解质溶液为1 mmol/L K4[Fe(CN)6]/K3[Fe(CN)6](0.1 mol/L PBS 缓冲液,pH 7.0)。
1.3 实验方法
1.3.1 金电极清洗和预处理
实验中所用的金电极(AuE,d=3 mm)在进行化学修饰前分别用尺度为1.0,0.3,0.05 μm的α-Al2O3粉抛光,并相继在二次水中超声洗涤,最后在0.1 mol/L H2SO4溶液中进行电化学清洗,在-0.2~1.6 V电势范围内循环扫描,显现出3个金氧化的特征峰和稳定的电流,取出电极,然后用二次水将电极表面冲洗干净,氮气吹干。
1.3.2 金纳米粒子的制备
实验中所用的13 nm尺度的金纳米粒子(AuNPs)制备过程参照文献[13]:将1.94 mL 0.1 mol/L的柠檬酸钠溶液加入到沸腾的氯金酸溶液(50 mL水和0.167 mL 10%氯金酸的混合液),煮沸10 min,得到酒红色胶体溶液,搅拌冷却至室温,即制备出13 nm的AuNPs胶体。将此AuNPs胶体溶液于4ºC存放备用。
1.3.3 电极传感界面的制备
AuNPs修饰的金电极(AuE/AuNPs)制备过程参照文献[14]:将清洁好的干净金电极置于1 mmol/L的1,6-己二硫醇的乙醇溶液中常温组装2 h,取出后用大量乙醇清洗电极表面,用氮气吹干后浸入到以上制备的AuNPs胶体溶液中常温组装1 h,然后取出,用大量二次水清洗电极表面,即制备出AuE/AuNPs电极。
传感界面制备:以制备好的AuE/AuNPs电极作为基底电极。首先将巯基功能化的17E DNAzyme用 50 mmol/L 的 Tris-HCl缓冲溶液 (pH 7.4)配制成1 μmol/L的组装溶液,溶液中同时包含 6 μmol/L 的三 (2-羧乙基)膦盐酸 (TCEP)。将AuE/AuNPs电极浸入到以上配制好的组装溶液中反应12 h,取出电极,用大量二次水清洗,然后浸入到1 mmol/L的巯基己醇溶液中1 h,封闭AuNPs表面未结合的空白位点,所制备的修饰电极记为 AuE/AuNPs/17E电极。将 AuE/AuNPs/17E电极清洗干净后储存到10 mmol/L pH 7.4的Tris-HCl缓冲溶液中保存。底物链17DS溶解于50 mmol/L的pH 7.4 Tris-HAc缓冲溶液中(含0.1 mol/L NaCl)配制成17DS浓度为2 μmol/L的溶液,将此溶液于95℃水浴加热2 min,在10 min内快速冷却到室温。然后将AuE/AuNPs/17E电极浸入到17DS溶液中于65℃水浴加热10 min,逐渐冷却到室温,室温下继续反应12 h以形成稳定的17E/17DS杂化结构,得到的电极即为最终的铅离子传感电极,记为AuE/AuNPs/17E/17DS电极。
1.3.4 铅离子的电化学检测
将新制的AuE/AuNPs/17E/17DS传感电极浸泡在一系列不同浓度的铅离子标准溶液(含50 mmol/L Tris-HAc,0.1 mol/L NaCl,pH 7.4) 中,37℃水浴中反应30 min达到最大的酶切反应程度,然后将电极转移到50 mmol/L Tris-HAc缓冲液中(含 0.1 mol/L NaCl,pH 7.4),冷却至室温,以除去电极表面残留的底物链分子,将电极转移到1 mmol/L K4[Fe(CN)6]/K3[Fe(CN)6](0.1 mol/L PBS 缓冲液,pH 7.0)电解质溶液中,进行EIS测定。
2 结果与讨论
2.1 传感电极检测铅离子的机理
图1为传感电极对铅离子检测的机理示意图。如图1所示,传感电极表面由于存在密集的17E DNAzyme与底物链杂交形成的双链结构,使得修饰电极在铁氰化钾/亚铁氰化钾电化学探针溶液中具有较大的电荷转移电阻,当电极与待测溶液中的铅离子作用时,17E DNAzyme能够选择性识别铅离子并与其结合,产生酶效应,快速切断其底物链17DS,破坏预杂交的双链结构,断裂的底物链从电极表面脱落,降低了电极表面DNA的覆盖密度,从而对溶液中负电性的铁氰化钾/亚铁氰化钾电化学探针静电排斥力减弱,减小了其在修饰电极界面的电荷转移电阻,EIS信号减小的程度与溶液中铅离子浓度相关。这样,通过测定修饰电极的EIS信号变化,可以方便快捷地实现溶液中铅离子浓度的检测。

图1 传感电极对铅离子检测机理示意图
2.2 电极传感界面的EIS表征
首先利用EIS技术表征了所制备的传感电极对溶液中铅离子的响应情况。图2显示了AuE/AuNPs电极在1 mmol/L K4[Fe(CN)6]/K3[Fe(CN)6](0.1 mol/L PBS缓冲液,pH 7.0)电解质溶液中的电化学阻抗谱图,其Niquist曲线仅可见一很小的半圆形区域(代表着电子转移电阻Ret),说明AuE/AuNPs电极在电化学探针溶液中具有较小的Ret。

图2 AuE/AuNPs电极的电化学阻抗谱图
图3为AuE/AuNPs/17E/17DS电极在探针溶液中的电化学阻抗图。电解质溶液为1 mmol K4[Fe(CN)6]/K3[Fe(CN)6](0.1 mol PBS 缓冲液,pH 7.0)。
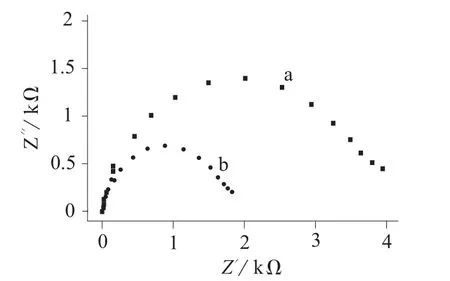
图3 AuE/AuNPs/17E/17DS电极与铅离子作用前(a)和作用后(b)的电化学阻抗谱图
由图3可知,其Niquist曲线出现了一个较大的Ret[图3(a)]。这主要归因于电极表面修饰有密集的带负电的17E/17DS杂交双链结构,对溶液中带负电荷的[Fe(CN)6]3-/4-探针产生排斥作用,从而在动力学上阻碍了电化学探针在电极界面上的电荷转移,因而显示出较大的电荷转移电阻。当AuE/AuNPs/17E/17DS电极与0.1 mg/mL的铅离子溶液作用后,电极的Ret明显减小[图3(b)]。证明传感电极上的17E DNAzyme对溶液中铅离子的有效识别并与其结合,产生酶效应,快速切断其底物链17DS,破坏杂交的双链结构,断裂的底物链17DS从电极表面脱落,导致电极表面负电性的DNA密度减小,从而减弱了电极对探针的屏蔽作用,因而Ret减小。
2.3 传感电极对铅离子的检测
为了考察传感电极对铅离子浓度的检测情况,首先考察了AuE/AuNPs/17E/17DS传感电极在铅离子溶液中的孵育时间对电极信号的影响。结果发现,传感电极与铅离子溶液作用25 min后的EIS信号基本达到稳定,为了使其作用更完全,实验采用作用时间为30 min。将传感电极浸泡在一系列不同浓度的铅离子溶液中30 min后,检测其EIS信号,结果见图4。从图4中可以看出,随着铅离子浓度增大,电极的Ret逐渐降低。EIS信号的减小,证明了传感界面对铅离子的识别以及发生的酶切反应,从而证实传感电极对铅离子的有效识别。

图4 传感电极对不同浓度铅离子的EIS响应
以EIS信号电子转移电阻变化率(Ret0-Ret)/Ret0为纵坐标y,对应铅离子浓度c的对数lgc为横坐标进行线性回归,得线性方程为y=0.179lgc+0.086,在1.0 μg/L~10 mg/L 的浓度范围内,(Ret0-Ret)/Ret0与铅离子浓度的对数之间存在着良好的线性关系(r2=0.995 3),检出限为 0.6 μg/L (S/N=3)。
2.4 传感电极对铅离子检测的选择性
为了进一步考察传感电极对铅离子检测的特异性,用最有可能对铅离子产生干扰的8种金属离子 (Zn2+,Co2+,Mg2+,Ca2+,Mn2+,Cd2+,Ni2+和 Cu2+)作对比试验。图5为传感电极对1.0 mg/mL各种金属离子的信号响应值。

图5 传感电极对浓度均为1 mg/mL的各种金属离子的信号响应值
图5试验结果显示,其它8种金属离子不会引起明显的信号变化,说明该传感器对铅离子具有良好的选择性。
2.5 精密度试验
分别对棉、麻、毛、涤纶等纺织纤维的代表性样品进行测试。实际样品的前处理方法严格参照现有的纺织品中铅离子测试标准(GB/T 30157-2013纺织品-总铅和总镉含量的测定)中样品前处理方法制备[15]。对样品中铅含量进行6次平行测定,结果见表1。由表1可知,4种样品中铅含量测定结果的相对标准偏差小于5.4%,表明该方法具有较好的精密度。

表1 精密度试验结果
2.6 回收试验
对上述棉、麻、毛、涤纶4种实际样品进行加标回收试验,考察传感电极对实际纺织样品中的铅含量检测的准确度。每种样品进行3次平行测定,计算平均加标回收率,试验结果见表2。由表2结果可知,4种样品的加标回收率在93.5%~106.0%之间,说明该方法具有较高的准确度。

表2 加标回收试验结果
2.7 比对试验
用本实验方法与国标法(GB/T 30157-2013)进行了比对试验,对4个不同铅离子含量的纺织品样品进行测定,两种方法的检测相关性见表3。
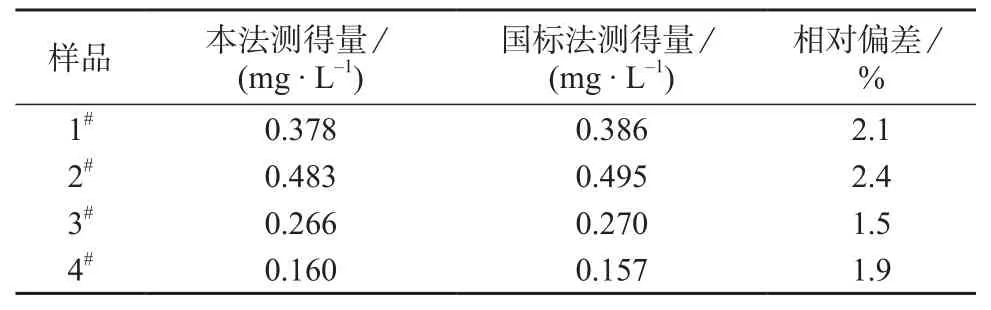
表3 本法与国标法对铅离子的检测结果
由表3可知,本法测定结果和国标法测定结果相符。
3 结语
基于新型的铅离子生物识别元件17E DNAzyme体系结合高灵敏的电化学阻抗技术,构建了一种阻抗型电化学生物传感器,实现了对溶液中铅离子的高灵敏选择性检测。该传感电极的响应值对铅离子的质量浓度在1.0 μg/L~10 mg/L范围内表现出良好的线性关系,检出限为0.6 μg/L。将该传感器用于实际纺织样品中的铅含量检测,具有良好的精密度与准确度。
[1] OEKO-TEX Standard 100-2009 General and Special Conditions[S].
[2] Consumer Product Safety Commission. Consumer product safety improvement act of 2008 [G]. 2008,122: 3 016.
[3] GB 20814-2014 染料产品中重金属元素的限量及测定[S].
[4] GB/T 17593.1-2006 纺织品重金属测定 第1部分:原子吸收分光光度法[S].
[5] GB/T 17593.2-2007 纺织品重金属测定 第2部分:电感耦合等离子体原子发射光谱法[S].
[6] OEKO-TEX Standard 200-2010 Testing Procedures[S].
[7] Santoro S W,Joyce G F. A general purpose RNA-cleaving DNA enzyme[J]. Proceedings of the National Academy of Sciences,1997,94(9): 4 262-4 266.
[8] Carmi N,Balkhi S R,Breaker R R. Cleaving DNA with DNA[J]. proceedings of the national academy of sciences,1998,95(5):2 233-2 237.
[9] Nelson K E,Bruesehoff P J,Lu Y. In vitro selection of high temperature Zn2+-dependent DNAzymes[J]. Journal of Molecular Evolution,2005,61(2): 216-225.
[10] Liu J,Lu Y. Preparation of aptamer-linked gold nanoparticle purple aggregates for colorimetric sensing of analytes[J].Nature Protocols,2006,1(1): 246-252.
[11] Zhang L B,Han B Y,Li T,et al. Label-free DNAzymebased fluorescing molecular switch for sensitive and selective detection of lead ion[J]. Chemical Communications,2011,47:3 099-3 101.
[12] Li T,Dong S,Wang E. A lead( Ⅱ)-driven DNA molecular device for turn-on fluorescence detection of lead(Ⅱ) ion with high selectivity and sensitivity[J]. Journal of the American Chemical Society,2010,132(38): 13 156-13 157.
[13] Grabar K C,Freeman R G,Hommer M B,et al. Preparation and characterization of Au colloid monolayers[J]. Analytical Chemistry,1995,67: 735-743.
[14] Xu S,Liu J,Wang T,et al. A simple and rapid electrochemical strategy for non-invasive,sensitive and specific detection of cancerous cell[J]. Talanta,2013,104: 122-127.
[15] GB/T 30157-2013 纺织品总铅和总镉含量的测定[S].
食药监总局规范食品快检方法使用快检不能替代常规食品检验
为了规范食品快速检测(以下简称“食品快检”)方法的使用和管理,合理发挥食品快检在食品安全监管中的作用,不久前食品药品监管总局发布《总局关于规范食品快速检测方法使用管理的意见(食药监科〔2017〕49号)》,其中对食品快检的含义、检测对象、适用范围等给出了相关意见。
意见中明确指出,食品快检不能替代食品检验机构利用常规实验室仪器设备开展的食品检验活动,不能用于食品安全监管工作中部署的食品抽样检验。复检不得采用快检方法。具体如下:
(1)食品快检是指利用快速检测设施设备(包括快检车、室、仪、箱等),按照食品药品监管总局或国务院其它有关部门规定的快检方法,对食品(含食用农产品)进行某种特定物质或指标的快速定性检测的行为。
(2)食品快检主要适用于需要短时间内显示结果的禁限用农兽药、在饲料及动物饮用水中的禁用药物、非法添加物质、生物毒素等的定性检测,检测主要针对食用农产品、散装食品、餐饮食品、现场制售食品,对于预包装食品原则上以常规实验室检验为主。
(3)食品药品监管部门在日常监管、专项整治、活动保障等的现场检查工作中,可以根据实际情况使用快检方法进行抽查检测。监管人员应当严格按照快检方法使用要求规范操作,详细记录检测食品品种和名称、数量、检测项目、检测日期、检测方法、检测人员姓名、检测结果以及所使用的快检产品生产企业、产品型号批号等信息。食品药品监管部门和监管人员对所检食品的快检项目结果负责。
(4)现场快检结果呈阳性的,被抽查食用农产品经营者应暂停销售相关产品,食品药品监管部门应当及时跟进监督检查和抽样检验,防控风险。被抽查食用农产品经营者对快检结果无异议的,食品药品监管部门应当依法处置;对快检结果有异议的,可以自收到或应当收到检测结果时起4 h内申请复检。复检不得采用快检方法。
(5)各省(区、市)、计划单列市、副省级省会城市食品药品监管部门要按照食品药品监管总局制定发布的《食品快速检测方法评价技术规范》和相应快检方法等要求,通过盲样测试、平行送实验室检验等方式对正在使用和拟采购的快检产品进行评价。评价结果显示不符合国家相应要求的,要立即停止使用或者不得采购。
(6)食品快检不能替代食品检验机构利用常规实验室仪器设备开展的食品检验活动,不能用于食品安全监管工作中部署的食品抽样检验。
(7)省(区、市)食品药品监管部门可以根据食品安全监管需要,组织专业技术机构对不属于国家规定的食品快检方法开展评价,评价结果符合有关要求的,可用于所在省(区、市)各级食品药品监管部门在食品安全监管中的初步筛查。
(食药监总局)
DNAzyme Based Electrochemical Impedance Sensor for Lead Detection in Textiles
Hong Hua1, Yuan Qi2, Zhang Aiping1, Wang Hongwei1, Shen Xiaoping1, Zhang Ruiping3
(1. Nantong Entry-Exit Inspection and Quarantine Bureau, Nantong 226004, China; 2. Wujiang Entry-Exit Inspection and Quarantine Bureau, Wujiang 215200, China; 3. Nantong University, Nantong 226007, China)
O657.1
A
1008-6145(2017)04-0031-05
10.3969/j.issn.1008-6145.2017.04.008
*南通市科技局科技计划项目(BK2014004);江苏出入境检验检疫局科技计划项目(2017KJ28)
联系人:洪华;E-mail: hongh@jsciq.gov.cn
2017-05-17
