认识氢键本质 理解反常物性
2017-07-21王国华
王国华
摘 要:认识氢键的本质及类型,可推断某些物质的物理性质结合典型实例从熔点、沸点、溶解度、粘度、密度、硬度、酸性等方面分析氢键对物质物理性质出现反常的影响,可深入理解并全面掌握物质物理性质的相似性与特殊性
关键词:氢键;反常物理性质;分子间作用力
许多同类物质物理性质的反常与微观结构中是否存在氢键有关,认识氢键的本质及类型,可推断某些物质的物理性质,可深入理解与解释物理性质中的反常现象.
一、氢键的本质
强极性键(A-)上的氢核, 与电负性很大的、含孤电子对并带有部分负电荷的原子B (F、O、N)之间的静电引力.现以F为例说明氢键的形成.在F分子中,由于F原子的电负性(4.0)很大,共用电子对强烈偏向F原子,而原子核外只有一个电子,其电子云向F原子偏移;这个半径很小、无内层电子的带部分正电荷的氢原子,使附近另一个F分子中含有孤电子对并带部分负电荷的F原子有可能充分靠近它,从而产生静电作用,这个静电作用力就是所谓的氢键.氢键的键能约为1-30kJ·mol-1,但与化学键比较,氢键属于一种较弱的作用力,其大小介于范德华力和化学键之间,约为化学键的十分之几,不属于化学键.
二、氢键的类型
1.分子之间氢键.可分为同种分子之间与不同种分子之间,例如2O 之间、N3与2O之间.
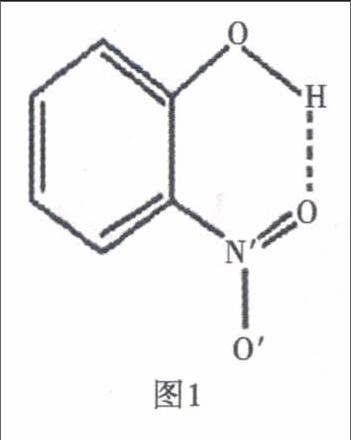
2.分子内氢键.某些分子内,如NO3、邻羟基苯甲醛、邻硝基苯酚分子可以形成分子内氢键.如图1为邻硝基苯酚分子,其中的羟基上的氢原子与氮氧双键上的氧原子可形成分子内氢键.
三、氢键对物质物理性质的影响
氢键通常是物质在液态时形成的,但形成后有时也能继续存在于某些晶态甚至气态物质之中.例如在气态、液态和固态的F中都有氢键存在.能够形成氢键的物质是很多的,如水、水合物、氨合物、无机酸和某些有机化合物.氢键的存在,影响到物质的某些物理性质.
分子间氢键使相邻分子之间的作用力更强,而形成分子内氢键将减弱相邻分子间的作用力,所以二者对物质的物理性质(如熔点、沸点、溶解度等)的影响相反.
1.熔点、沸点
分子间有氢键的物质熔化或气化时,除了要克服范德华力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔点、沸点比同系列氢化物的要显著高,如F、2O、 N3熔沸点分别远高于同族其它氢化物;分子内生成氢键,熔、沸点常降低,例如有分子内氢键的邻硝基苯酚熔点(4℃)比有分子间氢键的间硝基苯酚熔点(96℃)和对硝基苯酚熔点(114℃)都低, 硫酸、磷酸都是高沸点的无机强酸,但是硝酸由于可以生成分子内氢键的原因,却是挥发性的无机强酸.
2.溶解度
在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大.F和N3在水中的溶解度比较大、低碳的醇、酸易溶于水,就是这个缘故. 邻硝基苯酚由于形成分子内氢键,减少了与水分子形成氢键的可能,在水中的溶解度较低,而其同分异构体间-硝基苯酚和对-硝基苯酚可与水形成分子间氢键,它们在水中的溶解度较高,其溶解度是邻-硝基苯酚的7~8倍.
3.粘度
分子间有氢键的液体,一般粘度较大.例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为粘稠状液体.
4.密度
液体分子间若形成氢键,有可能发生缔合现象,分子缔合的结果会影响物质的密度.如水密度反常解释:一般情况下,物体遵守热胀冷缩,也就是对于同一物体“固体的密度应比液体大”,可是水却相反,这原因涉及到由于水分子是极性很强的分子,能通过氢键结合成缔合分子.液态水,除含有简单的水分子(2O)外,同时还含有缔合分子,最典型的两种是(2O)2和(2O)3.当温度在0℃水未结冰时,大多数水分子是以(2O)3的缔合分子存在,当温度升高到3.98℃(101kPa)时水分子多以双分子缔合水分子的形式存在(在水温由0℃升至4℃的过程中,由缔合水分子氢键断裂引起水密度增大的作用,比由分子热运动速度加快引起水密度减小的作用更大,所以在这个过程中,水的密度随温度的增高而加大,分子占据空间相對减小,此时水的密度最大.如果温度再继续升高在3.98℃以上,一般物质热胀冷缩的因素占主导地位.水温降到0℃时水结冰时几乎全部分子缔合在一起成为一个巨大的缔合分子,并由二维网带结构的水转化为三维六方晶系的冰,分子所占空间变大,密度反而变小.
5.硬度
氢键对物质硬度的影响 ,当分子晶体中有分子间氢键存在时,分子间作用力明显增强,故硬度增大,如水的晶体硬度(冰的莫氏硬度为: 0 ℃ ,1~2)较一般分子晶体大.
6.酸性
对于一些弱酸,分子间氢键的形成会使其电离常数减小,酸性减弱;而分子内氢键的形成会使其电离常数增大,酸性增强.如苯甲酸的Ka值为6.3×10- ,邻羟基苯甲酸的Ka值(1.0×10 -3 )明显大于其间位 (8.3×10- )、对位(2.7×10- )异构体及苯甲酸,酸性最强,这是由于邻位上的羟基可以与苯甲酸根生成分子内氢键.
四、典例分析
例1 下列事实不能用氢键来解释的是( )
A.冰的密度比水小,能浮在水面上
B.接近沸点的水蒸气的相对分子质量测量值大于18
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.2O比2S稳定
解析 氢键使冰晶体中的水分子呈一定规则排列,空间利用率低,密度小;氢键使接近沸点的水蒸气中含有少量(2O)2;邻羟基苯甲醛存在分子内氢键,而对羟基苯甲醛存在分子间氢键,增大了分子间作用力,沸点较高.2O比2S稳定是因为-O比-S的键能高. 答案 D.
例2 乙醇(C2O)和二甲醚(C3OC3)的化学组成均为C26O,但乙醇的沸点为78.℃,而二甲醚的沸点为-23℃,是什么原因?
解析 乙醇(C2O)和二甲醚(C3OC3)的化学组成相同,但分子结构不同,乙醇分子之间能形成氢键,使分子间产生了较强的结合力,沸腾时需要提供更多的能量去破坏分子间氢键,而二甲醚分子间没有氢键,所以乙醇的沸点比二甲醚的高.
参考文献:
[1]汪志成.化学平衡移动的几个疑难问题辨析[J].教学管理,2006(01):-6.
[2]刘霞.化学平衡常数的问题[J].河北理工学院学报,2004(02):2-1.
