高寒草甸植物系统发育与AM真菌侵染的关系
2017-07-20石国玺蒋胜竞罗佳佳周华坤冯虎元
石国玺,蒋胜竞,罗佳佳,周华坤,冯虎元,*
1 陇东学院生命科学与技术学院,甘肃省陇东生物资源保护与利用高校重点实验室, 庆阳 745000 2 中国科学院西北高原生物研究所,青海省寒区恢复生态学重点实验室,西宁 810008 3 兰州大学生命科学学院,细胞活动与逆境适应教育部重点实验室,兰州 730000
高寒草甸植物系统发育与AM真菌侵染的关系
石国玺1,2,蒋胜竞3,罗佳佳3,周华坤2,冯虎元3,*
1 陇东学院生命科学与技术学院,甘肃省陇东生物资源保护与利用高校重点实验室, 庆阳 745000 2 中国科学院西北高原生物研究所,青海省寒区恢复生态学重点实验室,西宁 810008 3 兰州大学生命科学学院,细胞活动与逆境适应教育部重点实验室,兰州 730000
测定了高寒草甸生态系统中17种常见植物根内AM真菌的侵染率,并将AM侵染率作为植物的一个功能特征,分析了其系统发育保守性。结果显示AM侵染率均无系统发育信号,其植物进化树中AM真菌侵染率的差异更多被最新分支节点所解释,而不是古老分支节点,说明高寒草甸生态系统中亲缘关系较近的植物,其AM侵染水平并不相同,不存在进化的保守性。系统报道了高寒草甸生态系统中植物系统进化发育与AM侵染间的关系,表明了植物系统进化与AM侵染间无显著关联。
植物系统发育;AM真菌;系统发育信号;系统进化保守性
植物系统发育(Plant phylogeny)也称系统发生关系,与个体发育相对而言,它是指植物物种的进化历史,即植物体在整个进化历程中所处的位置及与其他生物体之间的亲缘关系。菌根真菌是一类非常特殊且重要的土壤微生物,能与80%的陆生植物根系形成菌根互惠共生体[1],是地上地下生态系统相互联系的重要节点[2]。菌根真菌能够促进植物对氮磷等矿质营养的吸收[3],增强植物抗逆抗病能力[4],作为回报,植物提供给菌根真菌所需的碳水化合物[3]。此外,其他一些证据还表明菌根真菌影响植物群落[5]、土壤微生物群落[6]、参与土壤团聚体的形成[7- 8]。大量研究已经表明植物系统发育极大地影响着菌根真菌的丰度与群落组成[1, 9- 11]。如杨柳科植物的系统发育与其外生菌根真菌的丰富度和群落成显著正相关[11];亲缘关系越近的兰科植物其菌根真菌的侵染也越相似[12- 13]。然而,以上研究多旨在探究植物亲缘关系与外生菌根真菌(Ectomycorrhiza, ECM)、兰科菌根(Orchid Mycorrhiza, OM)真菌之间的关系,但对于丛枝菌根(arbuscular mycorrhizal, AM)真菌的侵染水平与植物亲缘关系间的关系仍不清楚。基于此,本文测定了高寒草甸生态系统中17种常见植物根内AM真菌的侵染水平,分别从植物科、功能群,系统发育3个层面分析了AM真菌侵染水平的差异,旨在探究植物系统发育与AM真菌侵染水平间的关系。根据生态位保守理论,植物亲缘关系越近的物种,生态功能特征越相似。因此,笔者预测亲缘关系越近的植物其根内AM真菌的侵染水平也相似,呈现出强的系统发育保守性。
1 材料与方法
1.1 样地概况与试验设计
本试验采样点位于青藏高原东侧的甘肃省甘南州玛曲县境内的瓦拉卡村,地理位置为35°58′N, 101°53′E,海拔 3500 m。该地为年均气温1.2℃的湿润高山气候,月平均气温从最低的1月份-10℃到最高的7月份11.7℃,年平均降水量为620 mm,年日照时间约为2580 h。植被类型是以嵩草为主的高寒草甸,其优势物种为矮嵩草(Kobresiahumilis),垂穗披碱草(Elymusnutans),鹅绒委陵菜(Potentillaanserina)与露蕊乌头(Aconitumgymnandrum)等。土壤类型为草甸黑钙土。生长季为5—9月。
2012年8月22日,在一块20 m×20 m平坦的草甸上,随机选取3个2 m×2 m的小区,在每个小区内随机选择3个50 cm×50 cm的样方,调查该样方内所有植物的丰富度,样方调查中丛生禾草与莎草以丛计数。筛选出3个小区内共有的植物物种,依次在3个小区中进行整株挖取。在每个小区内每种植物挖取足量根样后,混合,作为一个物种根样品。由于研究区植物多为多年生草本植物,大部分植物均为直根系、较粗,很难获得所需足量细根样,因而本研究仅获得了17个物种,共51个根样品(表 1,植物名目采用恩格勒分类系统排列)。所有根样都及时置于密封袋内,在低温冰盒中暂存,24 h内带回实验室处理。选择小而平的研究样地主要是为了确保研究区域具有较小的空间异质性。所选研究区域的土壤含水量为42.2%,pH值为7.12,总N含量为26 mg/kg,速效N含量为14.47 mg/kg,速效P含量为1.78 mg/kg。
1.2 根样染色和AM侵染率的测定
每一样品随机挑取约50个根段,在80℃水浴中用10%KOH溶液处理25 min后,置于2%的HCL中酸化30 min,用0.05%的Trypan blue 染液(质量体积比,溶剂为乳酸∶甘油∶水=1∶1∶1的混合物)常温情况下染色40—50 min,置于脱色液(体积比,乳酸∶甘油∶水=1∶1∶1)中脱色。脱色2—3 d后以PVLG(聚乙烯醇1.66 g,蒸馏水10 mL,乳酸10 mL,甘油1 mL;高温下配制)为浮载剂,将染色完成的根段压制成永久装片。在10×20倍显微镜下使用十字交叉法测定AM单位根长侵染率,丛枝侵染率及泡囊侵染率,每个样品至少测定200个视野[14]。丛枝侵染率(AC)反映了AM真菌与植物间物质交换的场所,泡囊侵染率(VC)反映了AM 真菌的物质储存功能,AC/VC反映了AM真菌在物质交换与储存功能间的权衡[15]。
1.3 统计分析
在SPSS 16.0软件(SPSS Inc.)中所有数据在进行arsin转化后检验其正态性及方差齐性(Levene′s 检验)。采用单因素方差分析检验AM真菌侵染率在物种、科及功能群水平的差异,使用LSD(Least-Significant Difference)法在95%的置信水平检验显著性差异。采用变异系数(Coefficient of variation,Cv)来表征不同植物科之间AM真菌侵染率的离散程度,其计算公式为变异系数 Cv =(标准误差 SE / 平均值Mean)× 100%。

表1 本研究中所有采集植物的基本信息
植物系统进化树根据APG III 系统中‘R20120829’ 亚系统树,使用‘Phylomatic’ 程序进行构建。植物系统发育树的枝长使用Phylocom 4.2(http://phylodiversity.net/phylocom/)中的 ‘Bladj’程序进行拟合[16]。植物进化中每个节点的贡献指数(Contribution indices, CIs)与整个系统树的谱系信号(Phylogenetic signal)被用于确定植物根内AM真菌侵染水平的系统保守性。CIs的计算使用Phylocom 4.2中的‘aotf’ 函数。CIs介于0与1之间,反应了整个系统进化树种某个节点分支对现存功能特征差异的贡献;如果在进化树中功能特征的差异更多被古老分支节点所解释,而不是最新的分支节点,则该功能特征在进化上是保守的[17]。谱系信号的计算使用R语言picante 程序包中的"multiPhylosignal"函数,利用K值法[18]。在95%的置信水平,若K> 1 表明被测功能性状具有很强的系统发育信号;K<1表明被测功能性状无系统发育信号。
2 结果与分析
2.1 在植物物种及其系统进化水平上的AM真菌侵染率
被测的10科17个物种全部均可以被AM真菌所侵染,其中13种(76%)能形成丛枝结构,16种(94%)可以形成泡囊结构,13种(76%)可以形成丛枝与泡囊双重结构(图1)。植物物种对AM真菌的单位根长侵染率(RLC;F=15.0,P<0.001),丛枝侵染率(AC;F=4.0,P<0.001)、泡囊侵染率(VC;F=11.0,P<0.001)及丛枝泡囊侵染率之比(AC/VC;F=5.1,P<0.001)均具有显著影响。所有物种中,角茴香RLC最高(97%),密花香薷次之(82%),中华羊茅最低(0.95%);AC则密花香薷最高,达20.7%,中华羊茅最小,仅有0.47%,灰苞蒿、蓬子菜、唐松草、矮嵩草均无丛枝侵染;VC表现为青甘韭最高,达62.7%,灰苞蒿最小(0.63%),中华羊茅无侵染;AC/VC表现为密花香薷最高达1.47,灰苞蒿、蓬子菜、唐松草、矮嵩草均为0(图1)。
所有被测植物侵染率的谱系信号分析结果显示AM真菌的RLC(K=0.53,P=0.23),AC(K=0.49,P=0.32),VC(K=0.74,P=0.14)与AC/VC(K=0.45,P=0.44)均未检测到显著系统发育信号;此外,CIs进一步验证了系统发育信号结果,表明在植物进化树中AM真菌侵染率的差异更多被最新分支节点所解释,而不是古老分支节点(图1);禾本科各属间的分支节点具有最高的CIs,解释了25%现存RLC的变异(节点A,P=0.016);毛茛科唐松草属与乌头属之间的分支节点最大能解释AC现存差异的30%(节点B,P=0.048);天门冬目、禾本目与莎草目各目间的分支节点最高能够解释65%的VC现存差异(节点C,P=0.022),而莎草科与禾本科间分支节点却仅能解释25%的AC/VC的现存差异(节点D,P=0.016)(图1)。在A、B、C、D 4个分支节点中,节点C最为古老,分支时间为110 M.Y,节点B次之(58.17 M.Y),节点A最小(27.3 M.Y)(图 1)。
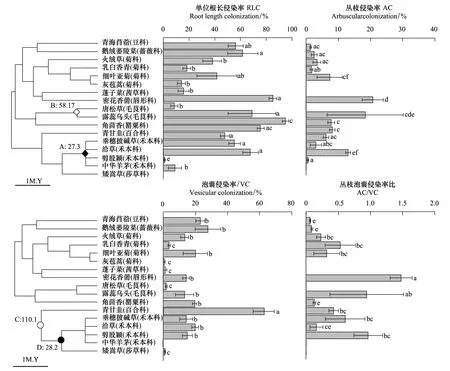
图1 所有被测植物根内AM真菌Fig.1 AM colonization in the roots of all measured plants左侧为17种植物的系统进化树,A、B、C、D分别代表显著最大解释现存RLC、AC、VC与AC/VC差异的分支节点;lM.Y为百万年
2.2 在植物科、功能群水平的AM真菌侵染率
AM真菌RLC(F=5.8,P<0.001),AC(F=2.7,P<0.014),VC(F=14.0,P<0.001)与AC/VC(F=3.4,P<0.003)在不同植物科之间存在显著差异,但在不同功能群间AC与AC/VC却差异不显著(P> 0.05)。百合科具有最高的RLC与VC,而唇形科则具有最高的AC与AC/VC值,其余8科植物侵染率均介于以上两科植物之间(图2)。菊科与禾本科植物均涉及到4种,但菊科植物的RLC与AC的Cv(RLC,18.7%;AC,39%)值大于禾本科Cv(RLC,18%;AC,26%),而其VC与AC/VC的Cv值(VC,31%;AC/VC,31%)却小于禾本科(VC,66%;AC/VC,33%)。毛茛科虽仅有2个物种被调查,但其侵染率(AC除外)的Cv值均高于菊科、禾本科。毛茛科植物的RLC、AC、VC与AC/VC的Cv系数分别为41%,73%,47%,71%。
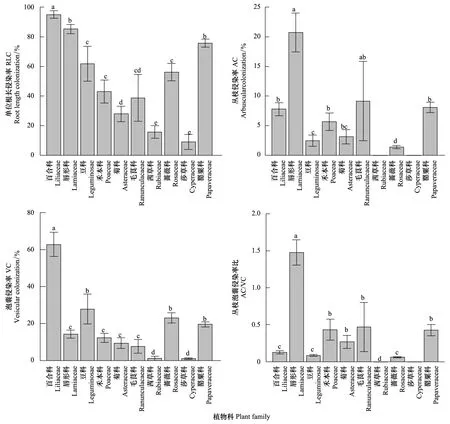
图2 植物不同科水平AM侵染率Fig.2 AM colonization at plant families level
不同功能群植物侵染率分析发现杂草、禾草与豆科植物三者间的RLC与VC无显著差异,但均显著高于莎草类植物(图 3);AC与AC/VC在不同功能群间表现为杂草类、禾草类的AC与AC/VC均高于豆类,但未达到显著水平;莎草类的AC与AC/VC均为0(图 3)。
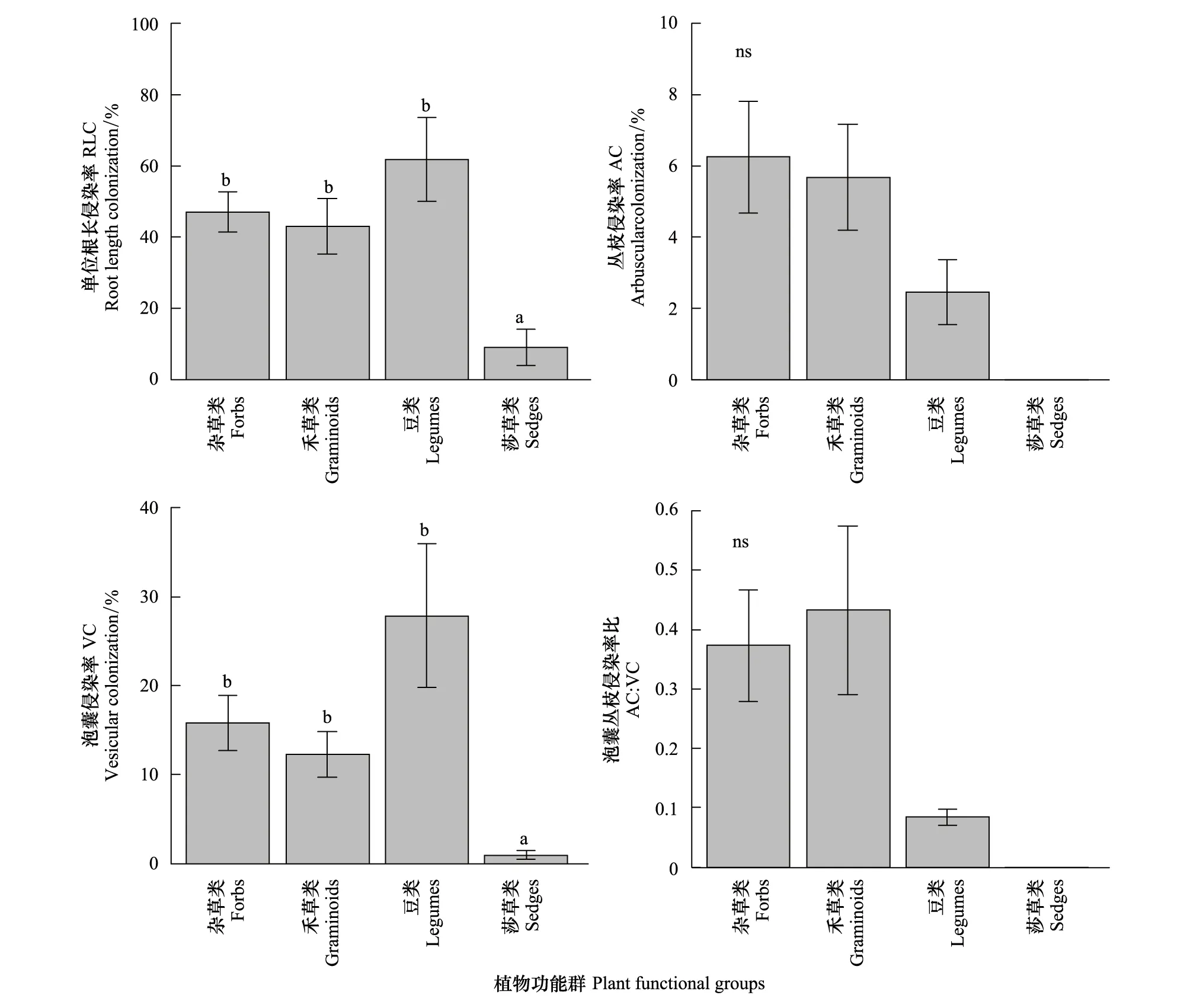
图3 莎草类、豆类、禾草类和杂草类4个功能群根系中的AM侵染率Fig.3 AM colonization in the roots of different plant functional groupsns表示无显著性差异
3 讨论
本研究从科、功能群与系统发育3个水平探究了高寒草甸生态系统中植物系统发育与AM真菌侵染水平之间的关系,结果显示所有被测植物侵染率均无显著系统发育信号;此外,CIs结果也显示植物进化树中AM真菌侵染率的差异更多被最新分支节点所解释,而不是古老分支节点,说明AM真菌的侵染在植物系统进化过程中并不是保守的,表现为亲缘关系较近的植物,其AM真菌侵染水平也不尽相似。这一结果并未支持生态位保守理论的预测,即亲缘关系越近的植物物种其根内AM真菌的侵染水平也相似。该结果与Reinhart等[9]对植物系统发育与菌根响应之间关系的研究结果一致,他们发现不能用已知亲缘关系的植物与AM真菌侵染间的关系去预测其近缘种的菌根侵染率。AM真菌的侵染在植物系统进化上的不保守性是由于部分植物在进化过程中形成自己独特的资源获取策略[1]。然而,本研究却与Lugo等[19]不一致,他们对极端干旱环境中的42种植物根内AM真菌的侵染水平进行了分析,发现AM真菌侵染率的差异表现出显著的植物系统发育模式,具有进化的保守性。3个原因可以解释这种不一致,空间异质性、样本量的大小与时空差异。一方面,Lugo等的研究区域为极度干旱区域,而本文的研究区域为高寒草甸。相比之下,高寒草甸生态系统较极度干旱生态系统具有较高的空间异质性,而空间异质性已经被证明影响着植物系统进化与内生真菌的相互关系[20- 21]。此外,空间异质性所导致的土壤营养可利用性[22-23]、光照强度[24-25]、pH[26]等在空间上的分异也被证明调节着AM真菌的侵染率;另一方面,Lugo等的研究调查了45种植物,隶属于18科,其种科比为2.5,而本研究仅调查了17个物种,其种科比为1.7。较小的种科比说明本研究中所调查的物种亲缘关系相对比较分散,这种比较分散的物种亲缘关系直接干扰了AM真菌侵染率谱系信号的检测。最后,本研究采用单一的采样时间与采样地点也是引起两项研究结果不一致的又一重要原因。因此,进一步研究需要在考虑调查更多物种及其亲缘关系的同时,也应考虑到采样的时空尺度对植物系统发育与AM真菌侵染间关系的影响。
本研究结果还显示被测的17个物种全部均可以被AM真菌所侵染,但在不同植物根内AM真菌的侵染率存在显著差异,说明在高寒草甸生态系统中与AM真菌共生已成为植物用来适应高寒环境的一种策略,但不同植物对AM真菌的策略存在差异;如灰苞蒿、唐松草、蓬子菜虽均为菌根植物,但它们均无丛枝侵染率,说明这些植物适合度的提高并不是由于AM真菌促进了他们对矿质营养的吸收,而可能是AM提高了它们对病原菌与环境胁迫的抵抗能力[27]。与同科其他植物相比,中华羊茅具有最低AM真菌侵染率,这主要是由于中华羊茅在长期进化中形成分支多而直径较小的须根系,使得中华羊茅可以直接从土壤颗粒中吸收矿质营养,减小其对AM真菌的依赖程度[28]。长期以来,莎草科植物一直被认为是非丛枝菌根植物,不能被AM真菌所侵染[3],但本文的研究结果并不支持这一观点。我们发现莎草科植物矮嵩草根内存在AM真菌菌丝与泡囊的侵染,无丛枝侵染。该结果与其他一些研究结果一致[29],说明与AM真菌共生并不是生活在高寒、低土壤营养环境中的莎草科植物的首选策略。这一观点也已经得到其他一些研究的确认,发现莎草科植物能够通过与外生菌根真菌共生,直接获取土壤中的有机物中的氮、磷等矿质营养[30]。
本文研究也显示菊科植物RLC与AC的Cv值大于禾本科Cv,而其VC与AC/VC的Cv值却小于禾本科,说明在植物系统发育上禾本科植物的RLC与AC较菊科保守,但菊科植物的VC与AC/VC较禾本科植物保守,即便属于同一科的植物其根内AM真菌的侵染率也不相同,也从植物科水平进一步验证了本文研究结果(均无显著系统发育信号)。至于毛茛科植物AM侵染率的Cv值高于菊科、禾本科,这仅仅是小样本样品在统计上的差异,并无实质生态学意义。植物功能群是指共同享有一些关键的功能性状而对特定环境因子有相似的反应机理,并对生态系统主要过程有相似影响的不同植物种类的组合。因此,我们推测不同功能群植物根内AM真菌的侵染水平也应不同,但本文的研究结果却与这一推断不一致,发现杂草、禾草与豆科类植物三者间的RLC与VC无显著差异,AC与AC/VC在不同功能群间无显著差异。考虑到植物的功能特征在进化上的保守性[31],因而这又从功能群的层面进一步支持了亲缘关系较近的植物,其AM真菌侵染水平也不尽相似的研究结论。
4 结论
本文中被测17种植物的AM侵染率均无显著系统发育信号,其植物进化树中AM真菌侵染率的差异更多被最新分支节点所解释,而不是古老分支节点,说明高寒草甸生态系统亲缘关系较近的植物,其AM真菌侵染水平并不相同,不存在进化的保守性。该结果系统报道了高寒草甸生态系统中植物系统进化发育与AM真菌侵染间的关系,表明了植物系统进化与AM侵染间无显著关联。从菌根真菌的角度为将来高寒退化草地的人工恢复过程中植物的选种提供了生态依据。进一步研究需加大样本量、从时间与空间尺度两个方面去探讨植物系统发育与AM侵染间关系的一般性规律。
[1] Wang B, Qiu Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants. Mycorrhiza, 2006, 16(5): 299- 363.
[2] Wardle D A, Bardgett R D, Klironomos J N, Setälä H, van der Putten W H, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[3] Smith S E, Read D J. Mycorrhizal Symbiosis. 3rd th. New York: Academic Press, 2010.
[4] Lewandowski B, De Bo G, Ward J W, Papmeyer W, Kuschel S, Aldegunde M J, Gramlich P M E, Heckmann D, Goldup S M, Souza D M, Fernandes A E, Leigh D A. Sequence-specific peptide synthesis by an artificial small-molecule machine. Science, 2013, 339(6116): 189- 193.
[5] Vestergård M, Henry F, Rangel-Castro J I, Michelsen A, Prosser J I, Christensen S. Rhizosphere bacterial community composition responds to arbuscular mycorrhiza, but not to reductions in microbial activity induced by foliar cutting. FEMS Microbiology Ecology, 2008, 64(1): 78- 89.
[6] Veresoglou S D, Shaw L J, Hooker J E, Sen R. Arbuscular mycorrhizal modulation of diazotrophic and denitrifying microbial communities in the (mycor) rhizosphere ofPlantagolanceolata. Soil Biology and Biochemistry, 2012, 53: 78- 81.
[7] Van Der Heijden M G A, Streitwolf-Engel R, Riedl R, Siegrist S, Neudecker A, Ineichen K, Boller T, Wiemken A, Sanders I R. The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland. New Phytologist, 2006, 172(4): 739- 752.
[8] Leifheit E F, Verbruggen E, Rillig M C. Arbuscular mycorrhizal fungi reduce decomposition of woody plant litter while increasing soil aggregation. Soil Biology and Biochemistry, 2015, 81: 323- 328.
[9] Reinhart K O, Wilson G W T, Rinella M J. Predicting plant responses to mycorrhizae: integrating evolutionary history and plant traits. Ecology Letters, 2012, 15(7): 689- 695.
[10] 杨海水, 王琪, 郭伊, 熊艳琴, 许明敏, 戴亚军. 丛枝菌根真菌群落与植物系统发育的相关性分析. 植物生态学报, 2015, 39(4): 383- 387.
[11] Tedersoo L, Mett M, Ishida T A, Bahram M. Phylogenetic relationships among host plants explain differences in fungal species richness and community composition in ectomycorrhizal symbiosis. New Phytologist, 2013, 199(3): 822- 831.
[12] Jacquemyn H, Merckx V, Brys R, Tyteca D, Cammue B P A, Honnay O, Lievens B. Analysis of network architecture reveals phylogenetic constraints on mycorrhizal specificity in the genusOrchis(Orchidaceae). New Phytologist, 2011, 192(2): 518- 528.
[13] Martos F, Munoz F, Pailler T, Kottke I, Gonneau G, Selosse M A. The role of epiphytism in architecture and evolutionary constraint within mycorrhizal networks of tropical orchids. Molecular Ecology, 2012, 21(20): 5098- 5109.
[14] McGonigle T P, Miller M H, Evans D G, Fairchild G L, Swan G A. A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New Phytologist, 1990, 115(3): 495- 501.
[15] Johnson N C, Rowland D L, Corkidi L, Egerton-Warburton L M, Allen E B. Nitrogen enrichment alters mycorrhizal allocation at five mesic to semiarid grasslands. Ecology, 2003, 84(7): 1895- 1908.
[16] Webb C O, Ackerly D D, Kembel S W. Phylocom: software for the analysis of phylogenetic community structure and trait evolution. Bioinformatics, 2008, 24(18): 2098- 2100.
[17] Moles A T, Ackerly D D, Webb C O, Tweddle J C, Dickie J B, Westoby M. A brief history of seed size. Science, 2005, 307(5709): 576- 580.
[18] Blomberg S P, Garland Jr T, Ives A R. Testing for phylogenetic signal in comparative data: behavioral traits are more labile. Evolution, 2003, 57(4): 717- 745.
[19] Lugo M A, Reinhart K O, Menoyo E, Crespo E M, Urcelay C. Plant functional traits and phylogenetic relatedness explain variation in associations with root fungal endophytes in an extreme arid environment. Mycorrhiza, 2015, 25(2): 85- 95.
[20] Wehner J, Powell J R, Muller L A H, Caruso T, Veresoglou S D, Hempel S, Rillig M C. Determinants of root-associated fungal communities within Asteraceae in a semi-arid grassland. Journal of Ecology, 2014, 102(2): 425- 436.
[21] Glynou K, Ali T, Buch A K, Kia S H, Ploch S, Xia X J, Çelik A, Thines M, Maciá-Vicente J G. The local environment determines the assembly of root endophytic fungi at a continental scale. Environmental Microbiology, 2015, doi: 10.1111/1462- 2920.13112.
[22] Egerton-Warburton L M, Johnson N C, Allen E B. Mycorrhizal community dynamics following nitrogen fertilization: a cross-site test in five grasslands. Ecological Monographs, 2007, 77(4): 527- 544.
[23] Liu Y J, Shi G X, Mao L, Cheng G, Jiang S J, Ma X J, An L Z, Du G Z, Johnson N C, Feng H Y. Direct and indirect influences of 8 yr of nitrogen and phosphorus fertilization on Glomeromycota in an alpine meadow ecosystem. New Phytologist, 2012, 194(2): 523- 535.
[24] Heinemeyer A, Ridgway K P, Edwards E J, Benham D G, Young J P W, Fitter A H. Impact of soil warming and shading on colonization and community structure of arbuscular mycorrhizal fungi in roots of a native grassland community. Global Change Biology, 2004, 10(1): 52- 64.
[25] Shi G X, Liu Y J, Johnson N C, Olsson P A, Mao L, Cheng G, Jiang S J, An L Z, Du G Z, Feng H Y. Interactive influence of light intensity and soil fertility on root-associated arbuscular mycorrhizal fungi. Plant and Soil, 2014, 378(1/2): 173- 188.
[26] Dumbrell A J, Nelson M, Helgason T, Dytham C, Fitter A H. Relative roles of niche and neutral processes in structuring a soil microbial community. The ISME Journal, 2010, 4(3): 337- 345.
[27] Powell J R, Parrent J L, Hart M M, Klironomos J N, Rillig M C, Maherali H. Phylogenetic trait conservatism and the evolution of functional trade-offs in arbuscular mycorrhizal fungi. Proceedings of the Royal Society B: Biological Sciences, 2009, 276(1676): 4237- 4245.
[28] Hetrick B A D, Wilson G W T, Leslie J F. Root architecture of warm-and cool-season grasses: relationship to mycorrhizal dependence. Canadian Journal of Botany, 1991, 69(1): 112- 118.
[29] Gai J P, Cai X B, Feng G, Christie P, Li X L. Arbuscular mycorrhizal fungi associated with sedges on the Tibetan plateau. Mycorrhiza, 2006, 16(3): 151- 157.
[30] Raab T K, Lipson D A, Monson R K. Non-mycorrhizal uptake of amino acids by roots of the alpine sedgeKobresiamyosuroides: implications for the alpine nitrogen cycle. Oecologia, 1996, 108(3): 488- 494.
[31] Losos J B. Phylogenetic niche conservatism, phylogenetic signal and the relationship between phylogenetic relatedness and ecological similarity among species. Ecology Letters, 2008, 11(10): 995- 1003.
Relationships between plant phylogeny and arbuscular mycorrhizal fungal colonization in an alpine meadow ecosystem
SHI Guoxi1,2, JIANG Shengjing3, LUO Jiajia3, ZHOU Huakun2, FENG Huyuan3,*
1UniversityKeyLaboratoryforProtectionandUtilizationofLongdongBio-resourcesinGansuProvince,CollegeofLifeSciencesandTechnology,LongdongUniversity,Qingyang745000,China2KeyLaboratoryofEcologyRestorationinColdRegioninQinghaiProvince,NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining810008,China3MOEKeyLaboratoryofCellActivitiesandStressAdaptations,SchoolofLifeSciences,LanzhouUniversity,Lanzhou730000,China
Arbuscular mycorrhizal (AM) fungal colonization in the roots of 17 common plant species were measured to analysis the phylogenetic conservatism of AM colonization that are believed to be plant functional traits. The results showed that there were no phylogenetic signals of AM colonization, and its extant significant variation was explained more by relatively recent than ancient divergences in the phylogeny, suggesting that closely related plant lineages had no similar traits. Our study systematically reports the relationships between plant phylogeny and AM colonization in an alpine meadow ecosystem, and highlights no significant relevance between plant phylogeny and AM colonization.
plant phylogeny; AM fungi; phylogenetic signal; phylogenetic conservatism
国家自然科学青年基金(31500427);青海省自然科学青年基金(2016-ZJ-957Q);中国博士后基金(2015M582735);陇东学院青年科技创新基金(XYZK1505);陇东学院博士基金(XYBY1602)
2016- 03- 21; 网络出版日期:2017- 02- 22
10.5846/stxb201603210503
*通讯作者Corresponding author.E-mail: fenghy@lzu.edu.cn
石国玺,蒋胜竞,罗佳佳,周华坤,冯虎元.高寒草甸植物系统发育与AM真菌侵染的关系.生态学报,2017,37(11):3628- 3635.
Shi G X, Jiang S J, Luo J J, Zhou H K, Feng H Y.Relationships between plant phylogeny and arbuscular mycorrhizal fungal colonization in an alpine meadow ecosystem.Acta Ecologica Sinica,2017,37(11):3628- 3635.
