合并乙型肝炎病毒感染对弥漫大B细胞淋巴瘤患者血清TNF-α、sIL-2r、IL-6及IL-10水平的影响
2017-07-18施淼颉邹善华
魏 征, 施淼颉, 邹善华, 刘 澎
复旦大学附属中山医院血液科,上海 200032
·论 著·
合并乙型肝炎病毒感染对弥漫大B细胞淋巴瘤患者血清TNF-α、sIL-2r、IL-6及IL-10水平的影响
魏 征, 施淼颉, 邹善华, 刘 澎*
复旦大学附属中山医院血液科,上海 200032
目的: 探讨合并乙型肝炎病毒(hepatitis B virus,HBV)感染对弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)患者血清细胞因子表达水平的影响及其临床意义。方法: 选择2013年9月至2014年4月于复旦大学附属中山医院血液科住院接受治疗的DLBCL患者共77例,测定初治及完全缓解后DLBCL患者血清中肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、可溶性白细胞介素2受体(soluble interleukin-2 receptor,sIL-2r)、白细胞介素-6(interleukin-6,IL-6)及白细胞介素-10(IL-10)的表达水平;以20例年龄匹配的同期健康体检者作为对照。进一步分析乙型肝炎病毒表面抗原(HBsAg)阳性及阴性DLBCL患者血清中细胞因子水平的差异。结果: 初治DLBCL患者血清TNF-α、sIL-2r及IL-6水平均明显高于健康对照组(均P<0.05);缓解期DLBCL患者血清TNF-α和sIL-2r水平明显低于初治患者(均P<0.05),但仍明显高于健康对照组(均P<0.05)。初治DLBCL患者中,HBsAg阳性者的上述血清细胞因子水平与HBsAg阴性者差异无统计学意义;缓解期DLBCL患者中,HBsAg阳性者的血清sIL-2r水平显著高于HBsAg阴性者(P<0.05)。结论: DLBCL患者血清TNF-α、sIL-2r和IL-6水平升高,其中TNF-α及sIL-2r水平与疾病缓解有关。HBsAg阳性DLBCL患者在疾病缓解后的sIL-2r水平明显高于HBsAg阴性者,sIL-2r水平与HBsAg阳性DLBCL患者预后不良之间的相关性还有待进一步研究。
弥漫大B细胞淋巴瘤;免疫调节;可溶性白介素-2受体;T淋巴细胞
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)中最常见的亚型,在中国NHL患者中占50%~60%。流行病学数据提示,乙型肝炎病毒(hepatitis B virus,HBV)感染增加了B细胞NHL(B-NHL)的患病风险[1]。在DLBCL患者中,HBV感染率明显高于T细胞淋巴瘤及滤泡淋巴瘤等其他NHL[2-4]。因此,HBV与DLBCL发病之间存在关联。本课题组前期研究证实,乙型肝炎病毒表面抗原(HBsAg)阳性DLBCL患者接受免疫化疗后,缓解率同HBsAg阴性患者相似,但生存期较短[5],因此提示HBV同时影响DLBCL患者的预后。
既往研究[6-12]证实,细胞因子与B细胞淋巴瘤发病密切相关。在常见细胞因子中,肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、可溶性白细胞介素2受体(soluble interleukin-2 receptor,sIL-2r)、白细胞介素-6(interleukin-6,IL-6)及IL-10水平与患者预后相关[13-15]。其中,血清sIL-2r水平可部分替代国际预后指数(international prognostic index,IPI)对患者预后的独立预测价值[16],即sIL-2r表达水平越高,患者预后越差[17]。而且化疗有效的患者在化疗后血清sIL-2r水平可趋于正常化[18]。既往研究[19]还发现,合并HBV感染使DLBCL患者化疗后出现更明显的细胞免疫抑制,主要表现为HBsAg阳性患者的CD4+细胞所占比例明显降低,较HBsAg阴性者的降低程度更为严重,且持续时间更久。那么,合并HBV感染对DLBCL患者细胞免疫抑制的同时,是否对患者血清细胞因子表达产生影响,目前尚无相关报道。因此,本研究旨在分析合并HBV感染对DLBCL患者血清TNF-α、sIL-2r、IL-6及IL-10表达水平的影响,以期进一步探索HBV感染对DLBCL患者预后影响的可能机制。
1 资料与方法
1.1 一般资料 收集2013年9月至2014年4月在复旦大学附属中山医院血液科住院接受化疗的DLBCL患者77例。所有患者均由病理确诊,根据WHO淋巴造血系统肿瘤分类确诊为DLBCL。选取初治DLBCL患者,以及经过一线至少4周期R-CHOP样方案治疗达到完全缓解的DLBCL患者(即缓解期DLBCL患者),进行病例对照研究;同时与健康成年人进行比较。入组期间共纳入初治DLBCL患者36例,其中HBsAg阳性者8例,HBsAg阴性者28例;化疗后完全缓解期DLBCL患者41例,其中HBsAg阳性者10例,HBsAg阴性者31例。所有患者均记录性别、年龄、体力状态和既往病史等。患者体力状态以美国东部肿瘤协作组(ECOG)评分表示,并记录IPI[20]。体检健康者20例,男女性各10例,标本均来自复旦大学附属中山医院体检中心废弃生物标本。对照组年龄20~55岁,血常规白细胞密度为(4.58~10.06)×109/L,淋巴细胞比例为25.2%~54.6%,既往无慢性疾病史及肿瘤病史,HBsAg检测阴性。本研究中生物标本的使用均获得复旦大学附属中山医院伦理委员会批准。所有研究对象均签署知情同意书。
临床治疗及疗效评估本研究纳入的DLBCL患者均接受至少4个周期的改良R-CHOP样方案治疗:利妥昔单抗(375 mg/m2,D0),环磷酰胺(750 mg/m2,D1),长春地辛(2.8 mg/m2,截顶剂量4 mg,D1),表柔比星(70 mg/m2,D1),以及强的松(60 mg/m2,D1-5)联合化疗,每21 d为1个周期。在患者治疗前及接受化疗后,采用CT、PET-CT或彩色超声多普勒等影像学手段判断病灶累及范围和病灶最大径,记录原发病灶位置(淋巴结或结外),并评估结外病灶数目。本研究纳入的缓解期DLBCL患者定义为根据《非霍奇金淋巴瘤疗效评价标准》[21]评估获得完全缓解的患者。
所有患者在治疗前后,均接受HBV血清标志物[包括HBsAg、乙型肝炎表面抗体(HBsAb)、乙肝病毒e抗原(HBeAg)、乙肝病毒e抗体(HBeAb)和乙型肝炎核心抗体(HBcAb)]以及乙型病毒性肝炎脱氧核苷酸(HBV-DNA)检测;HBsAg阳性者均采用核苷类似物抗病毒药物(拉米夫定或恩替卡韦)进行抗病毒治疗,自化疗前或化疗当日起,至少服用至化疗结束12个月。HBV再激活定义为在治疗中HBV-DNA从阴性转为阳性,或在治疗中HBV-DNA滴度较治疗前基线值升高1 000倍,本研究人群中未检测到HBV再激活。
1.2 主要试剂及方法 TNF-α、IL-2受体、IL-6及IL-10水平检测采用化学发光法,测定试剂盒购自Siemens公司,测定仪器为Siemens IMMULITE
1 000分析仪。
标本收集与处理患者或健康成年人标本均由美国BD公司的SST血清分离胶管收集,均为清晨空腹静脉血3 mL。凝血后,离心获得血清100 μL,加入上样管,上机检测。后续测定步骤由IMMULITE 1 000分析仪自动完成。
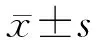
2 结 果
2.1 一般资料比较 分析36例初发DLBCL患者和41例治疗后完全缓解期DLBCL患者的年龄、性别、肿瘤分期及IPI危险分组情况,结果显示差异均无统计学意义(表1)。HBsAg阳性的初发DLBCL者中,3例患者检测到HBV-DNA(分别为1.11×103、1.06×104和2.07×103),其余的初发DLBCL患者及全部的缓解期DLBCL患者均未检测出HBV-DNA。
2.2 不同疾病缓解状态下DLBCL患者的血清细胞因子水平 初治DLBCL患者中,血清细胞因子TNF-α、sIL-2r和IL-6水平均明显高于健康对照(均P<0.001);在治疗后达到缓解的DLBCL患者中,血清细胞因子TNF-α和sIL-2r水平均明显低于初治DLBCL患者(P=0.003,P<0.001),但仍然高于健康对照(P<0.001,P=0.002,表2)。因此,血清TNF-α、sIL-2r和IL-6水平在DLBCL患者与健康者之间差异明显,其中TNF-α及sIL-2r水平在DLBCL患者获得完全缓解前后具有明显差异。

表1 入组患者一般资料的比较 n
2.3 不同HBV感染状态下初发DLBCL患者的血清细胞因子水平 在初治DLBCL患者中,将HBsAg阳性者与HBsAg阴性者的血清细胞因子进行比较,发现两组患者血清TNF-α、sIL-2r、IL-6及IL-10水平差异无统计学意义(表3),说明初治DLBCL患者的上述细胞因子水平不受合并HBV感染的影响。


血清细胞因子健康对照组(N=20)初治患者(N=36)缓解期患者(N=41)TNF-α水平ρB/(pg·mL-1)6.15±2.1819.38±18.17**9.73±2.67**△△sIL-2r水平zB/(U·mL-1)307.45±90.101849.56±2204.30**412.12±160.21**△△IL-6水平ρB/(pg·mL-1)1.15±0.498.43±9.88**4.66±14.2IL-10水平ρB/(pg·mL-1)2.00±021.28±59.392.54±1.72
**P<0.01与健康对照组相比;△△P<0.01与初治患者相比


血清细胞因子HBsAg阴性患者(N=28)HBsAg阳性患者(N=8)P值TNF-α水平ρB/(pg·mL-1)21.04±20.2013.60±5.200.314sIL-2r水平zB/(U·mL-1)1878.86±2329.061747.00±1831.960.884IL-6水平ρB/(pg·mL-1)8.43±10.418.41±8.370.997IL-10水平ρB/(pg·mL-1)12.11±18.0253.40±121.940.371
2.4 不同HBV感染状态下缓解期DLBCL患者的血清细胞因子水平 在治疗后达到完全缓解的DLBCL患者中,将HBsAg阳性者与HBsAg阴性者的血清细胞因子进行比较。结果发现,HBsAg阳性者血清sIL-2r水平明显高于HBsAg阴性者(P=0.039),而血清TNF-α、IL-6及IL-10水平差异无统计学意义(表4)。结果说明,合并HBV感染影响了缓解期DLBCL患者的sIL-2r水平,而不影响其TNF-α、IL-6及IL-10水平。


血清细胞因子HBsAg阴性患者(N=31)HBsAg阳性患者(N=10)P值TNF-α水平ρB/(pg·mL-1)9.74±2.829.70±2.310.963sIL-2r水平zB/(U·mL-1)383.03±135.39502.30±202.540.039IL-6水平ρB/(pg·mL-1)2.52±1.4111.30±28.710.359IL-10水平ρB/(pg·mL-1)2.26±1.003.40±2.950.258
3 讨 论
目前已证实,EB病毒(Epstein-Barr virus,EBV)、HBV和人类免疫缺陷病毒(Human immunodeficiency virus,HIV)等病毒与淋巴瘤的发病明显相关。相关的作用机制主要包括以下几点:(1)加速淋巴细胞的转化型生长;(2)激活原癌基因,或使抑癌基因失活;(3)干扰宿主的正常免疫功能[22]。如HIV感染所致获得性免疫缺陷状态,使CD4+细胞计数明显降低,出现各种病毒感染性相关肿瘤,如卡波西肉瘤和淋巴瘤(多为高度侵袭性B-NHL)等。DLBCL为NHL中最常见的亚型,具有高度侵袭性,而且HBV感染相关的淋巴瘤以DLBCL最为多见[2]。HBV感染后亦影响宿主细胞的免疫功能,使CD4+细胞表达下调,CD4+/CD8+比例降低[23]。本课题组前期研究已证实,尽管HBsAg阳性的DLBCL患者在治疗后完全缓解率及总缓解率较HBsAg阴性者相似,但HBsAg阳性DLBCL患者的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)均较HBsAg阴性者明显缩短[5,24]。HBsAg阳性DLBCL患者在发病初期的细胞免疫功能与HBsAg阴性患者相似,但在化疗中后期CD4+细胞计数及CD4+/CD8+比例低于后者,化疗后出现的细胞免疫抑制程度更为严重,持续时间也更久[19]。
免疫缺陷、慢性抗原刺激和自身免疫性疾病均与B-NHL的发病风险正相关,而过敏状态可能降低NHL的发生率[7-8,10,12]。上述这些疾病对B-NHL发病风险的影响均是基于细胞因子的表达水平异常[6,9,11]。常见细胞因子中,血清TNF-α、sIL-2r、IL-6和IL-10水平对DLBCL的预后具有独立预测价值[13-15]。其中,血清sIL-2r水平可部分替代IPI来预测患者预后[16]。合并HBV感染对DLBCL患者上述细胞因子表达水平的影响及是否由此影响患者预后,在目前均缺少相关的研究报道。因此,本研究通过检测DLBCL患者治疗前后细胞因子TNF-α、sIL-2r、IL-6及IL-10的水平,比较HBsAg阳性DLBCL患者与HBsAg阴性患者在治疗前、缓解期的细胞因子表达水平差异,分析HBV感染对DLBCL患者细胞因子表达的影响。
本研究结果显示,初治DLBCL患者的血清TNF-α、sIL-2r及IL-6水平明显高于健康对照组,而缓解期DLBCL患者血清TNF-α及sIL-2r水平相较初发患者明显降低,但仍高于健康对照组,上述差异均有统计学意义。因此,本研究验证了既往研究的结果,提示DLBCL患者的TNF-α、sIL-2r及IL-6水平与健康者相比存在明显差异,其中血清TNF-α及sIL-2r水平在初治及缓解期DLBCL患者之间有差异,缓解期DLBCL患者的血清TNF-α及sIL-2r水平趋于正常。
在初治DLBCL患者中,HBsAg阳性及阴性者的上述血清细胞因子水平(TNF-α、sIL-2r、IL-6及IL-10)并无明显差异;缓解期DLBCL患者中,HBsAg阳性者血清sIL-2r水平明显高于HBsAg阴性者,而TNF-α、IL-6和IL-10水平无明显差异。因此,推测合并HBV感染对初治DLBCL患者的上述细胞因子水平无明显影响,而主要影响缓解期患者的sIL-2r水平。与此类似的是,本课题组此前的研究[19]表明,合并HBV感染对DLBCL患者在治疗前的细胞免疫状态无明显影响,而在化疗后HBsAg阳性患者出现更为明显而持续的细胞免疫抑制。Lindqvist等[25]研究发现,T调节细胞(T regulatory cells,Treg)通过主动释放sIL-2r,竞争性结合体内IL-2,从而抑制效应细胞,致使B细胞淋巴瘤患者预后不良。因此,HBsAg阳性DLBCL患者较HBsAg阴性者预后差,其机制可能与合并HBV感染加重了患者化疗后的细胞免疫抑制,以及血清sIL-2r水平仍持续相对增高有关。
由于本研究历时较短,纳入病例数相对较少,同时仅选取了化疗前后DLBCL患者进行比较,并未对同一患者在治疗前后的细胞因子水平进行比较,因此研究结果存在偏倚可能,后续需通过扩大研究样本及对相同患者的治疗前后数据进行比较,来验证本研究结果。同时,本研究使用了拉米夫定及恩替卡韦等核苷类似物进行抗病毒治疗,致使本研究人群未出现HBV再激活,而且缓解期患者未检测出HBV-DNA,因此难以对HBV复制水平与细胞因子水平之间的关系做进一步分析。另外,合并HBV感染是否通过影响sIL-2r水平,对DLBCL患者的生存造成影响,还需要更完善的生存分析来证实。
[1] OKAN V, YILMAZ M, BAYRAM A, et al. Prevalence of hepatitis B and C viruses in patients with lymphoproliferative disorders[J]. Int J Hematol, 2008, 88(4):403-408.
[2] MARCUCCI F, MELE A. Hepatitis viruses and non-Hodgkin lymphoma: epidemiology, mechanisms of tumorigenesis, and therapeutic opportunities[J]. Blood, 2011, 117(6):1792-1798.
[3] NATH A, AGARWAL R, MALHOTRA P, et al. Prevalence of hepatitis B virus infection in non-Hodgkin lymphoma: a systematic review and meta-analysis[J]. Intern Med J, 2010, 40(9):633-641.
[4] 刘卫平, 郑 文, 王小沛, 等. 405例非霍奇金淋巴瘤患者乙型肝炎病毒感染率分析[J]. 中华血液学杂志, 2011, 32(8):521-524.
[5] WEI Z, ZOU S, LI F, et al. HBsAg is an independent prognostic factor in diffuse large B cell lymphoma patients in rituximab era: result from a multicenter retrospective analysis in China[J]. Med Oncol, 2014, 31(3):845.
[6] ELENKOV I J, IEZZONI D G, DALY A, et al. Cytokine dysregulation, inflammation and well-being[J]. Neuroimmunomodulation, 2005, 12(5):255-269.
[7] ENGELS E A. Infectious agents as causes of non-Hodgkin lymphoma[J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(3):401-404.
[8] GRULICH A E, VAJDIC C M, COZEN W. Altered immunity as a risk factor for non-Hodgkin lymphoma[J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(3):405-408.
[9] MARTINEZ-MAZA O, BREEN E C. B-cell activation and lymphoma in patients with HIV[J]. Curr Opin Oncol, 2002, 14(5):528-532.
[10] MELBYE M, SMEDBY K E, LEHTINEN T, et al. Atopy and risk of non-Hodgkin lymphoma[J]. J Natl Cancer Inst, 2007, 99(2):158-166.
[11] O'SHEA J J, MA A, LIPSKY P. Cytokines and autoimmunity[J]. Nat Rev Immunol, 2002, 2(1):37-45.
[12] ZINTZARAS E, VOULGARELIS M, MOUTSOPOULOS H M. The risk of lymphoma development in autoimmune diseases: a meta-analysis[J]. Arch Intern Med, 2005, 165(20):2337-2344.
[13] GIACHELIA M, VOSO M T, TISI M C, et al. Interleukin-6 plasma levels are modulated by a polymorphism in the NF-κB1 gene and are associated with outcome following rituximab-combined chemotherapy in diffuse large B-cell non-Hodgkin lymphoma[J]. Leuk Lymphoma, 2012, 53(3):411-416.
[14] GOTO N, TSURUMI H, GOTO H, et al. Serum soluble interleukin-2 receptor (sIL-2R) level is associated with the outcome of patients with diffuse large B cell lymphoma treated with R-CHOP regimens[J]. Ann Hematol, 2012, 91(5):705-714.
[15] USKUDAR TEKE H, GULBAS Z, BAL C. Serum levels of cytokines and prevalence of autoantibodies in lymphoma patients and their prognostic value[J]. J BUON, 2014, 19(1):191-197.
[16] MORITO T, FUJIHARA M, ASAOKU H, et al. Serum soluble interleukin-2 receptor level and immunophenotype are prognostic factors for patients with diffuse large B-cell lymphoma[J]. Cancer Sci, 2009, 100(7):1255-1260.
[17] NIITSU N, IIJIMA K, CHIZUKA A. A high serum-soluble interleukin-2 receptor level is associated with a poor outcome of aggressive non-Hodgkin's lymphoma[J]. Eur J Haematol, 2001, 66(1):24-30.
[18] HARRINGTON D S, PATIL K, LAI P K, et al. Soluble interleukin 2 receptors in patients with malignant lymphoma[J]. Arch Pathol Lab Med, 1988, 112(6):597-601.
[19] 魏 征, 程韵枫, 王志梅, 等. 合并乙肝病毒感染对弥漫大B细胞淋巴瘤患者细胞免疫功能的影响[J]. 中国癌症杂志, 2014, 24(10):765-769.
[20] International Non-Hodgkin′s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin's lymphoma[J]. N Engl J Med, 1993, 329(14):987-994.
[21] CHESON B D, PFISTNER B, JUWEID M E, et al. Revised response criteria for malignant lymphoma[J]. J Clin Oncol, 2007, 25(5):579-586.
[22] DAVE S S. Host factors for risk and survival in lymphoma[J]. Hematology Am Soc Hematol Educ Program, 2010, 2010:255-258.
[23] 李秀梅, 梁树人, 李顺天, 等. 乙型肝炎患者外周血T细胞亚群的分析及意义[J]. 山东医药, 2012, 52(20):63-65.
[24] LAW M F, LAI H K, CHAN H N, et al. The impact of hepatitis B virus (HBV) infection on clinical outcomes of patients with diffuse large B-cell lymphoma[J]. Eur J Cancer Care (Engl), 2015, 24(1): 117-124.
[25] LINDQVIST C A, CHRISTIANSSON L H, SIMONSSON B, et al. T regulatory cells control T-cell proliferation partly by the release of soluble CD25 in patients with B-cell malignancies[J]. Immunology, 2010, 131(3):371-376.
[本文编辑] 叶 婷, 张艺鸣
Effects of hepatitis B virus infection on the serum levels of TNF-α, sIL-2r, IL-6, and IL-10 in patients with diffuse large B cell lymphoma
WEI Zheng, SHI Miao-jie, ZOU Shan-hua, LIU Peng*
Department of Hematology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To investigate the impact of concurrent hepatitis B virus (HBV) infection on serum cytokine levels in patients with diffuse large B cell lymphoma (DLBCL) and its clinical significance. Methods: Seventy-seven DLBCL patients who were admitted into the Hematology Department of Zhongshan Hospital from September 2013 to April 2014 were selected. The serum levels of tumor necrosis factor alpha (TNF-α), soluble interleukin-2 receptor (sIL-2r), interleukin-6 (IL-6), and IL-10 in DLBCL patients were tested before initial chemotherapy and after complete remission. Twenty age-matched healthy subjects who underwent routine physical examination were included as the control. The serum levels of these cytokines in HBsAg positive and negative DLBCL patients were compared, and their clinical significance was further analyzed. Results: Compared with the healthy group, the serum levels of TNF-α, sIL-2r and IL-6 were significantly elevated in DLBCL patients (allP<0.05). The serum levels of TNF-α and sIL-2r in DLBCL patients in the remission group were significantly decreased (bothP<0.05), but were still significantly higher than those in the healthy control group (bothP<0.05). There was no significant difference in serum levels of TNF-α, sIL-2r and IL-6 between HBsAg positive and negative patients before the initial chemotherapy. Of patients in the remission group, HBsAg positive patients had higher serum level of sIL-2r as compared with the HBsAg negative patients (P<0.05). Conclusions: The serum levels of TNF-α, sIL-2r and IL-6 were elevated in patients diagnosed with DLBCL, and the serum levels of TNF-α and sIL-2r were associated with disease remission. Higher serum sIL-2r level in HBsAg positive DLBCL patients after complete remission may help to explain their inferior outcome, which needs further study.
diffuse large B cell lymphoma; immunomodulation; soluble interleukin-2 receptor; T lymphocyte
2017-04-10 [接受日期] 2017-05-07
上海市卫生和计划生育委员会科研课题(201440390). Supported by Research Project of Shanghai Municipal Health and Family Planning Commission(201440390).
魏 征,博士,主治医师. E-mail: wei.zheng@zs-hospital.sh.cn
*通信作者(Corresponding author). Tel: 021-64041990-607405, E-mail: liu.peng@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20170298
R 551.2
A
