大白菜根肿病研究进展
2017-07-10朱焕焕本刊编辑
文/朱焕焕 本刊编辑
大白菜(Brassica rapaL.ssp.pekinensis)别名菘、白菜、白菜花,芸薹属,白菜种。原产地为地中海沿岸和中国,长江以南为主要产区,种植面积占秋、冬、春菜播种面积的40%~60%。20世纪70年代后,中国北方栽培面积也迅速扩大,各地普遍栽培,其栽培面积和消费量在中国居各类蔬菜之首。大白菜具有较高的营养价值,益胃生津,清热除烦,故有“百菜不如白菜”的说法。但近年来由于栽培方式不当等原因,大白菜根肿病日益严重,导致大白菜产量和品质大幅度下降,现已成为大白菜病害防治中亟待解决的难题之一。
根肿病是由芸薹属根肿菌(Plasmodiophora brassicae)侵染引起的专性寄生的世界性土传病害,主要危害十字花科作物,如青花椰菜、花椰菜、甘蓝、抱子甘蓝、大白菜、芜菁等,最早发现于地中海西岸和欧洲南部,现遍布于许多国家[1]。
1 根肿病的概况
1.1 根肿病的发生规律
大白菜根肿病(俗称大根病,福建称菜癌,东北地区称菜瘤子)是一种土传真菌病害。芸薹属根肿菌引起的十字花科蔬菜根肿病,主要寄生于芸薹属多种植株的根部[2]。根肿病每年造成世界范围内的损失达到10%~15%[3]。感病植株被根肿菌侵染后形成根肿组织,植株矮小、易萎蔫。病原菌从腐烂的根肿组织中释放出来形成休眠孢子,能够存活很多年[4]。
根部肿大和植株萎蔫症状仅在土壤中根肿菌的浓度高于发病阈值时表现明显。这个阈值受土壤类型、植株品种的影响,但是影响度小于10个休眠孢子/g土壤。土壤的接种浓度低于102个休眠孢子/g土壤,受侵染程度很低,基本上不影响农作物的产量或地上病害症状[5]。在症状明显表现之前不容易预测和避免根肿菌的侵染。甚至在农民认为田间并无病菌的情况下,根肿菌的休眠孢子已经通过土壤和水进行传播了。因此,根肿病的有效控制很难进行。
1.2 根肿菌的生活史
根肿菌休眠孢子萌发和侵染的最适土温为18~25 ℃,最适土壤持水量为70%,最适土壤pH为5.4~6.5[6]。根肿菌休眠孢子在感病寄主根的分泌物溶液中萌发率可以达到75%[7]。连作使土壤中休眠孢子的数量突增[2],而这些休眠孢子可以在无寄主存在的土壤中存活15年以上。在芸薹属作物重复种植的过程中,这些休眠孢子在土壤中逐渐积累,导致病害程度逐年加重。
1.3 根肿菌的生理小种分化
根肿菌属专性寄生菌,1931年Honig首次证明了该病原菌存在生理小种分化。目前国际上广受认可的根肿菌生理小种鉴别系统有2个,即Williams 系统(表1)和ECD系统(表2)。Williams系统的寄主由4个十字花科植物品种组成,包括2个芜菁甘蓝品种Laurentian、Wilhelmsburger和2个结球甘蓝品种 Jersey queen、Badger shipper。根据4个寄主受根肿菌侵染的不同反应类型的排列组合,理论上应该有16个小种。Williams收集了来自16个国家的124份根肿病菌株,将鉴别品种按照Williams系统分类为1~9号生理小种。另一方面利用该分类系统鉴定了日本札幌的结球甘蓝病菌、下关的白菜病菌和京都的芜菁病菌,发现分别属于第2、5、8号生理小种[8]。Buczacki等[8]对Williams小种鉴别系统作出改进,建立了欧洲鉴别寄主系统(European Clubroot Differential Set,ECD)。该系统保留了Williams鉴别系统原有的3个品种——Jersey queen、Badger shipper 和 Wilhelms burger,此外又引进了12个寄主品种,构成了包含5个芸薹种作物(ECD01~ECD05)、5个芜菁甘蓝种作物(ECD06~ECD10)和5个甘蓝种作物(ECD11~ECD15)的1套系统,根据这15个寄主品种对不同根肿菌小种的抗性排列组合来鉴定生理小种。这套小种鉴别系统被认为更精确和实用,并且该系统还解释了十字花科根肿病的变异和地理扩散问题[9]。目前国际上已用ECD系统鉴定出小种24个以上。谢文瑞等[10]利用ECD测试了我国台湾桃园蔗竹、新竹、香山等7个地区的根肿病菌生理小种,认为属ECD16/0/0和
ECD16/0/31菌系。
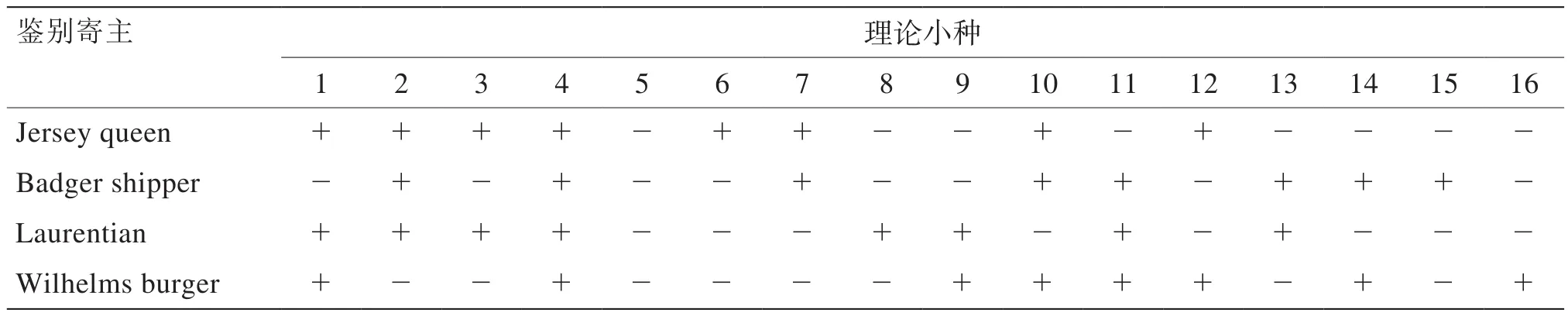
表1 威廉士十字花科根肿病菌鉴别系统(Williams)

表2 欧洲根肿病菌鉴别系统(ECD)
中国尚没有研究出适合国内根肿病菌生理小种鉴定的鉴别寄主系统。国内学者研究根肿病菌生理小种通常采用Williams鉴别系统[11]。国内根肿菌生理小种研究较少,沈向群等[12]利用Williams系统鉴定了来自中国15个大白菜根肿病主要发病区域的病原菌,得到5个生理小种,分别为小种2、4、7、10、11,其中以4号小种为主,并且主要分布在平原大白菜主产区,是危害面积最大的小种。费维新等[13]通过Williams鉴别系统鉴别安徽根肿病主要发病区域的病原菌,发现了4个生理小种,分别为2、4、5、7小种。
2 根肿病防治方法研究进展
目前生产中,根肿病防治技术采用的药剂处理方式包括喷雾法、灌药法和拌药法等[14]。喷雾法比较适合叶部病害的防治,拌药法和灌药法多用于根部病害的防治,近年来人们往往为了便于操作而倾向于选择灌药法防治根部病害。研究结果证实了拌土法是防治根肿病的有效方法。虽然拌土法作为一种传统方法还存在着费工费时的缺陷,但可以考虑开发新型的农用机械来弥补这一问题[5]。下面介绍根肿病的防治措施。
2.1 调整土壤酸碱度
根肿病易发生在酸性土壤中,因此可通过调整土壤酸碱度,破坏其菌落生活的适宜环境,从而控制病害。先进行土壤酸碱度测试,然后依据土壤酸度增施石灰,一般667 m2施30 kg,施用时间以播种前7~10 d为宜。可采用撒施的方式翻入土中,或采用穴施的方式,每穴约25 g,若大白菜根肿病出现病株,可用15%石灰乳浇根。这种通过提高土壤碱度来防控根肿病的方法是常用的防控方法之一。但是也有关于利用增加土壤酸碱度控制根肿病失败的例子[6]。这也许与土壤处理、土壤湿度和结构、根肿菌分布、石灰颗粒的大小和质量、施药和种植的间隔时间等因素有关。
2.2 控制营养元素及土壤含水量
Donald 等[14]通过分析健康植株与不同程度病害的患病植株,发现患病植株较健康植株增加最多的营养元素为钾;对根肿病发病阶段寄主的营养元素变化的研究表明,在缺钾的培养基质中生长的感病植株品种患病程度降低了60%。Murakami等[15]研究表明,增加钙和镁的剂量可以使根肿病的发生不受pH影响。杨明英等[16]研究表明土壤含水量与大白菜根肿病的发生具有相关性,当土壤含水量低于30%或高于80%时发病较轻;土壤含水量为40%、50%、60%、70%时发病较重。
2.3 土壤灭菌消毒
由于根肿菌可长期存活于土壤中,可通过土壤消毒来防控根肿病。根肿菌在水池淤泥、水坝、育苗块和定植穴中都可以检测到,这些案例中水源里的病原菌可能来自田间土壤[17]。研究表明,减少灌溉水中根肿菌的转移及活力将是未来研究的主要方向。有根肿病防控研究表明,根肿菌的休眠孢子在水中能够存活34个月,使用带菌浓度为10个休眠孢子/mL的水反复灌溉,可以导致植株根部肿大[18]。
2.4 耕作防控
研究人员认为常年的连作会影响根肿病的发病程度以及土壤中休眠孢子的寿命。早期通过拔除病株、改进排水沟、深耕法耕种和农作物轮作等来缓解病害,目前仍有很多地区采用这些方法。在耕作之前一定要清除患病植株,有研究表明将发病较轻的植株翻耕在土壤中,相当于增加了土壤带菌浓度(每克土增加105个休眠孢子)[6]。在根肿菌休眠孢子达到一定程度后,就会产生根肿菌,进而为害植株。严格控制耕作,避免患病植株的反复翻耕,这对控制根肿病的蔓延具有非常重要的意义。
2.5 化学防控
在广泛评估的多种化学药剂中,苯并咪唑类及其前体对防治根肿病最为有效。在对多种化学制剂的温室评估过程中,获得了几种潜在的有效药剂:苯菌灵、甲基硫菌灵和NF48[6]。通过评估五氯硝基苯(PCNB)和其他化合物,总结出五氯硝基苯(PCNB)只有在没有发生严重病害时能够有效地防控根肿病。王再强[19]认为,在根肿病发病后,可用50%多菌灵+25%甲霜·霜霉威或70%敌磺钠,每667 m2施加增根粉1 kg,采用随水浇灌的方式,可有效控制根肿病的蔓延。黄安吉[20]研究表明,通过拌药处理的防治效果优于灌药处理的效果,且施50%氟啶胺悬浮液(1 g/mL)的防治效果达85.94%,持续80 d的防治效果仍高达85.25%。另外,高熹等[21]研究表明,氰霜唑对大白菜根肿病防治有一定的效果,且建议氰霜唑灌根的时间为播种后的前3 d,灌根质量浓度为25~50 mg/L。
2.6 表面活性剂应用
目前有大量的表面活性剂被用于评估防控根肿病的效果。Donald等[14]研究发现500 μg/g磺基琥珀酸二辛酯类和2 000 μg/g环氧乙烷基酚防控效果最佳。进一步的研究发现,仅有Agral不抑制植株的生长。通过田间试验,了解了几种液体非离子型表面活性剂在配合和单独使用时的效果;在没有病菌压力的情况下,几种试剂在低浓度下都表现为抑制植株的生长。田间试验结果表明,在肥料中加入2%Agral和15~20 mg/kg硼(75 mL/株),可有效地控制根肿病的发生。但关于利用表面活性剂控制根肿病的原理尚不清楚,可能是表面活性剂可以阻断病菌的转移或直接将病原菌杀死,从而阻止根肿菌侵染植株根部形成肿瘤。
2.7 生物防治
受根肿菌侵染的土壤分布于世界各地,能有效控制微生物活力的生物制剂可以防控土壤带菌。Donald等[14]发现酚类化合物龙胆酸对根肿病的防治有一定的效果。Niwa等[22]经研究证实,高浓度有机质可以通过改善土壤状况,来抑制土传病害。有研究者认为,通过钙和土壤生物群同时作用,利用有机质适度调节土壤pH,可以有效地防治根肿病。此方法在苏格兰根肿病的防控上应用比较广泛。另外,Donald等[18]认为可以通过植株诱导法,减少土壤中休眠孢子的数量,从而控制根肿病的发生或危害程度。
2.8 综合治理
长期的实践证明,综合利用高水平的轮作,通过石灰增加土壤pH,添加钙、硼以及有效化学药剂等措施能够有效地防治根肿病[16]。但综合防治不是简单地将所有防治措施相加,这样只会导致成本增加,效果却不尽人意。虽然抗病品种的使用有一定的时效性,但可通过与人工手段相结合的方式,更有效地防治根肿病。同时,尽可能地减少有害化学药剂和高浓度复合肥的使用,从另一方面来说这也保证了土壤的性质和生态系统的平衡。
3 大白菜抗根肿病分子标记及分子标记辅助育种研究进展
3.1 分子标记的类型
分子标记可以分为4类,各有其优缺点。第一类是基于DNA-DNA杂交的分子标记技术,主要包括RFLP标记和VNTR标记,其特点是操作繁琐、费时费力,目前应用较少;第二类是基于PCR技术的分子标记,包括采用随机引物进行扩增的标记类型(如RAPD、SRAP、SSR标记等)以及采用特异引物扩增的标记类型(如STS、SCAR标记等),其特点是操作简单、快速高效;第三类是基于限制性内切酶和PCR的DNA标记(如AFLP、CAPS标记);第四类是基于单个核苷酸变异的DNA标记,该遗传的多态性是由DNA序列中发生单个或连续多个碱基发生插入、缺失等变异造成的,是基于基因组序列信息的新型分子标记类型,主要包括SNP标记和InDel标记,这类标记在今后的应用中将大有前景[23]。
3.2 利用分子标记定位大白菜抗根肿病基因
Kuginuki等[24]利用抗病材料和感病材料杂交后F1的36个DH群体,获得与抗根肿病基因连锁的3个RAPD标记RA12-75A、WE22B和WE49B,且它们在DH系和F2群体中均是连锁的,可以用于分子标记辅助育种中。1998年日本学者Matsumoto等[25]采用DH群体和RAPD技术构建了大白菜连锁图谱,发现根肿病抗性是由1对显性基因CRa控制,被定位在3号连锁群上,且R F L P标记HC352b和HC181与该基因的连锁距离分别为3、12 cM。2005年Matsumoto等[26]研究获得了与基因CRa连锁的RAPD标记E49380且两者之间的连锁距离为4.6 cM。Hayashida等[27]报道了1个紧密连锁的共线性SCAR标记HC352b-SCAR,该标记与金银CRa和标记E49380的连锁距离分别为2.9、7.5 cM,且可正确预测F2群体中根肿病的抗病类型。
2003年Suwabe等[28]利用抗病材料(G004)和感病材料(A9709)杂交后的F2群体,检测到2个抗病位点Crr1和Crr2,并筛选出了其共显性的SSR连锁标记BRMS-088和BRMS-096。研究表明BRMS-088与RA12-75A紧密连锁,推测Crr1与基因CRa为同一位点。2006年Suwabe等[29]利用Siloga的F2群体构建了基于SSR分子标记的大白菜遗传连锁图谱,发现了Crr1、Crr2、Crr4分别位于A08、A01、A06连锁群上,将2个主要的位点Crr1和Crr2定位在拟南芥4号染色体上的一小段基因组区域内,该区域是拟南芥的1个抗病基因簇区域MRCs。SSR连锁标记BRMS-088和BRMS-096分别与Crr1和Crr2紧密连锁,遗传距离分别为1.75、0.88 cM。其中位点Crr1、Crr2和Crr4分别为主效基因、修饰基因和微效基因。Hirai等[30]利用抗根肿病芜菁自交系(N-WMR-3)和感根肿病大白菜DH系(A9709)杂交获得F3分离群体,经遗传分析发现根肿病抗性基因是由1对主基因控制。且检测到1个新的抗根肿病位点Crr3。利用SAS、RAPD和STS技术,经筛选和转化获得STS标记OPC11-1S(显性)和OPC11-1S(共显性)。基因Crr3的两侧STS标记BRMS-088和BRMS-096之间的遗传距离为10 cM。之后日本学者Saito等[31]选用包含888个单株的F2代群体,并结合构建的连锁图谱,进一步将位点Crr3定位在2个STS标记BrSTS-33和BrSTS-78之间的0.35 cM区域内。
大白菜CR Shink DH系携带1个对根肿病生理小种2、4和8表现抗性的显性基因CRb。Piao等[32]利用抗根肿病材料与感根肿病材料杂交获得的F2分离群体定位了CRb基因,并将紧密连锁的AFLP标记转化成SCAR标记,SCAR标记TCR09(显性)与CRb基因的遗传距离为0.78 cM,CRb位点两侧的标记TCR01(共显性)和TCR09(显性)之间的遗传距离为2.9 cM。之后Piao等[33]经研究发现共显性标记TCR01能够准确鉴定出纯合抗性植株。王森等[34]利用94SK(感根肿病的大白菜自交系)和CR Shink DH(感根肿病)杂交获得F2分离群体,通过BAS和AFLP技术构建了遗传图谱,该遗传图谱包含179个标记位点、10个连锁群,覆盖长度576 cM,平均图距为3.3 cM。将抗根肿病基因定位在第1条连锁群9 cM范围内。其中,标记TCR09位于CRb的一侧,遗传图距为0.43 cM;位于该基因另一侧的标记P14、TCR02和TCR05的遗传图距分别为1.74、1.97、2.67 cM。Kato等[35]以CR Shinki为抗源,利用2个分子标记KB59N07和B1005将CRb基因定位在140 kb区间内,并获得了候选基因。Zhang等[36]利用CR Shinki的双单倍体群体,经遗传分析发现位于标记TCR79和TCR108之间0.14 cM区域内的抗根肿病基因位点CRb,预测候选基因为NBS-LRR类基因,并证实了该基因与Kato点位的CRb不是同一个基因。
Sakamoto等[37]利用K10(抗根肿病)和Q5(感根肿病)杂交获得的F2分离群体,构建遗传图谱,并通过QTL方法定位发现了CRk和CRc这2个位点。将CRk和CRc分别定位在连锁群A03和A02上。其中,STS标记HC688和m6R分别与位点CRk和CRc紧密连锁。王彤彤[38]利用5个不同来源的F1代高抗根肿病材料自交构建F2代群体,经遗传性分析,发现该材料中根肿病抗性由显性单基因控制。通过分离群体分组分析法(BSA)和InDel分子标记技术得到与该抗病基因距离最近的STS标记TCR05-R和InDel标记BrID90039,这2个标记与抗病基因的遗传距离分别为0.7、1.7 cM。Chu等[39]利用分子标记MS7-9和sN8591将Rcr1定位在A03上,遗传距离为0.28 cM。Yu等[40]发现了位于目标区域的14个SNP标记均与Rcr1完全连锁,且与Rcr1的遗传距离比MS7-9和sN8591与Rcr1的遗传距离要近。
3.3 大白菜抗根肿病育种研究
日本蔬菜和观赏植物试验组的田间试验表明,大白菜极易感染根肿病,几乎完全缺少对根肿病的抗性[41]。在大白菜根肿病研究上,日本与韩国较为领先。Piao等[42]利用韩国和日本的10个感病品种和37个抗病品种,获得标记TCR01200和TCR05279,可应用于鉴定对生理小种4有抗性的抗病品种。欧洲芜菁抗源材料主要有Gelria、Siloga、Debra、Milan white等。Standberg[43]发现在中国白菜中有抗6和7小种的显性基因。而中国的大白菜抗病品种较少,孙保亚等[44]从国外引进的抗根肿病大白菜杂交种中分离出大白菜抗根肿病自交系48个,并利用抗病自交系(9617CR80-2-1)和感病自交系华白(2-3-196-954-1-85-1)的F1、F2及BC1,对大白菜抗根肿病遗传规律进行了初步研究,确认大白菜根肿病遗传由1对显性基因控制。大白菜根肿病是一种严重影响大白菜生长的土传性病害,CRb基因是抗大白菜根肿病的重要基因。朴钟云等[45]以具有抗根肿病基因CRb的大白菜CR Shinkii DH系为抗源,通过分子标记辅助选择(Marker-assisted Selection,MAS)选育出大白菜优良自交系BJN3的9份抗根肿病近等基因系。这些近等基因系的结球相关性状与BNJ3无显著差异。李晓鸥等[46]对生产上的5个大白菜品种(巨珠、绿珠、青庆、绿宝及翠莲)进行了抗病性鉴定,结果表明绿珠、绿宝抗病性较强,巨珠最不抗病。陈静等[47]结合Williams系统和田间自然鉴定法,在以小种4为优势小种的重庆市涪陵发病区对79个甘蓝新组合进行了抗性鉴定,发现GZ78杂交组合表现高抗。任平平等[48]对已发表的6个CRb分子标记进行筛选,获得1个CRb紧密连锁的显性标记TCR05。该标记在抗性纯合材料中产生279 bp的PCR扩增片段,在感病材料中产生250 bp的PCR扩增片段,在抗病杂合材料中产生279 bp和250 bp的PCR片段。
4 问题与展望
目前,对于根肿病的防治,十字花科蔬菜生产体系还没有非常有效的解决方法。但可以采取调整土壤酸碱度、控制营养元素及土壤含水量、土壤灭菌消毒、耕作防控、化学防控、表面活性剂应用、生物防治、综合治理等措施缓解病害程度。
对根肿病的相关研究国内外大都集中在防治方面,育种方面研究很少,尤其分子育种方面进展很小。虽然在生产上也应用很多大白菜抗性品种,但这种抗性机制的可持续性并不高,已经有很多应用旧的抗性品种失败的报道。这就需要研究者们开发有效的分子标记,加快分子标记辅助育种工作的进程。另外,由于稳定遗传抗病性的材料很少,大部分材料都是杂合抗病,所以分子育种方面迫切需要开发出更多共显性标记来筛选抗病材料。在这种纯合抗病材料不易获取的情况下,可以通过小孢子培养技术来实现,目前针对根肿病的研究方面小孢子培养技术尚不是很成熟,仍有很大的开发空间。
大白菜的抗根肿病遗传机理比较复杂,既有质量性状遗传,又有数量性状遗传。同一抗原对不同的生理小种有不同的抗性,加之根肿菌生理小种的变异性,培育出来的抗根肿病品种在栽培过程中存在抗性逐渐衰退或丧失现象,且选育出的品种的适应性有限。在抗性基因标记上,目前至少有8个大白菜抗根肿病基因得到定位,分别是Crr1、Crr2、Crr3、Crr4、CRa、CRb、CRc和CRk(表3)。
如今,在进行根肿病的抗性遗传研究方面,要获得抗病和耐病的新品种需要解决的问题是开发出更多共显性标记来筛选抗病材料;筛选普遍抗病的材料;在鉴定不同生理小种方面开发足够有效的分子标记等。
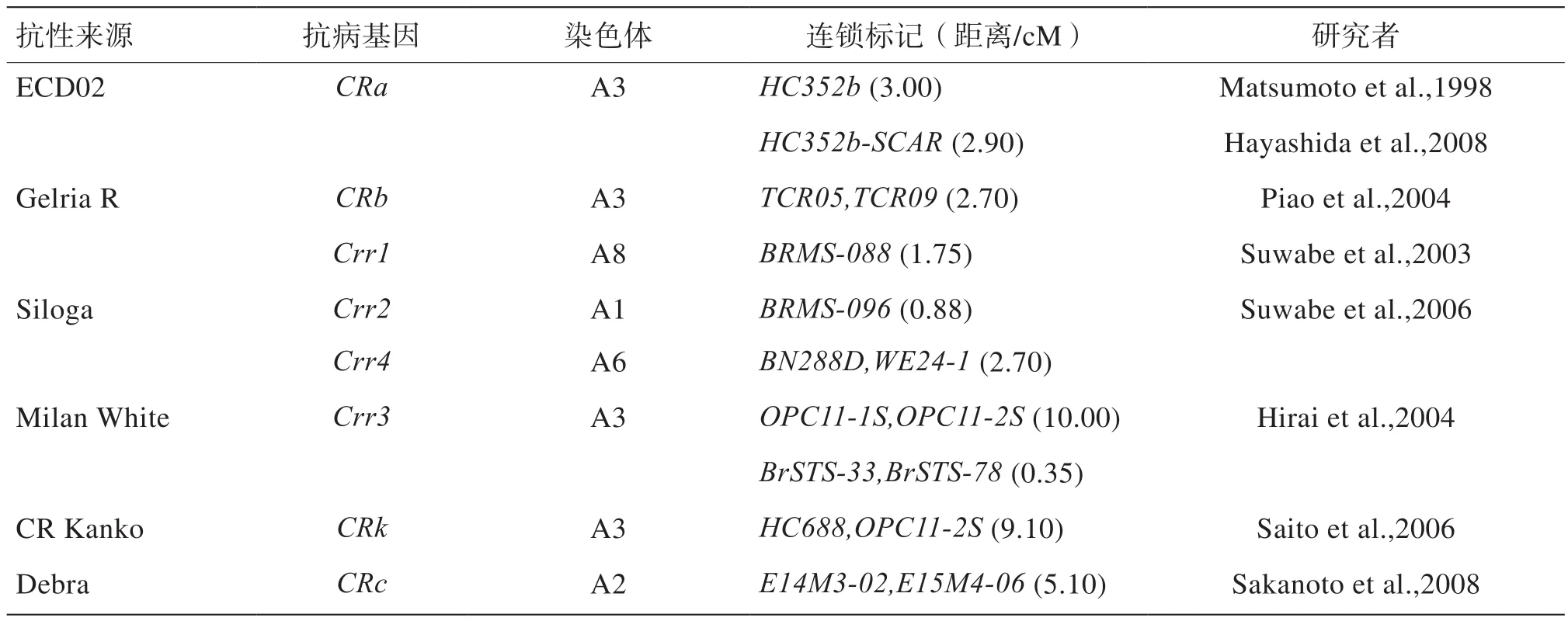
表3 大白菜抗根肿病基因位点及连锁标记信息
[1] 杨永林.十字花科蔬菜根肿病抑菌型土壤初探[J].植物保护学报,1990,17(2):127-131.
[2] OSAKI K, TANAKA S, ITO S. Pathogenicity ofPlasmodiophora brassicaepopulations from small,spheroid, resistant-type clubroot galls on roots of clubroot-resistant cultivars of Chinese cabbage(Brassica rapaL. subsp. pekinensis)[J]. Journal of General Plant Pahtology,2008,74(3):242-245.
[3] FAGGIAN R, STRELKOV S E. Detection and measurement ofPlasmodiophora brassicae[J]. Journal of plant growth regulation,2009,28(3):282-288.
[4] WAKEHAM A J, WHITE J G. Serological detection in soil ofPlasmodiophora brassicqeresting spores[J].Physiological and molecular plant pathology,1996,48(5):289-303.
[5] 李妍.大白菜根肿病病原菌检测与防治技术研究[D].哈尔滨:东北农业大学,2010.
[6] 李宝聚.李宝聚博士诊病手记(一):湖北长阳火烧坪十字花科根肿病—蔬菜"一乡一品"带来的问题[J].中国蔬菜,2008(7):55.
[7] 肖崇刚,郭向华.甘蓝根肿病菌的生物学特性研究[J].菌物系统,2002,21(4):597-603.
[8] BUCZACKI S T, TOXOPEUS H, MATTUSCH P, et al.Study of physiologic specialization inPlasmodiophora brassicae: proposals for attempted rationalization through an international approach[J]. Transactions of the British Mycological Society,1975,65(2):295-303.
[9] 朱明钊,张淑江,张慧,等.大白菜根肿病研究进展[C]//中国园艺学会十字花科蔬菜分会第十届学术研讨论文集.广州:中国园艺学会十字花科蔬菜分会,2016:9-14.
[10] 谢文瑞,黄一修.台湾十字花科蔬菜根肿病及抗病育种研究进展[J].植物保护学会会刊(台湾),1988,30(4):393-398.
[11] 黄蓉,胡建坤,张景云,等.江西省蔬菜根肿病菌致病性分化研究[J].植物病理学报,2017,47(1):133-137.
[12] 沈向群,聂凯,吴琼,等.大白菜根肿病主要生理小种种群分化鉴定初报[J].中国蔬菜,2009(8):59-62.
[13] 费维新,王淑芬,吴晓芸,等.根肿菌生理小种鉴定与甘蓝型油菜品种资源的抗性评价[J].中国油料作物学报,2016,38(5):626-639.
[14] DONALD C, POAER I. Integrated control of clubroot[J].Journal of plant growth regulation,2009,28(3):289-303.
[15] MURAKAMI H, TSUSHIMA S, KUROYANAGIY, et a1.Reduction of resting spore densit Y ofPlasmodiophora brassicaeand clubroot disease severity by liming[J]. Soil science and plant nutrition,2002,48(5):685-691.
[16] 杨明英,杨家鸾,孙道旺.土壤含水量对白菜根肿病发生的影响研究[J].西南农业学报,2004,17(4):482-483.
[17] FAGGIAN R, BULMAN S R, LAWRIE A C, et al.Specific polymerase chain reaction primers for the detection ofPlasmodiophora brassicaein soil and water[J].Phytopathology,1999,89(5):392-397 .
[18] DONALD E C, LAWRENCE J M, PORTER I J.Inf l uence of particle size and application met hod on the eff i cacy of calcium cyanamide for control of clubroot of vegetable brassicas[J].Crops Protect,2004,23(4):297-303.
[19] 王再强.大白菜根肿病的发生与防治[N].河北农民报,2016-06-02(6).
[20] 黄安吉.大白菜根肿病病原菌检测与防治技术研究[J].农技服务,2015,32(6):123.
[21] 高熹,杨涓鑫,陈春梅,等.灌根时间和浓度对氰霜唑防治大白菜根肿病效果的影响[J].现代农药,2013(5):49-51.
[22] NIWA R, KUMEI T, NOMURA Y, et a1. Increase in soil pH due to Ca-rich organic matter application causes suppression of the clubroot disease of crucifers[J]. Soil Biology and Biochemistry,2007,39(3):778-785.
[23] 程洁,李成琼,司军,等.十字花科植物根肿病研究进展[C]//中国园艺学会十字花科蔬菜分会第十届学术研讨会论文集.天津:中国园艺学会十字花科蔬菜分会,2012.
[24] KUGINUKI Y, AJISAKA H, YUI M, et al. RAPD markers linked to a clubroot-resistance locus inBrassica rapaL.[J].Euphytica,1997,98(3):149-154.
[25] MATSUMOTO E, YASUI C, OHI M, et al. Linkage analysis of RFLP markers for clubroot resistance and pigmentation in Chinses cabbage(Brassica rapassp.Pekinensis) [J]. Euphytica,1998,104(2):79-86.
[26] MATSUMOTO E, HAYASHIDA N, SAKAMOTO K,et al. Behavior of DNA markers linked to a clubroot resistance in segregating populations of Chinses cabbage(Brassica rapassp.Pekinensis)[J]. Engei Gakkai Zasshi, 2005,74(74):367-373.
[27] HAYASHIDA N, TAKABATAKE Y, NAKAZAWA N, et al. Construction of a practical SCAR marlers linked to clubroot resistance in Chinses cabbage,with intensive analysis ofHC352bgenes[J]. Journal of the Japan Society for Horticultural Science,2008,77(2):150-154.
[28] SUWABE K, TSUKAZAKI H, IKETANI H, et al.Indentification of two loci for resistence to clubroot(Plasmodiophora brassicaeworonin) inBrassica rapaL.[J]. Theoretical and Applied Genetics,2003,107(6):997-1002.
[29] SUWABE K, TSUKAZAKI H, HATAKEYAMA K, et al. Simple sequence repeat-based comparative genomics betweenBrassica rapaandArabidopsis thaliana: the genetic origin of clubroot resistence[J].GENETICS,2006,173(1):309-319.
[30] HIRAI M, HARADA T, KUBO N, et al. A novel locus for clubroot resistance and pigmentation inBrassica rapaand its linkage markers[J].Theoretical and Applied Genetics,2004,108(4):639-643.
[31] SAITO M, KUBO N, MATSUMOTO S, et al. Fine mapping of the clubroot resistence geneCrr3inBrassica rapa[J].Theoretical and Applied Genetics,2006,114(1):81-91.
[32] PIAO Z Y, DENG Y Q, CHOI S R, et al. CSAR and CAPS mapping ofCRb, a gene conferring toPlasmodiophora brassicaein Chinses cabbage(Brassica rapassp.Pekinensis)[J].Theoretical and Applied Genetics,2004,108(8):1458-1465.
[33] PIAO Z Y, CHOI S R, LEE Y M, et al. The use of molecular markers to certify clubroot resistant(CR)cultivars of Chinses cabbage[J].Horticulture Environment and Biotechnology, 2007(48):148-154.
[34] 王森,王剑,李宏博,等.利用抗、感根肿病F2群体构建大白菜AFLP遗传连锁图谱[J].华北农学报,2009,24(2)64-70.
[35] KATO T, HATAKEYAMA K, FUKINO N, et al.Fine mapping of the clubroot resistence geneCRband development of a useftil selectable maker inBrassica rapa[J].Breeding science,2013,6(3):116-124.
[36] ZHANG T, ZHAO Z, ZHANG C, et al. Fine genetic and physical mapping of theCRbgene conferring resistence to clubroot disease inBrassica rapa[J].Molecular Breeding,2014, 34(3):1173-1183.
[37] SAKAMOTO K, SAITO A, HAYASHIDA N, et al. Mapping of isolate-specific QTLs for clubroot resistence in Chinses cabbage(Brassica rapassp.Pekinensis)[J].Theoretical and Applied Genetics,2008,117(5):759-767.
[38] 王彤彤.大白菜根肿病抗性基因的分子标记及定位[D].北京:中国农业科学院研究生院,2012.
[39] CHU M, SONG T, FALK K, et al. Fine mapping of Rcr1 and analysis of its sffect on transcriptome patterns during infection byPlasmodiophora brassicae[J].BMC Genomics,2014,15(1):1166-1185.
[40] YU F Q, ZHANG X G, HUANG Z, et al. Identif i cation of genome-wide variants and discover of variants associated withBrassica rapaclubroot resistence gene Rcr1 through Bulked Segregant RNA sequencing[J].Plos One,2016,11(4):e0153218.
[41] 司军,李成琼,任雪松,等.十字花科植物根肿病及抗根肿病育种研究进展[J].西南农业学报,2002,15(2):69-72.
[42] PIAO Z Y, CHOI S R, LEE Y M, The use of molecular markers to certify clubroot resistance cultivars of Chinses cabbage[J]. Horticulture Environment and Biotechnology,2007(48):148-154.
[43] SRANDBERG J, WILLIAMS P H. Inherritance of clubroot resistance in Chinese cabbage[J].Phytopathology,1967(57):330.
[44] 孙保亚,沈向群,郭海风,等.大白菜抗根肿病遗传规律初探[J].中国蔬菜,2005(6):15-17.
[45] 朴钟云,吴迪,王淼,等.大白菜根肿病近等基因系的分子标记辅助选育[J].园艺学报,2010,37(8):1264-1272.
[46] 李晓鸥,吴飞燕.大白菜根肿病苗期人工接种抗病性鉴定技术初报[J].中国蔬菜,1990,1(6):9-10.
[47] 陈静,雪松,宋洪元,等.4个不同地区十字花科根肿病菌生理小种鉴定及甘蓝新组合的抗性鉴定[J].西南大学学报(自然科学版),2016,8(1):67-72.
[48] 任平平,马安峰,程斐,等.大白菜抗根肿病及印尼CRb的分子标记验证与种质资源筛选[J].山东农业科学,2016,48(6):7-10.
