海洋低氧环境下氮循环研究进展
2017-07-05徐耀飞阮爱东
徐耀飞,阮爱东,刘 皓
(1 河海大学 水文水资源与水利工程科学国家重点实验室,南京 210098;2.河海大学 水文水资源学院,南京 210098)
· 综 述 ·
海洋低氧环境下氮循环研究进展
徐耀飞1,2,阮爱东1,2,刘 皓1,2
(1 河海大学 水文水资源与水利工程科学国家重点实验室,南京 210098;2.河海大学 水文水资源学院,南京 210098)
由于人类活动和自然原因,海洋低氧现象频发,低氧环境极大影响了生源要素的生物地球化学循环过程。围绕氮要素,主要论述在低氧环境下氮循环的关键过程,包括反硝化作用、厌氧氨氧化作用以及硝化作用,并讨论了低氧环境下影响氮循环的主要因素。
海洋;低氧区;氮循环;氧化还原;微生物
1 引 言
溶解氧(DO)是调节海洋环境中生物地球化学循环过程的关键因子[1]。对海洋大多数生物而言,当DO低于2mg/L时,其生存能力将下降甚至死亡,所以一般将DO低于2mg/L的状态定义为低氧[2]。近几十年来,海洋低氧现象频发且日益加剧,其形成及加剧的原因主要为:一是由于大洋环流、涡流以及气候变化等自然原因使得水体出现盐跃层和温跃层,水体层化阻碍了表层DO向下扩散,导致下层水体低氧[3-4];二是由于人类活动而引起大量营养物质输入海洋,海水富营养化使得藻类大量繁殖,藻类死亡分解会消耗大量氧,从而导致海水氧不足[5-6]。自然原因引起的低氧区主要发生在远洋海域,一般在海面以下100m~1 000m的次表层水体,北太平洋东部、南太平洋东部以及南大西洋东部海域为典型区域[4]。而人类活动引发的低氧区域主要发生在河口以及近岸海域,全球已发现超过400个海洋低氧区域与人类活动有关[7],每年通过河流和大气沉降而向海洋排入的氮源污染物超过9千万吨[6],远远大于工业革命之前的排放量(4千万吨/年),大量污染物加剧了近岸海水富营养化,从而引发低氧问题。
低氧区的存在不仅破坏了区域生态系统的结构与功能,也极大影响了生源要素的生物地球化学循环过程,氮元素作为维持海洋生物活动的重要生源要素之一,其循环过程也受到了极大影响。近年来研究发现海洋氮收支存在明显的不平衡,氮输出要大于氮输入[8],尽管低氧区(DO<2mg/L)在全球海洋只占了4%,但全球海洋氮损失约有30%~50%是来自海洋低氧区[5],海洋低氧区很可能是海洋氮循环不平衡性的关键区域。反硝化和厌氧氨氧化被认为是氮循环过程在低氧环境下主要的生物化学过程,但研究发现在低氧环境下存在完整的氮循环过程,这说明了氮循环在低氧环境下的特殊性。所以,理解低氧环境下的氮循环过程是极为重要的。本文主要论述海洋低氧区氮素循环的主要过程,并探讨影响氮循环的因素。
2 低氧环境下氮循环的主要过程
氮循环是海洋生态系统物质循环的重要组成部分,一般包括固氮、硝化、反硝化、厌氧氨氧化、硝酸盐/亚硝酸盐异化还原(DNRA)、同化以及矿化等环节。
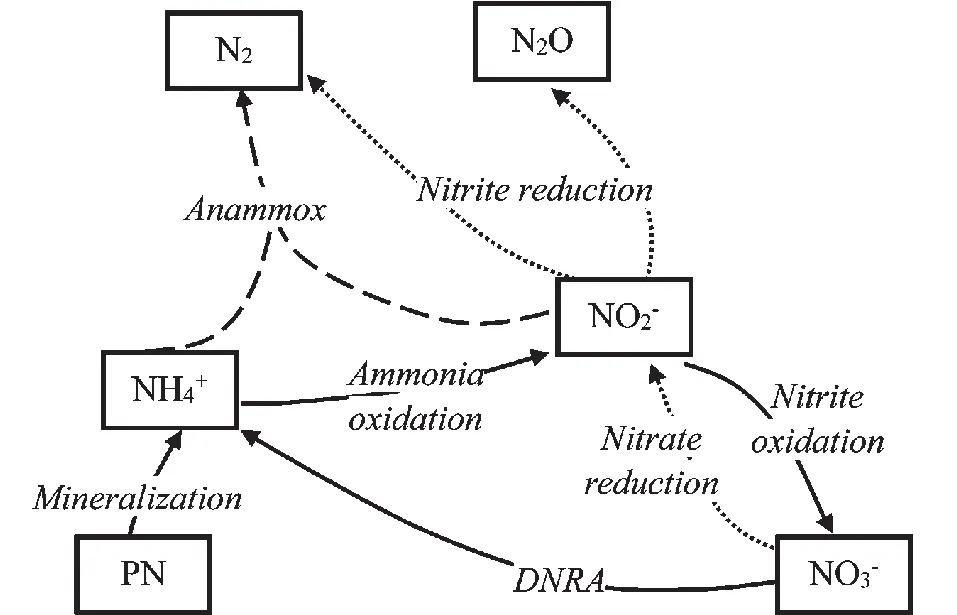
图 海洋低氧环境下氮循环主要过程Fig. The main process of nitrogen cycling in hypoxic ocean

反应过程功能基因反硝化作用NO-3还原narG、napANO-2还原nirS、nirKNO还原norBN2O还原nosZ厌氧氨氧化作用nirS、bzo硝化作用氨氧化amo、haoNO-2氧化nxr
2.1 反硝化作用
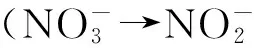
虽然厌氧氨氧化作用对氮损失贡献的确很大,但反硝化作用仍然是低氧区的氮损失重要途径,在一些区域内反硝化仍占主导地位[11~13]。有学者利用15N示踪法在研究了南太平洋东部的智利和秘鲁沿岸海域的N2O和N2的来源,发现72%的N2是由反硝化作用产生的[12]。
反硝化作用可以削减无机氮盐在海洋生态系统中的过度沉积,对海洋生态系统的稳定发挥着重要作用[14],同时反硝化作用对海洋N2O释放的巨大贡献力也加剧了温室效应[15-16]。
2.2 厌氧氨氧化
Kuypers等学者利用分子生物学技术、15N示踪技术以及梯烷脂分析等方法第一次在黑海低氧区发现了厌氧氨氧化作用,并且验证了厌氧氨氧化细菌与脱氮有直接联系[18]。有学者利用15N示踪技术和分子生物学技术分析了南太平洋东部低氧区中的氮循环微生物的垂向分布,定量PCR结果显示低氧核心区域厌氧氨氧化细菌占主导地位,其中Kuenenia属厌氧氨氧化菌stuttgartiensis占总RNA的7.9%[19],15N示踪结果检测到了厌氧氨氧化活动而未检测到反硝化作用[21],说明在南太平洋东部的低氧核心区厌氧氨氧化作用要大于反硝化作用。相同的情况在阿拉伯海也被发现,Scalindua属厌氧氨氧化细菌在低氧核心区占较高优势[22]。
2.3 硝化作用
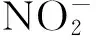
氨氧化反应是硝化作用的限速步骤,本质上是由氨单加氧酶(amo)催化完成的生化反应。在早期的研究中由于技术手段的有限,长期分离培养出的硝化微生物都是好氧自养型的变形菌纲中β-和γ-变形杆菌亚门[23],以致认为氨氧化细菌(AOB)是氨氧化过程的主要微生物。然而随着测序技术的发展,学者发现海洋泉古菌中也存在氨单加氧酶的编码基因amoA序列[24]。这促使学者们逐渐开始关注古菌在硝化作用中的贡献,发现氨氧化古菌(AOA)在自然界中广泛存在,且AOA在氮循环中也起着重要作用[25~27]。
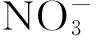
3 影响氮循环的因素
3.1 溶解氧
学者在以厌氧氨氧化为主的黑海低氧区研究发现,在3.5μM~8μM的DO条件下,厌氧氨氧化酶降低了30%~50%的活性,直到13.5μM时才被完全抑制[31]。也有其他的研究表明厌氧氨氧化对氧的耐受性在1~10μM[32]。最近研究发现反硝化作用对氧有较低的耐受性,半数抑制浓度(IC50)为0.3μM,而硝酸盐还原作用有较高的氧耐受性(4~20μM)。
而相对于这些厌氧过程,DO对硝化作用的限制性较弱。当DO≤1μM时,氨氧化作用仍能达到最大氨氧化速率的50%[32],而亚硝酸盐氧化速率为DO>10μM条件下的36%~59%[33]。
这些厌氧和好氧氮循环过程对氧的耐受能力,主要源于参与反应的微生物的不同特性。
3.2 有机质
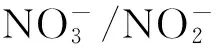
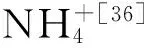
3.3 海水酸化
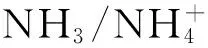
4 问题与展望
海洋低氧问题的加剧逐渐引起众多学者的关注,对海洋低氧环境下氮循环过程的研究也在不断深入,本文总结了海洋低氧环境下的关键过程的一些研究成果,并讨论低氧环境下影响氮循环的主要因素,但仍然存在很多需要讨论和解决的问题。
(1)海洋低氧环境的形成机制复杂,涉及物理、化学以及生物等诸多方面,无机氮、温度、盐度和水动力条件等都可能对低氧环境下的氮循环过程产生影响,这些因素对氮循环过程的影响有待进一步深入研究。
(2)反硝化与厌氧氨氧化都是海洋低氧环境下的重要脱氮过程,而何种情况下哪种反应机制占主导仍然不清楚,这两者之间的关系与生态位有待利用新的技术与方法去研究。
(3)目前对低氧环境下的氮循环过程研究技术和方法主要有同位素标记法、分子生物技术以及生物标志物,这些技术与方法都具有一定的适用范围和准确度,如何进一步改进研究方法以及发掘新的技术,有利于更加全面系统的研究海洋低氧环境下的氮循环过程。
(4)海洋低氧环境下氮循环过程也会影响其他生源要素的生物地球化学循环过程,比如碳、硫、铁等要素,加强不同要素的迁移转化之间的联系,有助于更好的理解海洋生物地球化学循环。
(5)我国近岸海域也不同程度的出现季节性低氧现象,对沿海水生态环境健康造成威胁,我国海域辽阔,进一步加强对我国海洋低氧环境以及生源要素的生物地球化学循环过程的研究,有助于对我国海洋环境的保护与管理。
[1] Deutsch C, Brix H, Ito T, et al. Climate-Forced Variability of Ocean Hypoxia [J].Science, 2011, 333(6040): 336-339.
[2] Gray J S, Wu R S, Or Y Y, et al. Effects of hypoxia and organic enrichment on the coastal marine environment [J].MarineEcologyProgressSeries, 2002,238(1): 249-279.
[3] Helly J J, Levin L A. Global distribution of naturally occurring marine hypoxia on continental margins[J]. Deep-sea Research Part I-oceanographic Research Papers, 2004, 51(9): 1159-1168.
[4] Paulmier A, Ruiz-Pino D. Oxygen minimum zones (OMZs) in the modern ocean [J].ProgressinOceanography, 2009, 80(3): 113-128.
[5] Reed D C, Harrison J A. Linking nutrient loading and oxygen in the coastal ocean: A new global scale model [J].GlobalBiogeochemicalCycles, 2016, 30(3): 447-459.
[6] Yang S, Gruber N. The anthropogenic perturbation of the marine nitrogen cycle by atmospheric deposition: Nitrogen cycle feedbacks and the 15N Haber‐Bosch effect [J].GlobalBiogeochemicalCycles, 2016, 30(10): 1418-1440.
[7] Diaz R J, Rosenberg R. Spreading dead zones and consequences for marine ecosystems.Science. 2008, 321(5891):926-9.
[8]Gruber N, Galloway J N. An Earth-system perspective of the global nitrogen cycle [J].Nature, 2008, 451(7176): 293-296.
[9] Zehr J P, Kudela R M. Nitrogen cycle of the open ocean: from genes to ecosystems [J].AnnualReviewofMarineScience, 2011, 3: 197-225.
[10] Yu S, Yao P, Liu J, et al. Diversity, Abundance, and Niche Differentiation of Ammonia-Oxidizing Prokaryotes in Mud Deposits of the Eastern China Marginal Seas [J].Frontiersinmicrobiology, 2016, 7(137):137.
[11] Bulow S E, Rich J J, Naik H S, et al. Denitrification exceeds anammox as a nitrogen loss pathway in the Arabian Sea oxygen minimum zone [J].DeepSeaResearchPartI:OceanographicResearchPapers, 2010, 57(3): 384-393.
[12] Dalsgaard T, Thamdrup B, Farías L, et al. Anammox and denitrification in the oxygen minimum zone of the eastern South Pacific [J].LimnologyandOceanography, 2012, 57(5): 1331-1346.
[13] Castro-González M, Farías L. The influence of anoxia and substrate availability on N2O cycling by denitrification in the upper boundary of the oxygen minimum zone off northern Chile [J].JournalofMarineResearch, 2015, 73(6): 185-205.
[14] Saggar S, Jha N, Deslippe J, et al. Denitrification and N 2 O: N 2 production in temperate grasslands: processes, measurements, modelling and mitigating negative impacts [J].ScienceoftheTotalEnvironment, 2013, 465: 173-195.
[15] Zhou Y, Lim M, Harjono S, et al. Nitrous oxide emission by denitrifying phosphorus removal culture using polyhydroxyalkanoates as carbon source [J].JournalofEnvironmentalSciences, 2012, 24(9): 1616-1623.
[16] Wang Q, Jiang G, Ye L, et al. Heterotrophic denitrification plays an important role in N 2 O production from nitritation reactors treating anaerobic sludge digestion liquor [J].WaterResearch, 2014, 62: 202-210.
[17] Quan Z X, Rhee S K, Zuo J E, et al. Diversity of ammonium‐oxidizing bacteria in a granular sludge anaerobic ammonium‐oxidizing (anammox) reactor [J].EnvironmentalMicrobiology, 2008, 10(11): 3130-3139.
[18] Kuypers M M M, Sliekers A O, Lavik G, et al. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea [J].Nature, 2003, 422(6932): 608-611.
[19] Stewart F J, Ulloa O, DeLong E F. Microbial metatranscriptomics in a permanent marine oxygen minimum zone [J].Environmentalmicrobiology, 2012, 14(1): 23-40.
[20] Jensen M M, Lam P, Revsbech N P, et al. Intensive nitrogen loss over the Omani Shelf due to anammox coupled with dissimilatory nitrite reduction to ammonium [J].TheISMEjournal, 2011, 5(10): 1660-1670.
[21] Lam P, Lavik G, Jensen M M, et al. Revising the nitrogen cycle in the Peruvian oxygen minimum zone [J].ProceedingsoftheNationalAcademyofSciences, 2009, 106(12): 4752-4757.
[22] Lüke C, Speth D R, Kox M A R, et al. Metagenomic analysis of nitrogen and methane cycling in the Arabian Sea oxygen minimum zone [J].PeerJ, 2016, 4(4): e1924.
[23] Head I M, Hiorns W D, Embley T M, et al. The phylogeny of autotrophic ammonia-oxidizing bacteria as determined by analysis of 16S ribosomal RNA gene sequences [J].Microbiology, 1993, 139(6): 1147-1153.
[24] Venter J C, Remington K, Heidelberg J F, et al. Environmental genome shotgun sequencing of the Sargasso Sea [J].Science, 2004, 304(5667): 66-74.
[25] Lam P, Jensen M M, Lavik G, et al. Linking crenarchaeal and bacterial nitrification to anammox in the Black Sea [J].ProceedingsoftheNationalAcademyofSciences, 2007, 104(17): 7104-7109.
[26] Dang H, Luan X W, Chen R, et al. Diversity, abundance and distribution of amoA-encoding archaea in deep-sea methane seep sediments of the Okhotsk Sea [J].FEMSmicrobiologyecology, 2010, 72(3): 370-385.
[27] Meng H, Katayama Y, Gu J D. More wide occurrence and dominance of ammonia-oxidizing archaea than bacteria at three Angkor sandstone temples of Bayon, Phnom Krom and Wat Athvea in Cambodia [J].InternationalBiodeterioration&Biodegradation, 2017, 117: 78-88.
[28] Ostrom N E, Russ M E, Popp B, et al. Mechanisms of nitrous oxide production in the subtropical North Pacific based on determinations of the isotopic abundances of nitrous oxide and di-oxygen [J].Chemosphere-GlobalChangeScience, 2000, 2(3): 281-290.
[29] Popp B N, Westley M B, Toyoda S, et al. Nitrogen and oxygen isotopomeric constraints on the origins and sea‐to‐air flux of N2O in the oligotrophic subtropical North Pacific gyre [J].GlobalBiogeochemicalCycles, 2002, 16(4):12-1-12-10.
[30] Santoro A E, Buchwald C, McIlvin M R, et al. Isotopic signature of N2O produced by marine ammonia-oxidizing archaea [J].Science, 2011, 333(6047): 1282-1285.
[31] Jensen M M, Kuypers M M M, Gaute L, et al. Rates and regulation of anaerobic ammonium oxidation and denitrification in the Black Sea [J].LimnologyandOceanography, 2008, 53(1): 23-36.
[32] Kalvelage T, Jensen M M, Contreras S, et al. Oxygen sensitivity of anammox and coupled N-cycle processes in oxygen minimum zones [J].PLoSOne, 2011, 6(12): e29299.
[33] Füssel J, Lam P, Lavik G, et al. Nitrite oxidation in the Namibian oxygen minimum zone [J].TheISMEjournal, 2012, 6(6): 1200-1209.
[34] Ward B B, Tuit C B, Jayakumar A, et al. Organic carbon, and not copper, controls denitrification in oxygen minimum zones of the ocean [J].DeepSeaResearchPartI:OceanographicResearchPapers, 2008, 55(12): 1672-1683.
[35] Kalvelage T, Lavik G, Lam P, et al. Nitrogen cycling driven by organic matter export in the South Pacific oxygen minimum zone [J].Naturegeoscience, 2013, 6(3): 228-234.
[36] Thamdrup B, Dalsgaard T, Jensen M M, et al. Anaerobic ammonium oxidation in the oxygen‐deficient waters off northern Chile [J].LimnologyandOceanography, 2006, 51(5): 2145-2156.
[37] Zeebe R E, Wolf-Gladrow D A. CO2 in seawater: equilibrium, kinetics, isotopes [M].GulfProfessionalPublishing, 2001.
[38] Qin W, Amin S A, Martens-Habbena W, et al. Marine ammonia-oxidizing archaeal isolates display obligate mixotrophy and wide ecotypic variation [J].ProceedingsoftheNationalAcademyofSciences, 2014, 111(34): 12504-12509.
[39] Beman J M, Chow C T, King A L, et al. Global declines in oceanic nitrification rates as a consequence of ocean acidification [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2011, 108(1): 208-213.
Research Progress of Nitrogen Cycling in Hypoxic Ocean
XU Yao-fei1,2,RUAN Ai-dong1,2,LIU Hao1,2
(1.StateKeyLaboratoryofHydrology-WaterResources&HydraulicEngineering,HohaiUniversity,Nanjing210098,China;2.CollegeofHydrology&WaterResources,HoHaiUniversity,Nanjing210098,China)
The growing marine hypoxia has been observed in recent decades resulted from anthropogenic activities and natural factors. The low oxygen conditions can greatly influence biogeochemical cycles of biogenic elements in the ocean, such as nitrogen cycling. The main processes of nitrogen cycling in low oxygen conditions are discussed, including denitrification, anaerobic ammonium oxidation and nitrification. The key factors that may affect the nitrogen cycling processes are also discussed.
Ocean;low oxygen zone;nitrogen cycling;redox;microbes
2017-02-17
国家自然科学基金项目“烟草薄片废水处理系统中烟碱的微生物降解机理与调控机制研究”(51378175)。
徐耀飞(1991-),男,江苏宜兴人,河海大学生态水利学专业2014级在读硕士研究生.主要研究方向为水环境微生物学。
阮爱华,ladruar@hhu.edu.cn。
X132
A
1001-3644(2017)03-0162-05
