尿素对肌原纤维蛋白热诱导凝胶非共价键作用力及特性的影响
2017-06-29杨玉玲王静宇张自业
张 兴,杨玉玲*,王静宇,张自业
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
尿素对肌原纤维蛋白热诱导凝胶非共价键作用力及特性的影响
张 兴,杨玉玲*,王静宇,张自业
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
研究尿素对肌原纤维蛋白凝胶非共价键作用力和特性的影响及其调控机制,揭示凝胶作用力和特性之间的关系,并探讨通过添加尿素研究凝胶氢键和疏水作用方法的科学性。分别用0.0~0.4 mol/L尿素处理肌原纤维蛋白并加热制成凝胶,用Zeta电位仪测定其静电相互作用;利用拉曼光谱仪测定其疏水相互作用与氢键;用离心法和质构仪测定相应尿素浓度条件下热诱导凝胶的保水性、硬度和弹性。结果表明,随着尿素浓度增大,热诱导凝胶的Zeta电位绝对值由7.83 mV下降到5.55 mV;S0-ANS从698.5逐渐增大到885.3;I760cm-1/I1003cm-1由0.957 1降到0.849 3;I850cm-1/I830cm-1先下降后上升;随着尿素浓度增大,凝胶保水性、硬度和弹性都存在下降的现象。相关性分析表明静电相互作用、表面疏水性和疏水相互作用显著影响肌原纤维蛋白热诱导凝胶保水性和质构特性。
肌原纤维蛋白凝胶;尿素;静电相互作用;疏水相互作用;氢键
肌原纤维蛋白凝胶网络形成是蛋白质分子之间吸引力和排斥力达到均衡的结果,形成和维持凝胶网状结构的作用力主要是疏水相互作用、氢键、静电相互作用、二硫键等[1]。凝胶的作用力决定着凝胶特性。尿素可作为食品中的配方助剂,用于由酵母发酵的焙烤制品、含醇饮料和凝胶制品,通过添加尿素改变蛋白质凝胶特性来研究凝胶中氢键和疏水相互作用是一种传统的研究凝胶作用力的方法。Ustunol等[2]通过添加尿素后测定肌原纤维蛋白-藻酸钙混合凝胶强度对凝胶作用力进行了研究,认为氢键和疏水相互作用是混合凝胶网络中主要的作用力。Ni Na等[3]分别通过添加0.6 mol/L NaCl、0.6 mol/L NaCl+1.5 mol/L尿素和0.6 mol/L NaCl+8 mol/L尿素,计算溶解度的差值来表示氢键和疏水相互作用的大小。
蛋白质中的苯丙氨酸和色氨酸在拉曼光谱中的特征谱峰分别在1 003 cm-1和760 cm-1处,能反映微环境中疏水相互作用的变化[4-5]。酪氨酸残基在拉曼光谱的830 cm-1和850 cm-1处存在的两个谱峰,能反映蛋白凝胶氢键的变化[6]。拉曼光谱法可以从分子水平定性定量分析蛋白质的功能基团,无损测量蛋白结构,且不受水影响。Zhang Ziye等[7]利用拉曼光谱法对肌原纤维蛋白凝胶作用力进行了研究。蛋白质的保水性对肉的嫩度、多汁性和色泽都有很大影响,是评价肉和肉制品的一项重要指标[8],有人研究了pH值对凝胶保水性、硬度的影响[9],但保水性、质构特性与作用力的关系鲜有明确报道。
传统的研究凝胶氢键和疏水相互作用的方法一般是通过添加尿素后测定凝胶的硬度、贮能模量等特性的方式间接完成的。氢键难以量化测定,直接测定凝胶氢键的方法极少,导致凝胶特性和作用力之间的关系并不明确。虽然理论上添加低浓度的尿素能改变凝胶氢键作用,高浓度时改变凝胶的疏水作用力。但这种方法和观点的科学性有待进一步证实。
本研究在添加不同浓度尿素的条件下利用Zeta电位仪、拉曼光谱仪、质构仪和离心法直接测定肌原纤维蛋白凝胶的静电相互作用、疏水作用、氢键、硬度、弹性和保水性、不仅能准确反映添加尿素对肌原纤维蛋白凝胶作用力和特性的影响,也能明确凝胶作用力与特性的关系,探讨和检验传统的通过添加尿素后测定凝胶特性进而研究凝胶氢键作用和疏水相互作用方法的科学性,为凝胶特性的控制提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
活AA鸡(40 日龄)30 只,其中母鸡和公鸡各15 只,购于南京青龙山养鸡场,宰杀、取鸡胸肉,于-18 ℃贮存。
实验所用化学试剂均为国产分析纯。
1.2 仪器与设备
Avanti J-26XP高效冷冻离心机 美国Beckman Coulter公司;DS-1高速组织捣碎机 上海标本模型厂;F700型荧光分光光度计 日本日立公司;Zetasizer Nano ZS Zeta电位分析仪 英国马尔文公司;LABRAM800激光拉曼光谱仪 法国JY公司;TA-XT Plus质构仪英国Stable Micro System公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
鸡胸肉于4 ℃条件下解冻20 min,剔除结缔组织和脂肪,切碎后用于提取鸡胸肉肌原纤维蛋白,蛋白提取和质量浓度测定详见Zhang Ziye等[10]的方法。4 ℃条件下保存。
1.3.2 尿素处理肌原纤维蛋白热诱导凝胶的制备
用磷酸盐缓冲液(0.6 mol/L KCl、10 mmol/L K2HPO4,pH 6.0)溶解肌原纤维蛋白沉淀,分别添加0.0、0.1、0.2、0.3、0.4 mol/L的尿素,制备60、30、1 mg/mL的肌原纤维蛋白溶液、水浴加热至65 ℃(1 ℃/min)制成凝胶,保温20 min,取出,自然冷却,并在4 ℃条件下保存9~16 h,分别用于测定其静电相互作用、氢键、疏水相互作用、保水性和质构特性。
1.3.3 静电相互作用的测定
将1 mg/mL的肌原纤维蛋白凝胶样品注入Zeta电位仪后,盖上塞子,进行电位测试。测试参数:散射角:90°,平衡时间:60 s,测试温度:25 ℃。每个样品共3 个重复。
1.3.4 凝胶表面疏水作用测定
将不同浓度尿素处理的肌原纤维蛋白分散于磷酸盐缓冲液(0.6 mol/L KCl、10 mmol/L K2HPO4,pH 6.0)中,分别得到质量浓度为0.125、0.250、0.500、1.000 mg/mL的肌原纤维蛋白溶液(pH 6.0、离子强度0.6),分别从25 ℃升温到65 ℃后保温,升温速率1 ℃/min,热处理时间均为60 min,加热结束后,冰浴15 min。各取2 mL,加入10 μL含8 mmol/L 8-氨基-1-萘磺酸(8-amino-1-naphthalene sulphonic acid,ANS)、0.1 mol/L K2HPO4的缓冲液(pH 7.0),混匀,黑暗中静置10 min后用于测定表面疏水性,荧光分光光度计的激发波长为374 nm,发射波长为485 nm。以荧光强度对蛋白浓度作曲线,曲线初始阶段的斜率即为蛋白质的表面疏水性指标(S0-ANS)。每个样品共3 个重复。
1.3.5 拉曼光谱的测定
取适量肌原纤维蛋白凝胶样品(60 mg/mL),用激光拉曼光谱仪进行测量,激发波长514.5 nm;激光出射功率:10 mW;显微物镜:50倍长焦距;光栅:600;狭缝:200 μm;积分时间:60 s;重复3 次累加得谱。拉曼光谱测试完成后用仪器自带的软件Labspec对光谱进行平滑,多点基线校正去除荧光背景。以苯丙氨酸环在1 003 cm-1伸缩振动的强度作为内标;以色氨酸疏水残基的760 cm-1处的归一化强度反映凝胶的疏水相互作用,酪氨酸残基双峰的比值即I850cm-1/I830cm-1值反映蛋白凝胶中的氢键的暴露和包埋情况[6]。
1.3.6 凝胶保水性的测定
参考Kocher等[11]的方法。将制备好的肌原纤维蛋白凝胶(30 mg/mL)与离心管称质量(记为m1),于4 ℃条件下经10 000×g离心10 min,去除上清液,记录离心后凝胶与离心管的质量(记为m2),离心管的质量(记为m)。根据以下公式计算凝胶保水性(water holding capacity,WHC),每个样品共3 个重复。
1.3.7 凝胶质构特性的测定
采用TA-XT Plus型质构仪的质构特性分析(texture profile analyse,TPA)法测定肌原纤维蛋白凝胶(30 mg/mL)的硬度,参数设置如下:选用P/6探头,测试前速率5 mm/s,测试中速率1 mm/s,测试后速率5 mm/s,探头探入距离为5 mm。每个样品共3 个重复。1.4 统计分析
用SPSS 17.0软件进行相关性分析和方差分析,如果方差分析效应显著,使用Duncan多范围检验进行多重比较。
2 结果与分析
2.1 尿素对肌原纤维蛋白凝胶静电相互作用的影响
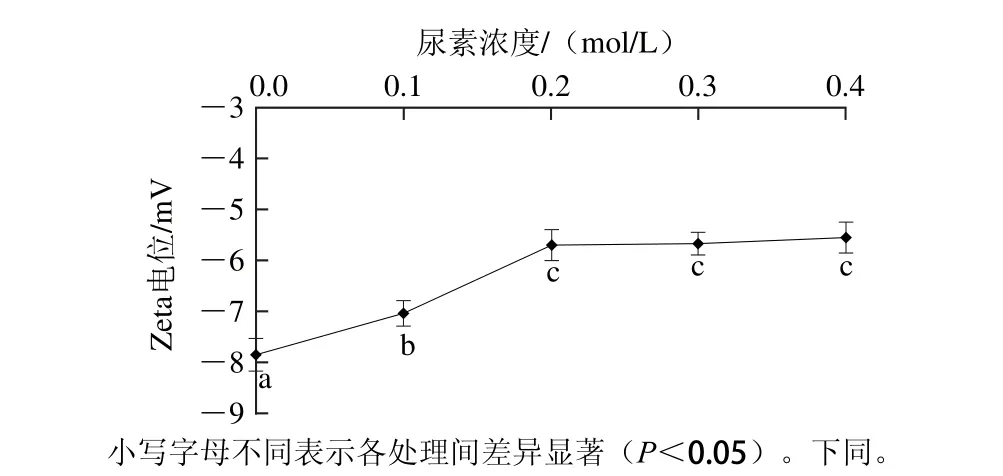
图1 尿素对肌原纤维蛋白凝胶Zeta电位的影响Fig. 1 Effect of urea on zeta potential of heat-induced myofibrillar protein gel
Zeta电位是带电颗粒表面剪切层的电位,是表征胶体体系稳定性的重要指标,用于描述胶体颗粒之间的静电相互作用[12-13]。由图1可见,肌原纤维蛋白在0.1~0.2 mol/L尿素处理后,其热诱导凝胶Zeta电位绝对值随着尿素浓度的增大而显著降低(P<0.05),超过0.2 mol/L后凝胶的Zeta电位变化差异不显著(P>0.05),凝胶电位绝对值在尿素浓度0.4 mol/L时达到最低,为5.55 mV。蛋白质分子中几乎所有的带电基团分布在蛋白分子表面。静电相互作用通常在蛋白聚集过程中表现为相互斥力,Zeta电位为负值,表明肌原纤维蛋白呈负电荷。肌原纤维蛋白在尿素的处理下其凝胶Zeta电位绝对值降低,表明随尿素浓度增大,蛋白凝胶表面负电荷数量显著减少,静电斥力逐渐下降,尿素可以部分转变为氰酸盐、氨等,而蛋白质的氨基酸能够与氰酸盐反应从而降低蛋白质的表面电荷分布。尿素浓度达到0.2 mol/L时电位值趋于稳定,尿素屏蔽电荷作用达到饱和,静电斥力不再降低。静电相互作用在肌原纤维蛋白凝胶网络结构的形成起着重要作用。Hamada等[14]用Zeta电位仪测得胶体(如蛋白)在高电位(正或负)时可能比低电位更稳定,更有利于蛋白分子聚集和凝结。当悬浮液中存在的蛋白分子携带大量电荷,即具有较大的正或负的Zeta电位,它们将倾向于互相排斥,不会发生絮凝。当分子的Zeta电位较低时,蛋白分子会相互接近并发生絮凝从而影响肌原纤维蛋白凝胶网络结构的形成,改变凝胶特性。
2.2 尿素对肌原纤维蛋白凝胶表面疏水性和疏水相互作用的影响
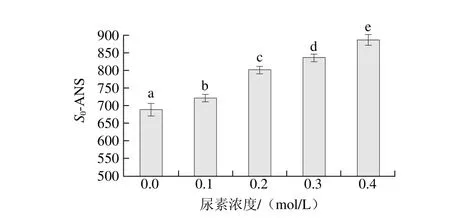
图2 尿素对肌原纤维蛋白凝胶表面疏水性的影响Fig. 2 Effect of urea on surface hydrophobicity of heat-induced myofibrillar protein gel
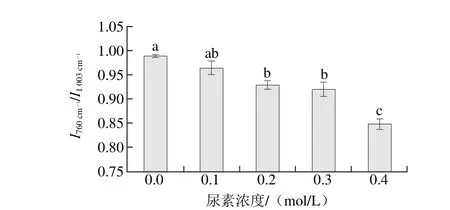
处条带强度随尿素浓度的变化Fig. 3 Normalized intensity of the 760 cm-1band as a function of urea concentration图3 归一化的760 cm-1
由图2可以看出,尿素浓度增大到0.4 mol/L,其肌原纤维蛋白凝胶的表面疏水性指标S0-ANS从698.5逐渐增大到885.3(P<0.05)。ANS是常见的阴离子探针,与暴露出的蛋白疏水基团结合以此来表征分子表面疏水性强弱[7],S0-ANS增大表明肌原纤维蛋白分子暴露出的疏水基团减少,表面疏水性减小。用拉曼光谱法测定的肌原纤维蛋白凝胶间疏水相互作用结果如图3所示,肌原纤维蛋白在0.1~0.4 mol/L尿素处理后其热诱导凝胶760 cm-1处归一化强度I760cm-1 /I1003cm-1随着尿素浓度的增大呈下降的趋势,在尿素浓度0.4 mol/L时凝胶的I760cm-1/I1003cm-1较0.1 mol/L时出现显著下降(P<0.05),0.2 mol/L和0.3 mol/L之间I760cm-1/I1003cm-1差异不显著(P>0.05),在0.4 mol/L时I760cm-1 / I1003cm-1降到最低为0.849 3。肌原纤维蛋白凝胶分子间疏水相互作用减弱表明疏水基团之间的结合减少,疏水基团埋藏的数量降低,暴露出疏水基团增多。用两种方法测得的凝胶疏水性基团变化趋势一致。
尿素主要破坏蛋白的疏水键而并非只破坏蛋白分子内和分子间的氢键[15]。蛋白分子疏水残基在高浓度尿素的影响下暴露情况受到增强,蛋白分子充分地展开,从而导致疏水相互作用力降低。同时尿素结合了蛋白质的肽键,破坏了蛋白质原有的二级结构,并通过对蛋白质分子去水化,削弱了疏水相互作用[16]。尿素同时可改变水的结构和动态,减少水对蛋白的疏水作用,促进疏水基团的溶剂化,从而降低疏水相互作用[17]。本实验中肌原纤维蛋白凝胶疏水相互作用随尿素浓度增大而减弱,疏水基团暴露增多,尿素通过与蛋白分子内氨基酸的结合破坏二级结构以及去水化作用来削弱疏水相互作用。
2.3 尿素对肌原纤维蛋白凝胶氢键的影响

表1 尿素对肌原纤维蛋白凝胶I850cm-1/I830 cm-1、N暴露和N包埋的影响Table 1 Effect of urea onI850cm-1/I830 cm-1ratio and molar fractions of exposed and buried tyrosine residues in myofibrillar protein
I850cm-1/I830cm-1可以反映苯环上—OH是与溶剂水分子生成氢键(“暴露”式)还是与蛋白质分子其他残基—COOH生成氢键(“埋藏”式)[6-7,10,18]。比值I850cm-1/I830cm-1≥1.25,说明酪氨酸残基是完全暴露在水环境或者极性环境中,如果I850cm-1/I830cm-1≤0.5,表明酪氨酸残基处在一个包埋的疏水环境中或者作为强氢键的供体状态中。比值在0.5~1.25之间,则表明一部分酪氨酸残基属于“暴露”式,一部分是“包埋”式的[6-7,10,19]。
由表1可知,与对照样I850cm-1/I830cm-1为1.014 7相比,I850cm-1/I830cm-1在添加0.1 mol/L的尿素时下降到0.993 0(P<0.05),随着尿素浓度的进一步增大(0.2~0.3 mol/L),比值逐渐上升,在尿素浓度0.4 mol/L达到最大值,为1.024 7(P<0.05)。与N暴露的变化趋势一致。表明酪氨酸暴露情况呈现先下降后上升的趋势,酪氨酸残基肌原纤维蛋白分子苯环上的—OH基团与其他残基—COOH生成的氢键逐渐转变为与溶剂水分子生成的氢键,蛋白分子间的氢键作用随尿素浓度增大而减弱,证明尿素破坏蛋白分子间的氢键。Zou Qin[20]也同样得出尿素通过直接与多肽链上酰胺单元结合形成氢键而使蛋白质变性的结论。
Hua Lan等[21]认为高浓度尿素条件下尿素先破坏蛋白与水之间的氢键作用,再破坏蛋白分子内的氢键。当尿素浓度较高时,尿素破坏蛋白质分子间氢键,同时削弱疏水相互作用,蛋白质被诱导成为极度伸展的状态,分子行为趋于无规卷曲[22]。从而推测尿素作用蛋白的机理可能是先少量破坏蛋白与水之间的氢键作用,再与蛋白分子内部的氨基酸结合,破坏蛋白分子内的氢键,从而破坏蛋白的二级结构,使蛋白变性。
2.4 尿素对肌原纤维蛋白凝胶硬度和弹性的影响
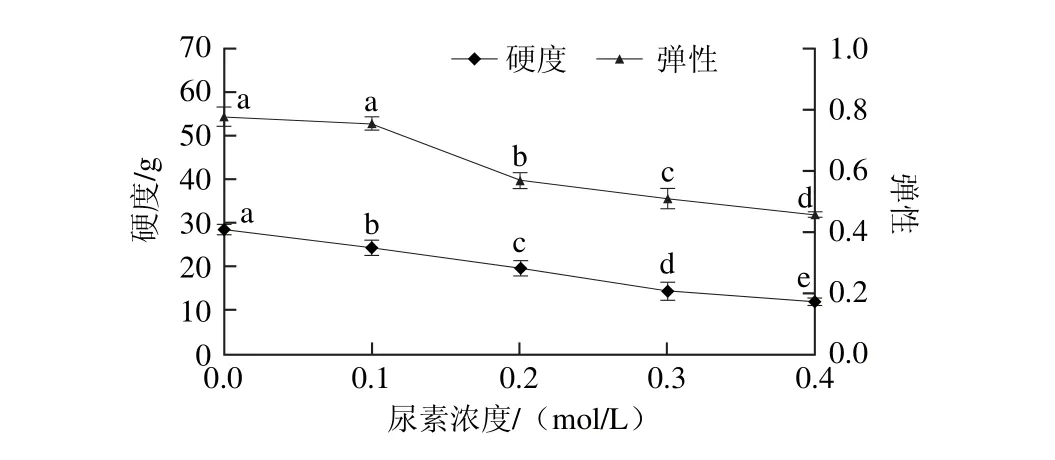
图4 尿素对肌原纤维蛋白凝胶硬度和弹性的影响Fig. 4 Effect of urea on hardness and springiness of heat-induced myofibrillar protein gel
不同尿素浓度对肌原纤维蛋白凝胶质构特性的影响如图4所示,肌原纤维蛋白在0.0~0.4 mol/L尿素的处理下,其热诱导凝胶硬度发生显著下降(P<0.05),空白组的凝胶硬度最大,为28.57 g;在尿素达到0.4 mol/L时,硬度最小,为12.2 g。尿素浓度从0.0 mol/L增加到0.1 mol/L,其凝胶弹性没有显著性变化(P>0.05);尿素浓度进一步增大(≥0.2 mol/L),凝胶弹性显著下降,在尿素浓度达到0.4 mol/L时,弹性最小,为0.457。肌原纤维蛋白凝胶硬度和弹性的变化趋势与文献报道相似[23]。Lefevre等[24]利用应变振动测试证明维持肌原纤维蛋白硬度的主要作用力是静电增强的疏水作用和二硫键作用。尿素通过破坏分子内氢键和分子间氢键,同时很大程度削弱了蛋白之间的疏水相互作用,蛋白之间的结合程度减弱,引起其凝胶硬度和弹性的降低。
2.5 尿素对肌原纤维蛋白凝胶保水性的影响
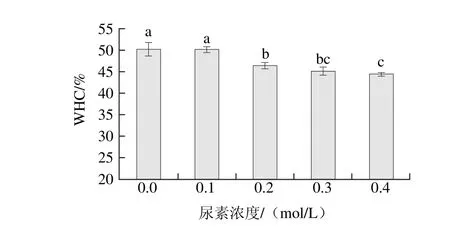
图5 尿素对肌原纤维蛋白凝胶保水性的影响Fig. 5 Effect of urea on WHC of heat-induced myofibrillar protein gel
由图5可见,尿素浓度在0.1 mol/L时,肌原纤维蛋白凝胶的保水性为49.77%,与空白组相比基本没有显著性变化(P>0.05)。尿素浓度从0.2 mol/L增大到0.4 mol/L,凝胶保水性显著降低,最终下降到45.35%(P<0.05)。肌原纤维蛋白热诱导凝胶形成过程中,蛋白先经过变性再通过互相交联形成有序的三维网状结构,并把水分包含在其中[25]。低浓度尿素主要破坏蛋白质三级结构使肽链伸展,高浓度时则严重破坏蛋白质二级结构。尿素破坏蛋白质分子间氢键和疏水相互作用,减弱蛋白与水分子的结合,同时由氢键和疏水作用维持的凝胶网络结构变得不稳定,网格胶孔中束缚水的能力减弱,从而降低了凝胶的保水性。高静电斥力条件下,使得肌原纤维蛋白结构变得松散、膨胀,并且电荷增加意味着能结合水分子的氢键结合位点增加,从而使更多的水保留在凝胶中[26-28]。本实验中肌原纤维蛋白凝胶的保水性随着尿素浓度增大与凝胶静电相互作用力降低而显著降低,这是因为当蛋白分子表面净相同电荷较少时,蛋白分子间的静电斥力降低,分子间相互接近并发生絮凝,形成的凝胶网络结构中胶孔数下降且孔径更小,无法容纳更多的水分;同时由于蛋白质分子所带的负电荷减少,蛋白质与水分子间通过偶极-离子作用结合的水分子显著减少;因此凝胶的静电作用降低是凝胶保水性降低的最主要原因。另外尿素导致结合水分子的氢键结合位点减少,蛋白和水形成氢键的能力降低,也使得凝胶的保水性降低。
2.6 相关性分析
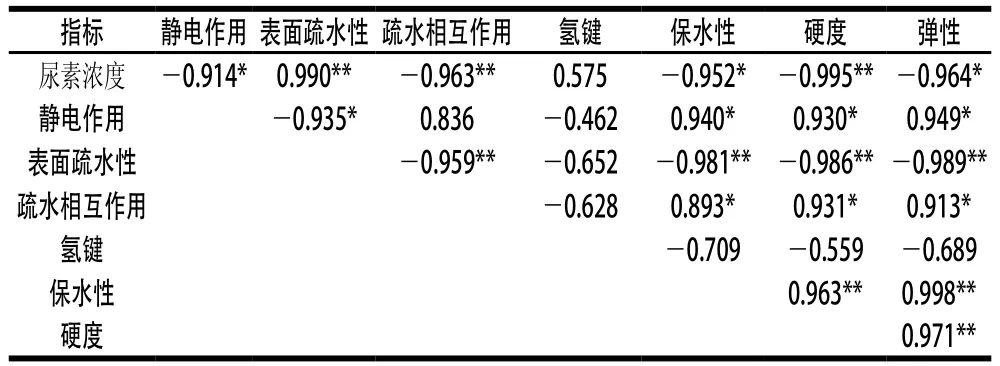
表2 肌原纤维蛋白凝胶非共价作用力、特性与尿素浓度之间的相关性Table 2 Correlation of non-covalent intermolecular forces and properties of heat-induced myofibrillar protein gel with urea concentration
由表2可见,尿素浓度与凝胶静电作用、表面疏水性、疏水相互作用及凝胶保水性和质构特性显著相关(P<0.05,P<0.01),表明尿素浓度显著影响静电、疏水作用、保水性和质构特性。静电作用和疏水相互作用与凝胶的保水性、硬度和弹性显著相关(P<0.05,P<0.01),表明静电作用和疏水作用是决定肌原纤维蛋白热诱导凝胶保水性和质构特性的主要作用力。疏水相互作用降低导致其与静电作用等共同维持的凝胶网络结构变得不稳定,对凝胶特性产生一定影响。氢键与尿素浓度、保水性、凝胶硬度均无显著相关性(P>0.05),说明低浓度尿素处理对氢键影响较小,其引起的氢键变化也不是导致凝胶保水性、硬度和弹性降低的主要原因。
3 结 论
本研究表明,肌原纤维蛋白在0.0~0.4 mol/L尿素处理下,其热诱导凝胶的静电相互作用和疏水相互作用以及凝胶的保水性、硬度和弹性都有明显下降。用此浓度范围的尿素处理肌原纤维蛋白并没有显著影响凝胶的氢键,而是显著改变了凝胶的静电和疏水相互作用,尿素通过转变为氰酸盐、氨等与蛋白质中的氨基酸反应从而降低其凝胶表面电荷分布,进而降低凝胶的静电作用力;尿素通过与蛋白氨基酸的结合破坏二级结构以及去水化作用来削弱凝胶的疏水相互作用。尿素浓度与静电作用、表面疏水性、疏水相互作用以及保水性、质构特性显著相关,凝胶静电作用降低和蛋白分子间疏水相互作用被破坏是添加尿素导致凝胶保水性、硬度和弹性显著下降的主要原因,也说明凝胶的静电作用和疏水在很大程度上影响凝胶的特性。由此可见凝胶特性由多种非共价键作用力共同影响决定,尿素也显著改变离子之间相互作用,故仅通过添加尿素测定凝胶的某种特性来反映氢键或疏水作用力变化的方法仍有待完善。
[1] OAKENFULL D, PEARCE J, BURLEY R W. Protein gelation: food proteins and their applications[M]. New York: Marcel Dekker, 1997: 111-142.
[2] USTUNOL Z, XIONG Youling L., MEANS W J, et al. Forces involved in mixed pork myofibrillar protein and calcium alginate gels[J]. Journal of Agricultural and Food Chemistry, 1992, 40(4): 577-580. DOI:10.1021/jf00016a009.
[3] NI Na, WANG Zhenyu, HE Fan, et al. Gel properties and molecular forces of lamb myofibrillar protein during heat induction at different pH values[J]. Process Biochemistry, 2014, 49(4): 631-636. DOI:10.1016/j.procbio.2014.01.017.
[4] LINLAUD N, FERRER E, PUPPO M C, et al. Hydrocolloid interaction with water, protein, and starch in wheat dough[J]. Journal of Agricultural and Food Chemistry, 2010, 59(2): 713-719. DOI:10.1021/jf1026197.
[5] NONAKA M, LI C E C Y, NAKAI S. Raman spectroscopic study of thermally induced gelation of whey proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(8): 1176-1181. DOI:10.1021/ jf00032a002.
[6] ZHANG Ziye, YANG Yuling, TANG Xiaozhi, et al. Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel[J]. Food Science and Technology Research, 2015, 21(4): 597-605. DOI:10.3136/fstr.21.597.
[7] ZHANG Z Y, YANG Y L, TANG X Z, et al. Chemical forces and water holding capacity study of heat-induced myofibrillar protein gel as affected by high pressure[J]. Food Chemistry, 2015, 188: 111-118. DOI:10.1016/j.foodchem.2015.04.129.
[8] XIONG Youling L.. Role of myofibrillar proteins in water-binding in brine-enhanced meats[J]. Food Research International, 2005, 38(3): 281-287. DOI:10.1016/j.foodres.2004.03.013.
[9] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170. DOI:10.3864/j.issn.0578-1752.2010.01.019.
[10] ZHANG Ziye, YANG Yuling, TANG Xiaozhi, et al. Chemical forces study of heat-induced myofibrillar protein gel as affected by partial substitution of NaCl with KCl, MgCl2and CaCl2[J]. CyTA-Journal of Food, 2015: 1-9. DOI:10.1080/19476337.2015.1091038.
[11] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science, 1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x.
[12] HUNTER R J. Zeta potential in colloid science: principles and applications[M]. New York: Academic press, 2013: 608.
[13] RUNKANA V, SOMASUNDARAN P, KAPUR P C. Mathematical modeling of polymer-induced flocculation by charge neutralization[J]. Journal of Colloid and Interface Science, 2004, 270(2): 347-358. DOI:10.1016/j.jcis.2003.08.076.
[14] HAMADA M, ISHIZAKI S, NAGAI T. Variation of SH content and kamaboko-gel forming ability of shark muscle protein by electrolysis[J]. Journal of the Shimonoseki University of Fisheries, 1994, 42: 131-135.
[15] KAMOUN P P. Denaturation of globular proteins by urea: breakdown of hydrogen or hydrophobic bonds?[J]. Trends in Biochemical Sciences, 1988, 13(11): 424-425.
[16] WALSTRA P, van VLIET T, AALBERSBERG W Y. Chapter Ⅱ: Functional properties[J]. Progress in Biotechnology, 2003, 23: 9-30.
[17] BENNION B J, DAGGETT V. The molecular basis for the chemical denaturation of proteins by urea[J]. Proceedings of the National Academy of Sciences, 2003, 100(9): 5142-5147. DOI:10.1073/ pnas.0930122100.
[18] IKEDA S, LI-CHAN E C Y. Raman spectroscopy of heat-induced finestranded and particulate β-lactoglobulin gels[J]. Food Hydrocolloids, 2004, 18(3): 489-498. DOI:10.1016/j.foodhyd.2003.07.003.
[19] LIU R, ZHAO S M, XIE B J, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5): 898-906. DOI:10.1016/j.foodhyd.2010.08.016.
[20] ZOU Qin, HABERMANN-ROTTINGHAUS S M, MURPHY K P. Urea effects on protein stability: hydrogen bonding and the hydrophobic effect[J]. Proteins: Structure, Function, and Bioinformatics, 1998, 31(2): 107-115. DOI:1002/(SICI)1097-0134(19980501)31:2<107::AID-PROT1>3.0.CO;2-J.
[21] HUA Lan, ZHOU Ruhong, THIRUMALAI D, et al. Urea denaturation by stronger dispersion interactions with proteins than water implies a 2-stage unfolding[J]. Proceedings of the National Academy of Sciences, 2008, 105(44): 16928-16933. DOI:10.1073/ pnas.0808427105.
[22] TANFORD C. Protein denaturation[J]. Advances in Protein Chemistry, 1968, 23: 121-282. DOI:10.1016/S0065-3233(08)60401-5.
[23] 董秋颖, 杨玉玲, 许婷. 从质构学角度研究肌原纤维蛋白凝胶形成的作用力[J]. 食品与发酵工业, 2009, 35(5): 45-49.
[24] LEFEVRE F, FAUCONNEAU B, OUALI A, et al. Thermal gelation of brown trout myofibrils from white and red muscles: effect of pH and ionic strength[J]. Journal of the Science of Food and Agriculture, 2002, 82(4): 452-463. DOI:10.1002/jsfa.1057.
[25] HAN M Y, ZHANG Y J, FEI Y, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology, 2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[26] OFFER G, KNIGHT P, JEACOCKE R, et al. The structural basis of the water-holding, appearance and toughness of meat and meat products[J]. Food Structure, 1989, 8(1): 151-170.
[27] OFFER G, TRINICK J. On the mechanism of water holding in meat: the swelling and shrinking of myofibrils[J]. Meat Science, 1983, 8(4): 245-281. DOI:10.1016/0309-1740(83)90013-X.
[28] WILDING P, HEDGES N, LILLFORD P J. Salt-induced swelling of meat: the effect of storage time, pH, ion-type and concentration[J]. Meat Science, 1986, 18(1): 55-75. DOI:10.1016/0309-1740(86)90066-5.
Effect of Urea Addition on Non-Covalent Intermolecular Forces and Properties of Heat-Induced Myofibrillar Protein Gel
ZHANG Xing, YANG Yuling*, WANG Jingyu, ZHANG Ziye
(Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
The effect and regulatory mechanism of urea on the properties and non-covalent intermolecular forces of heat-induced myofibrillar protein gel were studied. The relationship between intermolecular forces and gel properties was explored. This study discussed whether urea addition is a scientific method for studying gel hydrogen bonding and hydrophobic interaction. Heat-induced myofibrillar protein gels containing 0.0- 0.4 mol/L urea were prepared. The electrostatic interaction was measured using a zeta potential analyzer. The hydrophobic interaction and hydrogen bonding were measured using a Raman spectrometer. The water-holding capacity, hardness and springiness of the gels were measured by a centrifugation method and a texture analyzer. As urea concentration increased, the absolute value of zeta potential of the gels decreased from 7.83 to 5.55 mV, and the surface hydrophobicity (S0-ANS) of myofibrillar protein increased from 698.5 to 885.3. The I760cm-1/I1003cm-1ratio (normalized intensity) decreased from 0.957 1 to 0.849 3, while the I850 cm-1/I830 cm-1ratio declined first and then increased. The water-holding capacity, hardness and springiness exhibited a declining trend. Correlation analysis showed that electrostatic interaction, surface hydrophobicity and hydrophobic interaction had a significant effect on water-holding capacity and texture characteristics of heat-induced protein gel.
myofibrillar protein gel; urea; electrostatic interaction; hydrophobic interaction; hydrogen bond
10.7506/spkx1002-6630-201711003
TS201.2
A
1002-6630(2017)11-0012-06
张兴, 杨玉玲, 王静宇, 等. 尿素对肌原纤维蛋白热诱导凝胶非共价键作用力及特性的影响[J]. 食品科学, 2017, 38(11): 12-17. DOI:10.7506/spkx1002-6630-201711003. http://www.spkx.net.cn
ZHANG Xing, YANG Yuling, WANG Jingyu, et al. Effect of urea addition on non-covalent intermolecular forces and properties of heat-induced myofibrillar protein gel[J]. Food Science, 2017, 38(11): 12-17. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201711003. http://www.spkx.net.cn
2016-05-29
国家自然科学基金面上项目(31371798);江苏省高校优势学科建设工程项目
张兴(1990—),男,硕士,研究方向为食品大分子结构和功能特性。E-mail:zhangxingnufe@163.com
*通信作者:杨玉玲(1964—),女,教授,博士,研究方向为食品大分子结构和功能特性。E-mail:yulingy@sina.com
