低能量激光击打精子尾部鉴别存活精子中应用
2017-06-28叶明建朱卫中赵恩慧李金美胡晓薇
叶明建 朱卫中赵恩慧 李金美 胡晓薇
浙江省丽水市人民医院生殖中心(浙江丽水 323100)
低能量激光击打精子尾部鉴别存活精子中应用
叶明建 朱卫中*赵恩慧 李金美 胡晓薇
浙江省丽水市人民医院生殖中心(浙江丽水 323100)
目的 验证激光击打法鉴别存活精子的可行性。方法 选用不同脉冲输出时间的激光击打精子尾部的不同位置,观察活精子和死精子的形态变化,评估激光击打效果,选择合适的脉冲输出时间,确定理想的击打部位。采用激光击打法和伊红-苯胺黑活体染色两种方法检测不同来源的精子样本,分析两种方法检出存活精子的结果相关性。结果 采用脉冲输出时间100μs的激光击打精子尾部的3/4位置,可收到较好的击打效果。受低能量激光击打后有90%活精子出现形态变化,其中75%表现为明显变化,5%呈现明显的颈部折角,而死精子形态无任何变化。激光击打法的存活精子检出率与精子活体存活率呈高度正相关(r =0.9925),但前者明显低于后者(P<0.05)。结论 低能量激光击打法是鉴别存活精子简便而有效的方法,但需要注意操作要领。
生殖技术, 辅助; 精子注射, 细胞质内; 精子; 激光
卵胞浆内单精子注射(ICSI)是治疗梗阻性无精子症、重度少精子症及弱精子症的重要方法,而如何在不动精子中鉴别和选择存活精子是施行ICSI的技术难题。文献报道,用激光射击精子尾部后会引起蛋白变性,存活的精子会发生卷尾,而死精子无变化,使用此法从完全不动精子中筛选存活精子用于ICSI,经临床应用获得满意的受精率及临床妊娠结局[1-6]。但文献对采用激光击打精子尾部鉴别存活精子在技术操作层面的叙述不够详尽。
为验证激光击打法鉴别存活精子的可行性,本文采用不同能量激光击打精子尾部的不同位置,观察精子的形态变化,评估激光的击打效果,确定击打精子的最适能量和位置;同时采用激光击打法和伊红-苯胺黑活体染色两种方法检测不同来源的精子标本,分析两种方法检测精子存活率的相关性,进一步评估激光击打法鉴别存活精子这一方法的应用价值。
材料与方法
一、材料
1. 正常精液3份,参照《人类精液分析与处理实验室手册第5版》[7]完成检验,将3份精液充分混合。用HEPES液(含10%SSS)洗涤2次,制成浓度(30~50)×106/mL精子悬液。
2. 全部为死精子的新鲜精液标本1份,用伊红-苯胺黑染色法证实精子存活率为零。用HEPES液洗涤2次,制成浓度(30~50)×106/mL精子悬液。
3. 弱精子症新鲜精液2份,不动精子比例>60%。用HEPES液洗涤2次,制成浓度(30~50)×106/mL精子悬液。
4. 附睾穿刺冷冻精子2份(患者行ICSI后剩余),采用Quinn's(美国SAGE产品)精子冷冻液和解冻液进行精子的冷冻和解冻,按试剂说明书操作。用HEPES液洗涤2次,制成浓度(5~10)×106/mL精子悬液。
5. 少精子症冷冻精子2份,采用Quinn's精子冷冻液和解冻液进行精子的冷冻和解冻,按试剂说明书操作。用HEPES液洗涤2次,制成浓度(5~10)×106/mL精子悬液。
6. PVP 试剂,Quinn's产品。
7. HEPES洗精液,Quinn's产品。
8. SSS代血清,Continuous Single Cultuer产品。
9. Hamilton激光破膜仪,选用科研工作模式,激光功率固定为300mW。
10. 与提供精子标本的患者签署知情同意书。
二、方法
1. 活精子尾部在不同激光脉冲输出时间击打下的精子形态变化:取5个小皿各加入PVP液30μL,涂成直径15mm的圆形液滴,并覆盖3mL矿物油,每间隔5min透过矿物油在液滴的中央加入混合的正常精液3μL,静置15min让精子向四周扩散,分别用500μs、300μs、100μs、75μs和50μs脉冲输出时间的激光击打。游走并分布在液滴四周的精子均为活动力良好的活精子,随着时间延长其运动速度趋缓,有利于激光击打和形态观察。
将小皿置于显微注射的恒温平台上。分别选择激光脉冲输出时间为500μs、300μs、100μs、75μs和50μs,因100μs已是最小脉冲输出时间,故将100μs的激光功率由100%调整为75%(相当于75μs)和50%(相当于50μs),顺时针方向依次对准液滴周围活精子尾部的下段约3/4(从精子头部起)进行单次击打,在3s内观察尾部变化,各连续计数200个精子。精子尾部形态分为3种变化:(1)明显变化 ①尾尖卷曲成环;②精子颈部弯曲;③击打处下段弯曲且夹角>90°;(2)轻度变化 击打处下段有弯曲但夹角<90°;(3)无变化 精子尾轴未见变化。精子尾部在激光击打后精子出现的形态变化,见图1。

图1 精子尾部在激光击打后精子出现的形态变化A: 尾部卷曲成环; B: 颈部弯曲; C: 尾部明显弯曲; D: 尾部轻度弯曲; E: 无变化
2. 活精子尾部不同位置在激光脉冲输出时间100μs击打下的精子形态变化:取3个小皿同上法制作3个活精子扩散的液滴,静置15min后分别采用激光脉冲输出时间100μs,按顺时针方向在活精子尾部的中间点、3/4位置和尾尖3个位置连续击打200个活精子,观察精子形态变化。
3. 观察死精子及不同精子标本在激光脉冲输出时间100μs击打下的精子形态变化:在小皿中各加入PVP液30μL和精子存活率为零或其他的精子标本3~10μL,用枪头吹打混匀10次,涂成直径15mm的圆形液滴,覆盖3mL矿物油,将小皿置于显微注射的恒温平台上。采用100μs激光脉冲输出时间,选择精子均匀且散在分布的部位,按顺时针方向对视野下全部精子尾部的3/4位置进行单次击打,在3s内观察尾部变化,连续计数200个精子。精子尾部形态分类同上。上述精子标本在进行激光击打前分别制备伊红-苯胺黑染色涂片,稍后完成精子存活率计数。
4. 伊红-苯胺黑染色法:分别取伊红-苯胺黑染色液1滴(丽水中益生物技术有限公司产品)加入试管中,各加入待检的精子悬液1滴,混匀。30s后取出10μL混合液于玻片上制成薄片,干燥,油镜镜检。油镜观察200个精子,计数不着色精子的比例。不着色精子为活精子。
5. 统计分析:采用SPSS.10软件。
结 果
1. 活精子在不同激光脉冲输出时间击打下的精子形态变化:激光击打活精子尾部以脉冲输出时间100μs的效果最佳,有90%精子发生形态变化,有75%精子发生明显形态变化,击打处无灼烧痕迹。其中大部分表现为瞬间卷曲成环状,少部分在3s内呈现不同程度的尾部弯曲,有5%精子的颈部形成明显折角。500μs击打后精子尾部可见熔化和折断改变,300μs的击打效果稍低于100μs,75μs击打后精子形态变化率明显降低,而50μs击打后精子形态未见改变。活精子尾部在激光脉冲输出时间500μs、300μs、100μs、75μs、50μs击打下发生的形态变化,见表1。
2. 活精子尾部不同位置在激光脉冲输出时间100μs击打下的精子形态变化:激光脉冲输出时间100μs分别击打精子尾部的中间点、3/4位置和尾尖的3个位置,其精子形态变化率无显著性差异(P>0.05),其中100μs的击打结果与表1的100μs激光击打精子尾部3/4位置的结果略有差异。活精子尾部不同位置在激光脉冲输出时间100μs击打下的精子形态变化见表2。
3. 死精子在激光脉冲输出时间100μs击打下的精子形态变化:死精子在激光脉冲输出时间100μs击打下均未见精子尾轴发生变化,击打处未见灼烧痕迹。
4. 不同精子标本在激光脉冲输出时间100μs击打下的精子形态变化:不同精子标本在激光脉冲输出时间100μs击打下的精子形态变化率(%)与精子活体存活率(%)呈高度正相关(r =0.9925),但前者明显低于后者(P<0.05),表明有一定比例的活精子在激光击打下未出现形态变化。不同精子标本在激光脉冲输出时间100μs击打下的精子形态变化率及精子活体染色的存活率,见表3。
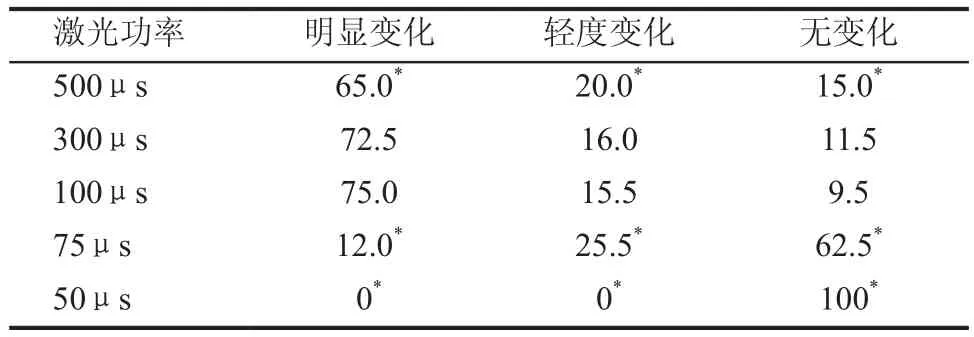
表1 活精子尾部在激光脉冲输出时间500μs、300μs、100μs、75μs、50μs击打下发生的形态变化(%)

表2 活精子尾部不同位置在激光脉冲输出时间100μs击打下的精子形态变化(%)

表3 不同精子标本在激光脉冲输出时间100μs击打下的精子形态变化率(%)及精子活体染色的存活率(%)
讨 论
如何鉴别活的不动精子,一直是困扰ICSI的技术难题。WHO《人类精液检查与处理实验室手册》第5版推荐的伊红染色法和低渗澎胀试验(HOS),前者经伊红染色后鉴别出的活精子无法用于ICSI;而后者操作繁琐且不是100%准确,可能会出现假阳性[8],并且不适用于冷冻-解冻精子[9];SperMagic是一种精子能量促进剂,在短时间内可以显著提高精子的活力,但研究样本较少,安全性有待观察[10];采用激光击打精子尾部是鉴别死活精子的一种方法,发生卷尾者为活精子,无反应者则视为死精子,活精子发生卷尾的机理仍不明确[1-3]。本文采用激光击打法还观察到一种新的精子形态变化形式,约5%的精子在尾部被击打后其颈部被牵拉瞬间呈明显折角,而尾部的卷尾及弯曲程度却显得不明显。
活精子在激光击打后有90%发生形态变化,而死精子形态无任何改变。因此发生形态变化的精子可判定为活精子,其中以形态发生明显变化如尾部卷曲成环、颈部和尾部发生明显弯曲的精子更具有确诊价值。需要说明的是,活精子尾部受激光击打后约有10%未见尾轴弯曲,因此尾部无变化不一定就是死精子。
弱精子、少精子及冻精标本在激光脉冲输出时间100us击打下的精子形态变化率(%)与精子活体存活率(%)呈高度正相关(r =0.9925),但前者结果明显低于后者(P<0.05),是因为有一定比例的活精子在激光击打下未出现形态变化,这就可以合理解释激光击打法检出的存活精子比例明显低于伊红-苯胺黑染色活体染色法的原因。
激光用于胚胎辅助孵化国内外已有大量的研究,多数认为是安全和有效的[11-14],但对能否提高冻融胚胎着床率和临床妊娠率仍有不同观点[15]。Mantoudis等[16]认为激光制动精子可能存在因热效应而破坏精子染色体进而影响胚胎的进一步发育的潜在危险;但徐志鹏等[17]通过末端转移酶介导的dUTP末端标记法和单细胞凝胶电泳法分别对激光辅助制动的精子进行检测,结果显示激光辅助制动精子后对精子核DNA并无明显影响,证实激光可以用来辅助ICSI操作;有较多文献报道采用激光法制动精子施行ICSI获得理想的妊娠结局,认为激光是筛选存活精子的有效方法,可以应用于睾丸精子ICSI[1-6]。
结果表明:采用低能量激光击打精子尾部,是在不动精子中鉴别存活精子简便而有效的方法,但需要注意操作要领。首先要尽量降低击打精子的激光能量,其次要尽可能将击打位置远离精子头部,以避免热效应损伤精子DNA。击打位置以尾部3/4位置为宜,接近精子尾尖不利于形态观察,击打的次数以一次为宜。
本文认为激光击打精子的安全性应高于胚胎的激光孵化,首先是前者的激光强度要比后者弱小数倍;其次是击打的位置远离了精子头部,减少了热效应可能产生的损害,但采用激光击打法鉴别存活精子的安全性仍有待进一步评估。
1 Ebner T, Yaman C, Moser M, et al. Laser assisted immobilization of spermatozoa prior to intracytoplasmic sperm injection in human. Hum Reprod 2001; 16(12): 2628-2631
2 Ebner T, Moser M, Yaman C, et al. Successful birth after laser assisted immobilization of spermatozoa before intracytoplasmic injection. Fertil Steril 2002; 78(2): 417-418
3 Aktan TM, Montag M, Duman S, et al. Use of a laser to detect viable but immotile spermatozoa. Andrologia 2004; 36(6): 366- 369
4 陈焕华, 冯贵雪, 张波, 等. 应用激光从完全不动精子中筛选存活精子行ICSI 后获临床妊娠: 附2 例报告. 中华男科学杂志 2015; 15(11): 988-991
5 陈焕华, 冯贵雪, 张波, 等. 激光筛远不动精子ICSI后成功分娩健康婴儿. 中国男科学杂志 2016; 30(4): 52-54
6 李培旭, 李尚为, 彭芝兰. 激光辅助法精子制动在睾丸精子卵母细胞内单精子注射中的应用. 激光杂志 2004; 25(2): 75-76
7 世界卫生组织. 人类精液分析与处理实验室手册第5版.北京: 人民卫生出版社, 2011: 9-56
8 Carreras A, Ramirez JP, Mendoza C. Sperm plasma membrane integrity measurement: A combined method. Andrologia 1992; 24(6): 335-340
9 Hossain A, Osuamkpe C, Hossain S, et al. Spontaneously developed tail swellings (SDTS) in fl uence the accuracy of the hypo-osmotic swelling test(HOS-test) in determining membrane integrity and viability of human spermatozoa. J Assist Reprod Genet 2010; 27(2-3): 83-86
10 王雪梅, 孙丽君, 郝大勇. SperMagic对极度严重少弱精症精子活动力及妊娠率的影响. 中国妇幼保健 2014; 29(1): 92-94
11 Lanzendorf SE, Ratts VS, Moley KH, et al. A randomized, prospective study comparing laser-assisted hatching and assisted hatching acidified medium. Fertil Steril 2007; 87(6): 1450-1457
12 Balaban B, Urman B, Alatas C, et al. A comparison of four different techniques of assisted hatching. Hum Reprod 2002; 17(5): 1239-1243
13 刘浩, 金志魁, 耿春惠. 激光辅助孵化对冻融胚胎种植潜力的影响. 中国实用妇科与产科杂志 2006; 22(5): 369-370
14 孙伟, 李静, 闻姬.人胚胎透明带与辅助孵化的研究进展. 中国优生与遗传杂志 2007; 15(12): 3-4, 2
15 Martins WP, Rocha IA, Ferriani RA, et al. Assisted hatching of human embryos: a systematic review and meta-analysis of randomized controlled trials. Hum Reprod Update 2011; 17(4): 438-453
16 Mantoudis E, Podsiadly BT , Gorgy A, et al. A comparison between quarter, partial and total laser assisted hatching in selected infertility patients. Hum Reprod 2001; 16(10): 2182- 2186
17 徐志鹏, 孙海翔, 胡娅莉. 激光辅助制动对精子核DNA的影响. 中华男科学杂志 2007; 3(13): 216-218
(2016-11-28收稿)
Strike sperm tails with low energy laser to identify viable sperm
Ye Mingjian, Zhu Weizhong*, Zhao Enhui, Li Jinmei, Hu Xiaowei
Center of Reproduction Medicine, The People’s Hospital of Lishui, Lishui 323000, China Corresponding author: Zhu Weizhong, E-mail: 7087807@163.com; Tel: 18957090517
Objective To investigate the feasibility of single laser shot method for identifying viable spermatozoa. Methods We gave the sperm a shot at the different site of the tail using laser with different pulse time, and then observed the morphology changes of sperm for determining suitable pulse time of laser and the right shooting position. We also detect the survival rate of sperms from different sources using laser and staining, then analyzed its correlation.Results Laser with pulse time of 100us and three quarters of the sperm tail had a better result. After giving a shot, 90% of live sperms exhibited changes in morphology. Among them, 75% had signi fi cant changes and 5% presented neck angle, but the dead sperm had no change in morphology. The survival rate of two methods above showed positive correlation(r =0.9925), but the laser method was signi fi cantly lower in survival rate(P<0.05).Conclusion Low energy laser is a simple and effective method for identifying viable sperm, but you should pay attention to operation details.
reproductive techniques, assisted ; sperm Injections, intracytoplasmic; spermatozoa; lasers
10.3969/j.issn.1008-0848.2017.01.006
R 698.2
*通讯作者,E-mail: 7087807@163.com;Tel: 18957090517
