植物乳杆菌天然质粒分类
2017-06-22孙大庆李洪飞宋大巍
孙大庆,李洪飞,宋大巍,杨 建,
(1.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
植物乳杆菌天然质粒分类
孙大庆1,李洪飞1,宋大巍2,杨 建1,2
(1.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
为建立植物乳杆菌天然质粒分类方法,以质粒复制起始蛋白(replication initiation protein,Rep)作为分类标记,通过系统进化树分析方法,将植物乳杆菌53 个编码Rep天然质粒划分为6 个质粒类型,包括5 个质粒家族和1 个新的复制类型质粒,之后进一步提出了每个质粒家族特有的骨干序列,最终建立了一种简单、有效的植物乳杆菌天然质粒的分类方法和标准。与以往质粒功能和不相容性分类方法相比较,本方法具有较好的实用性和通用性。关键词:植物乳杆菌;质粒;基因组;复制起始蛋白;复制子
植物乳杆菌广泛分布于动物、植物、人类体表和体内,以及众多发酵食品等自然和人工环境中,是乳酸菌中环境适应能力最强的菌种之一,并且它们已经广泛应用于食品、药品、饲料等工业产品加工中。由于具有十分重要的经济和社会价值,近年来植物乳杆菌生理、遗传、进化和分类学研究得到了广泛关注[1-2],已成为乳酸菌研究领域的模式菌种,并有人将它形象地称为“自然代谢工程师”[3]。
生物学研究发现,植物乳杆菌具有良好的环境适应能力和多种益生功能,不但得益于植物乳杆菌拥有乳酸菌中最大的基因组,并且植物乳杆菌含有的天然质粒很可能在其中扮演了重要角色。目前,越来越多的研究发现,质粒对植物乳杆菌在特殊环境下的生存和生产加工性状具有至关重要的作用,因为这些质粒编码了很多重要的功能蛋白质,例如碳水化合物利用、细菌素和胞外多糖合成、抗生素抗性等[4-5]。此外,天然质粒经常被用于构建穿梭载体,这些载体是植物乳杆菌分子生物学研究中不可或缺的研究工具[6-7]。因此,开展植物乳杆菌天然质粒的相关研究可以更好的促进植物乳杆菌基础和应用研究。
1989年第1个植物乳杆菌质粒完整基因组确定[8],至今NCBI Genome数据库中已收录68 个完整质粒基因组。经过统计和对比分析,与其他乳杆菌或乳酸菌比较,植物乳杆菌天然质粒在大小、数量和多样性方面都是最丰富的菌种[9]。近年来,随着测序技术的飞速发展,以往基于质粒功能和不相容性的分类方法由于费时、低效,已经越来越不能满足质粒基因组数量快速增加的需要,而基于比较基因组学的分类方法可能会更加方便且有效[10]。本研究以植物乳杆菌质粒丰富的基因组数据为基础,采用比较基因组学统计和分析方法,以质粒Rep作为分类标记,尝试建立一种简单、有效的天然质粒系统分类方法,希望为今后植物乳杆菌天然质粒的系统分类研究提供有益的探索和借鉴。
1 材料与方法
1.1 材料

表1 Genome数据库中收录的68 个植物乳杆菌质粒Table1 Sixty-eight plasmids of Lactobacillus plantarum recorded in the Genome database
植物乳杆菌68 个质粒基因组序列由NCBI Genome数据库下载获得,基本信息见表1。质粒pC194、pMV158、pUCL287基因组登录号分别为NC_002013.1、NC_010096.1、X75607.1。质粒pAD1和pIP501基因组序列来自文献[11-12]。
1.2 方法
从NCBI Genome数据库下载植物乳杆菌质粒基因组序列。利用BLAST-P在线软件进行Rep同源序列检索和保守结构域鉴定。利用DNAman5.5和MEGA6.0[13]软件进行多序列同源性比对和系统进化树构建,系统进化树采用Neighbor-Joining模型建树,并采用Bootstrap1 000计算置信度。
2 结果与分析
2.1 植物乳杆菌质粒Rep特征

表2 53 个植物乳杆菌质粒基因组和Rep蛋白的基本特征Table2 Basic characteristics of the genome of fifty-three plasmids and Rep protein in Lactobacillus plantarum
经序列比对和统计分析,在所有68 个质粒中发现15 个质粒没有编码已知的Rep,53 个质粒编码Rep,其中51 个质粒含有1 个Rep,质粒pMRI5.2和pZL3含有2 个Rep。根据Rep含有的保守结构域和同源性,可以将55 个Rep划分为5 个蛋白家族(表2)。
2.2 编码Rep蛋白的质粒
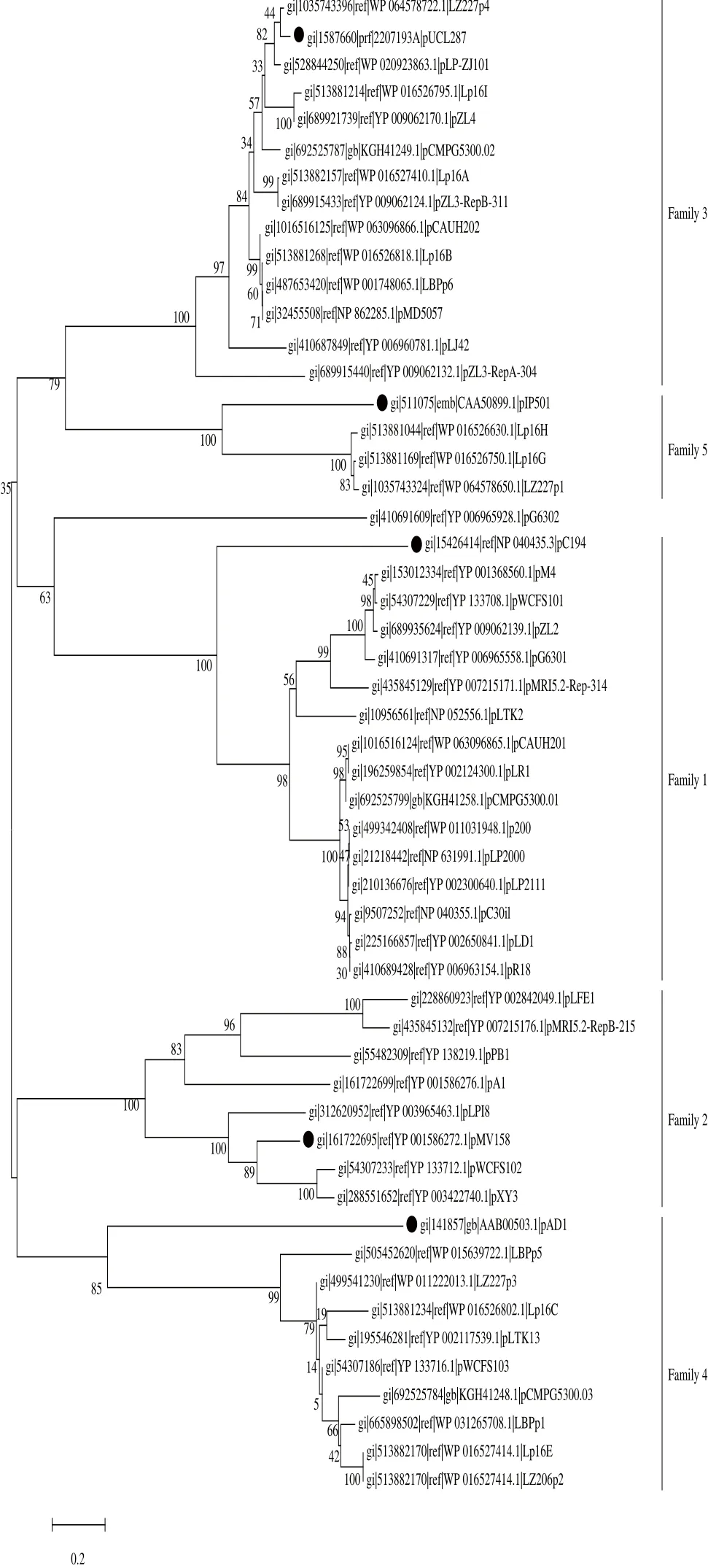
图1 植物乳杆菌质粒Rep蛋白氨基酸序列系统进化树Fig.1 Phylogenetic tree based on amino acid sequences of Rep proteins in Lactobacillus plantarum plasmids
2.2.1 Rep系统进化树基于Rep氨基酸序列同源性,构建了植物乳杆菌质粒和5 个蛋白家族参考质粒Rep系统进化树(图1)。没有包括假基因或截短基因编码Rep的质粒,这些质粒将在下文讨论。由图1可以看出,植物乳杆菌45 个质粒分别与5 个参考质粒聚类,只有质粒pG6302未按Rep家族聚类,单独成枝。因此植物乳杆菌46 个质粒根据Rep氨基酸序列同源性,可以有效地划分为6 个类型,包括5 个质粒家族和质粒pG6302。质粒pZL3含有2 个Rep,都属于Family 3,因此质粒pZL3属于Family 3。质粒pMRI5.2也含有2 个Rep,分属于Family 1和2,由于该质粒属于特殊的复合质粒,即2 个不同家族质粒正在发生融合[14],因此质粒pMRI5.2
可归类为Family 1和Family 2。上述结果表明,Rep是质粒分类研究中一个比较理想的遗传标记,基于Rep同源性可以建立一种简单、快速、有效的质粒分类方法,进而为植物乳杆菌天然质粒分类学研究提供分子水平的佐证和依据。尽管特殊的复合质粒一定程度上降低了本方法对它们分类的有效性,但这个局限性并不影响此分类方法的有效性和实用性。
2.2.2 RCR质粒Family 1分析

表3 Family 1质粒Rep蛋白保守基序Table3 Conservative motifs of Rep proteins in plasmid Family 1
植物乳杆菌质粒Family 1由14 个质粒组成(图1),与参考质粒pC194聚类,属于第1类滚环复制(rolling circle replication,RCR)质粒。Family 1质粒大小1.91~3.51 kb,GC含量35.81~39.49%,Rep蛋白大小317~319 aa(表2)。经进一步序列比对分析,Family 1质粒Rep与质粒pC194 Rep(232 aa)序列大小差异显著,显示了较低的同源性(20.94%~24.30%),但Family 1质粒和pC194 Rep蛋白均含有3个保守的Motifs,并且Motif中关键功能位点高度一致(表3),这些Motifs已被证明是pC194家族质粒复制起始的关键功能位点[15-16]。这进一步表明Family 1质粒属于RCR pC194家族。
pC194家族质粒最小复制子通常由rep基因、双链复制起点(double strand origin,dso)和单链复制起点(single strand origin,sso)组成。通过进一步的序列分析发现,Family 1质粒均含有高度保守的rep和dso序列,称为骨干序列,该序列与pC194家族质粒高度同源。虽然sso也是pC194家族质粒复制的必需元件,但近年研究发现该家族质粒sso可能并不保守[17]。共同骨干序列的存在进一步证明Family 1质粒属于pC194家族,并且该骨干序列比Rep氨基酸序列具有更好的特异性,因此,由rep和dso序列组成骨干序列可以作为Family 1特异性的遗传标记用于该家族质粒的分类。
2.2.3 RCR质粒Family 2分析

表4 Family 2质粒Rep蛋白保守基序Table4 Conservative motifs of Rep proteins in plasmid Family 2
植物乳杆菌质粒Family 2由6 个质粒组成(图1),与参考质粒pMV158聚类,属于第2类RCR质粒。Family 2质粒大小1.80~4.03 kb,GC含量34.33~38.24%,Rep蛋白大小196~237 aa(表2)。经序列比对分析,Family 2质粒Rep与质粒pMV158 Rep具有20.55%~62.56%同源性。质粒pMV158家族Rep蛋白含有5 个保守的Motifs(Ⅰ~Ⅴ),Motif Ⅲ和Motif Ⅳ对质粒前导链复制起始具有关键作用[16,18]。Family 2质粒中,除了pA1 Rep含有3 个保守Motifs,其余5 个质粒Rep均含有5 个保守的Motifs,并且这些Motifs的保守位点与pMV158 Rep的相应位点是完全一致的(表4)。因此根据Rep大小、同源性,尤其Motifs序列一致性可以看出,Family 2质粒属于RCR pMV158家族。
基因组序列分析发现,Family 2质粒含有一个共同保守的骨干序列,该序列由cop、ctRNA、rep和dso组成,它们是pMV158家族质粒复制和拷贝数调控典型的基因元件。这进一步证明Family 2属于RCR pMV158家族,同时由多个序 列组成的骨干序列可以作为Family 2质粒高特异性的分类标记。
2.2.4 theta复制质粒Family 3分析
植物乳杆菌质粒Family 3主要由12 个质粒组成(图1),与参考质粒pUCL287聚类,属于第1类theta型复制质粒。Family 3质粒大小5.52~93.54kb,GC含量33.37~42.41%,Rep蛋白大小307~311 aa(表2)。经比对分析,Family 3质粒Rep与质粒pUCL287 Rep(311 aa)序列具有68.17%~95.18%同源性,Rep蛋白在大小和序列同源性上显示了高度保守性,这表明Family 3质粒可能属于theta型复制pUCL287家族[19]。前面提到质粒pZL3含有2 个Rep,即RepB(311 aa,YP_009062124)和RepA(304 aa,YP_009062132)。RepB和RepA与质粒pUCL287 Rep蛋白同源性分别为82.64%和45.03%,因此基于氨基酸序列大小和一致性,采用RepB作为质粒pZL3的Rep进行后续分析。
进一步序列分析发现,Family 3质粒与pUCL287家族质粒复制子具有共同的骨干序列,该序列包括复制起点(origin of replication initiation,ori)(4 个11 bp和4.5 个22 bp正向重复序列)和rep基因。高度保守骨干序列的存在有力地证明了Family 3质粒属于theta型复制pUCL287家族,并且骨干序列可以作为特异性的遗传标记用于Family 3质粒的分类。质粒LZ206p3的rep基因发生了移码突变,Rep部分缺失,但在这个rep基因上游发现含有Family 3质粒典型的ori及其重复序列特征,因此质粒LZ206p3可归属为Family 3。
2.2.5 theta复制质粒Family 4分析
植物乳杆菌质粒Family 4主要由9 个质粒组成(图1),与参考质粒pAD1聚类,属于第2类theta型复制质粒。Family 3质粒大小16.10~45.41 kb,GC含量39.04~42.14%,Rep蛋白大小102~373 aa(表2)。质粒pAD1是theta型复制质粒RepA_N家族典型代表。经氨基酸序列比对分析,Family 4质粒Rep与质粒pAD1 Rep(336 aa)显示了很低的同源性(4.44%~29.07%),但Family 4质粒较大的Rep(大于200 aa)与pAD1 Rep N端显示高度同源性;Family 4质粒4 个较小的Rep(小于200 aa)与pAD1 Rep几乎没有同源性,但Family 4所有质粒Rep C端显示高度同源性;Rep蛋白N和C末端之间序列显示了很低的同源性。Family 4质粒Rep三个区域显示的同源性特征与近年RepA_N家族质粒Rep获得的研究结果一致,这与每个区域负责的复制起始功能密切相关[20-21]。RepA_N家族质粒Rep蛋白C端结构域是宿主菌属特异的复制体组件,决定了质粒的宿主范围[22],因此Family 4质粒Rep蛋白C端显示了高度同源性,而它们与质粒pAD1 Rep C端几乎没有同源性。这些分析结果表明Family 4质粒可能属于theta型复制RepA_N家族。
RepA_N家族质粒最大特征是ori在rep编码序列内部,具有一个非常简单、紧凑的复制子。该复制子仅由一个rep基因序列组成,rep上游编码Rep N端结构域,中间是ori,下游编码Rep C端结构域[21]。上文提到,Family 4质粒4 个小的Rep不含有RepA_N家族质粒Rep N端,而Family 4所有质粒Rep均含有家族特异的高保守的C端结构域,因此Rep高保守的C端序列可以作为Family 4质粒特异的骨干序列和遗传标记,用于该家族质粒的分类。
基于Family 4质粒Rep C端保守序列,经全基因组序列分析发现,有6 个质粒存在Rep C端同源序列,这些序列在数据库多数没有注释,仅有一个注释为推测蛋白,同时6 个质粒基因组中没有发现任何其他已知的Rep,因此这些与Family 4质粒Rep C端具有同源性蛋白的存在,暗示这6 个质粒可能属于Family 4,因此,将这6 个质粒归为Family 4类型质粒。
2.2.6 theta复制质粒Family 5分析
植物乳杆菌质粒Family 5由3 个质粒组成(见图1),与参考质粒pIP501聚类,属于第3类theta型复制质粒。Family 5质粒大小51.85~74.17 kb,GC含量41.33~42.56%,Rep蛋白大小510~512 aa(表2)。经氨基酸序列比对,Family 5的3 个Rep具有97.98%同源性,与无乳链球菌质粒pIP501 Rep(496 aa)具有31.47%~32.49%同源性。它们均含有保守的PriCT-1和HTH结构域,PriCT-1是引发酶C末端,可以引发复制体组装;HTH则是最常见的DNA结合结构域,但2 个结构域在复制起始中的分子作用机制仍是未知的[22]。根据Rep大小、同源性和2 个保守结构域,推测Family 5属于质粒pIP501相似的theta型复制质粒家族,尽管这个家族的复制机制目前仍是未知的[22-23]。
质粒pIP501最小复制子由rep基因及其下游的ori组成[24]。经进一步序列分析发现,Family 5家族质粒具有相似的复制子序列特征。因此,将rep基因和ori区域定义为Family 5质粒的骨干序列,该序列可以作为Family 5家族特有的遗传标记用于该家族质粒的分类。
2.2.7 theta复制质粒pG6302分析
植物乳杆菌质粒pG6302大小9.11 kb,GC含量36.39%,Rep蛋白200 aa(表2)。根据质粒大小、GC含量和Rep家族(pfam01051),质粒pG6302可能属于theta型复制质粒pUCL287家族,即Family 3。但经过进一步比对分析发现,质粒pG6302和pUCL287的Rep序列同源性仅为9.55%,远低于Family 3质粒和pUCL287 Rep同源性。另外,在质粒pG6302 rep基因上游约1.4 kb处,发现由4 个27 bp正向重复序列组成的ori,这个ori序列特征与Family 3质粒ori明显不同[25]。因此,根据Rep序列大小和同源性,尤其是ori中重复子的序列特征,推测质粒pG6302不属于Family 3,属于一种新的theta型复制质粒家族。
2.3 非编码Rep蛋白的质粒分析
经基因组序列分析,植物乳杆菌其余15 个质粒既不含有已知的Rep,也不含有上述质粒家族骨干序列的典型特征,因此它们可能属于新的未知的质粒家族。15 个质粒中p256、pLP9000和pG6303已有文献报道,但质粒pLP9000[26]和pG6303[25]的复制类型和调控机制仍是未知的,只有质粒p256进行了比较深入的研究。质粒p256大小7.22 kb,GC比例36.73%,表现出一些非典型特征:1)不存在RCR质粒dso和单链中间体;2)最小复制子688 bp,包含一个开放阅读框(open reading frame,ORF)、重复序列和4 个DnaA盒;3)最小复制子中ORF与任何已知蛋白没有同源性,并且移码突变不影响复制功能;4)质粒拷贝数5~10 个/染色体;5)最小复制子具有很窄的宿主范围[27]。这些特征表明,质粒p256与植物乳杆菌上述6 个类型质粒明显不同,推测它属于一个新的不依赖Rep蛋白的theta型复制质粒家族。质粒p256最小复制子序列与其他14 个质粒进行比对,发现质粒LBPp7含有一个几乎完全一致的区域(3 个碱基不配),因此质粒LBPp7和p256很可能属于同一个质粒家族。
3 讨 论
以往由于质粒基因组遗传变异率较高,加之完整基因组数量有限,基于基因组序列同源性进行分类是一件相当困难的事,因此,至今质粒的分类仍主要是以质粒编码的功能基因或质粒之间的不相容性作为分类标准,但这两种分类方法存在很大的局限性[10]。2000年以后随着DNA测序技术的飞速发展,大量质粒基因组数据快速增加,使基于基因组序列同源性进行质粒分类成为可能,并将在后基因组时代成为质粒系统进化分类学研究的热点和前沿[10]。
本研究以质粒编码Rep作为分类标记,并辅助参考质粒复制子序列特征,利用比较基因组学方法,对植物乳杆菌68 个完整测序质粒进行了分类研究。经序列比对和系统进化树分析,植物乳杆菌53个编码Rep质粒被划分为6 个质粒类型,包括5个质粒家族和1个新复制类型质粒。Family 1、2和复合质粒pMRI5.2属于小型(1~5 kb)RCR质粒,Family 3和质粒pG6302属于中型(6~15 kb)theta型复制质粒,Family 4、5属于大型(>15 kb)theta型复制质粒家族。Family 3质粒LZ227p4(93.54 kb)远远超出了该家族其他质粒大小,但该质粒基因组中含有2 个11 kb完全相同的大片段序列,且具有众多大小相同或相似的转座酶基因,因此推测该质粒很可能是测序的一个拼接产物,而非天然质粒,其真实基因组可能较小。在Rep分类基础上,提出了5 个质粒家族特异的骨干序列,为这些家族质粒的分类提供了更加准确和特异性的遗传标记。因此上述研究结果表明,Rep是植物乳杆菌天然质粒系统分类学研究中一个理想的遗传标记,基于Rep同源性可以建立一种简单、有效的质粒分类方法,进而可以为植物乳杆菌天然质粒系统分类学研究提供分子水平的佐证和依据。利用该方法进行更广泛宿主质粒的系统分类学研究,理论上本方法可适用于所有编码Rep蛋白的天然质粒的分类,与质粒功能和不相容性分类方法比较,具有十分优越的实用性和通用性。
显然对于非编码Rep蛋白质粒,本研究建立的分类方法是无效的,但今后或许可以通过质粒上ori序列的深入研究加以解决。植物乳杆菌含有15 个无Rep质粒,除了质粒p256和LBPp7被证明采用一种不依赖Rep蛋白的theta型机制,其他13 个质粒的复制机制和分类地位仍是未知的。这13 个质粒的复制有2 种可能,一种可能是与质粒p256相似,其复制起始不依赖质粒编码的Rep,而是完全依赖宿主提供的酶系进行,例如著名的ColE1家族质粒[28];另一种可能是这些质粒依赖于同细胞中其他质粒编码的Rep进行复制起始。然而,不论这些质粒属于哪种复制类型,即不论Rep由质粒还是染色体编码,质粒复制起始都需要其基因组中存在Rep-D NA作用位点,即ori,而这些ori通常具有特殊的序列和结构特征[29-30],例如AT富集、重复序列、回文序列、二级茎环结构等。因此,这些质粒ori序列的鉴定和解析,以及这些ori序列是否可以作为非编码Rep蛋白质粒分类的遗传标记,都需要今后对这些质粒进行更加深入的研究。
[1] SIEZEN R J, TZENEVA V A, CASTIONI A, et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches[J]. Environmental Microbiology, 2010, 12(3): 758-773. DOI:10.1111/j.1462-2920.2009.02119.x.
[2] NIEUWBOER M, HEMERT S, CLAASSEN E, et al. Lactobacillus plantarum WCFS1 and its host interaction: a dozen years after the genome[J]. Microbial Biotechnology, 2016, 9(4): 452-465. DOI:10.1111/1751-7915.12368.
[3] SIEZEN R J, van HYLCKAMA VLIEG J E. Genomic diversity and versatility of Lactobacillus plantarum, a natural metabolic engineer[J]. Microbial Cell Factories, 2011, 10(1): S3. DOI:10.1186/1475-2859-10-S1-S3.
[4] van REENEN C A, van ZYL W H, DICKS L M T. Expression of the immunity protein of plantaricin 423, produced by Lactobacillus plantarum 423, and analysis of the plasmid encoding the bacteriocin[J]. Applied and Environmental Microbiology, 2006, 72(12): 7644-7651. DOI:10.1128/AEM.01428-06.
[5] JALILSOOD T, BARADARAN A, LINGH, et al. Characterization of pR18, a novel rolling-circle replication plasmid from Lactobacillus plantarum[J]. Plasmid, 2014, 73: 1-9. DOI:10.1016/ j.plasmid.2014.04.004.
[6] RATTANACHAIKUNSOPON P, PHUMKHACHORN P. Construction of a food-grade cloning vector for Lactobacillus plantarum and its utilization in a food model[J]. The Journal of General and Applied Microbiology, 2012, 58(4): 317-324. DOI:10.2323/jgam.58.317.
[7] MAIDIN M S T, SONGA L, JALILSOOD T, et al. Construction of a novel inducible expression vector for Lactococcus lactis M4 and Lactobacillus plantarum Pa21[J]. Plasmid, 2014, 74: 32-38. DOI:10.1016/j.plasmid.2014.05.003.
[8] BOUIA A, BRINGEL F, FREY L, et al. Structural organization of pLP1, a cryptic plasmid from Lactobacillus plantarum CCM 1904[J]. Plasmid, 1989, 22(3): 185-192. DOI:10.1016/0147-619X(89)90001-2.
[9] 孙大庆, 李洪飞, 宋大巍, 等. 乳杆菌属天然质粒研究进展[J].食品科学, 2015, 36(11): 251-255. DOI:10.7506/spkx1002-6630-201511047.
[10] PETERSEN J. Phylogeny and compatibility: plasmid classification in the genomics era[J]. Archives of Microbiology, 2011, 193(5): 313-321. DOI:10.1007/s00203-011-0686-9.
[11] FRANCIA M V, HAAS W, WIRTH R, et al. Completion of the nucleotide sequence of the Enterococcus faecalis conjugative virulence plasmid pAD1 and identification of a second transfer origin[J]. Plasmid, 2001, 46(2): 117-127. DOI:10.1006/plas.2001.1533.
[12] THOMPSON J K, COLLINS M A. Completed sequence of plasmid pIP501 and origin of spontaneous deletion derivatives[J]. Plasmid, 2003, 50(1): 28-35. DOI:10.1016/S0147-619X(03)00042-8.
[13] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197.
[14] CHO G S, HUCH M, MATHARA J M, et al. Characterization of pMRI 5.2, a rolling-circle-type plasmid from Lactobacillus plantarum BFE 5092 which harbours two different replication initiation genes[J]. Plasmid, 2013, 69(2): 160-171. DOI:10.1016/j.plasmid.2012.11.005.
[15] RUIZ-MASÓ J A, MACHÓN C, BORDANABA-RUISECO L, et al. Plasmid rolling-circle replication[J]. Microbiology Spectrum, 2015, 3(1):PLAS-0035-2014. DOI:10.1128/microbiolspec.PLAS-0035-2014.
[16] KHAN S A. Plasmid rolling-circle replication: highlights of two decades of research[J]. Plasmid, 2005, 53(2): 126-136. DOI:10.1016/ j.plasmid.2004.12.008.
[17] YIN S, HAO Y L, ZHAI Z Y, et al. Functional analysis of the plasmid pM4 replicon from Lactobacillus plantarum M4: determination of the minimal replicon and functionality identification of the putative sso[J]. Plasmid, 2009, 62(3): 166-171. DOI:10.1016/j.plasmid.2009.07.004.
[18] MOSCOSO M, del SOLAR G, ESPINOSA M. Specific nicking-closing activity of the initiator of replication protein RepB of plasmid pMV158 on supercoiled or single-stranded DNA[J]. Journal of Biological Chemistry, 1995, 270(8): 3772-3779. DOI:10.1074/jbc.270.8.3772.
[19] BENACHOUR A, FRÈRE J, NOVEL G. pUCL287 plasmid from Tetragenococcus halophila (Pediococcus halophilus) ATCC 33315 represents a new theta-type replicon family of lactic acid bacteria[J]. FEMS Microbiology Letters, 1995, 128(2): 167-175. DOI:10.1111/j.1574-6968.1995.tb07518.x.
[20] WEAVER K E, KWONG S M, FIRTH N, et al. The RepA_N replicons of Gram-positive bacteria: a family of broadly distributed but narrow host range plasmids[J]. Plasmid, 2009, 61(2): 94-109. DOI:10.1016/ j.plasmid.2008.11.004.
[21] SCHUMACHER M A, TONTHAT N K, KWONG S M, et al. Mechanism of Staphylococcal multiresistance plasmid replication origin assembly by the RepA protein[J]. PNAS, 2014, 111(25): 9121-9126. DOI:10.1073/pnas.1406065111.
[22] GROHMANN E, GOESSWEINER-MOHR N, BRANTL S. DNA-binding proteins regulating pIP501 transfer and replication[J]. Frontiers in Molecular Biosciences, 2016, 3: 42. DOI:10.3389/fmolb.2016.00042.
[23] BRANTL S. Antisense-RNA mediated control of plasmid replicationpIP501 revisited[J]. Plasmid, 2015, 78: 4-16. DOI:10.1016/ j.plasmid.2014.07.004.
[24] BRANTL S, BEHNKE D. Characterization of the minimal origin required for replication of the streptococcal plasmid pIP501 in Bacillus subtilis[J]. Molecular Microbiology, 1992, 6(23): 3501-3510. DOI:10.1111/j.1365-2958.1992.tb01785.x.
[25] XI X D, FAN J, HOU Y, et al. Characterization of three cryptic plasmids from Lactobacillus plantarum G63 that was isolated from Chinese pickle[J]. Plasmid, 2013, 70(3): 321-328. DOI:10.1016/ j.plasmid.2013.07.004.
[26] REN D M, WANG Y Y, WANG Z L, et al. Complete DNA sequence and analysis of two cryptic plasmids isolated from Lactobacillus plantarum[J]. Plasmid, 2003, 50(1): 70-73. DOI:10.1016/S0147-619X(03)00010-6.
[27] SØRVIG E, SKAUGEN M, NATERSTAD K, et al. Plasmid p256 from Lactobacillus plantarum represents a new type of replicon in lactic acid bacteria, and contains a toxin-antitoxin-like plasmid maintenance system[J]. Microbiology, 2005, 151(2): 421-431. DOI:10.1099/ mic.0.27389-0.
[28] WANG Z J, YUAN Z H, HENGGE U R. Processing of plasmid DNA with ColE1-like replication origin[J]. Plasmid, 2004, 51(3): 149-161. DOI:10.1016/j.plasmid.2003.12.002.
[29] LILLY J, CAMPS M. Mechanisms of theta plasmid replication[J]. Microbiology Spectrum, 2015, 3(1). DOI:10.1128/microbiolspec.PLAS-0029-2014.
[30] WEGRZYN K, FUENTES-PEREZ M E, BURY K, et al. Sequencespecific interactions of Rep proteins with ssDNA in the AT-rich region of the plasmid replication origin[J]. Nucleic Acids Research, 2014, 42(12):7807-7818. DOI:10. 1093/nar/gku453.
Classification of Natural Plasmids in Lactobacillus plantarum
SUN Daqing1, LI Hongfei1, SONG Dawei2, YANG Jian1,2
(1. National Coarse Cereals Engineering Research Center, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
This study aimed to establish a classification method for natural plasmids of Lactobacillus plantarum (L. plantarum) by using plasmid replication initiation protein (Rep) as a taxonomic marker. Fifty three plasmids encoding Rep in L. plantarum were divided into six plasmid types by the method of phylogenetic analysis, including five plasmid families and one novel replication type of plasmid. Then, the backbone sequence specific to each plasmid family was further proposed. Finally, a simple and effective classification method and criterion for L. plantarum natural plasmids was established. Compared with the previous classification methods based on plasmid function and incompatibility, this method displayed relatively better practicability and versatility.
Lactobacillus plantarum; plasmid; genome; replication initiation protein; replicon
10.7506/spkx1002-6630-201712011
Q19
A
1002-6630(2017)12-0069-06
孙大庆, 李洪飞, 宋大巍, 等. 植物乳杆菌天然质粒分类[J]. 食品科学, 2017, 38(12): 69-74.
10.7506/spkx1002-6630-201712011. http://www.spkx.net.cn
SUN Daqing, LI Hongfei, SONG Dawei, et al. Classification of natural plasmids in Lactobacillus plantarum[J]. Food Science, 2017, 38(12): 69-74. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712011. http://www.spkx.net.cn
2016-10-28
黑龙江省青年科学基金项目(QC2014C020)
孙大庆(1979—),男,副研究员,博士研究生,研究方向为食品微生物与生物技术。E-mail:sundaqing1979@163.com
