小麦抗赤霉病主效QTL的聚合效应分析
2017-06-22李文阳闫素辉张从宇郑甲成杜军丽张子学时侠清
许 峰,李文阳,闫素辉,张从宇,郑甲成,杜军丽,张子学,时侠清
(安徽科技学院农学院,安徽凤阳 233110)
小麦抗赤霉病主效QTL的聚合效应分析
许 峰,李文阳,闫素辉,张从宇,郑甲成,杜军丽,张子学,时侠清
(安徽科技学院农学院,安徽凤阳 233110)
为了明确小麦抗赤霉病主效QTL的抗病效应,基于分子标记辅助选择,将来源于抗病品种苏麦3号的 Fhb1、 Fhb2和望水白的 Fhb4、 Fhb5回交导入感病品种矮抗58中,构建出30个不同QTL组合的株系,分别采用单花滴注和喷洒孢子悬浮液接种法,对其开展抗侵入、抗扩展和综合抗性鉴定。结果表明,携带 Fhb1和 Fhb2的株系表现出显著的抗扩展能力, Fhb1的效应显著高于 Fhb2,但二者都没有抗侵入效应;携带 Fhb4和 Fhb5的株系表现出明显的抗侵入性,二者累加后效应更显著,但均没有明显的抗扩展能力;不同抗性类型的QTL聚合后,其综合抗病性比单个QTL更显著。说明在育种中,将不同抗性类型的QTL聚合后比单个QTL的抗赤霉病效果更佳。
小麦;抗赤霉病;QTL;聚合效应
小麦是我国第三大粮食作物,按照种植区可划分为北方春麦区、北部冬麦区、黄淮冬麦区、长江中下游冬麦区、西南冬麦区等10个麦区,其中,淮河以北的麦区占全国小麦总面积的70%和产量的75%左右,是我国最重要的麦区[1]。小麦在田间生长过程中常常受到多种病害的侵袭,以锈病、白粉病和赤霉病危害较为严重,病害大发生年份会造成小麦产量的重大损失[2]。相对于前两种病害,赤霉病不仅导致小麦减产,同时也会降低小麦品质,感病麦粒携带的毒素给人畜还会带来重大健康隐患[3]。
小麦对赤霉病的抗性表现为多基因控制的数量性状遗传[4]。基于不同类型的遗传作图技术, Fhb1[5-7]、 Fhb2[8]、 Fhb3[9]、 Fhb4[10]、 Fhb5[11]、 Fhb6[12]和 Fhb7[13]基因已分别获得精确定位,其中, Fhb1和 Fhb2来自苏麦3号, Fhb4和 Fhb5源自望水白,其他均来自小麦的近缘物种,此外,还在宁7840、Frontana、Sincron、CM-82036等抗病种质中定位到超过100个数量性状位点(QTL)[14-15]。进一步的遗传定位分析表明,低籽粒病粒率(Type Ⅲ)、耐病即产量损失轻(Type Ⅳ)和降解毒素或抑制毒素积累(Type Ⅴ)的定位区间大多与抗侵入(Type Ⅰ)和抗扩展(TypeⅡ)的区间重合[16],因此在抗性鉴定中,TypeⅠ和TypeⅡ的抗性以及二者组合后的综合抗性,能够直观地反映被鉴定材料的抗病能力。
基因聚合作为改善作物品系中某一目标特征性状的有效方法,在质量性状基因研究中得到广泛利用。Yoshimura 等[17]将水稻抗百叶枯病基因 Xa1、 Xa3、 Xa4、 Xa5和 Xa10聚合在一起,显著提高了聚合品系的抗病性。Hittalmani 等[18]利用该方法对3个水稻抗稻瘟病性基因进行聚合,发现抗性水平和抗病谱都得到了明显提升和扩展。对于数量性状而言,尽管单个QTL的效应较小,但通过分子标记辅助选择(Molecular marker-assisted selection,MAS)聚合多个QTL的策略也可以达到相似的利用效果[19]。Zhu 等[20]采用该方法对大麦品系中控制产量的4个主效QTL进行聚合,当2H-QTL与4H-QTL、6H-QTL、7H-QTL中任意1个QTL累加后产量都能得到显著提高。
为深入了解小麦不同抗赤霉病QTL类型的田间抗病效应,本研究以矮抗58为受体亲本,通过多次回交将 Fhb1、 Fhb2、 Fhb4和 Fhb5导入其中,构建不同QTL组合的高代回交株系,并对其进行赤霉病田间抗性鉴定,以筛选出更合适的抗病QTL组合用于后续育种,为抗病育种工作提供有力支持。
1 材料与方法
1.1 材 料
苏麦3号和望水白均为高抗赤霉病品种,分别携带 Fhb1、 Fhb2和 Fhb4、 Fhb5基因,作为QTL的供体亲本,由南京农业大学农学院应用基因组实验室提供;矮抗58属于高感种质,作为回交亲本用于构建回交群体,由安徽科技学院农学院种子科学与工程实验室提供。
病原菌为禾谷镰刀菌(Fusariumgraminearium)F15高毒菌株,具有较强致病能力,由南京农业大学农学院应用基因组实验室提供。
1.2 方 法
1.2.1 病原菌培养
将低温保存的F15菌株活化后,在PDA培养基上培养6 d,待菌落长成后挑取适量菌丝,接种至绿豆汤培养基中,避光震荡培养7 d,当分生孢子浓度达到或高于1.0×105·mL-1时停止培养,用纱布过滤菌丝,用ddH2O稀释孢子液,调整分生孢子浓度至5.0×104·mL-1,4 ℃保存备用。
1.2.2 DNA提取、PCR反应及基因型分析
参考Ma等[21]的方法提取DNA。参考Röder等[22]的方法进行PCR反应和聚丙烯酰胺凝胶电泳。与 Fhb1、 Fhb2、 Fhb4和 Fhb5基因紧密连锁的标记信息见文献[7]-[10](表1)。将扩增的带型与亲本比较后归类,明确所有单株的基因型后筛选出位点纯合的基因型。
1.2.3 田间抗性鉴定和评价
通过分子标记辅助选择的方法将来自小麦抗病品种苏麦3号的 Fhb1和 Fhb2、望水白的 Fhb4 和 Fhb5导入至感病品种矮抗58遗传背景中,经过多轮回交、杂交和自交,在BC3世代获得15组、30个QTL位点纯合的株系,以供体亲本苏麦3号和望水白、轮回亲本矮抗58为抗感对照,考察不同QTL组合株系的田间抗病性。
供试小麦均种植于安徽凤阳的安徽科技学院种植园,试验分别在塑料大棚和大田两个不同的生长环境条件下进行。完全随机区组种植各试验材料,行宽1.0 m,行长30 m,行距0.30 m,每行播种30粒,重复6次。重复1和2在扬花期采用单花滴注法接种麦穗,取分生孢子浓度为5.0×104· mL-1的分生孢子液20 μL注入到麦穗中上部正在扬花的自上而下第5~6个小穗上;挂不同颜色标牌标明接种日期,接种30~40穗。接种后15 d调查病小穗数(Number of diseased spikelets,NDS),鉴定各株系的赤霉病抗扩展性。重复3和4在扬花期采用喷洒孢子悬浮液的方法进行接种,取浓度为1.0×105· mL-1的分生孢子液15 L对各株系的穗部进行均匀喷雾,隔天喷施1次,共进行4次。后期视田间气象状况及时灌溉,以保持田间在整个扬花期处于高湿度状态,盛花期后15 d调查病穗率(Percentage of infected spikes,PIS),鉴定各株系的赤霉病抗侵入性。重复5和6在扬花期同时进行单花滴注和喷洒孢子液,操作与前两种接种法一致,盛花期后21 d调查病小穗率(Percentage of damaged spikelets,PDS),鉴定各株系的赤霉病综合抗性。种子成熟后,单穗单收,脱粒后统计病粒率(Percentage of diseased kernel,FDK),分别鉴定各株系的抗侵入、抗扩展和综合抗病性。

表1 供试的小麦数量性状位点及选用的分子标记
TypeⅠ:抗侵入型;TypeⅡ:抗扩展型。 TypeⅠ:Resistance to penetration; TypeⅡ:Resistance to expansion.
病穗率(PIS)=(发病穗数÷总穗数)×100%
病小穗数(NDS)=单穗发病小穗数
病小穗率(PDS)=(发病小穗数÷单穗小穗总数)×100%
病粒率(FDK)=(感病籽粒数÷总籽粒数)×100%
1.3 数据分析
试验数据通过Excel 2007和SPSS 16.0软件进行统计分析,使用Dunnett’s法进行差异显著性检验。
2 结果与分析
2.1 小麦遗传材料的选育
与 Fhb1、 Fhb2、 Fhb4和 Fhb5紧密连锁的分子标记 Xbarc147、 Xgwm644、 Xgwm149和 Xbarc117的多态位点分别位于122、152、161和216 bp处(图1)。通过田间自然生长和温室加代培养分别获得BC3F1- Fhb1+ Fhb2和BC3F1- Fhb4+ Fhb5的单株,将两者杂交得到F1- Fhb1+ Fhb2+ Fhb4+ Fhb5,自交后通过分子标记辅助选择获得目标区间纯合的不同QTL组合F2单株(例如,F2- Fhb1+ Fhb2单株代表这两个QTL区段来自供体亲本,其他位点皆来自受体亲本),再自交繁育成F3代株系,用以田间抗性鉴定,评价不同QTL的抗病性。共获得15组不同QTL组合类型(图2),每种类型2个株系,共有30个株系(B1-B30)。

1在A、B中为苏麦3号,在C、D中为望水白;2:矮抗58; 3~8:F2单株;箭头所指为多态位点。
1 was Sumai 3 in A and B,and was Wangshuibai in C and D; 2:Aikang 58; 3-10:Individual plants of F2;Arrows indicate polymorphic positions.
图1 矮抗58背景下 Fhb1(A)、 Fhb2(B)、 Fhb4(C)和 Fhb5(D)基因型鉴定
Fig.1 Genotypes of Fhb1(A), Fhb2(B), Fhb4(C),and Fhb5 (D) in Aikang 58 background
2.2 抗侵入效应分析
小麦赤霉病的抗侵入能力通常用病穗率、病粒率来衡量。由表2可知,在塑料大棚和大田两种不同的环境下,供体亲本望水白的平均病穗率分别为3.5%和6.8%,平均病粒率为1.7%和2.4%;受体亲本矮抗58的平均病穗率和病粒率分别为62.3%、71.5%和33.4%、48.4%。携带单个 Fhb4株系的平均病穗率和病粒率分别为37.5%和23.2%;携带单个 Fhb5株系的平均病穗率和病粒率分别为37.5%和30.5%;同时携带 Fhb4和 Fhb5株系的平均病穗率和病粒率分别为18.1%和10.9%;没有携带 Fhb4或 Fhb5株系的平均病穗率和病粒率分别为65.5%和40.1%。差异显著性分析表明,同时携带 Fhb4和 Fhb5株系的抗侵入性显著高于携带单个 Fhb4或 Fhb5株系,而携带单个 Fhb4或 Fhb5株系的抗侵入性显著高于不含有 Fhb4或 Fhb5株系,但它们均显著低于供体亲本望水白;不含有 Fhb4或 Fhb5株系的抗侵入性与受体亲本矮抗58间无显著差异。 说明 Fhb4和 Fhb5具有显著的抗侵入能力,且两者之间存在明显加性效应。 Fhb1和 Fhb2没有显著的抗侵入能力。
2.3 抗扩展效应分析
小麦赤霉病的抗扩展能力通常用病小穗数、病粒率来衡量。由表3可知,在塑料大棚和大田两种环境下,供体亲本苏麦3号的平均病小穗数为1.2,平均病粒率为6.3%;受体亲本矮抗58的病小穗数和病粒率分别为7.8和73.1%。携带单个 Fhb1株系的平均病小穗数和病粒率分别为1.9和22.6%;携带单个 Fhb2株系的平均病小穗数和病粒率分别为4.0和51.6%;同时携带 Fhb1和 Fhb2株系的平均病小穗数和病粒率分别为1.8和21.4%;没有携带 Fhb1或 Fhb2株系的平均病小穗数和病粒率分别为7.6和73.4%。差异显著性分析表明,同时携带 Fhb1和 Fhb2株系的抗扩展性显著高于携带单个 Fhb2株系,但与携带单个 Fhb1株系无显著差异,而它们都显著高于不含有 Fhb1或 Fhb2株系,却显著低于供体亲本苏麦3号,不含有 Fhb1或 Fhb2株系与受体亲本矮抗58间无显著差异。说明 Fhb1和 Fhb2具有显著的抗扩展能力,且 Fhb1的抗扩展效应大于 Fhb2。 Fhb4和 Fhb5没有显著的抗扩展能力。

图2 遗传材料选育流程图

株系LineQTLFhb1Fhb2Fhb4Fhb5塑料大棚Plasticgreenhouse病穗率PIS/%标准误S.E.病粒率FDK/%标准误S.E.大田Field病穗率PIS/%标准误S.E.病粒率FDK/%标准误S.E.望水白Wangshuibai//++3.5a0.21.7a0.46.8a0.42.4a0.1矮抗58Aikang58----62.3d1.133.4d1.671.5d1.848.4d1.2B1+---58.9d1.332.4d1.573.4d2.244.3d1.1B2+---61.2d1.434.8d1.669.5d1.942.7d1.3B3-+--57.8d1.535.2d1.770.3d2.145.6d0.9B4-+--59.6d1.236.4d1.867.6d1.646.1d1.4B5--+-34.3c1.419.3c1.340.2c1.125.1c0.8B6--+-32.8c1.620.2c1.238.8c0.926.5c0.6B7---+33.5c1.122.3c1.541.5c1.424.8c0.7B8---+34.7c1.421.6c1.339.4c1.326.8c0.8B9++--65.4d1.538.8d1.771.5d2.145.3d1.2B10++--62.8d1.735.6d1.268.5d2.243.7d1.3B11+-+-33.7c1.222.4c1.139.8c1.527.1c0.9B12+-+-31.4c1.920.9c1.241.1c1.326.4c1.0B13+--+33.1c1.223.2c1.338.9c1.725.5c1.1B14+--+34.2c1.520.6c1.140.7c1.124.7c0.6B15-+-+36.2c1.221.7c1.043.2c1.322.9c0.4B16-+-+33.1c1.419.8c0.937.8c1.220.7c1.2B17-++-37.2c1.222.3c1.139.4c1.024.6c1.3B18-++-36.5c1.121.7c1.036.9c0.922.7c1.2B19--++14.2b0.89.7b0.522.5b0.612.3b0.4B20--++15.1b1.010.3b0.821.9b0.711.9b0.7B21+++-37.1c1.320.4c1.139.7c1.325.1c0.9B22+++-36.7c1.121.4c1.243.2c1.524.7c1.0B23+-++17.2b1.39.8b0.519.9b1.412.2b0.8B24+-++15.5b1.19.7b0.621.6b0.711.5b0.4B25++-+33.8c1.220.8c1.142.7c1.624.5c0.9B26++-+35.7c1.119.9c1.241.9c1.726.7c0.7B27-+++13.5b0.99.6b0.422.5b1.512.1b0.8B28-+++14.1b0.710.0b0.520.7b1.613.1b0.5B29++++15.6b1.29.4b0.821.5b0.710.8b0.3B30++++13.4b1.19.7b0.720.3b0.912.4b0.2
+:阳性;-:阴性;同列数据后不同字母表示在0.05水平差异显著。下同。
PIS:Percentage of infected spikes; FDK:Percentage of diseased kernel;+:Positive; -:Negative;Different letters following data indicate significant difference at 0.05 level. The same below.
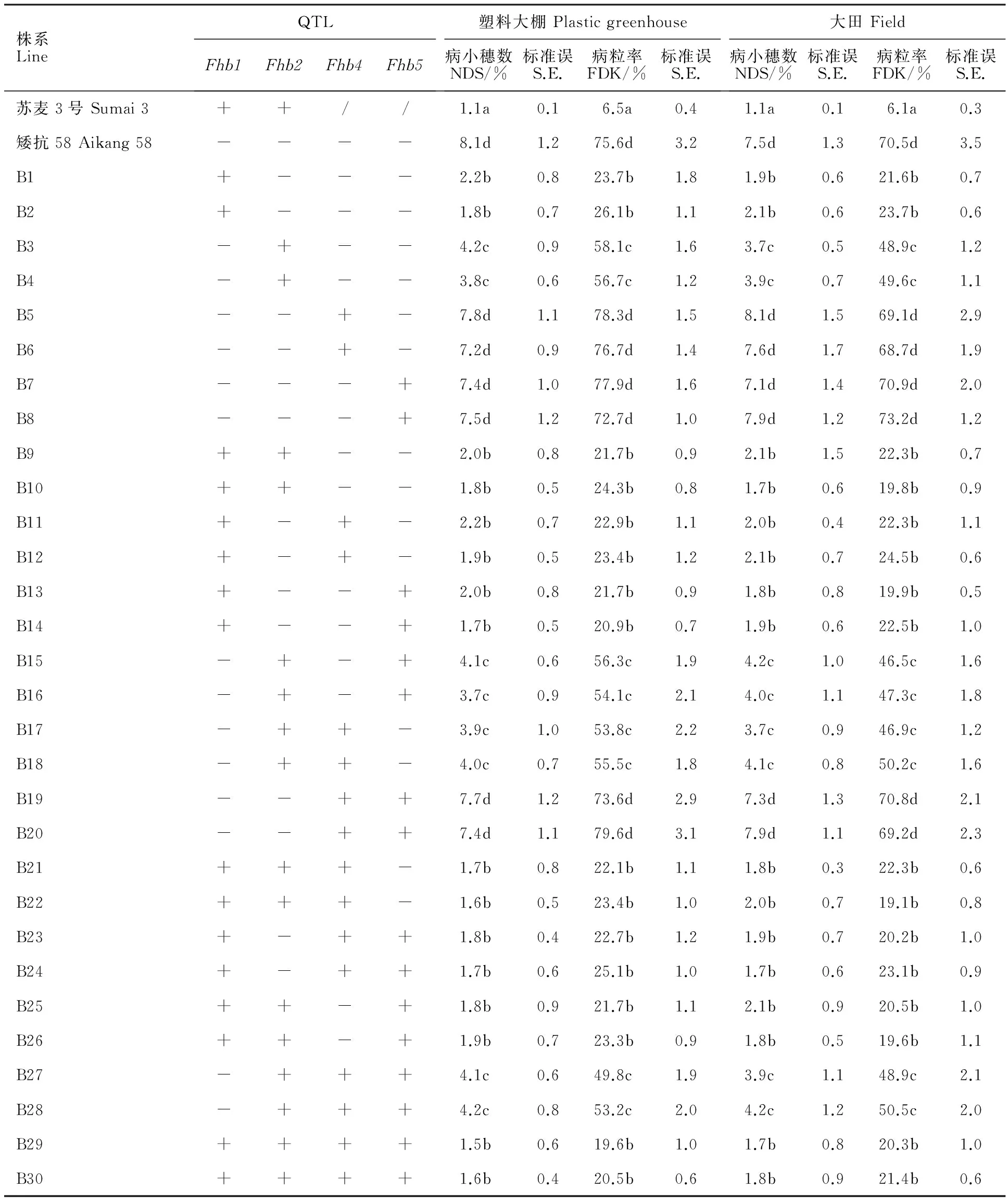
表3 不同QTL组合的抗扩展性
NDS:Number of disease spikelets.
2.4 田间综合抗病性分析
通常用盛花期后21 d的病小穗率、病粒率衡量鉴定材料的综合抗病性(表4)。在塑料大棚和大田两种环境下,供体亲本苏麦3号因其在生长后期颖壳变红,与病斑颜色接近,无法统计相应的病小穗率,但病粒率平均值为6.2%;供体亲本望水白的平均病小穗率和病粒率分别为8.1%和4.8%;受体亲本矮抗58的平均病小穗率和病粒率分别为92.5%和77.7%。携带单个QTL株系的平均病小穗率和病粒率分别为85.7%和73.6%;在含有2个QTL的株系中,携带同种抗性类型株系的平均病小穗率和病粒率分别为84.2%和73.9%,而携带 Fhb1株系的平均病小穗率和病粒率分别为38.6%和33.5%,携带 Fhb2株系的平均病小穗率和病粒率分别为59.1%和53.4%;在携带3个QTL的株系中,含有 Fhb1株系的平均病小穗率和病粒率分别为22.9%和18.9%,不含有 Fhb1株系的平均病小穗率和病粒率则分别为48.2%和44.9%;携带4个QTL株系的平均病小穗率和病粒率分别为20.1%和18.6%。差异显著性分析结果显示,携带单个QTL株系或携带两个同抗性型QTL株系综合抗性与受体矮抗58之间没有显著差异,但不同抗性类型的QTL组合株系的抗病能力显著高于单个QTL或同类QTL组合;携带 Fhb2株系抗病能力显著低于含有 Fhb1株系;当株系同时携带 Fhb1与 Fhb4、 Fhb5时,不论是否含 Fhb2,都表现出较高的抗病性;但是所有株系的抗病性都显著低于望水白和苏麦3号。

表4 不同QTL组合的综合抗病性
PDS:Percent of disease spikelets.
3 讨 论
苏麦3号和望水白是我国对小麦赤霉病田间抗性表现最佳的两个品种。前者是由中感赤霉病的品种阿芙和台湾小麦杂交后获得的超亲遗传后代,而后者则是从江苏溧阳收集到的一个农家品种,二者之间没有可以确定的共同遗传基础,因而可能携带了不同的抗赤霉病基因资源。苏麦3号在育种中利用较早,已经衍生出诸如宁7840、CM-82036等近200个小麦品系,但抗性水平普遍在中抗以下,且农艺性状表现不突出,生产上难以大规模推广使用[23]。望水白植株高大、茎秆细弱,农艺性状极差[24],与高产感病品种杂交产生的后代两极分化明显,几乎选择不到适中的类型,因而在生产上没有得到应用。
分析4个基因对小麦赤霉病的抗侵入性发现,来自望水白的 Fhb4和 Fhb5具有显著的抗侵入特性,两者之间存在加性效应,但是没有抗扩展能力。抗扩展性试验结果表明,来自苏麦3号的 Fhb1和 Fhb2具有显著的抗扩展能力, Fhb1的效应显著大于 Fhb2,两者聚合后不能带来比单个 Fhb1更显著的抗病性,且两者均没有明显的抗侵入能力。综合抗病性的分析显示,只携带1个QTL株系的抗病性与受体亲本无显著差异;携带2个QTL的株系,如果为同种抗性类型QTL,其抗病能力也与受体亲本无显著差异,而携带不同抗性类型QTL,则抗病性较对照显著增强。携带 Fhb2的株系抗病性显著弱于含有 Fhb1的株系,这与 Fhb2的抗扩展能力显著低于 Fhb1有直接关系。携带3个QTL的株系具有较高抗病性,但是当抗扩展QTL只有 Fhb2的株系,抗病表现显著低于其他三种组合类型;携带4个QTL的株系,具有较强的抗病性,但与携带 Fhb1的不同抗性类型组合的株系没有显著差异。抗侵入和抗扩展分别是小麦抵御赤霉病侵袭的两道主要屏障,任何一个失效都可能导致病原菌的成功定殖,因此,在QTL的实际利用中必须考虑将不同抗性类型的QTL聚合使用,单一使用某一抗性类型的QTL,最终都会导致育成材料失去抗病性,尤其是在赤霉病流行发生年份表现会更加明显。聚合3个或4个QTL的株系表现出更佳的抗病表现,但是与苏麦3号、望水白相比,抗病性仍然较低,这可能与供体亲本中携带的其他微效QTL未能有效利用有关。
连锁累赘是育种实践中的普遍问题,在抗赤霉病育种中也存在相同困扰。4个QTL所处的染色体区间大多与一些农艺性状位置接近,遗传上紧密连锁,而供体亲本的这些农艺性状位点多为表现较差的等位位点,在育种中大多已被淘汰[14-15]。因此,在利用这些抗性位点时,仅仅通过1次或少数几次杂交不可能完全去除掉不利位点,需要进一步扩大分离群体规模,同时结合分子标记辅助选择,找到与不利性状发生重组的个体,再进行杂交聚合,这样在保留抗病QTL的同时,最大程度规避不利农艺性状的干扰。本试验中获得的这些株系,虽然与受体亲本经过3次回交,仍然表现出与受体亲本不同的表现,而且聚合越多的QTL与受体亲本外观差异越大。因而建议利用不同抗性QTL时,应先从选择单个QTL开始,通过较大的分离群体获得没有不利连锁的QTL,再进行杂交聚合,将更容易获得抗性较好且农艺性状优良的后代。
[1] 李振声.我国小麦育种的回顾与展望[J].中国农业科技导报,2010,12(2):1.
LI Z S.Retrospect and prospect of wheat breeding in China [J].JournalofAgriculturalScienceandTechnology,2010,12(2):1.
[2] 何中虎,夏先春,陈新民,等.中国小麦育种进展与展望[J].作物学报,2011,37(2):202.
HE Z H,XIA X C,CHEN X M,etal.Progress of wheat breeding in China and the future perspective [J].ActaAgronomicaSinica,2011,37(2):202.
[3] 钱 丹,骆 孟,董晶晶,等.小麦品种宁7840突变体农艺性状和赤霉病抗性解析[J].麦类作物学,2016,36(2):243.
QIAN D,LUO M,DONG J J,etal.Evaluation of agronomic traits and resistance toFusariumhead blight of Ning 7840 and its mutants [J].JournalofTriticeaeCrops,2016,36(2):243.
[4]MESTERHAZY A.Types and components of resistance toFusariumhead blight of wheat [J].PlantBreeding,1995,114:377.
[5]WALDRON B L,MORENO-SEVILLA B,ANDERSON J A,etal.RFLP mapping of QTL forFusariumhead blight resistance in wheat [J].CropScience,1999,39:805.
[6]LIU S Y,ANDERSON J A.Targeted molecular mapping of a major wheat QTL forFusariumhead blight resistance using wheat ESTs and synteny with rice [J].Genome,2003,46:817.
[7]LIU S,PUMPHREY M,GILL B,etal.Toward position cloning of Fhb1,a major QTL forFusariumhead blight resistance in wheat [J].CerealResearchCommunications,2008,36:195
[8]CUTHBERT P,SOMERS D,BRULE-BABEL A.Mapping of Fhb2on chromosome 6BS:A gene controllingFusariumhead blight field resistance in bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2007,114:429.
[9]QI L L,PUMPHREY M O,FRIEBE B,etal.Molecular cytogenetic characterization of alien introgressions with gene Fhb3 for resistance toFusariumhead blight disease of wheat [J].TheoreticalandAppliedGenetics,2008,117:1155.
[10]XUE S L,LI G Q,JIA H Y,etal.Fine mapping Fhb4,a major QTL conditioning resistance toFusariuminfection in bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2010,121:147.
[11]XUE S L,XU F,TANG M Z,etal.Precise mapping Fhb5,a major QTL conditioning resistance toFusariuminfection in bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2011,123:1055.
[12]CAINONG J C,BOCKUS W W,FENG Y,etal.Chromosome engineering,mapping,and transferring of resistance toFusariumhead blight disease fromElymustsukushiensisinto wheat [J].TheoreticalandAppliedGenetics,2015,128:1019.
[13]GUO J,ZHANG X L,HOU Y L,etal.High-density mapping of the major FHB resistance gene Fhb7 derived fromThinopyrumponticumand its pyramiding with Fhb1 by marker-assisted selection [J].TheoreticalandAppliedGenetics,2015,128:2301.
[14]BUERSTMAYR H,BAN T,ANDERSON J.QTL mapping and marker-assisted selection forFusariumhead blight resistance in wheat:A review [J].PlantBreeding,2009,128:1.
[15]LIU S Y,HALL M,GRIFFEY C,etal. Meta-analysis of QTL associated withFusariumhead blight resistance in wheat [J].CropScience,2009,49:1955.
[16]XUE S L,LI G Q,JIA H Y,etal.Marker-assisted development and evaluation of near-isogenic lines for scab resistance QTLs of wheat [J].MolecularBreeding,2010,25:397.
[17]YOSHIMURA S,YOSHIMURA A,IWATA N,etal.Tagging and combining bacterial blight resistance genes in rice using RAPD and RFLP markers [J].MolecularBreeding,1995,1:375.
[18]HITTALMANI S,PARCO A,MEW T W,etal.Fine mapping and DNA marker assisted pyramiding of the three major genes for blast resistance in rice [J].TheoreticalandAppliedGenetics,2000,100:1121.
[19]ZHU H,BRICENO G,DOVEL R,etal.Molecular breeding for grain yield in barley:An evaluation of QTL effects in a spring barley cross [J].TheoreticalandAppliedGeneties,1999,98:772.
[20]ZHU H,BRICENO G,DOCVEL R,etal.Molecular breeding for grain yield in barley:An evaluation of QTL effects in a spring barley cross [J].TheoreticalandAppliedGenetics,1999,98:772.
[21]MA Z Q,SORRELLS M E.Genetic analysis of fertility restoration in wheat using restriction fragment length polymorphisms [J].CropScience,1995,35:1137.
[22]RODER M S,KORZUN V,WENDEHAKE K,etal.A microsatellite map of wheat [J].Genetics,1998,149:2007.
[23] 冷苏凤,张爱香,李 伟,等.江苏省小麦新品种(系)对赤霉病的抗性分析[J].江苏农业科学,2010,6:108.
LENG S F,ZHANG A X,LI W,etal.The resistance analysis of new varieties(lines) to wheat scab in Jiangsu province [J].JiangsuAgriculturalSciences,2010,6:108.
[24] 廖玉才,余毓君.小麦地方品种望水白抗赤霉病性的遗传分析[J].华中农学院学报,1985,4(2):6.
LIAO Y C,YU Y J.Genetic analysis of scab resistance in the local wheat variety Wangshuibai [J].JournalofHuazhongAgriculturalUniversity,1985,4(2):6.
Analysis of Pyramiding Effect of Major QTLs for Resistance to Scab in Wheat
XU Feng,LI Wenyang,YAN Suhui,ZHANG Congyu,ZHENG Jiacheng,DU Junli,ZHANG Zixue,SHI Xiaqing
(College of Agriculture,Anhui Science and Technology University,Fengyang,Anhui 233100,China)
In order to clarify the wheat scab resistance effect of major QTLs,four major QTLs were backcrossed into susceptible variety Aikang 58 based on molecular marker assisted selection,and 30 different combinations of QTL were conducted,which were used for inoculation,resistance to expansion and comprehensive resistance identification by single floret inoculation and spraying spores inoculation,respectively. Among them, Fhb1 and Fhb2 are derived from Sumai 3,and Fhb4 and Fhb5 are originated from Wangshuibai. The results showed that the lines containing Fhb1 and Fhb2 performed significant resistance to expansion,and the effect of Fhb1 was significantly higher than that of Fhb2,but neither of them had anti-penetration effect. The lines with Fhb4 and Fhb5 presented obvious resistance to penetration,and the cumulative effect of them was more remarkable than that of individual Fhb4 or Fhb5,but there was no obvious ability to anti-expansion effect. The lines with different resistance types of QTLs had more comprehensive resistance than those with any single resistance type of QTL. Therefore,pyramiding different resistance types of QTLs is more effective than single QTL for scab resistance in wheat breeding practice.
Wheat; Scab resistance; QTL; Pyramiding effect
时间:2017-05-12
2016-12-01
2016-01-04
安徽省教育厅自然科学基金重点项目(KJ2015A221);安徽科技学院重点学科资助项目(AKZDXK2015A03)
E-mail:xuf@ahstu.edu.cn
S512.1;S330
A
1009-1041(2017)05-0585-09
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170512.1955.006.html
