脉冲参数对LiCl-NaCl-KCl-TiClx熔盐体系沉积钛的影响
2017-06-15卢建红焦树强
张 龙,朱 骏,宋 阳,卢建红,焦树强
脉冲参数对LiCl-NaCl-KCl-TiCl熔盐体系沉积钛的影响
张 龙,朱 骏,宋 阳,卢建红,焦树强
(北京科技大学钢铁冶金新技术国家重点实验室,北京100083)
以TA3钛板为阳极,纯镍板为阴极,在550℃的 LiCl-NaCl-KCl-TiCl体系中,研究钛离子阴极电化学行为;同时研究脉冲电解参数对阴极沉积过程的影响。结果表明:阴极上Ti3+的电化学行为是经放电变成Ti2+再进一步被还原成Ti的过程;与恒电流电解相比,脉冲电解更易得到致密沉积产物,且产物结晶度更高、氧氮含量更低;脉冲电解参数对阴极产物沉积形貌有重要影响,电解周期(c)为10 min时,通断比()过大或过小均不利于阴极产物长大,且阴极电流效率低。最佳脉冲电解条件为阴极电流密度0.3 A/cm2、通电周期20 min、通断比()1,此时获得的阴极产物结晶度高,颗粒尺寸大且产物致密,电流效率达87.4%。
钛;脉冲电沉积;熔盐电解;阴极电流效率
钛因密度小、强度高、耐高温性能好、耐腐蚀等优异性能被赋予“第三金属”美誉,广泛应用于航空航天、海洋、化工、电子、生物医学等领域[1−3]。现行金属钛工业生产主要采用Kroll法,存在工艺流程长、能耗高、环境污染严重等诸多问题,限制了金属钛的进一步应用。随着经济发展,到2013年止,我国海绵钛产能占世界总产能的47.5%[3],因此寻找一种能耗低、环境友好的钛冶炼工艺对我国钛产业可持续发展具有重要意义。
熔盐电解法一直以来都是被看好的一种可替代Kroll工艺的钛冶炼方法,其工艺简单、反应温度相对较低且对环境友好[4−6]。早期研究采用TiCl4作原料,尽管在实验室中取得了成功,但在工业放大时遇到诸多问题而被迫放弃。其中最典型的代表为意大利GGT公司的Ginatta电解工艺[7]。近些年来,世界各国均加大了对非TiCl4原料熔盐电解制钛研究的力度,并提出了多种工艺方案。比较有代表性且已进入工业化规模试验的有英国剑桥大学FFC工艺[8]、日本京都大学OS工艺[9]、美国MER公司MER工艺[10]等。国内方面,以北京科技大学朱鸿民教授的熔盐电解制钛,以及焦树强教授的熔盐电解精炼钛为代表的一批具有完全自主知识产权的工艺技术,也已顺利开始工业化规模试验[11−12]。
与铝、镁工业电解不同,电解钛时熔盐一般处于静止状态。在这种情况下采用正常恒电流电解,容易出现阴极产物颗粒较细、夹盐严重等问题[13]。上述工业化规模试验过程中也发现,制约熔盐电解钛工业化生产的瓶颈主要有两个:一是如何有效将电解产物与电解质分离;二是如何获得质量稳定的阴极产物。这些问题均与阴极产物沉积形貌密切相关。阴极产物长得越大越致密,结晶程度越高,产物夹盐就越少,质量越好,电流效率也越高。研究表明[14−15],钛离子在金属(铂或低碳钢)电极上的沉积为瞬时形核过程,其晶核长大受扩散过程控制。因此,解决熔盐电解钛阴极沉积问题的主要途径在于强化阴极表面传质,如熔体搅拌,或脉冲电解。
相对熔体搅拌而言,脉冲电解更易操作控制。宁晓辉等[16]曾在750 ℃研究了NaCl-KCl体系中脉冲电流法在周期为10 s时不同通断比的参数下对金属钛沉积过程的影响,发现当通断比为1:1时,阴极可得到较好镀层。此外,倪福生等[17]还发现,在低温度下电解钛可降低产物中O、N、Fe等杂质含量。因此,本文作者选择在550 ℃下研究LiCl-NaCl-KCl-TiCl体系中脉冲电解参数(电解周期、电流通断比)对阴极钛沉积产物的影响。所获结果可为工业化熔盐电解生产金属钛提供理论基础和技术依据。
1 实验
实验采用分析纯LiCl、NaCl、KCl,按摩尔比4:1:5配料混匀,然后于300 ℃真空脱水48 h,再在高纯氩保护下升温至600℃预熔并保温5 h。随后,按照文献[18]的方法制备LiCl-NaCl-KCl-TiCl低价钛盐。
电化学测试和电解实验均在自制气氛电阻炉中进行(刚玉坩埚电解池,实验温度(550±1)℃,CHIND DI3000程序控温),如图1所示。电化学测试(Solartron 1278)采用三电极体系,工作电极镍板(2 mm×10 mm),对电极TA3钛板(50 mm×50 mm),参比电极为2 mm纯钛棒,测试所用熔盐中Ti2+和Ti3+的质量分数分别为0.47%和0.17%。电解实验使用预制好的LiCl-NaCl-KCl-TiCl熔盐(其中含Ti2+4.1%和Ti3+1.55%),阴极为10 mm×40 mm镍板,阳极为 50 mm×50 mm的TA3钛板,阴阳极极间距为2.25 cm;阴极电流密度0.3 A/cm2,电流由电化学工作站(Solartron 1278)提供。所有实验全程通氩气保护。
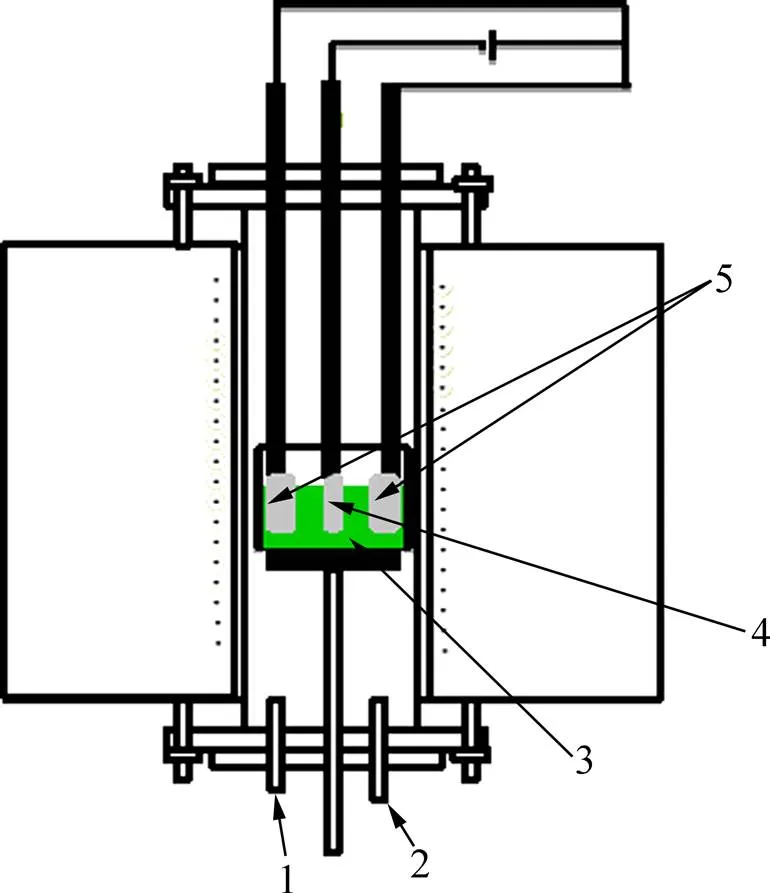
图1 电解装置示意图
实验结束并冷却至室温后,取出阴极产物。用质量分数2%~3%的稀盐酸浸泡30 min,再使用去离子水洗至中性,过滤后放入真空干燥箱干燥。用称量法测定阴极产物质量,按式(1)计算电流效率:
1/(Ti) (1)
式中:1为干燥后产物质量;为法拉第常数;为电流强度;为时间;Ti为钛的相对原子质量;为电子转移数。
用X射线衍射仪(XRD,Rigaku D/max-RB,Cu K照射)和冷场发射扫描电子显微镜(FESEM,JEOL JSM−6701F)分析产物形貌、成分和物相组成;用氧氮氢分析仪(LECO TCH600)分析产物中氧和氮含量。
2 结果与讨论
2.1 Ti离子的阴极行为
图2所示为Ni电极在LiCl-NaCl-KCl-TiCl体系中的循环伏安曲线。从图2可以看出,在负向扫描过程中,在0.1和−0.19 V附近出现了两个还原峰、,分别对应于在阴极Ti3+被还原成Ti2+及Ti2+还原成金属钛;正向扫描时,有对应的氧化峰′、′出现,这对应于阴极沉积的金属钛重新溶解生成Ti2+和Ti3+的过程。这与LiCl-KCl体系中的测试结果[19−20]类似。说明在LiCl-NaCl-KCl-TiCl体系中,Ti2+同样是一步还原过程,而Ti3+是两步还原,即先被还原成Ti2+,而后再被还原成金属钛。

图2 LiCl-NaCl-KCl-TiClx体系中Tin+的循环伏安曲线(温度550℃,扫描速率50 mV/s)
为验证循环伏安测试结果,采用镍工作电极在LiCl-NaCl-KCl-TiCl体系中进行方波伏安测试,结果如图3所示。由图3可见,Ti离子在还原过程中出现两个明显的还原峰。对该方波伏安曲线进行高斯拟合,通过式(2)计算两个过程的电子转移数[21]:
1/2=3.52/() (2)
式中:1/2为半峰宽;为摩尔气体常数;为温度;为反应转移电子数;为法拉第常数。计算得到两个峰对应的电子转移数依次为1.04和2.06。说明这两个反应分别为Ti3+得到一个电子转化为Ti2+,以及Ti2+得到2个电子转化为Ti的过程。
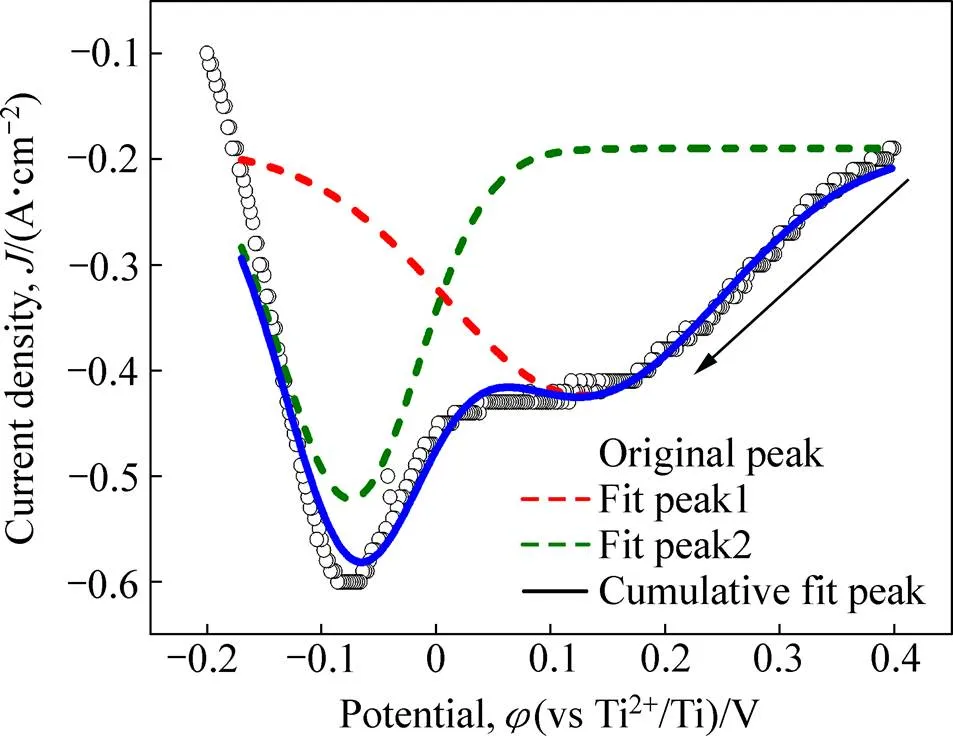
图3 550℃下Tin+在LiCl-NaCl-KCl-TiClx体系中的方波伏安曲线(方波振幅20 mV,频率50 Hz)
循环伏安和方波伏安的测试结果表明,Ti3+→Ti2+以及Ti2+→Ti这两个还原过程都受扩散控制。因为当电流密度较大时,电极表面的Ti3+、Ti2+很快被消耗,而熔体中Ti3+、Ti2+物质传输速率远低于电极表面消耗速率,所以电极表面Ti3+、Ti2+来不及补充,故在循环伏安扫描时出现对应峰。可见,在恒电流电解时,随着电解进行必定会导致电极表面Ti3+、Ti2+缺乏进而形成严重的浓差极化。这是导致钛电解阴极产物形貌不好,夹盐夹杂严重的根本原因。
2.2 脉冲电解沉积金属钛
根据上面的研究,如何消除钛离子扩散速度慢引起的浓差极化是改善阴极沉积的关键。脉冲电解是一个能有效解决该问题的手段。图4所示为脉冲电解电流−时间示意图。一个电解周期分为通电期on和断电期off。当电流处于on时,阴极表面发生电化学反应;当电流处于off时,阴阳极之间没有净电流流过,熔盐本体中的钛离子扩散到阴极附近以进行补充。图中,c=on+off表示电解周期,=on/off表示通断比。
图5所示为脉冲电解(=1,c=20 min)和恒电流电解时,槽电压随时间变化曲线的对比。恒电流电解时,槽压持续降低,这是由于随着电解的进行,阴极产物在电极表面不断沉积,从而导致电极面积不断增大所导致。电极面积的增大,会导致电流密度降低。这也是导致恒电流电解阴极产物形态较差的另一个重要原因。而脉冲电解的电压比较平稳,几乎不随时间改变,且不同周期间的电压也基本一致。这意味着脉冲电解条件对改善阴极产物沉积有利。

图4 脉冲电解电流−时间示意图
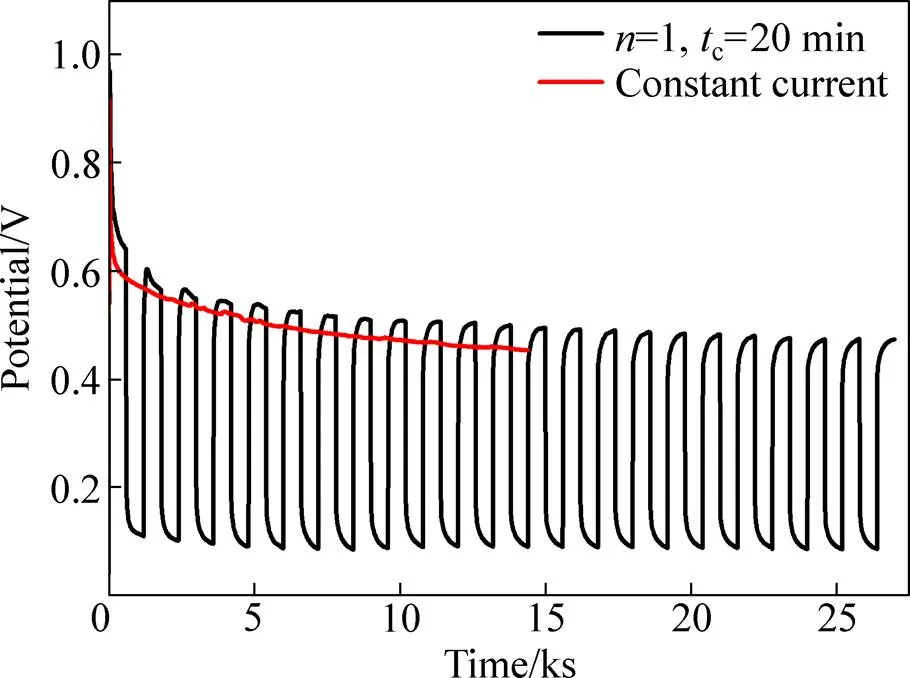
图5 脉冲电解(n=1,tc=20 min)和恒电流电解槽电压对比
图6所示为脉冲电解(=1,c=20 min)和恒电流电解所获阴极产物的光学照片与SEM像对比。由图6可以看出,脉冲电解所得产物较致密,基本为块体;而恒电流电解的产物大部分呈分散颗粒状。对比两者微观形貌,脉冲电流法所得产物尺寸较大,一般在数百微米左右;而恒电流电解产物平均尺寸不足100 μm。对产物进行XRD分析,结果如图7所示。与标准卡片(PDF No.89−5009)比对,确定产物为金属钛。用Jade 6.0软件计算得到脉冲电解和恒电流电解产物的结晶度分别为71.39%和60.48%。表明脉冲电解条件更有利于阴极沉积产物的晶体生长。显然,这对改善阴极产品质量有利。表1给出了两种产物的氧和氮含量分析结果。可以看到,相比恒电流电解,脉冲电解产物的氧含量和氮含量均至少降低了一半。

图6 脉冲电解(n=1,tc=20 min)和恒电流电解的阴极产物光学照片及SEM像
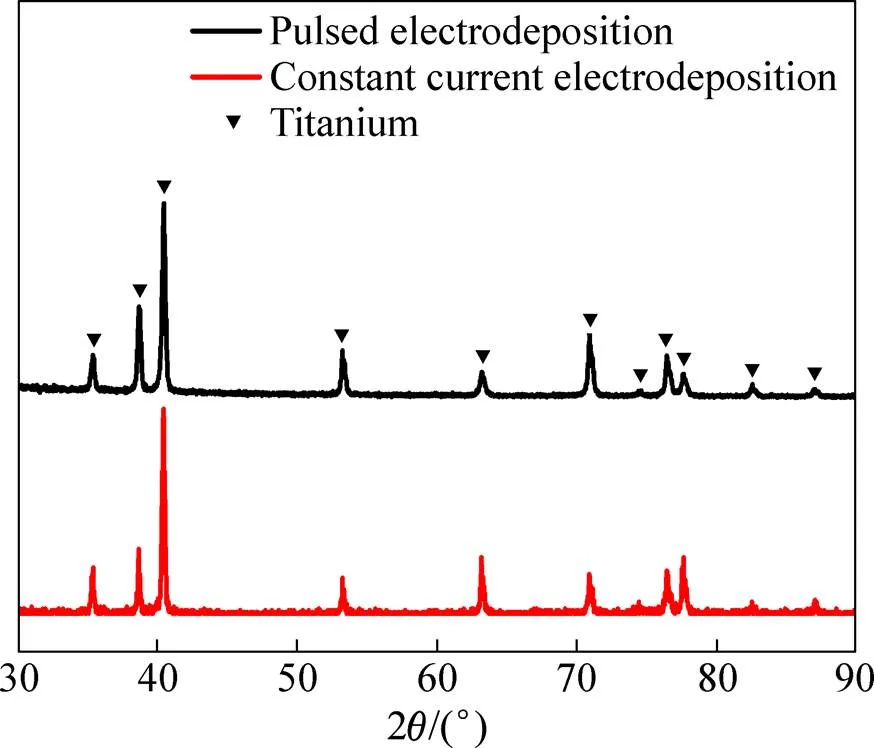
图7 脉冲电解(n=1,tc=20 min)和恒电流电解产物XRD分析

表1 脉冲电流法产物与恒电流电解产物中氧和氮含量
2.3 脉冲参数对沉积过程的影响
2.3.1 脉冲参数对产物形貌的影响
根据形核理论,电化学沉积产物的形貌主要由形核电流(也叫形核速率)和晶核生长电流(也叫晶核生长速率)之间的相互关系决定。在总电流不变的前提下,形核电流n与晶核生长电流g之间存在如下关系[18]:
=n+g(3)
由式(3)可见,电解过程中若形核电流过大,则晶核生长电流就必然减小,从而导致沉积产物颗粒细小。
另一方面,形核速率正比于单位时间内的形核数。而形核数主要取决于电极表面金属离子浓度[22]:
n=+lg(k/Me) (4)
式中:n为形核数;和是与金属特性及温度相关的常数;k为电流密度,A/cm2;Me为电极表面金属离子浓度,mol/L。
根据式(4),刚开始电解时,电极表面金属离子浓度最高,接近熔盐本体浓度。此时形核数最小,可得到较大晶粒产物。然而随着电解进行,电极表面金属离子被消耗,而熔盐本体中的金属离子由于扩散作用,不能及时补充到电极表面,从而造成电极表面金属离子浓度降低,形核数变大,产物变细。这就是恒电流电解产物较细的根本原因。而当采用脉冲电解,在断电期间,熔盐本体中的金属离子有时间扩散到电极表面,以维持电极表面金属离子浓度稳定,从而获得大颗粒产物。
图8所示为不同脉冲参数下阴极产物的SEM像。由图8可以看出,当电解周期为10和20 min、通断比=1时,所得产物颗粒较大。这是由于在通电周期较短的前提下,通断比较小(=1/3),通电时间不足,产物没有足够时间长大;而通断比较大(=3),断电时间短,电解过程中熔盐本体的钛离子来不及补充阴极附近区域内钛离子的消耗,导致产生浓差极化,故所得产物颗粒尺寸同样不大。不过随着电解周期的延长(c=30min),不同通断比下的产物尺寸接近。这意味着延长电解周期,也有利于产物长大,但通断比对产物大小基本不再有影响。造成这种现象,是由于延长电解周期后,通电时间和断电时间均相对较长,产物不仅有足够时间生长,同时阴极区附近消耗的钛离子也有足够时间得到补充,所以产物颗粒较大,尺寸相近。
2.3.2 脉冲参数对阴极电流效率的影响
阴极电流效率是反映电解工艺好坏的一个重要指标。本电解实验中所用电解质体系中Ti2+与Ti3+共存,其质量分数分别为4.1%和1.55%。根据2.1节得到的电子转移数,可计算出钛离子的平均电子转移数为2.27。将该值代入式(1),可得到不同电解周期下的阴极电流效率,如表2所列。由表2可见,在同一电解周期c下,通断比=1时的电流效率均最高。由前文SEM分析可知,这主要是因为在该通断比条件下所得产物颗粒均较大。这样的阴极沉积产物不仅夹盐夹杂少,而且在后续处理过程中不易损失,因此电流效率较高。这与文献[16]的研究结果一致。此外,通过对比发现,随着电解周期延长,脉冲通断比对电流效率及产物尺寸的影响在不断减弱。当周期c=20 min,通断比=1时,电流效率可达87.4%,远高于恒电流电解时的75.8%。说明脉冲电解不仅能改善阴极沉积产物的形貌和品质,还有助于提高阴极电流效率。

图8 不同电解参数下电解产物SEM像

表2 不同条件下电流效率值
(Galvanostatic electrolysis efficiency:75.8%)
3 结论
1) 脉冲电流电解较恒电流电解更易得到较致密的阴极产物,且产物结晶度更高、氧氮含量更低。
2) 阴极产物沉积形貌与脉冲电解参数有关。电解周期较短时,通断比过大或过小,均不利于阴极沉积产物长大;延长电解周期,有利于产物长大,同时通断比对产物尺寸的影响减小。
3) 在阴极电流密度为 0.3 A/cm2的条件下,电解周期c=20 min,通断比=1时,脉冲电解获得的阴极产物结晶度高,颗粒尺寸大且较致密,电流效率达87.4%。
REFERENCES
[1] WENG Qi-geng, YUAN Tie-chui, LI Jian, HE Yue-hui. Valence states, impurities and electrocrystallization behaviors during molten salt electrorefining for preparation of high-purity titanium powder from sponge titanium[J]. Transactions of Nonferrous Metals Society of China, 2014, 24(2): 553−560.
[2] SONG Y, JIAO S, HU L, GUO Z. The cathodic behavior of Ti(III) ion in a NaCl-2CsCl melt[J]. Metallurgical and Materials Transactions B, 2016, 47(1): 804−810.
[3] 中国有色金属工业协会钛锆铪分会. 中国钛工业现状及发展趋势[J]. 中国金属通报, 2015(5): 13−16. China Nonferrous Metals Industry Association Titanium Zirconium & Hafnium Branch. The present situation and development trend of titanium industry in China[J]. China Metal Bulletin, 2015(5): 13−16.
[4] 刘美凤, 郭占成. 金属钛制备方法的新进展[J]. 中国有色金属学报, 2003, 13(5): 1238−1245. LIU Mei-feng, GUO Zhan-cheng. New development of technologies for producing titanium metal[J]. The Chinese Journal of Nonferrous Metals, 2003, 13(5): 1238−1245.
[5] WANG Bin, LIU Kui-ren, CHEN Jian-she. Reaction mechanism of preparation of titanium by electro-deoxidation in molten salt[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(10): 2327−2331.
[6] 李 旭, 彭小燕, 段雨露, 张履国, 赵以容, 王学文, 徐国富. 工业纯钛的高温热氧化行为[J]. 中国有色金属学报, 2013, 23(8): 2190−2199. LI Xu, PENG Xiao-yan, DUAN Yu-lu, ZHANG Lu-guo, ZHAO Yi-rong, WANG Xue-wen, XU Guo-fu. Thermal oxidation behavior of commercial purity titanium at high temperature[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(8): 2190−2199.
[7] GINATTA M V, ORSELLO G. Plant for the electrolytic production of reactive metals in molten salt baths: US Patent 4670121[P]. 1987−06−02.
[8] CHEN G Z, FRAY D J, FARTHING T W. Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride[J]. Nature, 2000, 407(6802): 361−364.
[9] ONO K, SUZUKI R O. A new concept for producing Ti sponge: calciothermic reduction[J]. JOM, 2002, 54(2): 59−61.
[10] WITHERS J C, UPPERMAN G V. Electrolytic cell for the production of aluminum: U.S. Patent 4,338,177[P]. 1982−07−06.
[11] 朱鸿民, 焦树强, 顾学范. 一氧化钛/碳化钛可溶性固溶体阳极电解生产纯钛的方法. 中国: ZL200510011684.6[P]. 2005−12−28.ZHU Hong-min, JIAO Shu-qiang, GU Xue-fan. Pure titanium production from titanium monoxide/titanium carbide soluble solid anode electrolysis. China: ZL200510011684.6[P]. 2005−12−28.
[12] 焦树强, 胡月皎, 刘 勇, 焦汉东. 一种双电解槽熔盐电解制备纯钛的装置及其工艺. 中国: ZL201310259402.9[P]. 2013−09−11.JIAO Shu-qiang, HU Yue-jiao, LIU Yong, JIAO Han-dong. Device for preparing pure titanium by molten salt electrolysis through double electrolytic baths and process thereof. China: ZL201310259402.9[P]. 2013−09−11.
[13] 卢维昌, 徐永兰. 电解精炼回收废海绵钛及对电极过程机理的初步分析[J]. 稀有金属, 1980(3): 31−37. LU Wei-chang, XU Yong-lan. Preliminary analysis on the mechanism of recovery of waste sponge titanium by electrolytic refining[J]. Rare Metals, 1980(3): 31−37.
[14] 段淑贞, 顾学范. KCl−NaCl 熔盐体系中电镀钛的基础研究(一)[J]. 稀有金属, 1992, 16(2): 102−105. DUAN Shu-zhen, GU Xue-fan. Fundamental research on electroplate titanium in KCl-NaCl molten salt (I)[J]. Rare Metals, 1992, 16(2): 102−105.
[15] 段淑贞, 招光文. 难熔金属的熔盐电镀[J]. 稀有金属, 1987(5): 376−586. DUAN Shu-zhen, ZHAO Guang-wen. Molten salts electroplating of refractory metals[J]. Rare Metals, 1987(5): 376−586.
[16] 宁晓辉, 杜 超, 苏 峰, 焦树强, 朱鸿民. 脉冲参数对 NaCl-KCl-TiCl2熔盐中电沉积钛的影响[J]. 电镀与涂饰, 2011, 30(3): 1−3. NING Xiao-hui, DU Chao, SU Feng, JIAO Shu-qiang, ZHU Hong-min. Influence of pulse parameters on electrodeposition of titanium from NaCl-KCl-TiCl2melt[J]. Electroplating & Finishing, 2011, 30(3): 1−3.
[17] 倪福生, 陆庆桃, 陈世琯. LiCl-NaCl-KCl 体系中钛与其低价氯化物之间的平衡[J]. 稀有金属, 1984(5): 23−28. NI Fu-sheng, LU Qing-tao, CHEN Shi-guan. The equilibrium between metallic titanium and titanium ions in LiCl-NaCl-KCl melts[J]. Rare Metals, 1984(5): 23−28.
[18] NING X, ÅSHEIM H, REN H, JIAO S, ZHU H. Preparation of titanium deposit in chloride melts[J]. Metallurgical and Materials Transactions B, 2011, 42(6): 1181−1187.
[19] SONG J, WANG Q, HU G, ZHU X, JIAO S, ZHU H. Equilibrium between titanium ions and high-purity titanium electrorefining in a NaCl-KCl melt[J]. International Journal of Minerals, Metallurgy and Materials, 2014, 21(7): 660−665.
[20] ZHU X, WANG Q, SONG J, HOU J, JIAO S, ZHU H. The equilibrium between metallic titanium and titanium ions in LiCl-KCl melts[J]. Journal of Alloys and Compounds, 2014, 587: 349−353.
[21] RAMALEY L, KRAUSE JR M S. Theory of square wave voltammetry[J]. Analytical Chemistry, 1969, 41(11): 1362−1365.
[22] 姜民浩, 宋建勋, 张 龙, 刘 勇, 焦树强. CaCl2-TiCl2熔盐体系中制备高纯钛[J]. 电镀与涂饰, 2014, 33(23): 1008−1011. KANG Min-hao, SONG Jian-xun, ZHANG Long, LIU Yong, JIAO Shu-qiang. Preparation of high-purity titanium in CaCl2-TiCl2melts[J]. Electroplating & Finishing, 2014, 33(23): 1008−1011.
(编辑 龙怀中)
Influence of pulsed parameters on titanium electrodeposited from LiCl-NaCl-KCl-TiClmolten salt
ZHANG Long, ZHU Jun, SONG Yang, LU Jian-hong, JIAOShu-qiang
(State Key Laboratory of Advanced Metallurgy, University of Science and Technology Beijing, Beijing 100083, China)
The pulsed electrodepositon behaviors of titanium on nickel cathode were investigated in LiCl-NaCl-KCl-TiClmolten salt at 550℃by a molten electrolysis method using TA3 titanium plate as anode. And the effects of pulsed electrodeposition parameters on cathode products were also investigated. The results show that the electrochemical behavior of Ti3+→ Ti at cathode is a two-step diffusion-controlled process with intermediate Ti2+and Ti+. Comparing with galvanostatic electrodeposition, the products obtained by pulsed electrodeposition have higher compactness, higher crystallinity, and lower oxygen and nitrogen contents. The parameters of pulsed electrodeposition have important influences on the deposited products. When the electrolysis cycle time is short (c=10 min) and the ratio of current on/off () is higher or lower, the size of the products is smaller and the current efficiency is lower. The compact titanium products with large grains and current efficiency of 87.4% are obtained at cathodic current density of 0.3 A/cm2whenc=20 min and=1.
titanium; pulsed electrodeposition; molten electrolysis; cathode current efficiency
Project(2012AA062302) supported by the High Technology Research and Development Program of China; Project(51322402) supported by the National Natural Science Foundation of China
2016-03-18; Accepted date: 2016-09-12
JIAO Shu-qiang; Tel: +86-10-62333617, E-mail: sjiao@ustb.edu.cn
10.19476/j.ysxb.1004.0609.2017.05.026
1004-0609(2017)-05-1068-07
TF813
A
国家高技术研究发展计划资助项目(2012AA062302);国家自然科学基金优秀青年基金资助项目(51322402)
2016-03-18;
2016-09-12
焦树强,教授,博士;电话:010-62333617;E-mail:sjiao@ustb.edu.cn
