交替假单胞菌BYS-2产褐藻胶裂解酶条件研究
2017-06-09叶秀云许鑫琦
徐 凡,林 娟,叶秀云,朱 凡,许鑫琦
(福州大学生物科学与工程学院,福建省海洋酶工程重点实验室,福建 福州 350116)
交替假单胞菌BYS-2产褐藻胶裂解酶条件研究
徐 凡,林 娟,叶秀云,朱 凡,许鑫琦
(福州大学生物科学与工程学院,福建省海洋酶工程重点实验室,福建 福州 350116)
以褐藻酸钠作为褐藻胶裂解酶产生菌初筛培养基唯一碳源,从鲍鱼养殖水样中分离获得一株产褐藻胶裂解酶的微生物,形态学和分子生物学16S rDNA鉴定结果显示,该菌株为交替假单胞菌Pseudoalteromonassp.BYS-2. 对该菌株进行产酶条件研究,获得最适产酶配方为: 褐藻酸钠1 g·L-1,葡萄糖0.5 g·L-1,酵母膏10 g·L-1,黄豆饼粉3 g·L-1,(NH4)2HPO43 g·L-1,初始培养基pH8.0; 最佳产酶条件为: 接种量2%(体积分数),装液量50 mL/250 mL,发酵温度20 ℃,摇床转速200 r·min-1,在此条件下发酵24 h酶活力可达5.29 U·mL-1,比优化前(1.57 U·mL-1)提高2.37倍.
褐藻胶裂解酶; 筛选; 交替假单胞菌属; 产酶条件优化
0 引言
褐藻胶(alginate)主要存在于海带、 巨藻、 马尾藻等褐藻中,是褐藻细胞壁及细胞间质中的一种水溶性酸性多糖,由两种互为C5差向异构体的单体(β-D-甘露糖醛酸(M)、α-L-古罗糖醛酸(G))聚合而成[1]. 随着海洋多糖类新药研究的逐步深入,具有良好生物活性和药用价值的褐藻寡糖引起了人们的关注. 据报道[2-3],褐藻寡糖具有抗肿瘤、 抗凝血、 抗自由基氧化、 抗菌、 促进植物生长和诱导抗逆性等良好的生物活性. 褐藻胶裂解酶作为褐藻寡糖制备的工具酶,高活性褐藻胶裂解酶的开发应用就显得尤为重要.
褐藻胶裂解酶来源广泛,其中研究较多的大部分来自微生物, 现有报道过产褐藻胶裂解酶的微生物大多来自海洋,如假单胞菌、 交替假单胞菌、 弧菌、 黄杆菌、 克雷伯氏菌、 鞘氨醇单胞菌、 噬琼胶菌属、 芽孢杆菌等[4-10]. 从福建沿海多种藻类及海水泥沙样品中筛选产褐藻胶裂解酶的微生物,对其产酶条件进行研究,为后期褐藻胶裂解酶的开发应用提供理论基础.
1 材料与方法
1.1 材料
1.1.1 样品来源
鲍鱼养殖场水样.
1.1.2 主要试剂
褐藻酸钠,购自西陇化工股份有限公司; DNS溶液: 酒石酸钾钠182 g,3, 5-二硝基水杨酸5 g,苯酚5 g,亚硫酸钠5 g,氢氧化钠21 g,蒸馏水定容至1 L; 人工海水: MgCl2·6H2O 2.1 g,MgSO4·7H2O 4.2 g,KCl 0.9 g,CaCl2·H2O 1.2 g,NaCl 26.5 g,蒸馏水定容至1 L.
1.1.3 主要仪器设备
高压蒸汽灭菌锅(YXQ-LS-100SII型,上海博讯实业有限公司); 超净工作台(SW-CJ-2FI类B型,上海博迅实业有限公司医疗设备厂); 隔水式恒温培养箱(SHP-250型,上海精宏实验设备有限公司); 可见分光光度计(752N型,上海精密科学仪器有限公司); 高速冷冻离心机(CF16RXⅡ型,日本HITACHI公司); 恒温培养振荡器(ZWY-2101C型,上海智城分析仪器制造有限公司).
1.1.4 培养基
平板初筛分离培养基: 褐藻酸钠5 g,酵母粉0.5 g,KNO31 g,琼脂20 g,人工海水定容至1 L,调节pH值7.0~7.2.
基础发酵培养基: 褐藻酸钠5 g,酵母膏2 g,蛋白胨2 g,人工海水定容至1 L,调节pH值7.0~7.2.
海洋细菌2216E基础培养基: 蛋白胨5 g,酵母膏1 g,FeCl3·6H2O 0.018 g,琼脂20 g,人工海水定容至1 L,调节pH值7.0~7.2.
种子培养基: 采用2216E液体培养基.
1.2 实验方法
1.2.1 褐藻胶裂解酶产生菌的筛选
平板初筛: 将样品10倍梯度稀释后涂布于初筛分离培养基上,30 ℃倒置培养2 d,观察微生物菌落周围是否有透明圈或凹陷圈产生.
摇瓶复筛: 初筛得到的菌株分离纯化后接种于种子培养基振荡培养12 h,再转接到基础发酵培养基中进行产酶试验(30 ℃,200 r·min-1), 48 h后测定发酵液褐藻胶裂解酶活力.
1.2.2 褐藻胶裂解酶活力测定
1.2.2.1 葡萄糖标准曲线绘制

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
准确配制不同浓度的葡萄糖标准溶液,分别移取1 mL不同浓度标准溶液与1 mL DNS煮沸显色5 min,立即用冷水冷却至室温并定容至5 mL,在540 nm下测定吸光值,绘制葡萄糖标准曲线,如图1所示.
1.2.2.2 褐藻胶裂解酶活力测定
采用DNS(3, 5-二硝基水杨酸)法测还原糖含量[11]. 取发酵液于4 ℃、 12 000 r·min-1条件下离心2 min,所得上清液即为发酵粗酶液. 酶活力测定方法为: 0.1 mL粗酶液与0.9 mL的3 mg·mL-1褐藻酸钠底物于40 ℃水浴中反应15 min,加入1 mL DNS并煮沸5 min显色,然后立即用冷水冷却至室温并定容至5 mL,同时以灭活酶液组作为空白对照,在540 nm下测定吸光值,根据上述葡萄糖标准曲线计算还原糖含量. 酶活力单位定义为: 在该反应条件下,催化底物每分钟产生1 μmol 还原糖所需的酶量作为一个酶活力单位(U).
1.2.3 褐藻胶裂解酶产生菌的鉴定
1) 微生物菌落形态和细胞形态观察.
2) 分子生物学鉴定. 对菌株的16S rDNA序列进行扩增,并根据NCBI数据库中的序列比对结果构建该菌株的系统发育树,确定种属.
1.2.4 褐藻胶裂解酶产酶条件优化
1.2.4.1 碳源种类优化
分别以褐藻酸钠、 葡萄糖、 果糖、 蔗糖、 乳糖、 玉米糊精、 淀粉、 甘油、 乳酸作为发酵培养基中的唯一碳源,通过测定其发酵液酶活力,比较不同碳源对菌株BYS-2产酶能力的影响,确定发酵培养基的最佳单一碳源.
在基础发酵培养基5 g·L-1褐藻酸钠基础上,分别添加上述碳源,终质量浓度添加量为2 g·L-1,通过酶活力测定以确定发酵培养基的最佳复合碳源.
1.2.4.2 碳源添加量优化
在确定最佳碳源后,进一步比较不同碳源添加量(褐藻酸钠: 0.2、 0.5、 1.0、 2.0、 3.0、 4.0 g·L-1; 葡萄糖: 0.5、 1.0、 2.0、 3.0、 4.0 g·L-1)对菌株产酶能力的影响,确定最佳复合碳源添加量.
1.2.4.3 氮源种类优化
在碳源添加量优化的基础上,分别以蛋白胨、 酵母膏、 玉米粉、 酵母粉、 牛肉膏、 干酪素、 黄豆饼粉、 花生饼粉、 麦芽提取物、 麸皮、 尿素、 磷酸氢二铵、 硝酸铵、 硝酸钠作为发酵培养基的氮源,同时以基础发酵培养基作对照,比较不同氮源对菌株产酶能力的影响,确定最佳氮源种类.
1.2.4.4 氮源添加量优化
在氮源优化基础上,配制不同氮源添加量(酵母膏: 3、 7、 10、 15、 20 g·L-1; 黄豆饼粉: 0.5、 2.0、 4.0、 6.0、 8.0 g·L-1; 磷酸氢二铵: 2、 4、 6、 8 g·L-1)的发酵培养基,进一步比较不同氮源添加量对菌株产酶能力的影响,确定最佳氮源添加量.
1.2.4.5 氮源复配正交优化
在氮源种类及添加量优化的基础上,对最佳氮源含量进行L9(34)正交实验,分析复合氮源对菌株产酶能力的影响,从而确定最佳复合氮源及其添加量.
1.2.4.6 产酶培养基初始pH值优化
在碳氮源优化后的基础上,将发酵培养基初始pH值分别调至5.0、 6.0、 7.0、 8.0、 9.0,测定发酵液酶活,确定最佳培养基初始pH值.
1.2.4.7 接种量优化
将种子液分别以0.5%、 1.0%、 2.0%、 3.0%、 4.0%、 6.0%、 8.0% (体积分数)接种量接种到发酵培养基(50 mL/250 mL)中,考察不同接种量对菌株产酶的影响,确定最佳接种量.
1.2.4.8 发酵温度优化
设定发酵温度分别为15、 20、 25、 30、 35 ℃,测定不同温度下的酶活力,确定最佳产酶温度.
1.2.4.9 装液量优化
在250 mL锥形瓶中分别装入20、 40、 50、 60、 80、 100 mL的发酵培养基,比较不同装液量对菌体产酶能力的影响,确定最佳装液量.
1.2.4.10 摇床转速优化
设置摇床转速分别为150、 180、 200、 230、 250 r·min-1,比较不同转速对菌株产酶能力的影响.
1.2.4.11 发酵时间优化
在已优化的产酶培养基和发酵条件下发酵,定时取样,离心收集粗酶液,测定其发酵液酶活力,确定最佳发酵产酶时间.
2 结果与分析
2.1 褐藻胶裂解酶产生菌的筛选鉴定
从鲍鱼养殖场水样中筛选到一株可产褐藻胶裂解酶的微生物,编号BYS-2,菌落形态和细胞形态观察如图2所示. 该菌在筛选平板上呈乳白色,圆形微凸,不透明,表面湿润光滑,边缘整齐,较粘稠; 细胞呈椭圆形或短杆状,革兰氏染色阴性,无芽孢.
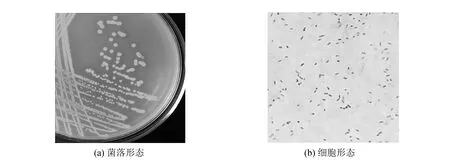
图2 菌株BYS-2的形态观察(×1 000)Fig.2 Morphology of strain BYS-2(×1 000)
通过NCBI数据库检索比对,结果显示该菌株的16S rDNA序列(1 498 bp)与已知菌株Pseudoalteromonassp. SP48(登录号EF067315.1)的一致性最高,达99%. 通过软件MEGA 5.2构建系统发育树如图3所示,结合该菌株形态鉴定结果确定该菌株为Pseudoalteromonassp. BYS-2.
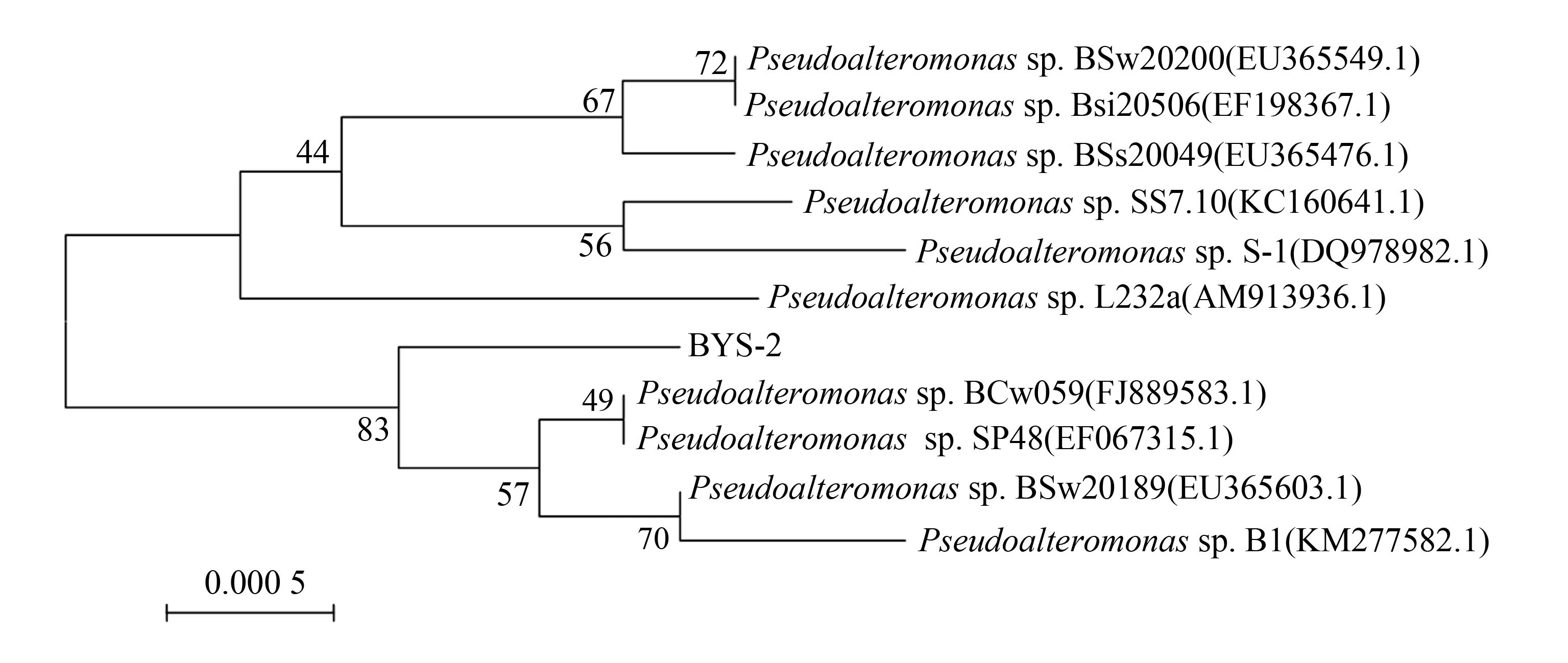
图3 菌株BYS-2系统发育树Fig.3 Phylogenetic tree of strain BYS-2
2.2 褐藻胶裂解酶产酶条件优化
对基础发酵培养基中的碳源、 氮源、 初始pH值,以及接种量、 装液量、 发酵温度、 摇床转速和产酶时间等条件进行优化,确定最优的产酶方案.
2.2.1 碳源种类优化
不同种类碳源及复合碳源对菌株BYS-2产酶的影响见图4. 由图4可知,褐藻酸钠(相对酶活力设为100%)对菌株产酶具有明显的促进作用,这表明该菌株所产褐藻胶裂解酶很可能是一种诱导酶,而褐藻酸钠不仅作为碳源,而且可以起诱导剂作用,因此选取褐藻酸钠为产酶的主要碳源,在此基础上再添加其它碳源,研究复合碳源对产酶效果的影响.
葡萄糖、 乳糖和蔗糖与褐藻酸钠组成的复合碳源均对菌株产酶具有促进作用,其中葡萄糖作用最为明显,与只添加5 g·L-1褐藻酸钠(相对酶活力设为100%)相比,其相对酶活力提高了74%,因此对葡萄糖与褐藻酸钠组成的复合碳源进行添加量研究.
2.2.2 碳源添加量优化
在添加2 g·L-1葡萄糖基础上,研究不同褐藻酸钠添加量对菌株BYS-2产酶的影响,结果见图5. 培养基中褐藻酸钠添加量为1 g·L-1(相对酶活力设为100%)时菌株产酶效果最好,大于1 g·L-1则菌株产酶量缓慢下降,因此确定褐藻酸钠的最佳添加量为1 g·L-1.
在添加1 g·L-1褐藻酸钠基础上,进一步研究不同葡萄糖添加量的影响. 由图5可知,葡萄糖的最适添加量为0.5 g·L-1(设2 g·L-1添加量的相对酶活力为100%),增加葡萄糖添加量则产酶能力下降,这可能是因为葡萄糖作为碳源容易被菌体利用,从而阻碍产酶代谢. 因此,确定复合碳源的添加量为: 褐藻酸钠1 g·L-1,葡萄糖0.5 g·L-1.

图4 不同碳源对产酶的影响 Fig.4 Effects of various carbon sources on alginate lyase production

图5 碳源添加量对产酶的影响 Fig.5 Effects of different concentrations of carbon sources on alginate lyase production
2.2.3 氮源种类优化
不同种类氮源对菌株BYS-2产酶效果的影响见图6. 由图6可知,在添加的有机氮源和无机氮源中,酵母膏、 黄豆饼粉和磷酸氢二铵的产酶效果较好,与基础发酵培养基(相对酶活力设为100%)相比,褐藻胶裂解酶活力分别为94.21%、 145.82%和121.77%,因此后续对这3种氮源进一步进行添加量研究.
2.2.4 氮源添加量优化
3种氮源添加量对菌株BYS-2产酶的影响见图7,由图中可知,酵母膏、 黄豆饼粉、 磷酸氢二铵的最佳添加量分别为15、 2和4 g·L-1.

图6 不同氮源对产酶的影响 Fig.6 Effects of various nitrogen sources on alginate lyase production
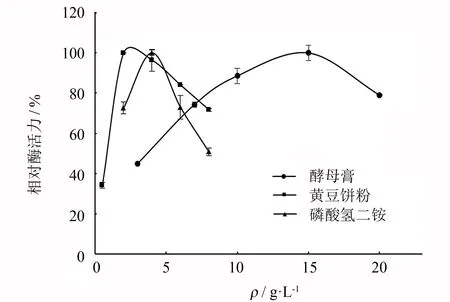
图7 氮源添加量对产酶的影响Fig.7 Effects of different concentrations of nitrogen source on alginate lyase production
2.2.5 氮源复配比例的正交优化
初步确定菌株BYS-2产酶培养基中氮源种类及其添加量后,对上述3种氮源进行添加量正交试验(见表1). 由表1可知,试验组8的酶活力最高,而由极差分析结果表明3种氮源对产酶影响大小为: 磷酸氢二铵>黄豆饼粉>酵母膏. 最优氮源复合为A1B2C1,即复合氮源最佳添加量为: 酵母膏10 g·L-1、 黄豆饼粉3 g·L-1、 磷酸氢二铵3 g·L-1. 由复合氮源方差分析(表2)知,3种氮源因子对产酶影响均不显著,其中磷酸氢二铵作用大于黄豆饼粉和酵母膏的影响,这也与表1中因素主次分析结果一致.

表1 复合氮源极差分析
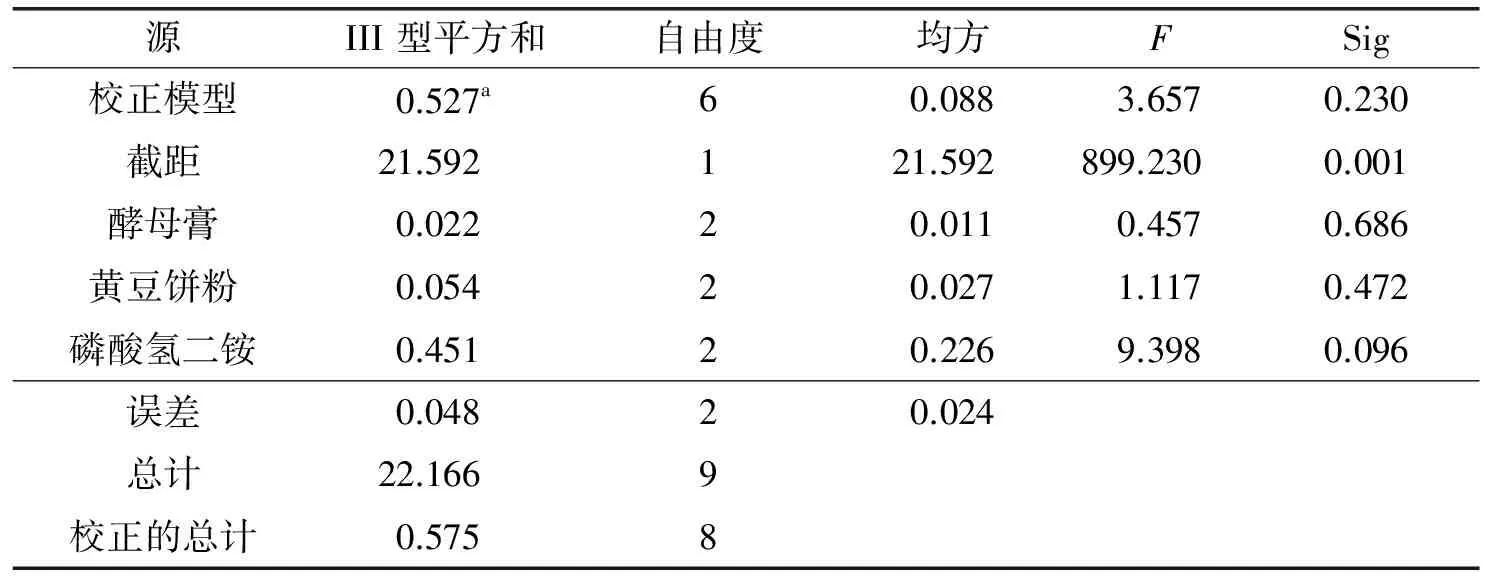
表2 复合氮源方差分析表
2.2.6 发酵培养基初始pH值的优化

图8 培养基初始pH值对产酶的影响 Fig.8 Effects of media initial pH value on alginate lyase production
培养基初始pH值对产酶的影响见图8. 由图8可知,当pH值为5.0时,菌株BYS-2产酶量几乎为零,这主要由于pH 5.0的酸性条件不适合于该菌生长; 在pH 6.0~9.0范围内该菌产酶能力较高,并在pH 8.0达到最高(以基础发酵培养基pH 7.0相对酶活力设为100%). 因此,发酵培养基的初始pH值选择8.0.
2.2.7 接种量优化
接种量对产酶的影响见图9. 以初始接种量6%为参照(相对酶活力设为100%),当接种量小于6%时,菌株产酶能力较高,且在2%时达到最高值,4%以后产酶能力下降. 这可能是由于接种量过大导致菌体生长旺盛,消耗营养物质而不利于产酶,因此选择接种量为2%.
2.2.8 发酵温度优化
温度对产酶的影响见图10. 图10显示,温度对菌株产酶能力有显著影响. 在15 ℃时菌株产酶能力相对较低,这可能是由于温度过低不利于菌体生长,进而也影响其产酶能力; 在20 ℃时(相对酶活力设为100%)产酶能力最高,相对于对照组(30 ℃)提高了1.98倍; 当温度超过20 ℃时,随着温度的上升菌株产酶能力逐渐下降,在35 ℃时仅为20 ℃的19%. 因此选择最佳产酶温度为20 ℃.

图9 接种量对产酶的影响 Fig.9 Effects of inoculation quantity on alginate lyase production

图10 温度对产酶的影响 Fig.10 Effects of temperature on alginate lyase production
2.2.9 装液量优化
装液量对产酶的影响见图11. 由图11可知,当装液量为50 mL/250 mL时(相对酶活力设为100%)产酶能力最高,之后随着装液量增加酶活力迅速下降,这可能是因为装液量过大导致溶氧不足,从而影响菌体生长和产酶.
2.2.10 摇床转速优化
转速对产酶的影响见图12. 由图12可知,菌株产酶能力随着摇床转速的上升呈持续增大趋势,可能因为菌株BYS-2是耗氧菌,随着转速上升,发酵液中溶氧量增加,有助于菌体的生长和产酶. 在最大转速250 r·min-1时,产酶能力相比200 r·min-1(相对酶活力设为100%)提高了60%,但在250 r·min-1条件下,培养基易溅出造成污染,综合考虑,采用200 r·min-1转速.

图11 装液量对产酶的影响 Fig.11 Effects of liquid media volume on alginate lyase production

图12 转速对产酶的影响 Fig.12 Effects of shaker speed on alginate lyase production
2.2.11 产酶时间优化
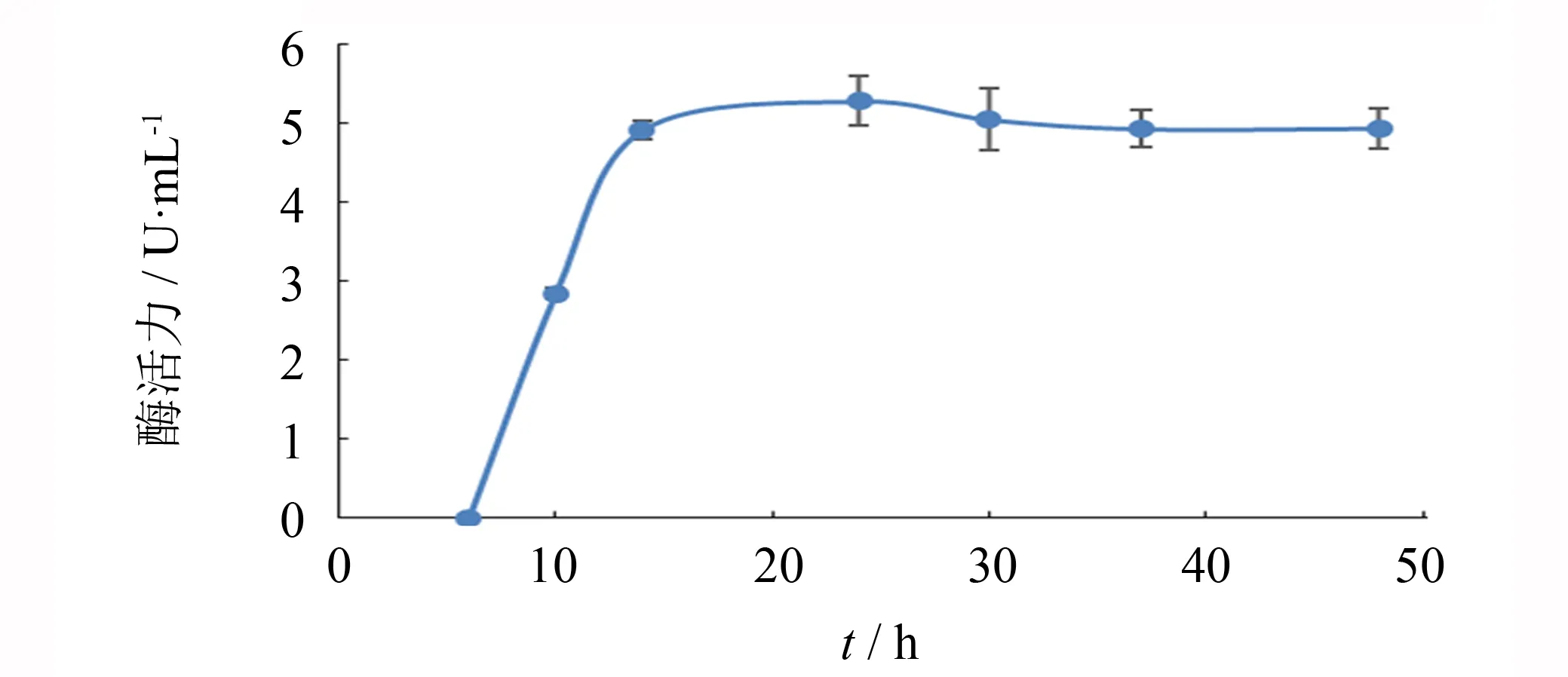
图13 发酵时间对产酶的影响Fig.13 Effects of fermentation time on alginate lyase production
在上述产酶培养基和发酵条件优化的基础上进行产酶发酵试验,每隔一定时间取样测定酶活力,研究发酵时间对该菌株产酶的影响,实验结果如图13所示. 该菌在6 h以前以菌体生长为主,6 h后酶活力逐渐上升,在14 h后酶活力基本保持稳定,24 h时酶活力达到最高,为5.29 U·mL-1.
3 结语
褐藻寡糖具有良好的生物活性和药用价值,目前降解褐藻胶制备褐藻寡糖的方法主要有化学降解法和酶解法,酶法制备褐藻寡糖具有专一性强、 反应条件温和易控、 产物稳定活性高等优点. 从福建沿海地区鲍鱼养殖场水样中筛选获得一株产褐藻胶裂解酶的交替假单胞菌Pseudoalteromonassp. BYS-2,通过对该菌产酶培养基及产酶条件进行优化,得到优化的产酶方案为: 褐藻酸钠1 g·L-1,葡萄糖0.5 g·L-1,酵母膏10 g·L-1,黄豆饼粉3 g·L-1,磷酸氢二铵3 g·L-1,发酵培养基初始pH值8.0,接种量2%,装液量50 mL/250mL,摇床转速200 r·min-1,发酵温度20 ℃,在此条件下发酵24 h菌株产酶能力可达5.29 U·mL-1,相比优化前提高2.37倍. 已报道的褐藻胶裂解酶大部分来源于海洋细菌,汤海清等[12]筛选到一株褐藻胶裂解酶产生菌PseudoalteromonastetrodonisQZ-4, 通过产酶优化后, 得到该菌最大产酶活力为1.43 U·mL-1,侯保兵等[13]筛选的不动杆菌X8, 经优化菌株酶活可达0.874 U·mL-1. 陆地来源的褐藻胶裂解酶产生菌极少且产酶活力低,张书利等[14]从土壤中筛选到一株芽孢杆菌W1经产酶优化酶活力达0.104 4 U·mL-1. 本实验筛选得到的Pseudoalteromonassp. BYS-2产酶能力较高,为褐藻胶裂解酶的生产和应用打下良好基础.
[1] 纪明矦. 海藻化学[M]. 北京: 科学出版社, 1997: 231-235.
[2] 张玉娟, 罗福文, 姚子昂,等. 海藻酸钠寡糖生物活性的研究进展[J]. 中国酿造, 2014, 33(1): 5-8.
[3] 祝玲, 程璐, 蔡俊鹏. 褐藻胶寡糖潜在药用价值的研究进展[J]. 中药材, 2006, 29(9): 993-996.
[4] AN Q D, ZHANG G L, WU H T,etal. Alginate-deriving oligosaccharide production by alginase from newly isolatedFlavobacteriumsp. LXA and its potential application in protection against pathogens[J]. Journal of Applied Microbiology, 2009, 106(1): 161-170.
[5] XIAO L, HAN F, YANG Z,etal. A novel alginate lyase with high activity on acetylated alginate ofPseudomonasaeruginosaFRD1 fromPseudomonassp. QDO3[J]. World Journal of Microbiology & Biotechnology, 2006, 22(1): 81-88.
[6] BAKKEVIG K, SLETTA H, GIMMESTAD M,etal. Role of the pseudomonas fluorescens alginate lyase (AlgL) in clearing the periplasm of alginates not exported to the extracellular environment[J]. Journal of Bacteriology, 2005, 187(24): 8 375-8 384.
[7] KAWAMOTO H, HORIBE A, MIKI Y,etal. Cloning and sequencing analysis of alginate lyase genes from the marine bacteriumVibriosp. O2[J]. Marine Biotechnology, 2006, 8(5): 481-490.
[8] DUAN G, HAN F, YU W. Cloning sequence analysis, and expression of gene alyPI encoding an alginate lyase from marine bacteriumPseudoalteromonassp. CY24[J]. Canadian Journal of Microbiology, 2009, 55(9): 1 113-1 118.
[9] 李丽研, 管华诗, 江晓路, 等. 海藻工具酶: 褐藻胶裂解酶研究进展[J]. 生物工程学报, 2011, 27(6): 838-845.
[10] OSTGAARD K, KNUTSNnuts S H, DYR N,etal. Production and characterization of guluronate lyase from klebsiella pneumoniae for applications in seaweed biotechnology[J]. Enzyme & Microbial Technology, 1993, 15(9): 756-763.
[11] JACK P, GILBERET A. Alginic acid metabolism in bacteria[J]. Journal of Biological Chemistry, 1962, 237(2): 309-316.
[12] 汤海青. 用海洋细菌PseudoalteromonastetrodonisQZ-4 发酵生产褐藻胶裂解酶的研究[D]. 杭州: 浙江大学, 2010: 28-50.
[13] 侯保兵,刘书来,张建友, 等. 褐藻胶裂解酶产生菌的发酵优化研究[J]. 水产科学,2009, 11(28): 667-670.
[14] 张书利, 管斌, 邱向锋,等. 褐藻胶裂解酶产生菌的筛选鉴定及其产酶条件研究[J]. 现代食品科技, 2006, 22(3): 24-27.
(责任编辑: 洪江星)
Optimization of alginate lyase-producing conditions byPseudoalteromonassp. BYS-2
XU Fan, LIN Juan, YE Xiuyun, ZHU Fan, XU Xingqi
(College of Biological Science and Technology,Fuzhou University,Fujian Provincial Key Laboratory of Marine Enzyme Engineering,Fuzhou, Fujian 350116, China)
With sodium alginate as the only carbon source of primary screening medium, one of the microorganisms that producing alginate lyase had been isolated from abalone aquaculture water, which was identified asPseudoalteromonassp.BYS-2 via morphological characteristics and 16S rDNA sequence analysis. Based on the results of fermentation experiments, the optimal liquid medium consisted of those compounds as follow: sodium alginate 1 g·L-1, glucose 0.5 g·L-1, yeast extract 10 g·L-1, soybean cake powder 3 g·L-1, (NH4)2HPO43 g·L-1, pH 8.0. The optimal fermentation conditions included: inoculation 2%(volume fraction) , medium volume 50 mL /250 mL, incubate temperature 20 ℃ and shaking speed 200 r·min-1. Fermenting about 24 h under these conditions, alginate lyase activity could reach 5.29 U·mL-1which was 2.37 times higher than before optimization (1.57 U·mL-1).
alginate lyase; screening;Pseudoalteromonas; enzyme production optimization
10.7631/issn.1000-2243.2017.03.0446
1000-2243(2017)03-0446-08
2016-01-26
林娟(1970-),博士,教授,主要从事应用微生物学和分子酶学等方面的研究,ljuan@fzu.edu.cn
国家海洋局海洋公益性行业科研专项基金(201305015),福建省海洋高新产业发展专项基金(闽海洋高新[2013] 20号)
Q93
A
