培门冬酶与左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病不良反应对比研究
2017-06-05陈启文
钟 楠,陈启文
(南昌大学第一附属医院儿科,南昌 330006)
培门冬酶与左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病不良反应对比研究
钟 楠,陈启文
(南昌大学第一附属医院儿科,南昌 330006)
目的 对比培门冬酶及左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病出现的不良反应,为临床用药提供依据。方法 收集118例急性淋巴白血病患儿,均按CCLG-ALL 2008方案进行化疗,分别使用培门冬酶(228例次,培门冬酶组)或左旋门冬酰胺酶(282例次,左旋门冬酰胺酶组)化疗,包含诱导缓解、延迟强化方案。2组患儿定期检测血常规、肝功能、血糖、血浆蛋白、凝血功能、血淀粉酶、尿淀粉酶等指标,记录患儿临床表现及各项指标变化。不良反应采用2003年美国癌症研究所制定的不良反应通用术语标准3.0版本进行分级。结果 培门冬酶组过敏反应发生率低于左旋门冬酰胺酶组(P=0.011),2组骨髓抑制、血糖升高、凝血功能异常、肝功能异常和急性胰腺炎的发生率比较差异无统计学意义(P>0.05)。结论 对儿童急性淋巴细胞白血病的治疗,培门冬酶较左旋门冬酰胺酶注射次数更少,且过敏反应发生率更低。
急性淋巴细胞白血病; 培门冬酶; 左旋门冬酰胺酶; 不良反应; 儿童
门冬酰胺酶作为一种关键的化疗药物之一,对儿童急性淋巴细胞白血病的治疗有着非常重大的意义。对于儿童长期无病生存而言,门冬酰胺酶是必不可少的[1]。加入联合化疗方案以来,自1970年至2004年儿童总生存率从34%提高至86%[2]。其主要的作用机制是将门冬酰胺水解成门冬氨酸和氨。细胞的生存依赖于门冬酰胺,正常细胞可自身合成,也可从血液中获取,而肿瘤细胞不能自主合成,只能从外源性途径摄取,缺乏时即出现细胞凋亡[3]。目前市场上有3种不同的门冬酰胺酶:1)天然大肠埃希菌来源的左旋门冬酰胺酶;2)天然欧氏杆菌来源的左旋门冬酰胺酶;3)聚乙二醇化的门冬酰胺酶,又称为培门冬酶。有研究[3]表明,培门冬酶与左旋门冬酰胺酶相比较具有更小的免疫原性和更长的半衰期。使用左旋门冬酰胺酶和培门冬酶化疗都可能出现过敏反应、骨髓抑制、肝功能异常、凝血功能异常、血浆蛋白下降、血糖增高、急性胰腺炎等不良反应。本文比较培门冬酶与左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病的部分不良反应,以期为临床用药提供依据。
1 对象与方法
1.1 研究对象
收集南昌大学第一附属医院儿科2010—2014年收治的118例急性淋巴细胞白血病患儿,其中男78例,女40例,年龄1~14岁。均按中国小儿血液病协作组于2008年制定的CCLG-ALL 2008化疗方案[4]进行诊断及分型。按随机数字表法分为培门冬酶组和左旋门冬酰胺酶组,每组59例。
培门冬酶组使用培门冬酶化疗228例次:平均年龄(7.0±4.3)岁,男142例次,女86例次;T系48例次,B系180例次;标危110例次,中危112例次,高危6例次。
左旋门冬酰胺酶组使用门冬酰胺酶化疗282例次:平均年龄(8.4±4.6)岁,男174例次,女108例次;T系66例次,B系216例次;标危152例次,中危116例次,高危14例次。2组患者年龄、性别、免疫分型及危险度比较差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方案
诊断明确后按CCLG-ALL 2008方案[4]进行化疗,包含诱导缓解、延迟强化方案。培门冬酶组使用培门冬酶化疗,左旋门冬酰胺酶组使用门冬酰胺酶化疗。
1.2.1 诱导缓解方案
培门冬酶分别于化疗第9、24天使用,间隔14 d,肌内注射,体表面积≥0.6 m2时,剂量为2500 U·m-2,体表面积<0.6 m2时,剂量为82.5 U·kg-1,当总剂量>1500 U时,均分两部位肌内注射,总剂量>3000 U时,均分三部位肌内注射。
左旋门冬酰胺酶分别于化疗第9、11、13、15、17、19、21、23天使用,皮试阴性后,肌内注射,剂量为6000 U·m-2;若出现皮试阳性,使用激素脱敏后继续原方案化疗。
其他联合化疗药物长春新碱、柔红霉素、泼尼松均为标准剂量。
1.2.2 延迟强化方案
培门冬酶于化疗第2天使用,肌内注射,剂量与诱导缓解方案相同;左旋门冬酰胺酶分别于化疗第2、4、6、8、10、12天,皮试阴性后肌内注射,剂量同诱导缓解方案;皮试阳性后处理方案同上。其他联合化疗药物长春新碱、柔红霉素、地塞米松均为标准剂量。
1.3 观察指标
从化疗第1天开始,每3 d检测血常规,观察白细胞、血红蛋白、血小板变化;每7 d检测肝功能及凝血功能;使用培门冬酶或者左旋门冬酰胺酶后每2 d检测血糖、尿淀粉酶,期间如果有异常结果根据病情随查相应指标,直至化疗结束。
不良反应采用2003年美国癌症研究所制定的不良反应通用术语标准3.0版本[5]进行分级,其中血细胞分级标准见表1。

表1 血细胞分级标准
1.4 统计学方法
采用SPSS19.0软件进行统计分析,计数资料的组间比较采用卡方检验,等级资料的组间比较采用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组骨髓抑制发生情况比较
化疗后2组患儿血白细胞计数、血红蛋白、血小板计数比较差异无统计学意义(均P>0.05),见表2,提示2组骨髓抑制发生率无明显差异。

表2 2组患者骨髓抑制发生情况比较 例次
2.2 2组肝功能损伤发生情况比较
共有40例次患者出现丙氨酸氨基转移酶异常,其中培门冬酶组26例次(11.4%),左旋门冬酰胺酶组20例次(7.0%),2组比较差异无统计学意义(P>0.05)。
2.3 2组凝血功能异常发生情况比较
化疗期间培门冬酶组及左旋门冬酰胺酶组均出现不同程度的凝血功能异常,2组比较差异无统计学意义(P>0.05),见表3。
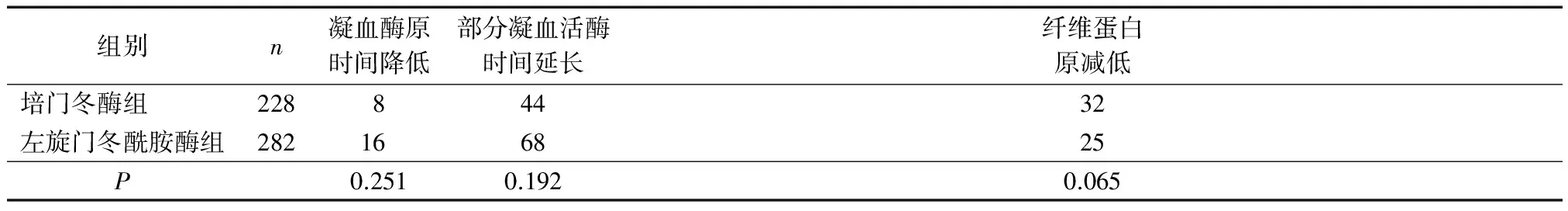
表3 2组患者凝血功能异常发生情况比较 例次
2.4 2组过敏反应比较
培门冬酶组患者有5例次皮肤出现一过性皮疹,使用地塞米松脱敏后继续原方案化疗。左旋门冬酰胺酶组有20例次患者出现过敏反应,其中4例次患者皮试阳性,脱敏后继续原方案化疗;16例次患者表现为局部皮肤瘙痒伴皮疹,12例次脱敏后继续完成原化疗方案,4例次因过敏反应治疗欠佳未完成后续化疗。2组患者的过敏反应发生率比较差异有统计学意义(P=0.011),见表4。

表4 2组患者过敏反应比较 例次
2.5 2组急性胰腺炎发生情况比较
培门冬酶组及左旋门冬酰胺酶组各有2例出现急性胰腺炎,均为急性水肿性胰腺炎,经限制饮食及抑制消化酶分泌等综合治疗,病情痊愈,2组急性胰腺炎发生率比较差异无统计学意义(P>0.05)。
2.6 2组血糖升高发生情况比较
培门冬酶组及左旋门冬酰胺酶组分别有5例和4例出现血糖升高,总体发生率较低,经控制和调整饮食及短时使用胰岛素后均很快回复正常,2组血糖升高发生率比较差异无统计学意义(P>0.05)。
3 讨论
门冬酰胺酶是联合化疗的重要组成部分,其主要作用机制是消耗门冬酰胺,随着门冬酰胺的大量消耗,必将导致正常细胞的缺乏,某些代谢旺盛的器官尤其明显,随即出现各种不良反应。培门冬酶是聚乙二醇与门冬酰胺酶共价结合形成,通过对门冬酰胺酶的N-末端定位修饰,增大其分子量,降低肾脏清除率,延长半衰期[1]。有文献[6]报道,培门冬酶的半衰期为4.8~7.0 d,而大肠杆菌来源的门冬酰胺酶为15.6 h。同时培门冬酶因偶联乙二醇形成立体屏蔽效应,降低了它的免疫原性[7]。
3.1 过敏反应
提取自大肠杆菌的门冬酰胺酶,属于来源于细菌的异种蛋白,人体易产生过敏反应。当门冬酰胺酶共价连接一个聚乙二醇变成培门冬酶时,可显著降低其免疫原性。本研究结果提示培门冬酶的过敏反应发生率低于左旋门冬酰胺酶。
有研究[8]表明,对门冬酰胺酶过敏的患者,机体可产生抗门冬酰胺酶抗体,即使使用抗组胺药物治疗,体内门冬酰胺酶的活性也将降低,可能影响患儿的长期预后。本研究并未对门冬酰胺酶活性进行检测,关于这方面的研究有待提高。
3.2 肝功能异常
门冬酰胺酶导致肝损害的机制并不明确,可能与门冬酰胺的减少相关[9]。门冬酰胺酶相关的肝毒性很少出现致死的并发症,但临床可能因其负面影响而延后化疗。本研究中共510例次标本,其中仅有40例次(7.8%)出现转氨酶升高,且2组比较差异无统计学意义(P>0.05)。但化疗过程中定期检测肝功能,积极预防使用护肝药物是很有必要的。
3.3 血细胞减少、凝血功能异常
门冬酰胺酶导致骨髓抑制的机制目前不太明确,可能其本身直接导致骨髓抑制,也可能通过其他联合化疗药物作用[9]。是否与门冬酰胺酶通过改变肝脏代谢来影响硫唑嘌呤和甲氨蝶呤的药代动力学机制类似仍有待考证[8]。门冬酰胺酶对凝血功能有不同程度的影响,但引起自发性出血的病例未出现。有文献[10]提到,停药1~2周后凝血功能各项指标可恢复正常。
3.4 急性胰腺炎
出现恶心、呕吐等症状的患者例数很多,但诊断急性胰腺炎的只有4例。左旋门冬酰胺酶组和培门冬酶组各2例,且经过禁食、降酶等治疗后,均恢复正常,无急性坏死性胰腺炎病例出现。胰腺炎的发生与多因素相关,例如个体体质、饮食特点、胰腺炎家族史等,目前其发病机制尚不清楚,可能与门冬酰胺酶对胰腺直接损害相关,胰腺损伤后致使胰酶逸出激活,出现胰腺炎。有数据[1]表明,门冬酰胺酶相关胰腺炎发病率大约为5%~18%,病死率占2%~5%。本研究中,胰腺炎发病率为0.8%,病死率为0%,可能与使用左旋门冬酰胺酶、培门冬酶化疗前半个月至结束后半个月均提倡患者低脂饮食有关。虽然急性胰腺炎发生率不高,但急性胰腺炎作为门冬酰胺酶最严重的并发症之一,仍需高度警惕,应定期对血尿淀粉酶、血糖等指标进行监测,做到及时早期发现及治疗胰腺炎。
3.5 高血糖
高血糖出现的主要原因是门冬酰胺酶干扰胰岛β细胞合成胰岛素,且存在胰岛素抵抗的患者更容易发生[8]。有研究[11]表明高血糖多出现在年龄>10岁的儿童,可能与生长激素的分泌有关,因生长激素有拮抗胰岛素的作用。另外,肥胖也是门冬酰胺酶相关高血糖的独立危险因素。本研究中发生高血糖的患者共9例,其中有8例年龄超过10岁,无肥胖患者,仅培门冬酶中的1例患者使用胰岛素降血糖,其余的8例均通过调节饮食恢复正常,未出现因高血糖延后化疗情况。因此使用门冬酰胺酶化疗期间,患者因注意适量限制糖类的摄入,饮食以高蛋白为主。
综上所述,培门冬酶与门冬酰胺酶相比较显示等同毒性,在骨髓抑制、肝功能异常、凝血功能等方面均无差异。但培门冬酶注射次数少,可减少患儿痛苦,且过敏反应发生率低,因过敏延后及中断化疗的现象也相应减低。
[1] Tong W H,Pieters R,de Groot Kruseman H A,et al.The toxicity of very prolonged courses of PEGasparaginase or Erwinia asparaginase in relation to asparaginase activity,with a special focus on dyslipidemia[J].Haematologica,2014,99(11):1716-1721.[2] Heitink Pollé K M J,Prinsen B H,de Koning T J,et al.High incidence of symptomatic hyperammonemia in children with acute lymphoblastic leukemia receiving pegylated asparaginase[J].JIMD Rep,2013,7:103-108.
[3] 王艳春,陶蕾.左旋门冬酰胺酶在儿童急性淋巴细胞白血病临床应用的安全性分析[J].药物评价研究,2012,35(4):285-288.
[4] 孙伊娜,柴忆欢,何海龙,等.CCLG-ALL2008方案治疗儿童急性淋巴细胞性白血病的临床疗效[J].江苏医药,2011,24(37):2922-2925.
[5] 殷蔚伯,谷铣之,余子豪.肿瘤放射治疗学[M].4版,北京:中国协和医科大学出版社,2008:1354-1369.
[6] 梁英,贺艳娟,邹浪,等.乙二醇化门冬酰胺酶治疗成人急性淋巴细胞白血病的疗效及安全性[J].中国全科医学,2015,18(32):3981-3984.
[7] Vrooman L M,Supko J G,Neuberg D S,et al.Erwinia ssparaginase after allergy to E.coli asparaginase in children with acute lymphoblastic leukemia[J].Pediatric blood cancer,2010,54(2):199-205.
[8] Hijiya N,van der Sluis I M.Asparaginase-associated toxicity in children with acute lymphoblastic leukemia[J].Leuk Lymphoma,2016,57(4):748-757.
[9] Merryman R,Stevenson K E,Gostic W J 2nd,et al.Asparaginase-associated myelosuppression and effects on dosing of other chemotherapeutic agents in childhood acute lymphoblastic leukemia[J].Pediatr Blood Cancer,2012,59(5):925-927.
[10] Kearney S L,Dahlberg S E,Levy D E,et al.Clinical course and outcome in children with acute lymphoblastic leukemia and asparaginase-associated pancreatitis[J].Pediatr Blood Cancer,2009,53(2):162-167.
[11] Yoshida H,Imamura T,Saito A M,et al.Protracted administration of L-asparaginase in maintenance phase is the risk factor for hyperglycemia in older patients with pediatric acute lymphoblastic leukemia[J].PLoS One,2015,10(8):e0136428.
(责任编辑:钟荣梅)
Comparison of Adverse Reactions of Pegaspargase and
L-asparaginase for Acute Lymphoblastic Leukemia in Children
ZHONG Nan,CHEN Qi-wen
(DepartmentofPediatrics,theFirstAffiliatedHospitalofNanchang
University,Nanchang330006,China)
Objective To compare the adverse reactions of pegaspargase and L-asparaginase in the treatment of acute lymphoblastic leukemia in children,and to provide a basis for clinical medication.Methods A total of 118 children were treated with L-asparaginase(282 case times) or pegaspargase(228 case times) according to the CCLG-ALL 2008 protocol,including remission induction and delayed reinforcement programs.Blood routine,liver function,blood glucose,plasma protein,coagulation function,serum amylase and urine amylase examinations were performed and changes in clinical manifestations and indicators were recorded in both groups.Adverse reactions were classified according to Common Terminology Criteria for Adverse Events version 3.0.Results The incidence of allergic reaction in pegaspargase group was lower than that in L-asparaginase group(P=0.011).No significant differences in the incidence of myelosuppression,hyperglycemia,coagulation disorder,liver dysfunction and acute pancreatitis were found between the two groups(P<0.05).Conclusion Compared with L-asparaginase,treatment with pegaspargase can reduce the frequency of injection and the incidence of allergic reaction in children with acute lymphoblastic leukemia.
acute lymphoblastic leukemia; pegaspargase; L-asparaginase; adverse reactions; children
2016-10-07
钟楠(1992—),女,硕士研究生,主要从事儿科学的研究。
陈启文,主任医师,E-mail:13970807656@163.com。
R733.71
A
1009-8194(2017)02-0072-04
10.13764/j.cnki.lcsy.2017.02.030
