自噬促进肺腺癌细胞对培美曲塞耐药的实验研究①
2017-06-05蔡方雨邹志田朱晓峰
蔡方雨,邹志田,朱晓峰
(佳木斯大学附属第一医院胸心外科,黑龙江 佳木斯 154003)
自噬促进肺腺癌细胞对培美曲塞耐药的实验研究①
蔡方雨,邹志田,朱晓峰
(佳木斯大学附属第一医院胸心外科,黑龙江 佳木斯 154003)
目的:研究自噬在对培美曲塞耐药的肺腺癌细胞中的作用。方法:采用MTT法检测对培美曲塞耐药的H1299和A549细胞的增殖;采用免疫印迹检测对培美曲塞耐药的H1299和A549细胞自噬相关蛋白的改变;采用自噬抑制剂CQ抑制自噬后观察培美曲塞对耐药H1299和A549细胞的抑制作用。结果:成功培养出对培美曲塞耐药的肺腺癌细胞系;对培美曲塞耐药的肺腺癌细胞自噬相关蛋白Beclin-1表达和LC3-I 向LC3-II 的转换增加,p62表达降低;自噬抑制剂CQ提高培美曲塞对耐药肺腺癌细胞的抑制作用。结论:对培美曲塞耐药的肺腺癌细胞自噬增强,抑制自噬提高培美曲塞对耐药肺腺癌细胞的抑制作用,自噬的激活是肺腺癌细胞对培美曲塞耐药的原因之一。
肺腺癌;培美曲塞;耐药;自噬
肺癌是最常见的癌症类型,而且也是癌症死亡的首要原因,非小细胞肺癌是肺癌中最常见的类型[1,2]。对于局部晚期或转移性的肿瘤组织学被证实为腺癌或大细胞癌的患者,培美曲塞联合顺铂被推荐为一线治疗选择[3]。培美曲塞是一种新型抗叶酸制剂,可通过抑制肿瘤细胞内多种酶的活性影响肿瘤细胞DNA合成,从而发挥抑制肿瘤生长的作用[4]。自噬与肿瘤发生的关系已在许多研究中有所报道[5]。多项研究表明自噬是肿瘤治疗的新靶点[6~8]。现已知许多应激因素可以诱导癌细胞自噬上调,包括营养不足、缺氧、抗肿瘤治疗带来的细胞损伤,并且某些癌症细胞可能利用自噬的增强作为耐药机制或促进肿瘤生长[9]。同其他化疗药物相似,耐药是导致培美曲塞对肺癌患者疗效不佳的重要因素。肺癌细胞对培美曲塞耐药的产生是否与用药期间肺癌细胞自噬作用的激活有关尚不明确。本研究通过体外培养耐培美曲塞的A549和H1299细胞株,并观察耐药细胞株自噬相关蛋白表达情况以及耐药细胞株在自噬受抑制条件下对培美曲塞的敏感性变化,进而探讨肺腺癌对培美曲塞的耐药机制与肺腺癌细胞自噬功能之间的关系。
1 材料与方法
1.1 细胞株与主要试剂
人NSCLC细胞A549、H1299购自ATCC; DMEM高糖培养基购于Hyclone公司;胎牛血清购于Biological Industries公司; 蛋白Marker购自Fermentas公司; PVDF膜购于Millipore公司; 培美曲塞(PEM)购于美国礼来公司; 氯喹( chloroquine,CQ) 购于Aladdin公司; LC3I/II, Beclin-1, p62,β-actin抗体购于Cell Signaling Technology;羊抗兔IgG二抗购于北京中杉金讲桥生物科技公司。
1.2 方法1.2.1 耐药细胞培养
用含有PEM的完全培养液培养A549、H1299两种肺腺癌细胞系,PEM浓度为2μmol/L,每48h更换培养液,连续培养3个月。3个月后进行耐药检测。
1.2.2 细胞增殖抑制实验
取对数期肺腺癌细胞,接种于96孔培养板内,每孔加入0.5×104个细胞,空白组只含有培养基而无细胞,24h后将培养液换成含PEM的完全培养液,培养72h后,加入20μLMTT,37℃孵育4h,用加入100μL二甲基亚砜溶解MTT,用酶标仪在490nm波长下测量吸光值。通过GraphPad Prism 5.0软件绘制细胞增殖活性曲线。
1.2.3 免疫印迹分析
将A549、A549-PEM、H1299、H1299-PEM细胞分别接种于6孔板中,24h后加入含有不同浓度PEM的完全培养液,处理72h后,弃去原培养液,用冷PBS清洗,细胞裂解液裂解细胞,12000G×5min离心后收集上清,加入1/4体积的蛋白上样液,沸水中煮10min,上样进行SDS-PAGE电泳,电转,5%脱脂牛奶室温封闭PVDF膜1h,相应一抗于4℃摇床孵育过夜,TBST洗膜10min×3次,加入相应的HRP标记的二抗,室温孵育1h,用碧云天 ECL发光液、柯达胶片显影,β-actin作为对照。
1.3 统计学方法
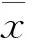
2 结果
2.1 培养耐PEM的A549,H1299细胞系
经过3个月的连续培养,成功培养出了两株耐PEM的肺腺癌细胞系,分别命名为A549-PEM、H1299-PEM。与A549、H1299相比,A549-PEM、H1299-PEM对PEM的敏感性明显降低,差异具有统计学意义,见图1、2。
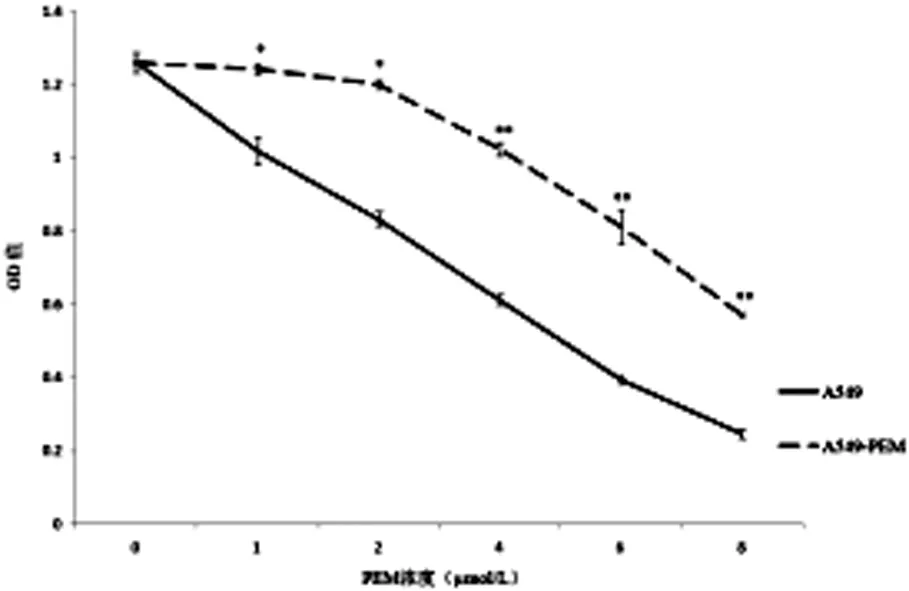
图1A549与A549-PEM对PEM的敏感性对比
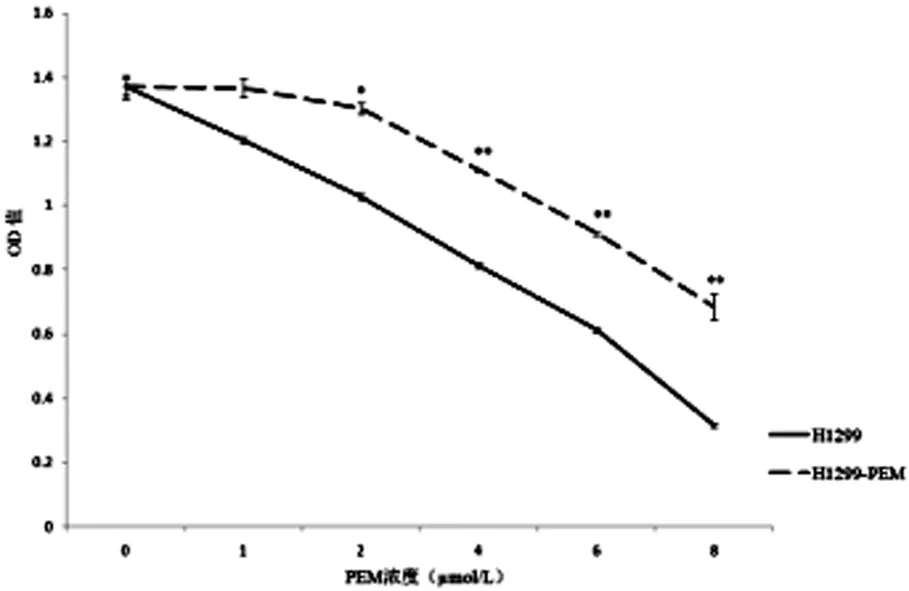
图2 H1299与H1299-PEM对PEM的敏感性对比
2.2A549-PEM、H1299-PEM自噬相关蛋白表达增加
LC3-I/II、Beclin-1、p62是自噬活化中的重要蛋白。LC3-I向LC3-II的转换增加,Beclin-1蛋白的表达与自噬活化呈正相关;p62的表达同自噬活化呈负相关。Westernblot结果表明,A549-PEM、H1299-PEM中,LC3-I向LC3-II的转换增加,Beclin-1蛋白的表达增加,p62蛋白的表达减少,见图3。
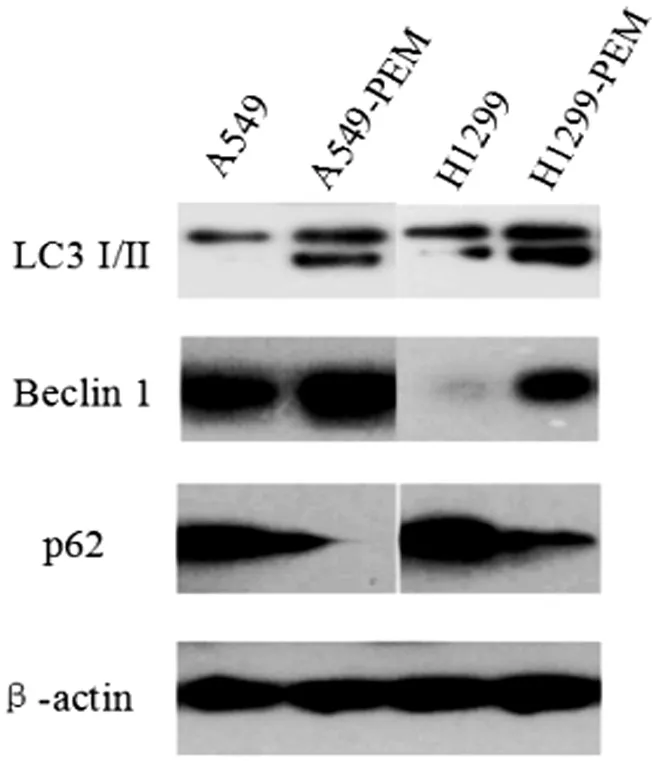
图3 Western blot结果
2.3 抑制自噬提高PEM对A549-PEM、H1299-PEM的抑制作用
为了进一步证明自噬活化导致肺腺癌细胞耐药的发生,我们用CQ来抑制自噬并检测自噬抑制后PEM对耐药细胞的作用。MTT分析表明,自噬抑制剂CQ促进了PEM对A549-PEM、H1299-PEM的抑制作用(P<0.05),统计学意义明显,见图4、5。
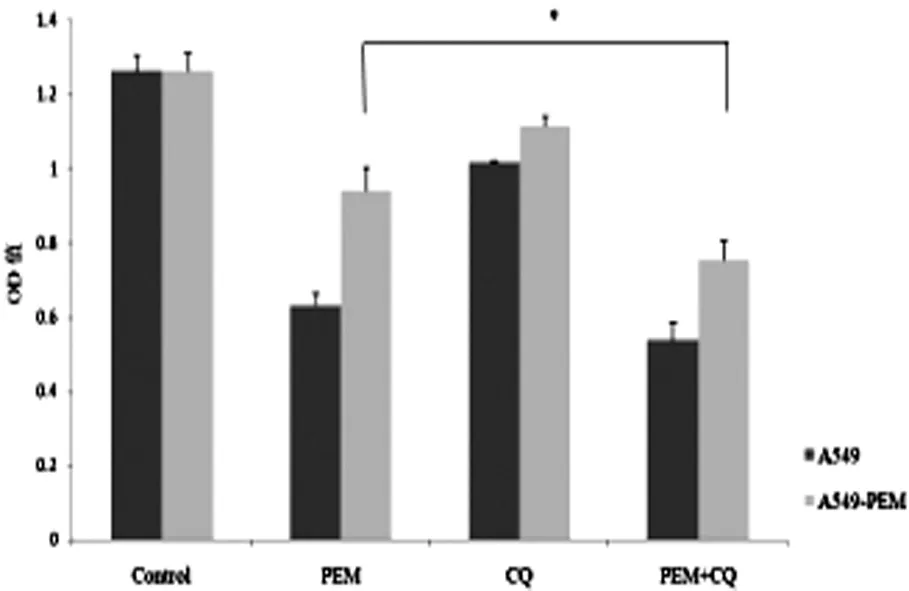
图4 应用CQ后PEM对A549-PEM抑制作用变化
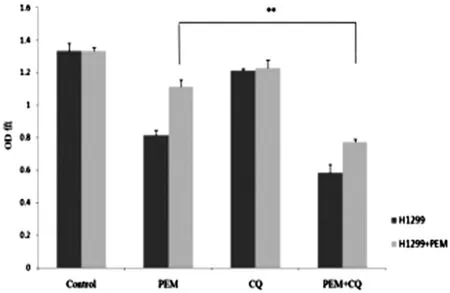
图5 应用CQ后PEM对H1299-PEM抑制作用变化
3 讨论
自噬是细胞维持自我稳态和进化上的一种保守降解过程,是细胞的一种自我防御机制[7,10]。为从细胞成分中获取能量和营养,自噬作用通过将长寿蛋白和受损细胞器转入溶酶体内进行降解,并将养分释放入细胞质内以回收利用建立新的大分子[7,9]。自噬在正常条件下保持基础的活跃水平,但在外界压力因素影响下,自噬作为细胞生存机制,会通过增加非选择性或选择性降解来进行应答。化疗药物可能会进一步诱导改变细胞的信号传导和代谢,从而激活细胞自噬机制以便抵抗外界压力。在肿瘤的发生和治疗期间肿瘤细胞的代谢异常,以及随后肿瘤细胞依赖自噬适应这样的失调,为癌症治疗提供了新的分子靶点[8]。
微管相关蛋白1A/1B轻链3(LC3)是一个可溶性蛋白,其分子量为17kDa,并且广泛分布于人工培养细胞和哺乳动物组织[11]。在自噬中,胞浆型LC3(LC3-I)通过与磷脂酰乙醇胺结合形成LC3-磷脂酰乙醇胺共轭体(LC3-II),聚集于自噬体膜。自噬体与溶酶体融合形成自噬溶酶体,自噬体内成分由溶酶体水解酶降解。同时,LC3-II在自噬溶酶体的腔内被分解。因此,自噬体的标记LC3-II在溶酶体内的转化反映了自噬活动[13]。LC3已经被广泛用于检测细胞自噬[14]。
在哺乳动物和果蝇中,自噬抑制与p62水平的增加有相关性,这提示p62蛋白的稳态水平反映自噬活动状态。同样,p62水平降低有关自噬激活[15]。P62是多结构域的蛋白质,含有不同种类的蛋白质-蛋白质相互作用结构域,包括N-端PB1结构域,ZZ型锌指结构域,核定位信号(NLS),出口基序(NES),LC3相互作用区(LIR),KEAP1互动区(KIR),和一个C-末端的泛素相关区域(UBA)。P62的多个结构域的功能均与自噬密切相关[16]。多项证据表明,自噬障碍导致p62的积累,从而促进肿瘤的发生[17~19]。p62可作为一个标记蛋白来检测自噬[15]。
Beclin1是自噬机制中的核心蛋白。Beclin1被确定为一个与Bcl-2抗凋亡家族成员在BH3结构域结合的蛋白。正常条件下的稳态,Beclin1与不同的Bcl-2家族成员结合,而其从Bcl-2的解离会介导自噬。Beclin1与自噬活化剂相互作用,通过促进PI(3)K、VPS34 的活化和自噬体的形成来调控自噬[16]。检测BECN1 现已经被许多人做为监控自噬的方式[13]。
众多研究已经确认,在肿瘤细胞暴露于抗癌药物后,肿瘤细胞的自噬机制被激活[5]。而这一点也在我们的研究中得以印证。在我们成功培养的A549-PEM、H1299-PEM中,LC3-I向LC3-II的转换增加,Beclin-1蛋白的表达增加,p62蛋白的表达减少,这样的结果充分说明培美曲塞激活了肺癌细胞的自噬机制,使得细胞自噬活动增加。但是这种自噬增加是否是导致肺癌细胞耐药的原因尚不明确,我们进行了进一步实验。我们用CQ抑制了自噬,发现抑制自噬大大提高了培美曲塞对A549-PEM、H1299-PEM的抑制能力,即抑制自噬提高了A549-PEM、H1299-PEM对培美曲塞的敏感性。这表明自噬是导致肺腺癌细胞对培美曲塞耐药的原因之一。但是,很显然,还存在其它的导致耐药的原因,这也是我们未来的研究方向。我们希望通过对肺腺癌细胞耐药的研究,找到新的治疗肺腺癌的靶点。
综上,培美曲塞可以激活肺腺癌细胞的自噬机制,耐培美曲塞肺腺癌细胞自噬增强,抑制自噬提高耐培美曲塞肺腺癌细胞对培美曲塞的敏感性,自噬的激活是肺腺癌细胞对培美曲塞耐药的原因之一,自噬介导的耐药机制是否是导致肺腺癌细胞对培美曲塞耐药的核心机制尚待研究探索。
[1]SongXY,ShiK,ZhouSJ,etal.ClinicopathologicalsignificanceandapotentialdrugtargetofRARβinnon-small-celllungcarcinoma:ameta-analysisandasystematicreview[J] .DrugDesDevelTher,2016,10:1345-1354
[2]赵洋,朱晓峰,杨成鹏,等.CXCL12及其受体CXCR7在非小细胞肺癌中的表达[J]. 黑龙江医药科学,2016,39(2):44-46
[3]FleemanN1,BagustA,McLeodC,etal.Pemetrexedforthefirst-linetreatmentoflocallyadvancedormetastaticnon-smallcelllungcancer[J].HealthTechnolAssess, 2010,1:47-53
[4]CalvertH.Pemetrexed(Alimta):apromisingnewagentforthetreatmentofbreastcancer[J] .SeminOncol, 2003, 2(3):2-5
[5]TotonE,LisiakN,SawickaP,etal.Beclin-1anditsroleasatargetforanticancertherapy[J].JPhysiolPharmacol, 2014, 65(4):459-467
[6]AmaravadiRK,Lippincott-SchwartzJ,YinXM,etal.PrinciplesandCurrentStrategiesforTargetingAutophagyforCancerTreatment[J].ClinCancerRes, 2011, 17(4):654-666
[7]YangZJ,CheeCE,HuangS,etal.TheRoleofAutophagyinCancer:TherapeuticImplications[J] .MolCancerTher, 2011, 10(9):1533-1541
[8]CheongH,LuC,LindstenT,etal.Therapeutictargetsincancercellmetabolismandautophagy[J] .NatBiotechnol,2012, 30(7):671-678
[9]LebovitzCB,RobertsonAG,GoyaR,etal.Cross-cancerprofilingofmolecularalterationswithinthehumanautophagyinteractionnetwork[J].Autophagy, 2015, 11(9):1668-1687
[10]郭文博,邹志田,朱晓峰.STAT3和Ki-67在非小细胞肺癌中的表达[J]. 黑龙江医药科学,2016,39(2):111-113
[11]RichettaC,FaureM.Autophagyinantiviralinnateimmunity[J].CellMicrobiol, 2013, 15(3):368-376
[12]TanidaI,UenoT,KominamiE.LC3andAutophagy[J] .MethodsMolBiol, 2008, 445:77-88
[13]TanidaI,Minematsu-IkeguchiN,UenoT,etal.Lysosomalturnover,butnotacellularlevel,ofendogenousLC3isamarkerforautophagy[J] .Autophagy, 2005, 1(2):84-91
[14]MizushimaN,YoshimoriT.HowtointerpretLC3immunoblotting[J] .Autophagy, 2007, 3(6):542-545
[15]KlionskyDJ,AbdallaFC,AbeliovichH,etal.Guidelinesfortheuseandinterpretationofassaysformonitoringautophagy[J] .Autophagy, 2012, 8(4):445-544
[16]张标,朱晓峰,刘丽,等. 通过免疫组化方法研究MTA1与Bcl-2在肺腺癌的表达与关系[J]. 黑龙江医药科学,2012,35(1):93-94
[17]LinX,LiS,ZhaoY,etal.Interactiondomainsofp62:abridgebetweenp62andselectiveautophagy[J] .DNACellBiol, 2013, 32(5):220-227
[18]MathewR,KarpCM,BeaudoinB,etal.AutophagySuppressesTumorigenesisThroughEliminationofp62[J] .Cell, 2009, 137(6):1062-1075
[19]ZalckvarE,BerissiH,MizrachyL,etal.DAP-kinase-mediatedphosphorylationontheBH3domainofbeclin1promotesdissociationofbeclin1fromBcl-XLandinductionofautophagy[J] .EMBORep, 2009, 10(3):285-292
Activation of autophagy caused the pemetrexed resistance in lung adenocarcinoma cells
CAIFang-yu,ZOUZhi-tian,ZHUXiao-feng
(Department of Cardio-Vascular,The First Affiliated Hospital of Jiamusi University,Jiamusi 154003,hina)
Objective:To study the role of autophagy in pemetrexed-resistant lung adenocarcinoma cells. Methods:Detect the proliferation of Pemetrexed-resistant H1299 cells and A549 cells with MTT assay. After inhibiting autophagy with CQ, we observed the subtle effects of Pemetrexed on drug-resistant cells. Western blot was used to test the autophagy-related proteins. Results:We obtained cultured lung adenocarcinoma cell strain with drug resistance successfully. In Pemetrexed-resistant lung adenocarcinoma cell strain, the conversion of LC3 (LC3-I to LC3-II) increased, the expression of Beclin-1 increased, the expression of p62 decreased. And we found that the autophagy inhibitor CQ improved the inhibitory effect of pemetrexed on drug-resistant cells.Conclusion:Autophagy is activated in Pemetrexed-resistant lung adenocarcinoma cells. The resistance to autophagy improved the inhibitory effect of pemetrexed on drug-resistant cells. The activation of autophagy is one of the causes which lead to pemetrexed resistance in lung adenocarcinoma cells.
lung adenocarcinoma; pemetrexed; drug-resistant; autophagy
蔡方雨(1990~)男,黑龙江哈尔滨人,在读硕士研究生。
邹志田(1962~)男,黑龙江佳木斯人,博士,主任医师,硕士研究生导师。E-mail: zxf700105@sina.com。
R734.2
A
1008-0104(2017)02-0079-03
2016-10-16)
