骨髓间充质干细胞及Klotho基因移植对慢性缺氧大鼠心脏重构的影响
2017-06-05李慧萍曹帅王恩阳朱向情尹娜魏玲潘兴华
李慧萍,曹帅,王恩阳,朱向情,尹娜,魏玲* ,潘兴华*
(1昆明总医院地方干部病房,昆明650032;2云南省干细胞工程实验室,昆明650032)
心脏重构(cardiac remodeling)是各种病理因素引起心力衰竭及心房颤动的共同病理机制[1],心肌纤维化和心肌细胞凋亡在心脏重构中起着重要作用。骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)是存在于骨髓中的具有高度自我更新能力和多向分化潜能的多能干细胞,可以在特定的环境下分化成骨细胞、脂肪细胞、心肌细胞等,而且能分泌多种细胞因子,抑制心肌细胞凋亡,减少基质胶原沉积[2,3]。Klotho基因是新近发现的抗衰老基因,具有抗氧化应激、抗细胞凋亡[4]和抑制心肌纤维化等作用[5]。本研究建立了SD大鼠慢性缺氧心脏重构的模型,体外培养BMSCs和重组慢病毒介导Klotho基因,通过尾静脉移植至慢性缺氧心脏重构大鼠体内,探讨BMSCs和Klotho基因移植对慢性缺氧大鼠心脏重构的影响。
1 材料与方法
1.1 分组和模型建立
SPF级的雄性SD大鼠30只[许可证号:SCXK(滇)2011-0004],10周龄。所有SD大鼠的实验操作过程都遵循国家实验动物的管理条例和管理实施细则。适应性喂养1周,随机分为4组:正常对照组(n=6)、模型组(n=8)、BMSCs组(n=8)和 Klotho组(n=8)。正常对照组不给予缺氧处理,同时用于提取BMSCs。其余各组放入缺氧箱中[6],设置氧浓度为10%,持续缺氧28 d,造模期间大鼠共死亡7只,剩余模型组5只、BMSCs组6只、Klotho组6只。造模结束后,将BMSCs通过尾静脉注射方式以每只5×106/ml移植至慢性缺氧模型大鼠体内,即BMSCs组,4周后麻醉取材;将Klotho基因按照1×109TU/ml移植至模型大鼠体内,即Klotho组,4周后麻醉取材。
1.2 BMSCs的体外分离培养、鉴定及在心肌中的定位
采用贴壁分离法进行培养,在37℃、饱和湿度和5%CO2条件下分离培养大鼠BMSCs,取第3代BMSCs进行实验。进行成脂诱导和成骨诱导,用油红O和茜素红工作液染色。鉴定脂滴的形成和钙结节[7]。以流式细胞仪鉴定 BMSCs的表面标志CD34、CD44 和 CD90。
将慢病毒介导绿色荧光蛋白(green fluorescent protein,GFP)转染至BMSCs进行荧光标记,通过尾静脉注射移植5×106/ml至大鼠体内,4 d后摘除心脏,冰冻切片观察BMSCs在心肌中的分布。
1.3 心肌中Klotho mRNA的表达
采用逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测各组大鼠心肌中Klotho mRNA的表达。Trizol法提取BMSCs的总RNA,按照反转录试剂盒说明书取1μg RNA反转录获得cDNA,并以cDNA为模板,扩增目的片段。PCR引物由上海生工生物有限公司合成。PCR结束后获取 Ct值,并计算 2-△△Ct,分析表达差异。Klotho上游和下游引物分别为5’-CAATGGCTTCCCTCCTTTACCT-3’和 5’-TTCTCTTCTTGGCTACAACCCC-3’。GAPDH上游和下游引物分别为5’-TTCCTACCCCCAATGTATCCG-3’和 5’-CATGAGGTCCACCACCCTGTT-3’。
1.4 心肌细胞中胶原浓度的测定
采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测各组大鼠血清、心肌中Ⅰ型前胶原羟基端肽(procollagenⅠC-propeptide,PⅠCP)、Ⅲ型前胶原羟基端肽(procollagenⅢ C-propeptide,PⅢCP)浓度,用标准物和吸光度(A)计算出标准曲线的多项式二次回归方程,将样品的A值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.5 心肌组织学检测
采用HE染色、MASSON染色和Tunel检测,并在镜下观察变化。应用Image-pro plus 6.0软件计算MASSON染色蓝色胶原纤维占整个组织面积的比率,即心肌胶原容积分数(collagen volume fraction,CVF)。计算Tunel检测中凋亡细胞数量和总细胞数量的百分比,即为心肌细胞凋亡率。
1.6 统计学处理
采用SPSS 17.0软件进行数据处理。计量资料以均数±标准差()表示,组间比较采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 BMSCs的培养和鉴定
培养48 h可见短小梭形的BMSCs贴壁生长,原代细胞约10 d达90%以上融合,细胞为均一分布漩涡状排列的长梭形细胞群。传代后细胞增殖时间缩短,平均5 d达85%以上融合。分别用成脂、成骨诱导剂诱导分化BMSCs,以证明其具有多向分化性:成脂诱导后用油红O染色,使脂滴呈橘红色;成骨诱导后用茜素红染色,使成骨钙结节被染成深红色(图1)。流式细胞仪检测结果显示,BMSCs的表面抗原CD44(99.8%)和CD90(99.7%)表达呈阳性,CD34(0.5%)等表达呈阴性,说明培养扩增的细胞为BMSCs。慢病毒介导GFP转染的BMSCs在大鼠心肌的分布情况如图2所示。
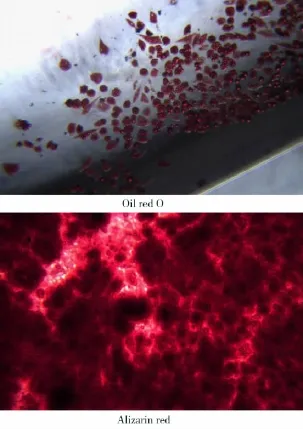
图1 BMSCs分化染色结果Figure 1 Staining results of differentiation of BMSCs(×100)BMSCs:bone marrow mesenchymal stem cells

图2 大鼠心肌冰冻切片的荧光显微镜结果Figure 2 Fluorescence microscopy for frozen sections of rat myocardium(GFP×20)
2.2 各组大鼠心肌中Klotho mRNA表达的比较
正常对照组、模型组和Klotho组中Klotho mRNA的相对表达量分别为(1.80 ±0.53)、(0.78 ±0.14)和(4.86±0.61)。与正常对照组相比,模型组的相对表达量显著降低,而Klotho组的相对表达量显著增加,差异均具有统计学意义(P<0.05)。
2.3 各组大鼠PⅠCP和PⅢCP浓度的比较
无论在心肌还是血清中,与正常对照组比较,模型组、BMSCs组和Klotho组中PⅠCP和PⅢCP的浓度均显著升高(P<0.01);而与模型组比较,BMSCs组和Klotho组中PⅠCP和PⅢCP的浓度均显著降低(P <0.01;表1)。
2.4 HE和MASSON染色及各组大鼠CVF的比较
HE染色显示,正常对照组心肌细胞呈短柱状,细胞核呈椭圆形、深染(图3A);模型组心肌细胞水肿,组织局灶性坏死并伴炎性细胞浸润,局部可见带状纤维化(图3C);Klotho组仍有大量坏死灶及炎性细胞(图3E);BMSCs组仍有少量聚集的坏死炎性细胞(图3G)。MASSON染色后胶原纤维呈蓝色,肌肉和纤维素呈红色。正常对照组心肌间质胶原成分极少(图3B);模型组心肌胶原成分大量增多,胶原纤维互相连接成网状,排列紊乱(图3D);Klotho组(图3F)和BMSCs组(图3H)心肌胶原成分明显减少,主要分布于血管及心肌间隙较大的部位。正常对照组、模型组、Klotho组和 BMSCs组的 CVF分别为(0.06±0.03)%、(33.51±10.66)%、(8.13±4.94)%和(7.55±2.18)%。与正常对照组相比,模型组、Klotho组和BMSCs组的CVF均显著升高(P<0.01);与模型组相比,Klotho组和BMSCs组的CVF均显著降低(P <0.01)。
2.5 心肌组织切片Tunel检测及心肌细胞凋亡率
DAPI将所有细胞核染色,在紫外激发下呈蓝色;FITC荧光素将凋亡细胞核标记,在绿光激发下呈绿色(图4)。正常对照组、模型组、BMSCs组和Klotho组的心肌细胞凋亡率分别为(0.12±0.05)%、(67.72 ±10.73)%、(10.19 ±2.03)%和(32.43 ±2.74)%。与正常对照组相比,模型组、BMSCs组及Klotho组的心肌细胞凋亡率均显著升高(P<0.01);与模型组相比,BMSCs组和Klotho组的心肌细胞凋亡率均显著降低(P<0.01);与Klotho组相比,BMSCs组的心肌细胞凋亡率显著降低(P<0.01)。
表1 各组大鼠PⅠCP和PⅢCP浓度的比较Table 1 Comparison of PⅠCP and PⅢCP contents among groups(pg/ml±s)

表1 各组大鼠PⅠCP和PⅢCP浓度的比较Table 1 Comparison of PⅠCP and PⅢCP contents among groups(pg/ml±s)
PⅠCP:procollagenⅠ C-propeptide;PⅢCP:procollagenⅢ C-propeptide;BMSCs:bone-marrow mesenchymal stem cells.Compared with control group,**P <0.01;compared with model group,##P <0.01
Group n PⅠCP PⅢCP Serum Myocardium Control 6 568.97 ±63.08## 787.51 ±85.80## 312.47 ±63.97## 470.45 ±47.92 Serum Myocardium##Model 5 2487.73 ±19.38** 2790.01 ±16.15** 1518.21 ±36.14** 1591.09 ±10.26**Klotho 6 1514.26 ±31.34**## 1763.04 ±35.41**## 906.54 ±26.15**## 1092.64 ±24.73**##BMSCs 6 1406.56 ±23.34**## 1463.02 ±24.46**## 826.54 ±26.85**## 992.64 ±27.66**##

图3 心肌组织HE和MASSON染色Figure 3 HE staining and MASSON staining of myocardium tissue(×400)

图4 Tunel检测结果Figure 4 Results of Tunel detection(×400)
3 讨论
心脏重构是以心肌纤维化和心肌细胞凋亡为特征的病理表现,是各种病理因素引起心力衰竭及心房颤动的共同病理机制[1]。研究发现[8,9],BMSCs及抗衰老基因(Klotho基因)均能有效改善心功能。
BMSCs存在于骨髓中,具有高度的自我更新能力和多向分化潜能,移植到心脏组织后,由于其独有的归巢和修复能力,可定向分化为心肌细胞以替代受损者。研究显示,BMSCs移植在冠状动脉结扎心肌梗死模型中可使心功能得到不同程度的改善[8],并认为其可能的机制包括:BMSCs分化为心肌细胞参与了宿主心脏的收缩、通过分泌细胞因子促进缺血区血管新生、抑制心脏重构等。在BMSCs移植心力衰竭大鼠的实验中发现[10],移植后能降低心肌中Ⅰ、Ⅱ型胶原沉积,降低基质金属蛋白酶表达,改善心功能。且随着BMSCs移植数量的增加,梗死心肌中病理性胶原纤维的沉积量可逐渐减少,有利于梗死心脏结构功能的改善[12]。本实验研究结果与上述实验结果类似:BMSCs移植至慢性缺氧心脏重构大鼠体内4周后,大鼠血清和心肌中的PⅠCP和PⅢCP浓度较模型组显著降低,心肌中CVF和心肌细胞凋亡率较模型组显著降低。提示BMSCs移植可以逆转心肌纤维化和心肌细胞凋亡,从而发挥逆转心脏重构的作用。也有实验表明,BMSCs移植在受损心肌中会分化为其他细胞。因此,BMSCs移植改善心功能的作用虽然已被证实,但其具体的作用机制还需要进一步深入研究。
Klotho基因是具有抗衰老作用的基因,Klotho基因敲除的小鼠会表现出与人类神经系统衰老类似的表现,而过表达Klotho蛋白可以改善衰老症状,延长小鼠的寿命[13]。Song 等[9]研究发现,腹腔注射Klotho蛋白能够抑制异丙肾上腺素诱导的小鼠心肌细胞凋亡,阻止心肌重构的发生。刘其峰等[13]研究发现,在单侧输尿管梗阻肾病大鼠模型体内腹腔注射Klotho基因,能够显著减轻大鼠肾间质纤维化。李莎莎等[14]也发现,Klotho基因可以抑制肾脏细胞凋亡和减轻肾脏纤维化。本实验采用重组慢病毒介导Klotho基因,将其移植在心脏重构大鼠体内4周后,大鼠血清和心肌中的PⅠCP及PⅢCP浓度较模型组均显著降低,心肌中CVF和心肌细胞凋亡率较模型组显著减少。提示Klotho基因移植可以逆转心肌纤维化和心肌细胞凋亡,从而发挥逆转心脏重构的作用,但其具体的作用机制还需要深入研究。
本研究结果显示,与Klotho组相比,BMSCs组的心肌细胞凋亡率显著降低(P<0.01)。我们推测可能是因为BMSCs通过静脉移植可以归巢在心肌中,并具有分化成心肌细胞替代凋亡细胞的作用,而Klotho基因则不具备这一项功能。但Klotho基因可以调节离子通道及多种信号通路[15],因此我们设想其逆转心脏重构的作用机制是通过调节离子通道和信号通路实现的。提示我们将Klotho转染至BMSCs或许对心脏重构的逆转效果更佳,这将是我们进一步研究的目标。
综上所述,BMSCs和Klotho基因移植均具有逆转心脏重构的作用,二者在减轻心肌纤维化方面无显著差异,在抑制心肌细胞凋亡方面,BMSCs移植较Klotho基因移植效果更显著。但二者发挥逆转心脏重构的具体分子机制还需要进一步研究。
[1]Li X,Han J,Li L,et al.Effect of farnesyltransferase inhibition on cardiac remodeling in spontaneously hypertensive rats[J].Int J Cardiol,2013,168(4):3340 - 3347.DOI:10.1016/j.ijcard.2013.04.038.
[2]Mazo M,Arana M,Pelacho B,et al.Mesenchymal stem cells and cardiovascular disease:a bench to bedside roadmap[J].Stem Cells Int,2012,2012:175979.DOI:10.1155/2012/175979.
[3]Narita T,Suzuki K.Bone marrow derived mesenchymal stem cells for the treatment of heart failure[J].Heart Fail Rev,2015,20(1):53 -68.DOI:10.1007/s10741-014-9435-x.
[4]Banerjee S,Zhao Y,Sarkar PS,et al.Klotho ameliorates chemically induced endoplasmic reticulum(ER)stress signaling[J].Cell Physiol Biochem,2013,31(4-5):659-672.DOI:10.1159/000350085.
[5]贾政,魏玲,刘茜.重组腺病毒介导Klotho基因转导对大鼠心力衰竭心肌重构的影响[J].中华心血管病杂志,2015,43(3):219 -226.DOI:10.3760/cma.j.issn.0253-3758.2015.03.008.Jia Z,Wei L,Liu Q.Impact of transfection with recombinant adenovirus vector-mediated Klotho gene on myocardial remodeling in a rat model of heart failure[J].Chin JCardiol,2015,43(3):219 - 226.DOI:10.3760/cma.j.issn.0253-3758.2015.03.008.
[6]林梦娇,田倪妮,魏玲,等.慢性缺氧大鼠心肌HSP47 mRNA的表达及其与PⅠCP和PⅢNP含量的相关性研究[J].中华老年多器官疾病杂志,2017,16(4):288-292.DOI:10.11915/j.issn.1671-5403.2017.04.067.Lin MJ,Tian NN,Wei L,et al.Myocardial HSP47 mRNA expression and its correlation with serum PⅠCP and PⅢNP contents in rats under chronic hypoxic condition[J].Chin J Mult Organ Dis Elderly,2017,16(4):288 -292.DOI:10.11915/j.issn.1671-5403.2017.04.067.
[7]闵敏,张雪静,马红,等.人脂肪间充质干细胞的原代培养及体外成骨成脂诱导分化[J].江苏大学学报(医学版),2013,23(3):185-190.Min M,Zhang XJ,Ma H,et al.Osteogenic differentiation of primary cultured human adipose-derived mesenchymal stem cells accompanying adipogenic differentiation in vitro[J].J Jiangsu Univ(Med Ed),2013,23(3):185-190.
[8]Krause U,Harter C,Seckinger A,et al.Intravenous delivery of autologous mesenchymal stem cells limits infarct size and improves left ventricular function in the infarcted porcine heart[J].Stem Cells Dev,2007,16(1):31-37.
[9]Song S,Gao P,Xiao H,et al.Klotho suppresses cardiomyocyte apoptosis in mice with stress-induced cardiac injury via downregulation of endoplasmic reticulum stress[J].PLoS One,2013,8(12):e82968.DOI:10.1371/journal.pone.0082968.
[10]Li L,Zhang Y,Li Y,et al.Mesenchymal stem cell transplantation attenuates cardiac fibrosis associated with isoproterenolinduced global heart failure[J].Transplant Int,2008,21(12):1181-1189.DOI:10.1016/0009-2509(94)00195-W.
[11]Dixon JA,Gorman RC,Stroud RE,et al.Mesenchymal cell transplantation and myocardial remodeling following myocardial infarction[J].Circulation,2009,120(11 Suppl):S220 -S229.DOI:10.1161/CIRCULATIONAHA.108.842302.
[12]Chang R,Li Y,Yang X,et al.Protective role of deoxyschizandrin and schisantherin A against myocardial ischemia-reperfusion injury in rats[J].PLoS One,2013,8(4):e61590.DOI:10.1371/journal.pone.0061590.
[13]刘其锋,叶建明,李莎莎.Klotho抑制内质网应激反应减轻UUO大鼠肾间质纤维化的实验研究[J].中国中西医结合肾病杂志,2015,16(3):203-206.Liu QF,Ye JM,Li SS.Klotho alleviates renal interstitial fibrosis via inhibition of endoplasmic reticulum stress in UUO rats[J].Chin JIntegr Trad West Nephrol,2015,16(3):203 -206.
[14]李莎莎,邓志勇,何敖林,等.Klotho对CsA慢性肾毒性大鼠肾脏内质网应激相关凋亡的影响[J].生命科学研究,2015,19(5):422-425.Li SS,Deng ZY,He AL,et al.Klotho ameliorates cyclosporineinduced chronic nephrotoxicity via inhibition of endoplasmic reticulum stress[J].Life Sci Res,2015,19(5):422 - 425.
