一株鹅源多杀性巴氏杆菌TSP-1的分离鉴定与药敏试验
2017-06-01张召兴李蕴玉张香斋贾青辉常超越闫艳娟李佩国
张召兴,李蕴玉,张香斋,贾青辉,常超越,闫艳娟,李佩国
(河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛,066004)
一株鹅源多杀性巴氏杆菌TSP-1的分离鉴定与药敏试验
张召兴,李蕴玉,张香斋,贾青辉,常超越,闫艳娟,李佩国*
(河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛,066004)
为了确定引起雏鹅急性死亡的病原菌,从送检的病死雏鹅的肝脏、心血、肺脏病料组织中分离到1株病原菌,并命名为TSP-1。通过培养特性、形态学观察、生化试验、16S rRNA基因序列分析等鉴定方法,分离菌株TSP-1鉴定为多杀性巴氏杆菌。动物试验表明,分离菌株TSP-1具有很强的致病性。药敏试验结果表明:分离菌株TSP-1对头孢克肟、氟苯尼考、阿奇霉素、阿米卡星等4种药物高度敏感;对头孢曲松、庆大霉素、恩诺沙星、强力霉素等4种药物中度敏感;对氨苄西林、阿莫西林、四环素等6种药物耐药。
鹅;多杀性巴氏杆菌;分离鉴定;16S rRNA;药敏试验
鹅巴氏杆菌病是由禽多杀性巴氏杆菌(Pasteurellamultocida)引起鹅的一种急性、败血性传染病[1]。该菌是一种禽类养殖中常见病原菌,广泛存在环境中,可感染家畜、家禽等多种动物也可感染人,可以引发猪肺疫、禽霍乱、牛出血性败血症等多种疾病[2,3]。巴氏杆菌可以感染不同日龄的鹅,一旦发病多数呈急性败血症型,发病率和死亡率都较高[4]。该病主要通过消化道和呼吸道感染,也可以通过吸血昆虫和损伤的皮肤、黏膜等多种途径感染[5]。同种动物之间可以相互感染,发病无明显的季节性,但在气候剧变、冷热交替、闷热、潮湿等时期多发生。外界环境的改变,导致机体抵抗力降低是本病主要的发病诱因之一,家禽发生该病时,多呈流行性[6]。
2016年11月,唐山市某养鹅场,38日龄雏鹅突然发病,多数病鹅呈急性死亡,病鹅出现了精神沉郁、食欲减少或不食、咳嗽,并且口鼻有黏液性分泌物流出,还伴有严重的腹泻症状,有的昏迷痉挛而死亡。对病死鹅进行剖检,无菌采集病料肝脏、肺脏、心血等组织进行分离鉴定,确定了引起雏鹅死亡的病原菌为多杀性巴氏杆菌,并对分离菌株TSP-1进行了药敏试验,以期为该病的防治提供基础依据。
1 材料与方法
1.1 病料来源
唐山市某养鹅场,38日龄的雏鹅5万只,发病率为25%,死亡率为19%,对送检的死亡的雏鹅进行剖检,无菌操作采集具有典型病理变化的肝脏、心血、肺脏等病料,进行分离鉴定。
1.2 主要试剂与仪器
普通琼脂培养基、营养肉汤(购于青岛高科园海博生物技术有限公司);药敏纸片(购于北京天坛药物生物技术开发公司);美兰染色液试剂盒(购于青岛高科技工业园海博生物技术有限公司);小牛血清(购于四季青公司);微量发酵管(购于杭州天和微生物公司);ID32E肠道菌鉴定试条(购于法国梅里埃公司);琼脂糖,TAE,DL2000 Marker,2×Taq Marker Mix,Gold View核酸染液,10×Loading buffer,树脂型TM基因组DNA提取试剂盒(均购于北京康为世纪生物科技有限公司);体积分数为0.07的绵羊脱纤血液琼脂培养基;常规的试剂及仪器由本实验提供。
1.3 实验动物
38日龄雏鹅8只,购于唐山市某养鹅场。
1.4 病原的分离纯化
无菌采集的病死雏鹅的肝脏、心血、肺脏和脾脏等病料组织,接种于体积分数为0.07的绵羊脱纤血液琼脂培养,37 ℃恒温培养12~18 h,选取圆形、透明、露珠样优势生长菌接种划线含普通培养基纯化培养后,提取纯化培养后优势菌落接种在体积分数为0.10的含小牛血清营养肉汤培养基中37 ℃,200 r/min恒温震荡培养,并调取纯培养的单菌落涂片,美兰染色,显微镜下观察细菌形态。
1.5 病原菌生化试验
按微量发酵管和ID32E肠道菌鉴定试剂条说明书经行操作,用自动生化鉴定系统进行生化试验。
1.6 病原菌的16S rRNA PCR检测
将纯化培养后的分离菌株STP-1接种于含体积分数为0.10的小牛血清营养肉汤培养基中,37 ℃震荡培养12~16 h。按照树脂型TM基因组DNA提取试剂盒说明书提取基因组DNA,参考文献[7]报道的16S rRNA通用引物,由上海生工生化有限公司合成。以提取的基因组DNA为模板,经行PCR反应。PCR扩增反应体系( 50 μL):2×Taq Marker Mix25 μL,上下游引物各2 μL,DNA模板2 μL, ddH2O 19 μL。反应条件:94 ℃预变性5 min;94 ℃变性50 s,58 ℃退火50 s,72 ℃延伸50 s,72 ℃中延伸10 min,共30个循环。取出5 μL扩增产物于质量浓度为10 g/L的琼脂糖凝胶中,150 V电泳20 min,观察PCR扩增产物的条带,将PCR产物送上海生工进行序列测定,测序结果与GenBank数据库中登录基因序列进行同源性比较分析。
1.7 致病性试验
[8]的方法,将实验雏鹅分为2组,每组4只,第1组为试验组,每只雏鹅腹腔注射分离菌株TSP-1剂量为0.25 mL(5×108CFU/mL);第2组接种等量的营养肉汤作为阴性对照。接种12 h后,观察7 d记录发病及死亡情况,对于死亡的雏鹅剖检,无菌取其肝脏、心血、肺脏等病料组织分离并鉴定。
1.8 药敏试验
采用K-B药敏纸片法进行药敏试验,判定标准按照美国临床检验标准委员会(NCCLS)推荐的标准K-B纸片法结果判断[9]。
2 结果分析
2.1 病死鹅剖检结果
剖检变化可见,病死雏鹅呈败血症型,肝脏肿大,质脆呈现淡黄色或白色大小不等坏死点;肺充血、出血、水肿,气管内有带有血丝的粘液,伴有出血;心冠脂肪及心外膜有大量出血点;小肠黏膜严重出血,有的小肠肠腔内存在大量黄色的粘液。
2.2 分离菌株形态特征与培养特性结果
分离菌株TSP-1在体积分数为0.07的绵羊脱纤血液琼脂培养基,可见均匀一致的灰白色、圆形、湿润、不溶血的露珠样小菌落(图1);在普通琼脂上可见灰白色、针尖大的、圆形的菌落,但是生长贫瘠。涂片染色镜检,美蓝染色呈典型的两极浓染球杆菌,呈卵圆形,中央不易着色。

图1 分离菌株TSP-1株美蓝染色鉴定结果(1 000×)
2.3 分离菌株的生化特性鉴定结果
分离菌株TSP-1 硫化氢、尿素酶、VP、赖氨酸和鸟氨酸、精氨酸双水解酶阴性,接触酶、氧化酶为阳性,吲哚试验为阳性。经ATB自动生化仪鉴定分析系统检测分析,鉴定结果为多杀性巴氏杆菌,评定结果合格率为 99.9%(表1)。
2.4 分离菌株的16S rRNA PCR扩增与测序结果
用16S rRNA的通用引物对分离菌株TSP-1进行了PCR 鉴定,分离菌株TSP-1扩增出大约为1 500 bp的目的条带(图2)。将测序结果进行拼接(图3),与GenBank DNA序列数据库中基因序列进行比对,与已发表的多杀性巴氏杆菌的基因序列同源性为100%,确定了分离菌株TSP-1为多杀性巴氏杆菌。
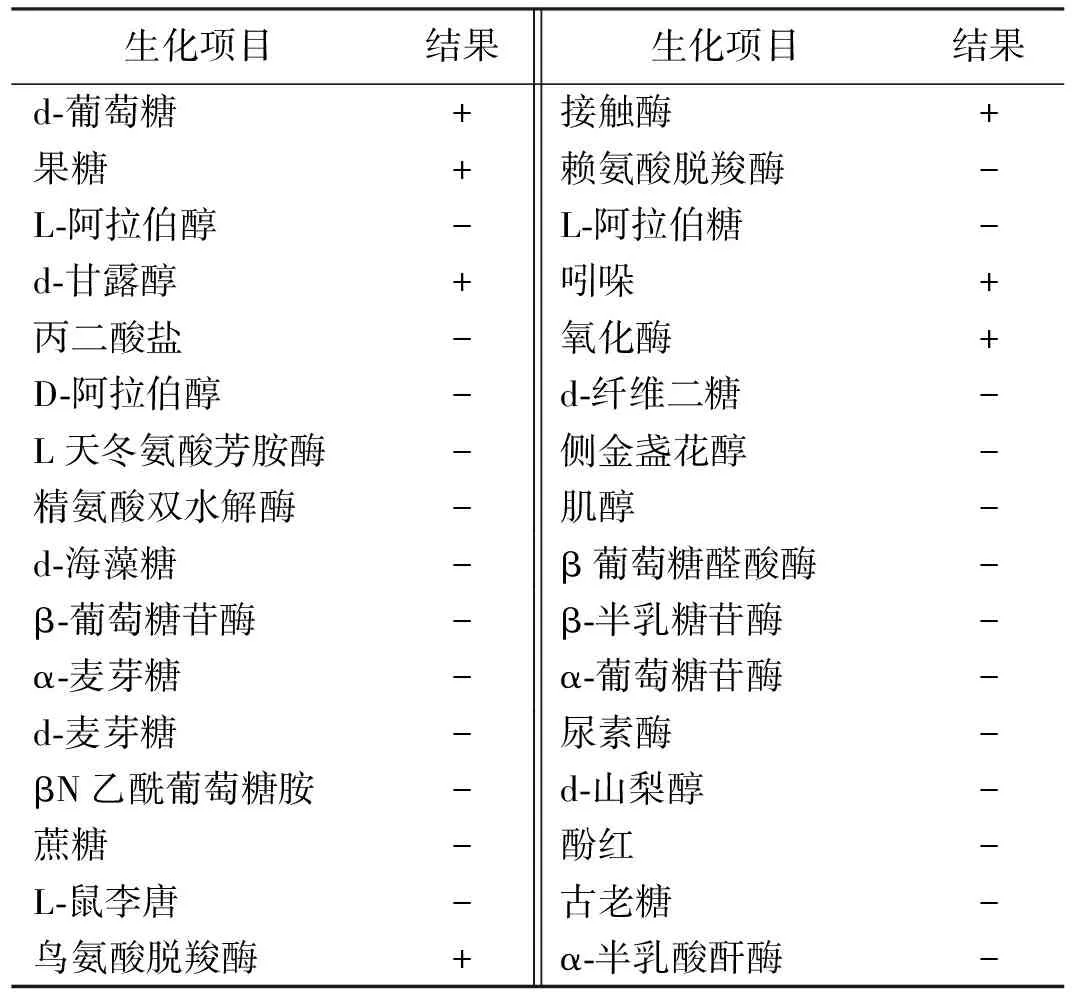
表1 分离菌株生化特性鉴定结果
注:+为阳性,-为阴性。
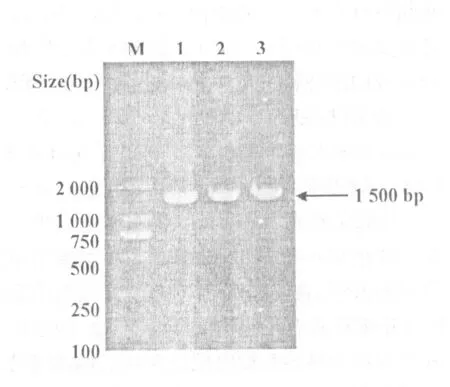
图2 分离菌株TSP-1株16S rRNA PCR扩增结果M,DL-2000 Marker;1~3,分离菌株TSP-1

图3 分离菌株TSP-1测序拼接序列结果

表2 分离菌株STP-1药敏试验结果
注:R为耐药,I为中介,S为敏感。
2.5 致病性试验结果
试验组雏鹅在攻毒24 h后出现死亡。剖检后,无菌采集肺脏、肝脏、心血组织等进行分离鉴定,结果显示所分离菌与TSP-1株一致。对照组4只雏鹅健康存活,表明分离菌株TSP-1具有一定致病性。
2.6 药敏试验结果
分离菌株TSP-1对头孢克肟、氟苯尼考、阿奇霉素、阿米卡星等4种药物高度敏感(表2);对头孢曲松、庆大霉素、恩诺沙星、强力霉素等4种药物中度敏感;对氨苄西林、阿莫西林、四环素等6种药物耐药。
3 讨 论
本次试验对病死的雏鹅进行剖检,无菌采集病料肝脏、肺脏、心血等组织中分离到1株病原菌,并命名为TSP-1。通过培养特性、形态学观察、生化试验鉴定方法进行鉴定,结果显示分离菌株TSP-1的培养特性、形态学及生化特性与《伯杰细菌鉴定手册》[10]中报道的多杀性巴氏杆菌的形态特性及生化特性一致,初步判定分离菌株TSP-1为多杀性巴氏杆菌。
为了进一步确定实验结果,用16S rRNA PCR方法进行了测定,测序结果运用BLAST软件比对,与多杀性巴氏杆菌同源性为100%,从分子生物学的角度证实了TSP-1为多杀性巴氏杆菌。在细菌的分离鉴定过程中,用以PCR方法鉴定作为辅助的检测方法,能够更加准确地确定病原,也是常用的方法[2],许多文献报道了利用多杀性巴氏杆菌标志性的基因,建立诊断多杀性巴氏杆菌PCR方法[11]。
鹅巴氏杆菌病是危害业养鹅主要疾病之一,该病发病急、死亡快,其发病率和死亡率都很高,近几年报道的该病不断增多,严重影响的我国养鹅业的发展[12]。本次实验在唐山地区分离的鹅多杀性巴氏杆菌TSP-1株具有很强的致病性,与张邑帆等[13]报道的从病死鹅中分离的多杀性巴氏杆菌具有很强的致病性一致。鹅多杀性巴氏杆菌病在防治过程中比较困难,由于饲养环境中病原微生物污染,另外在养殖过程中发生于各种应激有关,导致抵抗力下降,引发该病的发生[14]。目前,应该研制多杀性巴氏杆菌多价疫苗来有效预防该病的发生。本次实验药敏试验显示,仅对头孢克肟、氟苯尼考、阿奇霉素、阿米卡星4种药物高度敏感;对其他的药物存在不同的耐药性。与杨泽晓等[8]报道的鹅多杀性巴氏杆菌对头孢他啶、头孢唑肟和氟苯尼考等药物敏感,对其他的药物有耐药性一致。与刘红玉等[2]、于成接等[5]报道的有差异性,可能与分离的地区、血清型有关。因此当养殖场发生该病时,根据药敏试验结果进行合理用药,才能获得良好的治疗效果。
参考文献:
[1] 马驿,陈钦旭,陈秀眉,等.鹅巴氏杆菌病病原分离鉴定与中药的筛选[J].中国兽医杂志,2011,47(9): 49-52.
[2] 刘红玉,邵周伍林,李刚,等.一株鹅源巴氏杆菌的分离鉴定及耐药性分析[J].中国兽医科学,2014,44(02):119-123.
[3] 张召兴,耿田田,李蕴玉,等.貉源多杀性巴氏杆菌的分离鉴定与药敏试验[J].中国兽医杂志,2016,52(7): 40-42.
[4] 陈薄言.兽医传染病学[M].第五版.北京:中国农业出版社,2014.
[5] 于成接,丁优玲,华亚峰,等.禽霍乱巴氏杆菌的分离鉴定与致病性研究[J].中国兽医杂志,2013,49(2): 21-23.
[6] 么乃全,李斯齐,邸海洋,等.火鸡多杀性巴氏杆菌的分离鉴定及致病性研究[J].中国兽医科学,2016, 46(02): 242-246.
[7] 尹秀凤,王元珍,丁美娟,等.禽巴氏杆菌Pm-HB株的分离与鉴定[J].中兽医医药杂志,2014,41(5): 45-48.
[8] 杨泽晓,刘常钰,王印,等.一株鹅源多杀性巴氏杆菌强毒株的分离鉴定及其血清型鉴定相关基因的克隆[J].浙江农业学报, 2016,28(6): 935-943.
[9] National Committee for Clinical Laboartory Standards.Perfomrance standards for antimicrobial disk and dilution susceptibility test for bacteria isolated from anima1s:approved standard[S].seconded.NCCLS document M31-A2.Wayne USA,2000.
[10] 布坎南·R·E,吉本斯·N·E.伯杰细菌鉴定手册(第8版)[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:516-521.
[11] 王帅涛,宫强,秦翠丽.多杀性巴氏杆菌毒力因子、免疫原及重要基因研究进展[J].中国畜牧兽,2010,37(3):186-188.
[12] 杨泽晓,周香,王印,等.肉鹅巴氏杆菌病的诊治[J].动物医学进展,2013,34(1):119-122.
[13] 张邑帆,沈克飞,郑华.一株鹅巴氏杆菌的分离及鉴定[J].上海畜牧兽医通讯,2014(4):40-41.
[14] 赵蕾,李坤林,孙翠平,等.鹅源A型多杀性巴氏杆菌的分离与鉴定及PCR分型[J].中国家禽,2011,33(18):62-63.
(责任编辑:朱宝昌,杨静)
加入台湾华艺CEPS中文电子期刊服务的声明
《河北科技师范学院学报》自2004年10月起,加入台湾中文电子期刊服务——思博网(CEPS)。中文电子期刊服务——思博网是目前台湾地区最大的期刊全文数据库,收录台湾地区300余种核心期刊的全文,其访问地址为:www.ceps.com.tw。自此,读者可以通过这一网址检索《河北科技师范学院学报》于1994年起各期的全文。此外,由于《河北科技师范学院学报》被CEPS收录,故凡向本刊投稿者,均视为其文稿刊登后可供思博网(CEPS)收录、转载并上网发行;其作者文章著作权使用费与稿酬本刊一次付清,不再另付其他报酬。请各位继续支持本刊,谢谢!
学报编辑部
本刊加入《中国学术期刊(光盘版)》和《中国期刊网》全文数据库的声明
为了适应我国信息化建设的需要,继续扩大作者学术交流的渠道,本刊已加入《中国学术期刊(光盘版)》和《中国期刊网》全文数据库。本刊已许可中国学术期刊(光盘版)电子杂志社在中国知网及其系列数据库产品中,以数字化方式复制、汇编、发行、信息网络传播本刊全文。该社著作权使用费与本刊稿酬一并支付。作者向本刊提交文章发表的行为即视为同意我社上述声明。如不同意文章编入该光盘版和数据库,请另投它刊。
学报编辑部
Identification and Drug Sensitivity Test of P.MultocidaTSP-1 Isolated from Goose
ZHANG Zhaoxing, LI Yunyu, ZHANG Xiangzhai, JIA Qinghui, CHANG Chaoyue, Yan Yanjuan, LI Peiguo
(Key Laboratory of Preventive Veterinary Medicine in Hebei Province, Hebei Normal University of Science and Technology, Qinhuangdao Hebei, 066604, China)
In order to identify the pathogen causing acute death in goose, a suspected pathogenic bacterium from the clinical death cases of goose, was isolated and named as STP-1. The morphological observation, biochemical identification and sequence analysis of 16S rRNA were conducted. All the data indicated the suspected strain was a member ofP.multocida. STP-1 strain also had a strong pathogenicity to goose in further animal regression. Drug sensitivity test exhibited STP-1 was high sensitive to spore cefixime, florfenicol, azithromycin and amikacin, moderately sensitive to ceftriaxone, gentamicin, enrofloxacin and doxycycline, but resistant to ampicillin, amoxicillin and tetracycline etc.
goose;P.multocida; identification; 16S rRNA; drug sensitivity test
10.3969/J.ISSN.1672-7983.2017.01.010
2017-03-02
S852.61
A
1672-7983(2017)01-0048-05
张召兴(1988-),男,研究生在读。主要研究方向:动物病原微生物及其防控。
*通讯作者,男,博士,教授。主要研究方向:动物疫病防控技术。E-mail:lpeiguo@163.com。
