黄芪多糖抗心肌缺血再灌注损伤的线粒体机制研究❋
2017-06-01范宗静谢连娣董巧稚逯金金
范宗静,谢连娣,董巧稚,崔 杰,刘 洋,吴 旸,逯金金
(北京中医药大学东方医院心血管科,北京 100078)
【实验研究】
黄芪多糖抗心肌缺血再灌注损伤的线粒体机制研究❋
范宗静,谢连娣,董巧稚,崔 杰,刘 洋,吴 旸△,逯金金
(北京中医药大学东方医院心血管科,北京 100078)
目的:通过观察黄芪多糖对缺血再灌注损伤大鼠心肌线粒体膜电位、膜通透性转换孔(mPTP)活性及钙离子浓度等指标的影响,以探索黄芪多糖产生心肌保护作用的线粒体机制。方法:健康成年SD雄性大鼠35只分为假手术组、缺血再灌注组、黄芪多糖预处理组、黄芪多糖后处理组、阳性药物腺苷对照组各7只,采用冠状动脉结扎的方法建立大鼠心肌缺血模型,测定心肌线粒体膜电位、线粒体膜通透性转换孔(mPTP)活性、线粒体钙离子浓度及ROS水平等指标。结果:与假手术组比较,缺血再灌注损伤组线粒体膜电位、mPTP的开放程度、线粒体钙离子浓度及ROS水平均显著升高,而经黄芪多糖处理后线粒体膜电位、mPTP的开放程度、线粒体钙离子浓度及ROS水平明显降低。结论:黄芪多糖可通过减轻钙超载,减少ROS 产生,降低膜电位水平及抑制mPTP 过度开放,从而减轻缺血再灌注损伤对线粒体膜结构的破坏,保护线粒体功能,进而保护心脏舒缩功能。
心肌缺血再灌注损伤;线粒体;黄芪多糖
心肌缺血再灌注损伤[1](myocardial ischemia reperfusion mjury,MIRI),是指心肌缺血后在恢复循环的早期所出现的较缺血时更为严重的心肌损害,临床表现多种多样,常见的表现为心律失常、血压骤降、心功能不全甚至猝死等病情加重的现象。MIRI可引起一系列线粒体功能紊乱现象,包括mPTP的开放、线粒体基质Ca2+超载以及ROS的产生等。中药在治疗 MIRI 方面前景广阔[2]。黄芪多糖从黄芪中分离萃取,临床应用广泛,目前其研究具有显著的心肌保护作用[3-4]。本研究应用最佳作用浓度的黄芪多糖,通过制作大鼠心肌缺血再灌注损伤模型,并以心肌线粒体作为研究靶点,观察黄芪多糖对心肌线粒体膜电位(mitochondrial membrane potential,△Ψm)、线粒体膜通透性转换孔(Mitochondrial permeability transitionpore,mPTP)活性等指标的作用,从细胞线粒体层面研究黄芪多糖对心肌保护作用的机制,为其应用于临床提供理论依据。
1 材料
1.1 动物
健康成年SD雄性大鼠35只(北京维通利华实验动物技术有限公司提供,动物合格证号SCXK(京)2012-0001),体质量300~350 g,实验前大鼠观察驯养3 d,喂饲普通基础饲料并保持环境安静。
1.2 试剂
5 μmol/L鱼藤酮,5 mmol/L琥珀酸,0.25 mol/L蔗糖,0.1 mol/L Tris-HCl,110 mmol/L KCI,5 mmol/L KH2PO4。HEPES、咪唑、EDTA、CaCl2均购自Sigma 公司。
1.3 仪器设备
Sp-Ⅲ心电监护仪(由美国COLIN公司提供),TKR-200C小型动物呼吸机(由江西特力麻醉呼吸设备公司提供),低温超速离心机(BECKMEN公司),电动玻璃匀浆器(购自宁波新芝科器研究所),生物医学信号采集处理系统(由北京微信斯达科技发展有限责任公司提供),原子吸收分光光度计 (购自AA-6601F,岛津),VIS-723分光光度计(购自上海精密科学仪器有限公司),电子天平(由梅特勒-托利多仪器有限公司提供)。
2 方法
2.1 缺血再灌注模型的制备
将大鼠麻醉后进行气管插管连接动物呼吸机,调呼吸比2∶1,潮气量6~8 mL,频率80次/min,多导联心电监测。开胸暴露心脏,并找到分离左冠状动脉前降支,以5-0无创缝合线穿过血管,阻断左冠状动脉前降支血流,心电图显示ST段抬高(>0.15 mv),说明结扎成功;再灌注时解开活结,即可使阻断的左冠状动脉前降支血流再通,缺血再灌注模型建立,每次都由同一人完成操作步骤。
2.2 动物分组
将35只大鼠按随机数字表法分成5组各7只。假手术组仅于冠状动脉左前降支穿线但不结扎,并于穿线前和再灌给予等量生理盐水。缺血再灌注组结扎冠状动脉左前降支,阻断血流120 min,再灌注60 min,此组不给药。黄芪多糖预处理组阻断血流前立即髂静脉给予黄芪多糖(30 mg/kg)5 min推入,结扎120 min后进行再灌注,再灌注60 min后给予相应容积的生理盐水。黄芪多糖后处理组阻断血流前立即给予相应容积的生理盐水,结扎120 min后进行再灌注,并于60 min后给予黄芪多糖(30 mg/kg)5 min推入。阳性药物对照组阻断血流前立即经髂静脉给予腺苷(305 μg/kg/min)5 min内推入,并于120 min后进行再灌注,60 min后给予相应容积的生理盐水。
2.3 大鼠心肌线粒体提取
再灌结束后剪碎心肌组织,置于7 ml 0.3 mmol/L蔗糖、10 mmol/L咪唑(pH 7.4,4℃)溶液中进行研磨,离心10 min后取上清液,再次离心20 min得到少量沉淀物,然后用洗液(成分为25 mmol/L蔗糖,75 mmol/L甘露糖,50 μmol/L EGTA,O.1 mol/L KCI,pH 7.4,4℃)洗1遍,再次离心20 min,沉淀物即为心肌线粒体。并对线粒体活性及纯度进行琥珀酸脱氢酶测定。通过透射电镜观察线粒体超微结构并进行照片分析。
2.4 大鼠线粒体膜电位测定
取线粒体膜电位测定反应介质2 ml并进行混匀,测定荧光值(F1),发射波长设定为525 nm,激发波长设定为500 nm;测试后加入线粒体悬液100 μl进行5 min25℃孵育,然后加入100 nmol CaCl2使线粒体肿胀;进行5 min离心提取上清,然后测荧光值(F2),计算每毫克线粒体所引起荧光值的变化[(ΔF)=(F1-F2)/(mg prot)],从而反映线粒体ΔΨm。
2.5 线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)活性测定
先在石英杯中加入反应缓冲液2 ml,然后加入浓度0.5 mg/ml的线粒体100 μl,25℃孵育2 min后,加入100 nmol CaCl2诱发线粒体肿胀。在540 nm波长下,用分光光度计测定加入CaCl2即刻的吸光度值(A0)和10 min时的吸光度值(A10),计算吸光度值的差值(ΔA540=A0-A10),表示MPTP的活性,以反映线粒体通透性转换的程度。
Ca2+作为常用的mPTP 开放诱导剂,用Ca2+进行诱导后测定mPTP 的变化能力,可反映线粒体mPTP 的初始状态。将线粒体置于高Ca2+浓度体系中,Ca2+通过诱导mPTP的开放引起线粒体膨胀,使线粒体的吸光度在10 min 内逐渐减小。线粒体的吸光度值减少越小,说明Ca2+诱导的mPTP 开放程度越小,mPTP 的初始状态开放程度越大。相反,线粒体的吸光度值减少越大,说明Ca2+诱导的mPTP 开放程度越大,mPTP 的初始状态开放越少。
2.6 线粒体钙离子浓度测定
每组中分别取线粒体悬液1.5 ml置于10 ml的加盖刻度试管中,然后加入5 ml浓硝酸置于阴暗处硝化1周。烘箱加热使硝酸分解蒸发,并加入1%的氯化镧至10 ml混匀制成样品。用分光光度计测吸收光密度并计算浓度。
2.7 活性氧簇水平(ROS)测定
将心肌组织制成单细胞悬液,再用DMEM培养液悬浮分散细胞并进行培养,观察到细胞成片搏动后将用于实验。各组细胞均加入ROS荧光标记,空白对照孔不做任何处理。用PBS清洗细胞吹打后收集,然后用流式细胞仪检测细胞内ROS水平。各实验组分析所用ROS水平为该实验组流式细胞仪所测值减去空白对照孔的基础值。
2.8 统计学方法
3 结果
3.1 各组心肌线粒体膜电位比较
表1显示,经测定反应介质的荧光值F1=442.48,假手术组的线粒体荧光值最高,缺血再灌注损伤组的荧光值最低,从而得出线粒体膜电位在假手术组中最低,在缺血再灌注损伤组中最高。黄芪多糖后处理组和预处理组线粒体膜电位水平较缺血再灌注损伤组的膜电位均有所减低(P<0.05)。
表1 各组大鼠心肌线粒体膜电位比较
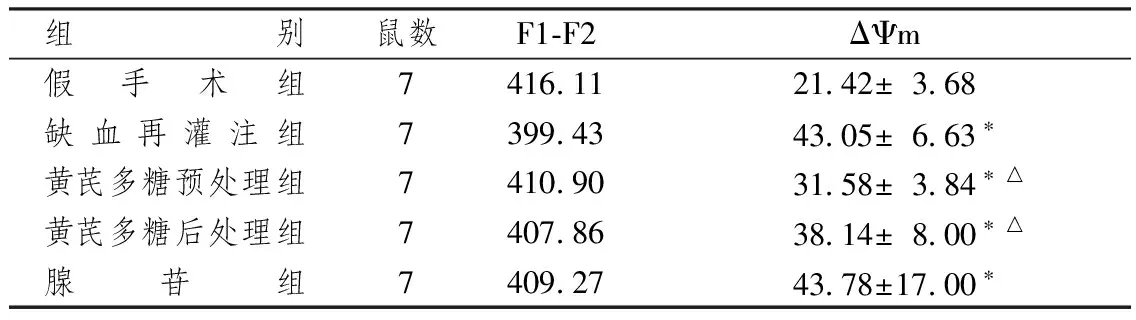
组 别鼠数F1⁃F2ΔΨm假手术组7416 1121 42±3 68缺血再灌注组7399 4343 05±6 63∗黄芪多糖预处理组7410 9031 58±3 84∗△黄芪多糖后处理组7407 8638 14±8 00∗△腺苷组7409 2743 78±17 00∗
注:与假手术比较:*P<0.05;与缺血再灌注组比较:△P<0.05
3.2 各组大鼠心肌线粒体mPTP活性、心肌细胞活性氧簇水平(ROS)以及线粒体钙离子浓度比较
表2显示,假手术组mPTP的活性最高,缺血再灌注损伤组mPTP的活性最低,黄芪多糖预处理组和黄芪多糖后处理组以及腺苷组的mPTP活性均较缺血再灌注损伤组的活性高(P<0.05),提示黄芪多糖能够模拟阳性药物腺苷抑制mPTP的开放。
表2显示,假手术组的钙离子浓度最低,而缺血再灌注损伤组的钙离子浓度最高。黄芪多糖预处理组和后处理组与缺血再灌注损伤组比较,线粒体钙离子浓度均减低(P<0.05)。黄芪多糖预处理组的钙离子浓度低于黄芪多糖后处理组,差异有统计学意义。
表2显示,缺血再灌注损伤与假手术组比较ROS显著增高。黄芪多糖预处理组和后处理组以及腺苷组3组均较缺血再灌注损伤组ROS明显降低。预处理组与较后处理组和腺苷组比较,ROS也有所降低,差异有统计学意义。
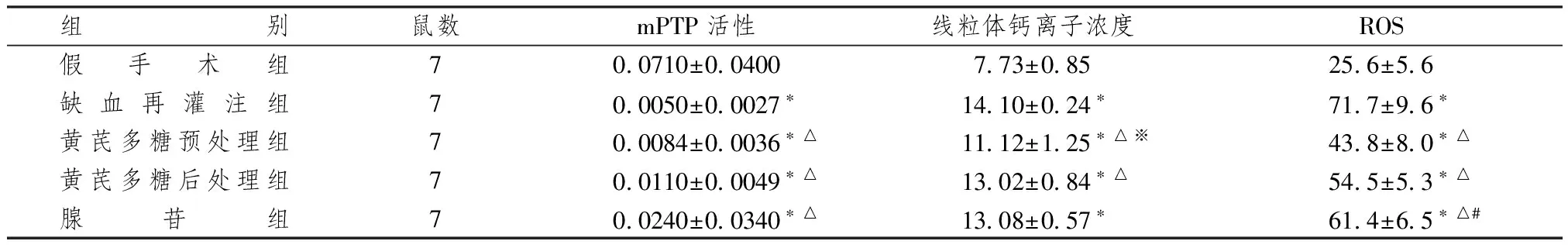
表2 各组大鼠心肌线粒体mPTP活性比较
注:与假手术组比较:*P<0.05;与缺血再灌注组比较:△P<0.05;与黄芪多糖后处理组比较:※P<0.01;与黄芪多糖预处理组比较:#P<0.05
4 讨论
黄芪多糖是黄芪的有效活性成分之一,经过高科技多道工艺萃取,目前已证实其具有心肌保护作用,然而其心肌保护的具体细胞信号传导机制尚不清楚,尤其是心肌线粒体途径研究目前还比较少。
线粒体在调节活性氧的生成、细胞凋亡、钙稳态中扮演着关键角色,线粒体的完整性对心肌细胞存活至关重要[5],目前已成为心肌保护的重要靶点。MIRI能引起线粒体功能障碍,包括心肌能量合成受阻,膜电位的下降、钙超载、离子稳态失衡及自由基大量产生等。MIRI过程使线粒体的各种稳态平衡均发生严重改变,这些因素相互影响并形成恶性循环,从多种途径参与MIRI的发生[6]。
mPTP是线粒体进行氧化应激、细胞呼吸、合成ATP等生命活动的必要条件,也是影响线粒体稳定性和细胞功能的关键因素,是MIRI后心肌细胞损伤的重要原因7-8]。mPTP的持续开放可损伤细胞线粒体[9-10],在某些生理情况下mPTP 呈关闭状态,而线粒体内膜只是对某些代谢底物及离子存在选择性通透。当在应激时mPTP 呈开放状态,会允许相对分子质量<1500 的小分子通过,从而导致线粒体质渗透压的升高,而引起线粒体基质水肿、外膜损伤、促细胞凋亡因子及细胞色素C等释放。同时,呼吸链与氧化磷酸化解偶联,并使线粒体跨膜电位消失,ATP合成停止,致使心肌细胞的死亡[11]。
当缺血再灌注发生时,离体心肌细胞线粒体内会产生大量的ROS,导致心肌细胞的损伤。心肌损伤的机制包括细胞膜的脂质过氧化作用、蛋白质变性及基因组DNA断裂。最近有研究结果表明,△Ψm在MIRI时异常去极化与ROS的破坏作用同时发生[12],ROS的增加和再灌注后使ΔΨm 快速复极化,从而诱发线粒体内膜通透性升高,导致mPTP的持续开放,mPTP的开放则会诱发细胞质中Ca+大量流入到线粒体内,引起细胞质内钙超载,导致线粒体膜结构受损[13],引发线粒体功能障碍。所以,线粒体内mPTP开放的、Ca+超载与 ROS的损伤互相作用,形成恶性循环。
本研究显示,经黄芪多糖预处理或后处理后,mPTP活性均较缺血再灌注损伤组的活性增高,线粒体的膜电位、钙离子浓度及ROS的释放均有所减低。进而推测黄芪多糖可以通过抑制钙库内钙大量释放减轻钙超载,从而减轻缺血再灌注对线粒体呼吸功能的损害。此外,黄芪多糖使ROS产生减少,又进一步减轻ROS对线粒体膜结构的破坏,黄芪多糖抑制mPTP 过度开放,降低线粒体膜兴奋性,从而保持线粒体内膜完整,保证线粒体ATP合成,保护线粒体功能并进一步改善心肌能量代谢,保护心脏舒缩功能。
[1] SCHULZE CJ, WANG W, KUMARI R, et al. Imbalance between tissue inhibitor of metallopreteinase-4 and matrix metalloproteinase-4 during acute myocardial correction of myocardial ischemia-reperfusion injury [J]. Circulation, 2003, 107(19): 2487-2492.
[2] 李冀,王秀珍,李在斯,等.中药治疗心肌缺血再灌注损伤的研究进展[J]. 中医药学报,2015,43(2): 107-109.
[3] 梁丽娟,屠鹏飞,赵奎君.黄芪多糖的药理作用研究进展[J]. 中国药房,2010,21(43): 4113-4115.
[4] 朱丹. 黄芪多糖对人心脏微血管内皮细胞缺血再灌注损伤影响的研究[D]. 北京:北京中医药大学,2009.
[5] 杨一萍,骆媛,范礼斌.线粒体在心肌缺血再灌注损伤中的作用研究进展[J].中国药理学与毒理学杂志,2012,26(4): 577-580.
[6] PENNA C, PERRELLI M G, PAGLIARO P. Mitochondrial pathways, permeability transition pore, and redox signaling in cardioprotection: therapeutic implications[J]. Antioxid Redox Signal,2013,18(5):556-599.
[7] ELROD JW, MOLKENTIN JD. Physiologic functions of cyclophilin D and the mitochondrial permeability transition pore[J]. Circ J, 2013, 77(5):1111-1122.
[8] DAVIDSON S M, YELLON D M, MURPHY M P, et al. Slow calcium waves and redox changes precede mitochondrial permeability transition pore opening in the intact heart during hypoxia and reoxygenation[J]. Cardiovasc Res, 2012,93(3): 445-453.
[9] HOSHOVS′KA, LUVSHYMANS′KA TV, RUDYK OV, et al. Mitochondria permeability transition as a target for ischemic preconditioning[J]. Fiziol Zh,2011,57(4):34-45.
[10] KURIAN G A, BERENSHTEIN E, SAADA A. et al. Rat cardiac mitochondrial sub-populations show distinct features of oxidative phosphorylation during ischemia, reperfusion and ischemic preconditioning[J]. Cell Physiol Biochem,2012,30(1):83-94.
[11] THORSTEN M.LEUCKER, MARTIN BIENENGRAEBER, MARIA MURAVYEVA, et al. Endothelial-cardiomyocyte crosstalk enhances pharmacological cardioprotection[J]. Journal of Molecular and Cellular Cardiology,2011,51:803-811.
[12] LYON AR,JOUDREY PJ,JIN D,et al.Optical imaging of mitochondrial function uncovers actively propagating waves of mitochondrial membrane potential collapse across intact heart[J]. J Mol Cell Cardiol,2010,49(4):565-575
[13] 李朝杰,龙明智.心肌缺血-再灌注损伤的相关分子机制及防治[J]. 国际心血管病杂志,2011,38(5): 273-276.
Astragalus Polysaccharides (APS) Protects Against Myocardial Ischemia-Reperfusion (I/R) Injury Through Mitochondrial Mechanisms
FAN Zong-jing, XIE Lian-di, DONG Qiao-zhi,CUI Jie, LIU Yang, WU Yang△,LU Jin-jin
(DongFangHospital,BeijingUniversityofChineseMedicine,Beijing100078,China)
Objective: To investigate the mitochondrial mechanisms of Astragalus Polysaccharides (APS) therapy by observing the effects on the expression of the mitochondrial membrane potential (MMP), the active of mitochondrial permeability transition pore (mPTP) and the concentration of calciumion in rats with myocardial ischemia-reperfusion (I/R) injury. Methods: Thirty five (35) male Sprague-Dauley (SD) rats were randomly divided into the following 5 groups: sham operation group, I/R injury group, APS pre-treatment group, APS post-treatment group and adenosine control group. We measure the levels of MMP, the concentration of calciumion, the level of reactive oxygen species (ROS), andtheactiveofmPTP. Results: Compared with the sham operation group, the I/R injury group showed significantly increase with the levels of MMP, the concentration of calciumion, the level of reactive oxygen species (ROS), andtheactiveofmPTP. Compared with the I/R injury group, the APS pre-treatment group and the APS post-treatment group showed significantly decrease in all these indicators. Conclusion: APS play a protecting role on cardiac function through protecting the function of mitochondria, which byreducingthe levels of ROS,theconcentrationofacalciumion,thelevelofMMP, andinhibitingtheopening ofmPTP.
Myocardial ischemia reperfusion injury(MIRI); Mitochondrium;Astragalus polysaccharides
国家自然科学基金面上项目(81573900)-黄芪多糖对缺血再灌注损伤人微血管内皮细胞线粒体分裂以及凋亡的影响;国家自然科学基金青年基金项目(81102573)-黄芪多糖对缺血再灌注损伤大鼠心肌线粒体mPTP开放及其调控因素的影响;北京中医药大学中青年教师类课题面上项目(2015-JYB-JSMS10)-黄芪多糖后处理对缺血再灌注损伤人心肌细胞线粒体通透性转换孔道(mPTP)开放等作用的研究
范宗静(1983-),女(满族),河北承德人,主治医师,医学硕士,从事中西医结合心血管疾病的防治与研究。
△通讯作者:吴 旸,男,主任医师,医学博士,硕士研究生导师,从事中西医结合心血管疾病的防治与研究,Tel:010-67689756,E-mail:drwuyang@163.com。
R285.5
B
1006-3250(2017)04-0484-04
2016-10-17
