白芷种子蛋白质提取方法的比较
2017-05-30吴萍郭俊霞李青苗夏燕莉张美肖特方清茂
吴萍 郭俊霞 李青苗 夏燕莉 张美 肖特 方清茂
摘要 [目的] 建立适用于白芷种子的SDS-PAGE蛋白质样品提取方法。[方法]比较5种提取方法所获得白芷种子总蛋白质产量以及SDS-PAGE电泳的谱带数目、强度和电泳分辨率等方面的差异。[结果] 方法a所提蛋白质含量高,杂质少,电泳谱带清晰;方法b所提蛋白质溶液电泳谱带清晰,分辨率较高,但提取含量较低;方法c和d所提蛋白质杂质较多,纯度不高,分辨率较低;方法e所提蛋白质纯度较高,但蛋白条带缺失较多。[结论]方法a提取白芷种子蛋白质的效果最好,所提蛋白效率較高,杂质少,电泳谱带清晰,分辨率高,谱带数多,优于其他提取法。
关键词 白芷种子;蛋白质提取;聚丙烯酰氨凝胶电泳
中图分类号 S567.1+9 文献标识码 A 文章编号 0517-6611(2017)06-0118-03
Comparison of Protein Extraction Methods for Angelica dahurica Seeds
WU Ping, GUO Jun-xia, LI Qing-miao et al (Sichuan Academy of Traditional Chinese Medicine Sciences, Chengdu, Sichuan 610041)
Abstract [Objective] To establish a suitable protein extraction protocol for total proteins extraction from Angelica dahurica seeds. [Method] We compared the total protein yield and SDS-PAGE electrophoretic band number and strength, lectrophoresis resolution by five different methods. [Result] Method a had higher protein content, less impurity and clearer electrophoresis band. Method b had clearer electrophoresis band, higher resolution, but lower protein content. Methods c and d had more impurity, lower purity and resolution. Method e had higher protein purity, but more lack of protein bands. [Conclusion] Method a has the best extraction effects of protein from A. dahurica seeds, which has higher protein extraction efficiency, less impurity, clearer band, higher resolution, more band number. Thus, method a is superior to other four methods.
Key words Angelica dahurica seed;Protein extraction;Polyacrylamide gel electrophoresis
种子是遗传因素的载体之一。受遗传基因控制的蛋白质分子普遍存在于种子内,并在植物的生长发育过程中起着重要作用[1]。种子蛋白是基因表达的产物,能在种子内积累到很大量而不降解,其电泳谱带具有高度稳定性、专一性和叠加性,在植物的生长发育过程中起着重要作用[2]。种子蛋白作为一种遗传标记被越来越多地应用于种、属关系,种间或种内遗传多样性分析,品种鉴定、物种起源及植物种质资源的研究[3]。1991年,国际种子检验协会将蛋白质电泳方法正式定为标准的品种鉴定方法,并纳入种子检验规程[4]。目前,蛋白质电泳技术已广泛应用于农作物、蔬菜、牧草等种子的品种鉴定[5]、纯度测定[6]、亲缘关系分析[7]。但药用植物种子的蛋白质电泳研究报道甚少,而关于白芷种子蛋白质电泳的研究鲜有报道。
白芷为伞形科植物白芷[Angelica dahurica (Fisch. ex Hoffm.) Benth. et Hook.f]或杭白芷[Angelica dahurica(Fisch. ex Hoffm.) Benth. et Hook. f. var. formosana (Boiss.) Shan et Yuan]的干燥根,因初生根杆为芷,色白,故名白芷,以根入药,其性温,气芳香,味辛、微苦,归胃、结肠、肺经,具有散风除湿、通窍镇痛、消肿排脓等功效[8],可药食两用。白芷以种子繁殖为主,多采用育苗移栽,在常规保存手段下,隔年陈种子发芽率不高,而制约种子发芽率的原因尚不清楚。细胞或组织中受体分子、信号分子等参与基因表达调控,即基因调控均需要蛋白质的参与[9],陈年白芷种子发芽率降低也是基因表达调控的结果。蛋白质提取是电泳
的第1步,蛋白质样品制备的好坏直接决定结果的成败。笔者以白芷种子为材料,采用5种蛋白质提取方法进行比较分析,以期优化出一套适于白芷种子的蛋白质提取方法,为探索白芷种子衰老等理论机制的研究提供技术平台。
1 材料与方法
1.1 供试材料
供试白芷(Angelica dahurica)种子来源于遂宁市永兴镇中脊村,2015年采收。
1.2 主要仪器与试剂
Mini-PROTEAN Tetra小型垂直电泳槽、PowerPacTM HC高电流电泳仪购自美国Bio-rad伯乐公司;Heraeus Multifuge X3低温离心机购自美国Thermo公司;甘氨酸、三羟甲基氨基甲烷、十二烷基磺酸钠(SDS)、尿素、硫脲、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、三氯乙酸(TCA)、β-巯基乙醇(2-ME)、TEMED、过硫酸铵均购自Sigma公司。
1.3 方法
1.3.1 蛋白质提取。
方法a:取种子粉碎,过40目筛,称0.1 g 于离心管中,加入2 mL预冷的提取液A (7 mol/L尿素,2 mol/L 硫脲,4% CHAPS,40 mmol/L Tris-base, 2% 2-ME),混悬后冰上静置3~4 h,4 ℃、12 000 r/min 离心20 min,上清液置于-80 ℃冰箱中备用。
方法b:取种子粉碎,过40目筛,称0.1 g于离心管中,加入预冷的提取液B(100 mmol/L HEPES, pH 7.5, 5 mmol/L EDTA, 5 mmol/L EGTA, 10 mmol/L Na3VO4, 10 mmol/L NaF, 5% 甘油, 2% 2-ME) 2 mL,混悬后冰上静置3~4 h,4 ℃、12 000 r/min 离心20 min,上清液置于-80 ℃冰箱中备用。
方法c:取种子粉碎,过40目筛,称0.1 g于离心管中,加入2 mL预冷的提取液C(150 mmol/L Tris-HCl, pH 8.0, 25% 甘油,2% 2-ME),混悬后冰上静置3~4 h,4 ℃、12 000 r/min 离心20 min,上清液置于-80 ℃冰箱中备用。
方法d:取种子粉碎,过40目筛,称0.1 g于离心管中,加入稀释8倍的浓缩胶缓冲液2 mL [含4.95%丙烯酰胺混合液(29∶1),12.5% 0.5 mol/L Tris-HCl,pH 6.8,0.1% SDS,0.1% 过硫酸铵,1% TEMED],冰浴30 min后,60 ℃水浴40 min,冷却,10 000 r/min离心15 min取上清,-80 ℃冰箱中备用。
方法e:每份材料取研磨后过40目筛的种子粉末0.1 g于离心管中,加入2 mL样品提取液E (50 mmol/L Tris-HCl, pH 6.8,2%SDS,5% 2-ME,10%甘油,0.1%溴酚兰),混匀,室温放置1~2 h。10 000 r/min离心10 min,取上清液进行电泳,-80 ℃冰箱中备用。上样时100 ℃沸水加热4 min 后进行。
1.3.2 紫外分析仪定量测定蛋白质含量。以牛血清白蛋白为标准蛋白,采用紫外分析仪定量测定上述样品的蛋白质含量。
1.3.3 聚丙烯酰氨凝胶电泳。
采用SDS-PAGE法,分离胶12%,浓缩胶5%,垂直平板电泳,加样量为10 μL。电泳缓冲液为Tris-Gly(pH 8.3)系统,起始电压75 V,在指示剂进入分离胶后改为150 V,恒压电泳,待指示剂至胶板下沿1 cm左右停止电泳。
1.3.4 染色与脱色。
胶剥离后放入加有R250染色液的染色皿中,染液漫过胶即可,置于摇床上,转速约为45 r/min,时间约1 h,完成后染液倒去并用水洗去染液。取出染色过的胶放于加有脱色液的染缸里,脱色液漫过胶即可,置于摇床上,转速约为45 r/min,本底色脱净,条带清晰可见即可,完成后倒掉脱色液。
1.3.5 图谱分析。用Quantity one软件进行拍照并做图像分析。
2 结果与分析
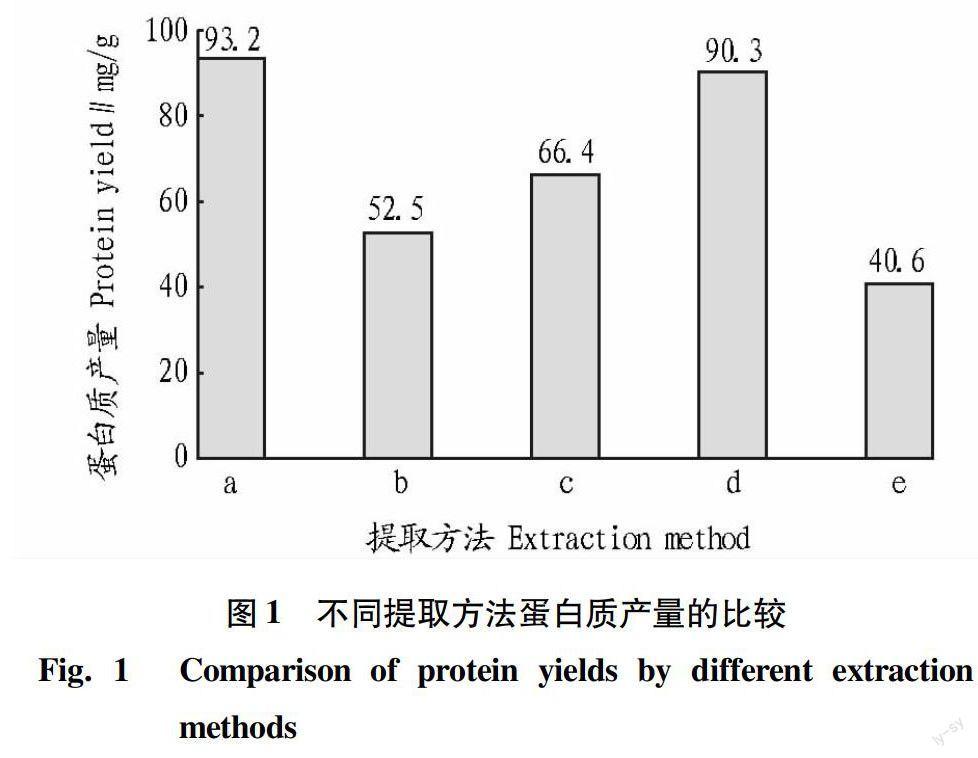
2.1 蛋白质产量的比较
蛋白质产量和纯度是评价提取方法的重要指标。产量越高,蛋白质提取越完全。蛋白质纯度不同,对电泳的影响也不同,较多的杂质将严重影响电泳结果。因此,蛋白质产量越高,纯度越好,提取方法越好。
由图1可知,提取方法a、b、c、d、e的蛋白质含量测定结果分别为93.2,52.5,66.4,90.3,40.6 mg/g。其中,方法a所提的蛋白质含量最高,为93.2 mg/g,方法e所提的蛋白质含量最低,为40.5 mg/g,极差为52.7 mg/g。
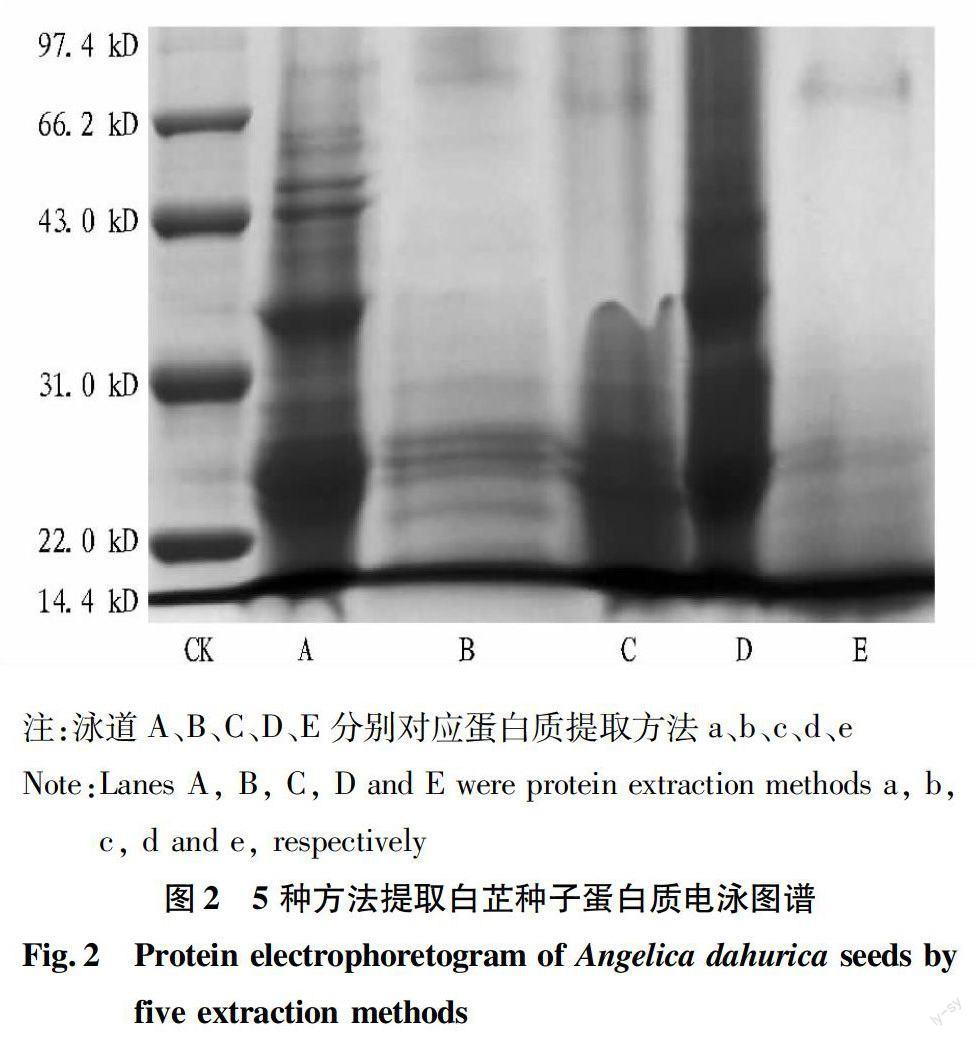
2.2 电泳结果比较
图2为5种白芷种子蛋白质提取方法的SDS-PAGE电泳图谱。结果显示,不同的提取方法所得的PAGE图谱各异,存在条带数目、强度、清晰度等方面的差异。泳道A谱带较全且清晰;泳道B谱带高分子量蛋白质有缺失,条带较弱;泳道C、D、E谱带缺失较多,其中泳道C出现纹理状,样品中杂质较多;泳道D条带模糊且背景较深,拖尾严重,可能是由于样品中杂质和不溶性蛋白质较多;泳道E条带较弱,蛋白质缺失严重。
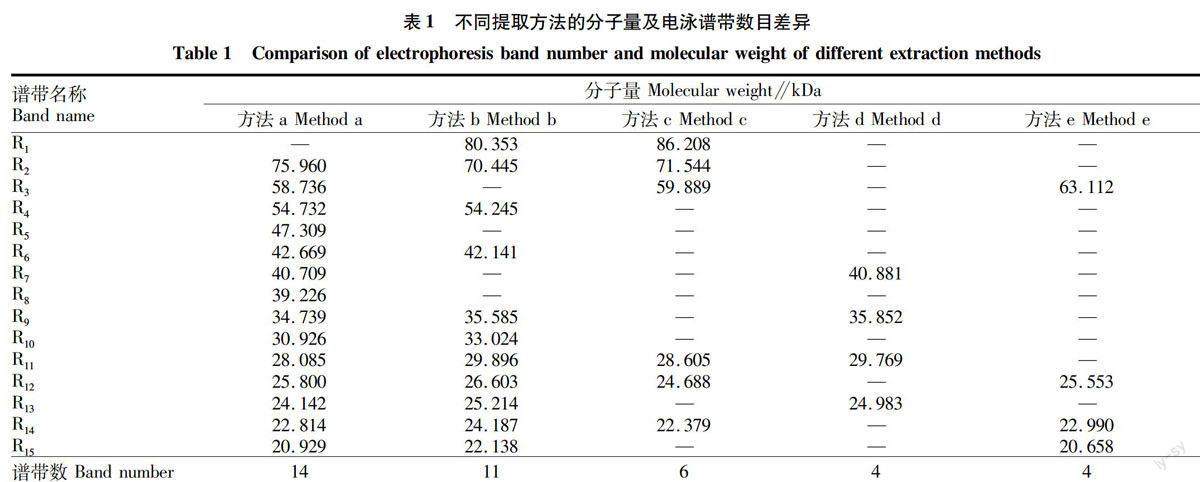
由表1可知,白芷种子的SDS-PAGE电泳图谱共有15条谱带,均为中、低分子量蛋白质,主要集中在14.4~66.2 kD。方法a谱带数目最多为14条,其次是方法b有11条,方法c有6条,而方法d和e均仅有4条。不同泳道谱带的分子量见图3。结果显示,方法a提取的蛋白质(泳道A)种类较多,提取效率较高,这与蛋白质产量的分析结果一致。
3 结论与讨论
种子保存的核心问题是如何控制种子的生命力[10]。蛋白质在种子抗衰老过程中作用很大,贮藏过程中蛋白质分解是种子老化乃至活力丧失的明显特征及原因[11]。种子活力在基因水平上的差异也是通过基因表达的产物蛋白体现出来的。聚丙烯酰胺凝胶电泳是常用研究蛋白质表达的方法之一,具有设备简单、操作方便和分辨率高等优点。蛋白质样品的提取是电泳的第一步,直接决定结果的成败。该研究针对白芷种子蛋白质样品制备设计5种方法,通过蛋白质产量及电泳结果的分析,得出方法a更适合于白芷种子蛋白质的制备,可能是因为方法a中蛋白质提取液含有尿素和硫脲,两者发挥协同作用增强了蛋白质的溶解,甚至可以溶解一些非水溶的贮藏蛋白质。
蛋白质产量和纯度是评价提取方法的重要指标[1]。该研究以白芷种子为材料,选取5种不同的蛋白质提取方法进行比较分析。结果显示,方法a和d所提蛋白质含量明显高于其他3种提取方法。其中,方法d提取的蛋白质溶液,电泳谱带背景较深,杂质较多,分辨率较低;而方法a和b所提蛋白质溶液,电泳谱带清晰,分辨率较高;虽然方法a所提蛋白质溶液的电泳谱带在部分条带出现高丰度蛋白质,致使谱带展宽,但对电泳的分辨率影响不大。方法c虽然所提蛋白质含量高于方法b和e,但杂质较多,提取纯度较低,影响电泳的分辨率。方法e虽然所提蛋白质纯度较高,但蛋白质损失嚴重,蛋白质条带缺失较多。因此,综合各方面情况,方法a提取白芷种子蛋白质的效果最好,其提取效率高,杂质少,电泳谱带清晰,分辨率高,谱带数多。
参考文献
[1] 李晓琳,邵爱娟,陈敏,等.酸浆种子蛋白提取方法的比较研究[J].中国实验方剂学杂志,2010,16(1):14-17.
[2] 马瑞君,王钦,孙坤,等.云南沙棘种子蛋白谱带多样性分析[J].兰州大学学报(自然科学版),2002,38(3):78-81.
[3] 胡志昂,王洪新.蛋白质多样性和品种鉴定[J].植物学报,1991,33(7):556-564.
[4] 国际种子检验协会(ISTA).国际种子检验规程[M].北京:中国农业出版社,1996:196.
[5] 兰海燕,李立会.蛋白质凝胶电泳技术在作物品种鉴定中的应用[J].中国农业科学,2002,35(8):916-920.
[6] 王文宏,朱旭辉.应用蛋白质凝胶电泳法鉴定玉米种子纯度的探讨[J].杂粮作物,2002,22(1):57-58.
[7] 吴浩,彭昕,张煜炯,等.蛋白质电泳指纹图谱在各产地贝母亲缘关系研究中的应用[J]. 中成药,2015,37(8):1757-1761.
[8] 国家药典委员会.中华人民共和国药典:第1部[M].北京:化学工业出版社,2010.
[9] GRG A,WEISS W,DUNN M J. Current two-dimensional eletrophoresis technology for proteomics[J].Proteomics,2004,4:3665-3685.
[10] 王文军,景新明.种子蛋白质与蛋白质组的研究[J].植物学通报,2005,22(3):257-266.
[11] ABDUL-BAKI A A.Biochemical aspects of seed vigor[J].Hortscience,1980,15:765-771.
