葡萄籽原花青素聚合度分析方法的研究
2017-05-18高德艳梁红敏任继波张晶莹胡文效
高德艳,梁红敏,任继波,张晶莹,胡文效
(山东省葡萄研究院,山东济南250100)
葡萄籽原花青素聚合度分析方法的研究
高德艳,梁红敏,任继波,张晶莹,胡文效*
(山东省葡萄研究院,山东济南250100)
优化葡萄籽原花青素物质的量测定方法,确定比色条件,建立标准曲线。该方法线性范围为0.055 μmol/mL~0.275 8 μmol/mL,检出限为2.912×10-4μmol/mL,加标回收率在95%~100%,精密度RSD为0.757 1%;通过建立原花青素聚合度计算方法,测定不同原花青素聚合度进行验证试验,试验结果证实该法灵敏度高、重现性良好,适用于不同原花青素聚合度的分析。
原花青素;聚合度;葡萄籽
随着我国葡萄产业的迅速发展,葡萄籽作为葡萄产业的资源性副产物具有很高的利用价值。葡萄籽中含有丰富的原花青素,原花青素(Proanthocyanidins)是由儿茶素、表儿茶素及其没食子酸酯类缩合而成的多酚类化合物,具有较强的抗氧化活性,在医药、食品、保健品及化妆品行业具有广泛的应用前景。根据聚合度不同,原花青素分为低聚体原花青素(OPC,聚合度DP≤5)和高聚体原花青素(PPC,聚合度>5);由于单体组成及成键类型不同,同一聚合度原花青素有多种异构体,形成复杂混合物。不同聚合度原花青素抗氧化活性不同,大量研究证实随着原花青素聚合度的增加,其抗氧化活性和对羟自由基和超氧阴离子自由基清除能力逐渐降低[1-2]。
文献中原花青素聚合度的分析方法主要有硫解-HPLC法[3]、RP-HPLC-MS联用法[4]、薄层层析法及凝胶渗透色谱法[5]。其中凝胶色谱法是利用不同分子量聚苯乙烯为标准品测定原花青素分子量,该法适用于大分子单一化合物分子量的测定,不适用于低分子量原花青素及混合原花青素聚合度的测定。Kennedy等[6]用RP-HPLC法分析酸催化裂解原花青素产物,得到原花青素平均聚合度,该法需要与质谱联用,操作复杂,并且由于水解不完全导致与实际聚合度的偏差。前两个方法操作较复杂,测定时间长,同时也受到标准品的限制,该法不易推广。有研究表明:原花青素在乙酸体系中仅末端黄烷-3-醇参与香草醛反应,而在甲醇溶剂体系中各黄烷-3-醇均参与反应[3],根据此原理可建立测定原花青素物质的量的方法。
本研究在香草醛-硫酸(甲醇体系)测定原花青素质量的基础上,研究原花青素物质的量测定方法,优化反应体系各反应条件,建立一种快速分析原花青素聚合度的方法,并对该方法进行评价及验证性试验。
1 材料与方法
1.1 试剂与仪器
儿茶素(纯度>98%):美国sigma试剂公司;原花青素(纯度>95%):天津尖峰天然产物研究开发有限公司、浙江森宇天然产物有限公司;原花青素B2(纯度>98%):天津尖峰天然产物研究开发有限公司;香草醛、乙酸、甲醇、盐酸(均为分析纯):国药集团化学试剂有限公司。
UV5200紫外可见分光光度计:上海美谱达仪器有限公司;电热恒温水浴锅:广东环凯仪器有限公司;WND-200型高速中药粉碎机:浙江省兰溪市伟能达电器有限公司;RE-52AA型旋转蒸发器:上海亚荣生化仪器厂。
1.2 方法
1.2.1 原花青素物质的量浓度曲线建立及方法评估
采用香草醛比色法测定原花青素物质的量浓度。具体反应条件:配制0.016 g/L~0.080 g/L(+)-儿茶素-乙酸溶液、含4%(体积分数)盐酸0.5 g/100 mL香草醛-乙酸溶液,避光反应一定时间后于400 nm~600 nm范围内扫描,测定最大吸收波长。
考察不同反应条件(试剂体积比、反应温度、反应时间)对吸光值的影响,确定最佳反应条件,绘制原花青素物质的量浓度-吸光值标准曲线,并对该标准曲线的线性范围、检出限及回收率进行计算与分析。
1.2.2 样品聚合度的计算
通过对不同已知聚合度原花青素进行测定与分析,考察该方法的适用性。采用上述1.2.1方法测定原花青素的物质的量浓度,结合香草醛-硫酸法[8]测定原花青素质量可计算原花青素聚合度(DP),聚合度计算公式如下:
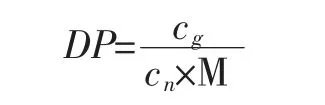
式中:cg为原花青素质量浓度,g/L;cn为原花青素物质的量浓度,moL/L;M为(+)-儿茶素摩尔质量,290 g/moL。
2 结果与讨论
2.1 反应条件的选择
原花青素与香草醛反应产物在光照条件下不稳定,因此反应和测定时需在避光条件下进行。
2.1.1 最大吸收波长
在1 mL儿茶素-乙酸溶液(浓度0.05 mol/L)加入5 mL香草醛-乙酸溶液,室温避光下反应5 min后在400 nm~600 nm范围内扫描,以最大吸收波长作为检测波长见图1。
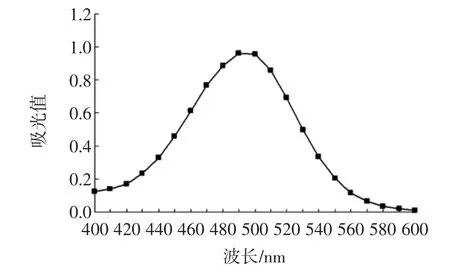
图1 检测波长-吸光值曲线Fig.1 Detection wavelength-absorbance curve
由图1可知,以乙酸为溶剂时,产物的最大吸收波长为500 nm。确定检测原花青素物质的量浓度波长为500 nm。
2.1.2 体积比的确定
为了确保试样中原花青素与香草醛反应完全,对检测过程中所需的香草醛溶液与待测样品体积比对吸光值的影响进行研究,即在1 mL儿茶素溶液中分别按体积比1∶2、1∶4、1∶6、1∶8和1∶10加入香草醛-乙酸溶液,室温下避光反应5 min,测定500 nm下的吸光值,并转化为单位体积反应溶液的吸光度,结果如图2所示。
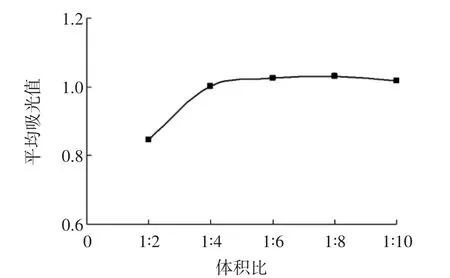
图2 体积比-吸光值曲线Fig.2 Volume-absorbance value curve
由图2可看出,香草醛与试样体积比对反应吸光值影响较大,随着香草醛体积的增加,吸光值增加,当在样品与香草醛体积比为1∶5时,继续增加香草醛吸光值不再增加,此时原花青素与香草醛反应基本完全。因此样品溶液与香草醛试剂的最佳体积为1∶5。
2.1.3 反应温度及反应时间的确定
考察不同反应温度(20、25、30、35、40、50℃)及不同反应时间(1 min~20 min)对吸光值的影响,确定最佳反应温度及反应时间,结果如图3所示。

图3 反应温度与时间-吸光值曲线Fig.3 The reaction temperature and time-absorbance value curve
由上图3可以看出,随着反应温度的升高,吸光值逐渐降低,并随反应时间的延长有所降低。其中在20℃反应条件下,样品吸光值在20 min内较稳定且反应较完全,因此选择反应温度为20℃。从时间曲线可看出在较短时间内(5 min~7 min)酚醛缩合反应较完全,之后吸光值有所降低。确定香草醛与试样反应时间为6 min。
2.2 方法评价
2.2.1 标准曲线和检测限
在2.1.1~2.1.3单因素试验最佳条件下绘制原花青素物质的量浓度-吸光值标准曲线,结果见图4。
从图4可看出在500 nm处吸光度x与物质的量浓度呈良好的线性关系,其回归方程y=0.172x+ 0.000 7,相关系数R2=0.999 6。其中,x为吸光度,y为物质的量浓度(μmol/mL),其线性范围为0.055 μmol/mL~0.275 8 μmol/mL,计算的检出限为LOD=3Σ/s=2.912× 10-4μmol/mL,说明该方法的灵敏度高。
2.2.2 精密度
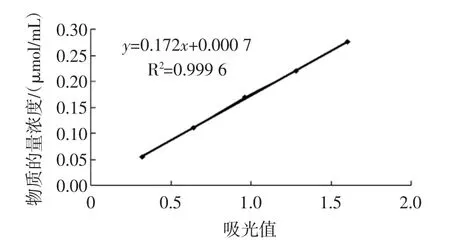
图4 原花青素物质的量浓度-吸光值标准曲线Fig.4 The amount of substance concentration of proanthocyanidins-absorbance value of the standard curve
取两种不同浓度的样品溶液分别平行测定5次进行精密度试验,结果见表1。不同浓度样品的RSD(平均标准偏差)均小于1.0%,说明本法重现性好,符合测定要求。

表1 精密度试验结果Table 1 Precision test results
2.2.3 回收率
取原花青素待测样品溶液1 mL(物质的量为0.032 μmol)各5份,分别加入0.010、0.020、0.040、0.08 μmol的(+)-儿茶素标准品,测定物质的量以及计算回收率,回收率计算结果见表2。

表2 回收率试验结果Table 2 Recovery test results
由表2可知,该法测定原花青素物质的量浓度线性范围较宽,原花青素回收率(回收率/%=(加标试样测定值-试样测定值)/加标量×100)在95%~100%的理想范围内,说明本法准确性高。
2.3 样品聚合度
通过不同已知聚合度范围原花青素为参考,测定其物质的量计算并计算出聚合度进行方法验证,结果见表3。

表3 不同原花青素聚合度分析Table 3 Analysis of polymerization degree of different procyanidins
由表3可知,对不同原花青素(已知聚合度范围)通过2.2.1方法胶进行聚合度测定,试验结果表明该法重现性良好,适用于聚合度10以内的原花青素聚合度的测定与分析。
3 讨论
本方法确定原花青素物质的量测定方法,结合原花青素质量测定方法分析其聚合度。通过已知聚合度范围原花青素为参考依据验证该方法的适用性,试验结果显示该法适用于不同聚合度(2~10)原花青素及原花青素混合物聚合度的分析;值得说明的是,对于原花青素混合物,该法分析得到的聚合度为原花青素平均聚合度;对于纯度不高的原花青素,分析其聚合度为样品中原花青素的平均聚合度,杂质对其无影响。综上所述该法简单易行、重现性良好,适用于不同原花青素聚合度的分析。
[1]孙芸,谷文英.葡萄籽原花青素聚合度与功效关系的研究[D].无锡:江南大学,2004
[2] 赵丹,曾新安,徐中岳.不同聚合度葡萄皮原花青素的抗氧化活性[J].食品与发酵工业,2012,38(4):104-107
[3] Larry G Butler,Martin L Price,Jeffery E Brothertod.Vanillin Assay for Proanthocyanidins(Condensed Tannins):Modification of the Solvent for Estimation of the Degree of Polymerization[J].Agric Food Chem,1982,30:1087-1089
[4]任其龙,魏冠红,金米聪,等.反相高效液相色谱-电喷雾质谱法鉴定葡萄籽低聚原花青素[J].食品与发酵工艺,2006,32(3):79-83
[5]张佰清,闫冬雪.薄层及凝胶色谱法测定树莓籽原花青素的平均聚合度[J].食品工业科技,2013,34(11):317-319
[6] James A Kennedy,Graham P Jones.Analysis of proanthocyanidin cleavage products following acid-catalysis in the presence ofexcess phloroglucinol[J].J Agric Food Chem,2001,49(4):1740-1746
[7] 张晶莹,胡文效,高德艳,等.葡萄籽原花青素检测方法的比较[J].中外葡萄与葡萄酒,2013(6):18-20
Study on Analytical Methods of Grape Seed Proanthocyanidins Polymerization Degree
GAO De-yan,LIANG Hong-min,REN Ji-bo,ZHANG Jing-ying,HU Wen-xiao*
(Shandong Academy of Grape,Jinan 250100,Shandong,China)
This paper optimized the amount of substance concentration of grape seed proanthocyanidins measurement method to determine the colorimetric condition,a standard curve was established.The amount of substance concentration of proanthocyanidins measurement conditions,establish a standard curve,the standard curve range 0.055 μmol/mL-0.275 8 μmol/mL,the detection limit was 2.912×10-4μmol/mL,the recoveries of 95%-100%,precision of RSD was 0.757 1%;test verified by measuring different degree of polymerization of proanthocyanidins,the results confirmed that the method of high sensitivity and good reproducibility.The method was suitable for the analysis different DP of proanthocyanidins.
procyanidins;the degree of polymerization;grape seed
10.3969/j.issn.1005-6521.2017.10.029
2016-08-25
山东省农业重大应用技术创新项目
高德艳(1988—),女(汉),硕士,主要从事生物活性成分活性分离、活性评价等方向研究。
*通信作者:胡文效,男,研究员,研究方向:生物化工专业生物分离方向、食品科学与工程专业葡萄与葡萄酒方向。
