杆菌肽与牛血清白蛋白相互作用的荧光光谱
2017-05-17张玉明倪志华
张玉明 倪志华


摘要:利用荧光光谱法研究杆菌肽与牛血清白蛋白的相互作用,结果表明,杆菌肽可使牛血清白蛋白的内源荧光发生猝灭。在不同温度下研究杆菌肽对牛血清白蛋白的荧光猝灭作用,利用Stern-Volmer方程处理试验数据,证明荧光猝灭机理属于静态猝灭。杆菌肽与牛血清白蛋白具有1个结合位点,计算得到不同温度下杆菌肽与牛血清白蛋白的结合常数(KA)为3.38×104L/mol(298 K)、2.92×104L/mol(308 K)、1.56×104L/mol(318K)。通过计算热力学参数可知,杆菌肽与牛血清白蛋白的相互作用是吉布斯自由能降低的自发过程,且二者间的主要作用力类型为静电作用。三维荧光光谱试验显示,杆菌肽的加入引起牛血清白蛋白构象的变化,表现为蛋白质内部色氨酸残基所处微环境的疏水性降低。
关键词:杆菌肽;牛血清白蛋白;相互作用;荧光光谱;猝灭;热力学参数
中图分类号:Q631 文献标志码:A 文章编号:1002—1302(2016)01—0245—03
杆菌肽是一种药用饲料添加剂,在畜牧养殖业应用广泛,具有促进动物生长、抑制肠道中有害微生物生长、提高机体免疫力的作用,被誉为绿色抗生素饲料添加剂。牛血清白蛋白(bovine serum albumin,BSA)是血浆中含量最丰富的蛋白质之一,在血液中主要具有维持渗透压、缓冲pH值等作用。BSA可与多种阳离子、阴离子、其他小分子物质结合,具有储运内源性代谢产物、外源性药物的重要生理功能;因此,BSA与药物分子的相互作用研究已受到重视。杆菌肽被摄入机体后,极有可能与血液中的BSA结合,以复合物形式在体内吸收、转运。研究杆菌肽与BSA之间的相互作用,有助于了解药物在体内的运输分布和代谢,对于阐明杆菌肽的药理作用和药代动力学具有重要意义。荧光光谱法是研究蛋白质等生物大分子与各种小分子相互作用的重要手段。应用荧光光谱法研究杆菌肽与BSA问的相互作用,着重阐述杆菌肽与BSA的荧光猝灭机理、结合常数、热力学常数,并使用三维荧光技术研究杆菌肽对BSA高级结构的影响。
1材料与方法
1.1仪器与试剂
F97pro型荧光分光光度计(上海棱光技术有限公司),BSll0S型精密电子分析天平(德国sartorius公司),HH系列数控恒温水浴锅(金坛市科析仪器有限公司),明澈-D型超纯水机(Millipore公司)。杆菌肽(上海金穗生物科技有限公司),牛血清白蛋白(北京索莱宝科技有限公司),其他试剂均为分析纯。以0.1 mol/L磷酸缓冲液(pH值7.4)为溶剂,配制0.1 mmol/L的BSA标准溶液。杆菌肽使用超纯水配成1.0 mmol/L的标准溶液。
1.2方法
准确移取一定量的杆菌肽标准溶液于10 mL具塞玻璃试管中,加入BSA标准溶液1.0 mL,于一定温度下恒温放置1 h。在激发和发射光栅狭缝均为5 nm、激发波长为280 nm时,扫描270~500 nm波长范围内BSA、BSA-杆菌肽的荧光光谱。在激发波长270~400 nm、发射波长270~400 nm范围内进行三维荧光扫描,比较溶菌酶与杆菌肽一溶菌酶体系的荧光等高线。
2结果与分析
2.1荧光猝灭光谱
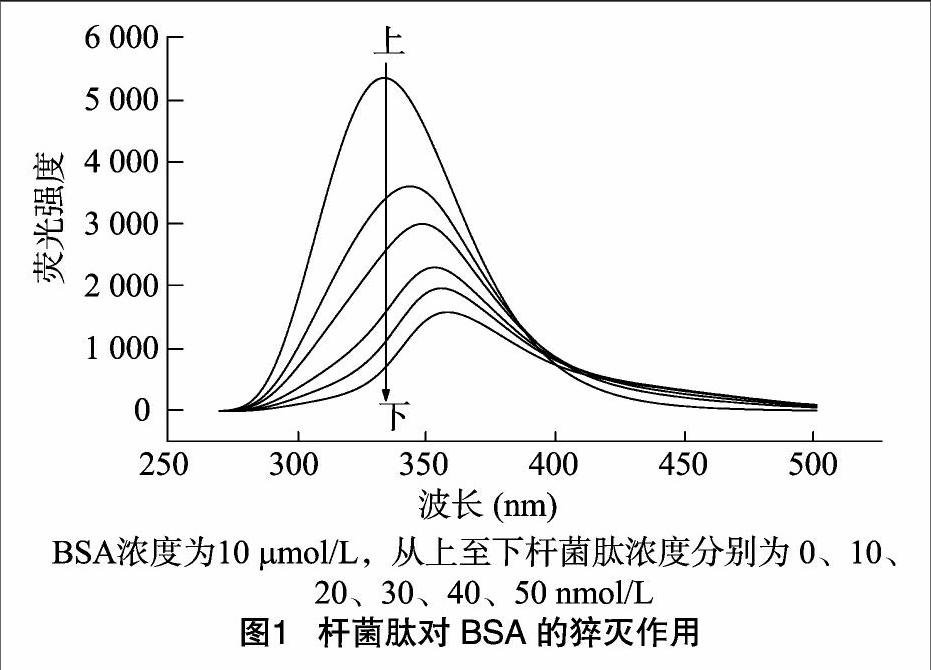
BSA分子因含有色氨酸、酪氨酸、苯丙氨酸等氨基酸残基而发射内源荧光,其中色氨酸的荧光强度最大。激发光为280 nm时,可认为蛋白质所呈现的荧光源自分子中的色氨酸。荧光猝灭指任何降低某样品荧光强度的过程,分子间的相互作用可导致荧光猝灭。
由图1可知,BSA溶液在波长280 nm光激发下可在333.4 nm处具有最大荧光发射峰。在BSA浓度保持恒定的情况下,BSA的内源性荧光强度随杆菌肽浓度的增加而有规律地降低,表明杆菌肽对BSA的內源荧光发生了猝灭作用。随着杆菌肽的加入,BSA的最大荧光发射峰出现红移。杆菌肽浓度为50 nmol/L时,BSA溶液体系的最大荧光发射峰由333.4 nm变化为357.8 nm,即红移了24.4 nm。一般认为,蛋白质中色氨酸残基的最大发射峰与其所处环境的极性密切相关,由发射波长的改变可判断蛋白质构象的变化。上述现象表明杆菌肽的加入使BSA构象发生了变化,色氨酸残基所处环境疏水性降低,杆菌肽与BSA分子发生了相互作用。
2.2杆菌肽对BSA的荧光猝灭机理
有机小分子对蛋白质的荧光猝灭作用主要分为动态猝灭和静态猝灭。动态猝灭主要是一种能量转移或电子转移过程,不影响蛋白质的结构和生理活性;静态猝灭主要是由于小分子和蛋白质等生物大分子发生了相互作用,可能生成不发荧光的配合物。一般认为,动态猝灭是荧光体与猝灭剂之间因相互碰撞而使荧光被猝灭的过程,温度升高可增加分子碰撞的机会,从而提高猝灭效率;静态猝灭是荧光体与猝灭剂之间形成了基态配合物,温度升高使配合物的稳定度下降,从而减小静态猝灭的程度。动态猝灭和静态猝灭均符合Stem-Volmer关系式:
以峰的位置来看,加入杆菌肽后BSA的瑞利散射峰起始位置、荧光峰位置均无显著变化。以峰的强度来看,图3-b中“铅笔”“指纹”形纹线变得稀疏,“指纹”形纹线的变化趋势尤为明显。可见,加入杆菌肽后瑞利散射峰和荧光峰的相对强度均有不同程度的降低。
BSA的空间结构由3个结构域组成,每个结构域由2个亚结构域以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨基酸残基均包埋在圆筒内部而构成疏水腔。杆菌肽分子与BSA的结合部位可能均处于这种疏水腔中,由于杆菌肽与BSA发生反应生成一种新复合物,从而导致疏水微环境极性的改变,进而引起BSA构象的变化。三位荧光光谱结果验证了本试验结论,即杆菌肽与BSA发生了相互作用,荧光猝灭机制属于静态猝灭。
3结论
利用荧光光谱法研究了杆菌肽与BSA的相互作用,杆菌肽对BSA的内源荧光具有较强的猝灭作用,原因是杆菌肽与BSA分子结合形成复合物。分别测定不同温度下杆菌肽与BSA的结合常数、结合位点、热力学参数,结果表明杆菌肽对BSA的荧光猝灭机制为静态猝灭,二者的结合主要基于静电作用,约形成1个结合位点。三维荧光光谱研究表明,杆菌肽与BSA的结合导致了蛋白质分子内部疏水微环境极性的改变,进而导致BSA构象的变化。
