紫外分光光度法测定恩诺沙星微囊含量方法的建立
2017-05-16苏晓晴张李琦郑明学戴浩楠史晨婕白瑞席柔贡鑫张黎徐之勇
苏晓晴,张李琦,郑明学,戴浩楠,史晨婕,白瑞,席柔,贡鑫,张黎,徐之勇
(山西农业大学 动物科技学院,山西 太谷 030801)
紫外分光光度法测定恩诺沙星微囊含量方法的建立
苏晓晴,张李琦,郑明学*,戴浩楠,史晨婕,白瑞,席柔,贡鑫,张黎,徐之勇
(山西农业大学 动物科技学院,山西 太谷 030801)
[目的]为了建立一种操作简便、准确可行的恩诺沙星明胶微囊的含量测定方法,试验选用紫外分光光度法进行测定。[方法]通过专属性、线性、准确度、精密度试验等方法学研究,建立紫外分光光度法测定恩诺沙星明胶微囊含量的方法。[结果]恩诺沙星对照品溶液在2~16 mg·L-1范围内线性关系良好,标准曲线方程为A=0.103 0C-0.028 0(r=0.998 8);精密度RSD为0.00%、0.14%、0.11%(n=3);平均回收率为101.53%、98.03%、98.07%(n=3),RSD为0.25%、0.05%、0.00%(n=3)。[结论]该方法的专属性好,线性、回收率和精密度均符合要求,可以用作对恩诺沙星明胶微囊进行质量控制的测定方法。
恩诺沙星; 明胶微囊; 紫外分光光度法
恩诺沙星(Enrofloxacin)是上世纪80年代德国拜耳公司首先研制成功的动物专用药,是化学合成的第三代喹诺酮类抗菌药物。恩诺沙星具有广谱抗菌、杀菌活性强、渗透性强、体内分布广泛,与其他抗菌药无交叉耐药性等特点。该药适用于牛、猪、禽、犬、猫和水生动物的敏感细菌及支原体所致的消化系统、呼吸系统、泌尿系统及皮肤软组织的各种感染[1]。恩诺沙星制剂在兽医临床上已得到广泛应用,生产中已将其制成多种剂型,如片剂、粉剂、注射剂、普通颗粒剂等,但恩诺沙星本身具有强烈苦味和异味而影响适口性,甚至引起猪拒食,将药物进行包被可以改善其苦味。现已研发出的新剂型有纳米粒[2,3]、微球[4]、β-环糊精包合物[5]、 缓释颗粒剂[6]等,但这些制剂还存在包被不完全、粒径大、缓释效果不明显等缺点。山西农业大学病理实验室现以明胶为囊材,恩诺沙星为芯材,戊二醛为固化剂,采用单凝聚法制得恩诺沙星明胶缓释微囊。
依据《兽药研究技术指导原则》,须对制剂进行质量研究,含量测定为质量研究中重点内容之一,所以建立含量测定的方法非常重要。经过查阅相关文献,未见报道恩诺沙星明胶微囊含量测定的具体方法。《中国兽药典》[7]2010版中规定的恩诺沙星含量测定方法为高效液相色谱法;《兽药质量标准》[8]2003年版中恩诺沙星可溶性粉的含量测定方法为紫外分光光度法。高效液相色谱法的优点是灵敏度高、检测限低、精确度高,但该方法成本昂贵、操作繁琐、不适于快速分析和现场检测;紫外分光光度法成本较低、操作快速简便、重现性和稳定性好,适于临床应用中对药物的快速检验。所以笔者采用紫外分光光度法对恩诺沙星明胶微囊含量进行测定,依据《兽用化学药物质量控制分析方法验证技术指导原则》对此方法的专属性、线性、准确度、精密度等进行验证,从而对分析方法的科学性、准确性和可行性进行考察,分析该方法是否符合测试项目的目的和要求,最终建立单凝聚法恩诺沙星明胶微囊的含量测定方法。
1 材料与方法
1.1 主要药品与试剂
恩诺沙星原料药(含量99%),购自浙江国邦药业有限公司;恩诺沙星对照品(含量99.8%)、胰酶,购自北京索莱宝科技有限公司;恩诺沙星明胶微囊,实验室自制;空白明胶微囊,实验室自制;氢氧化钠,购自天津市大茂化学试剂厂;磷酸氢二钾,购自中国上海华星化工厂;磷酸二氢钾,购自北京精求化工有限责任公司。
1.2 主要仪器
电子分析天平,购自奥豪斯仪器有限公司;超声波清洗器,购自昆山市超声仪器有限公司;恒温玻璃水浴锅,购自金坛市杰瑞尔电器有限公司;紫外可见光分光光度计,购自上海元析仪器有限公司。
1.3 试剂的配制
1.3.1 胰酶液的配制
磷酸二氢钾0.41 g,磷酸氢二钾5.59 g,胰酶10 g,去离子水1 000 mL,调节pH值至8.0,配制后,37 ℃、100 r·min-1条件下振荡2 h,使胰酶游离出来,过滤,取滤液待用[9]。
1.3.2 恩诺沙星对照品母液的配制
精确称取实际含量为10 mg 的恩诺沙星对照品,置于100 mL容量瓶内,用0.1 mol·L-1氢氧化钠溶液定容至刻度,制成100 mg·L-1的恩诺沙星对照品母液,4 ℃保存,备用。
1.3.3 恩诺沙星对照品系列浓度的配制
精密吸取对照品母液1、2、3、4、5、6、7、8 mL置于50 mL容量瓶中,加氢氧化钠溶液稀释至刻度摇匀,制得2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0 mg·L-1系列浓度的恩诺沙星对照品溶液。
1.3.4 恩诺沙星明胶微囊及空白明胶微囊母液的配制
精密称取恩诺沙星明胶微囊0.1 g,置于100 mL烧杯中,加50 mL胰酶液,放于45 ℃恒温水浴锅内,期间每隔半小时振摇一次,于2.5 h时超声半小时取出,加0.1 mol·L-1氢氧化钠溶液定容至100 mL容量瓶内,摇匀,过滤即得1 g·L-1的恩诺沙星明胶微囊母液。
精密称取空白明胶微囊0.1 g,配制成1 g·L-1的空白明胶微囊母液,配制方法同上。
1.3.5 恩诺沙星明胶微囊及空白明胶微囊系列浓度配制
分别取恩诺沙星明胶微囊母液1、2、3、4、5、6 mL于6个100 mL容量瓶中,用氢氧化钠定容至刻度,制得10、20、30、40、50、60 mg·L-1的恩诺沙星微囊溶液。
分别取空白明胶微囊母液2、3 mL于100 mL容量瓶中,用氢氧化钠定容至刻度,制得20、30 mg·L-1空白明胶微囊溶液。
1.4 检测波长的选择
取恩诺沙星对照品溶液及恩诺沙星明胶微囊溶液,利用紫外分光光度计在200~400 nm范围内扫描,根据紫外吸收图谱确定恩诺沙星最大吸收波长。
1.5 专属性试验
取恩诺沙星明胶微囊溶液及空白明胶微囊溶液,依照紫外分光光度法,分别以空囊液和胰酶液为参比校准基线,将上述溶液分别在波长200~400 nm处进行扫描,记录紫外吸收谱图以确定恩诺沙星明胶微囊与恩诺沙星对照品的最大吸收是否相同以及辅料(空白明胶微囊)在最大吸收波长处有无吸收。
1.6 恩诺沙星明胶微囊溶解时间的测定
精确称取3份同批次恩诺沙星明胶微囊0.1 g,分别置于3个100 mL烧杯中,加50 mL胰酶液,放于45 ℃超声波清洗器内24 h,期间每隔半小时振摇一次,从1 h开始,每小时取样一次,每次取样1 mL,取样前超声半小时,加0.1 mol·L-1氢氧化钠溶液定容至100 mL容量瓶内,摇匀,过滤即得20 mg·L-1的恩诺沙星明胶微囊溶液,以空囊液为参比,在确定的最大波长处测定以上各浓度恩诺沙星明胶微囊溶液的吸光度值(OD值),测定不同时间微囊溶解度的变化。
1.7 标准曲线的建立
取2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0 mg·L-1系列浓度的恩诺沙星对照品溶液,用紫外分光光度计测定其OD值,以吸光度(A)为纵坐标,浓度(C)为横坐标进行线性回归,得出回归方程、相关系数及线性图。
1.8 精密度试验
取同一批号的恩诺沙星明胶微囊制成20、30、40 mg·L-13种不同浓度供试品溶液,以空囊液为参比,分别用紫外分光光度计测定其在最大吸收波长处吸光度,每个浓度重复测定3次,记录并计算相对标准偏差(RSD),相对标准偏差(RSD)=标准偏差(SD)/计算结果的算术平均值(X)×100%。
1.9 回收率试验
取3份30 mg·L-1恩诺沙星明胶微囊溶液于三个烧杯中,每份10 mL,分别添加10 mL浓度为10.0、20.0、30.0 mg·L-1的恩诺沙星对照品溶液,最终制备成5.0、10.0、15.0 mg·L-1三个浓度的供试液,分别测定其在最大吸收波长处的OD值。每个浓度重复3次。计算3个不同添加浓度的回收率、平均回收率、RSD,加样回收率/%=加样后测定值/加入对照品含量×100%。各浓度下平均回收率应在98.0%~102.0% 之间,9个回收率数据的RSD应不大于2.0%[10]。
1.10 数据处理
用SPSS 19.0 数据统计软件对试验结果中的组间数据进行ANOVA方差差异显著性分析,试验结果中的数据均以平均值±标准误表示。
2 结果与分析
2.1 检测波长的选择
恩诺沙星对照品及恩诺沙星明胶微囊紫外吸收图谱见图1、图2,由图可知恩诺沙星对照品溶液最大吸收波长为270 nm,恩诺沙星明胶微囊溶液的吸收波长也为270 nm,所以试验选用270 nm为检测波长。
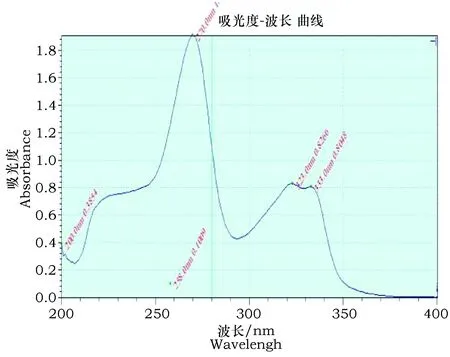
图1 恩诺沙星对照品紫外吸收图谱 Fig.1 Enrofloxacin UV absorption
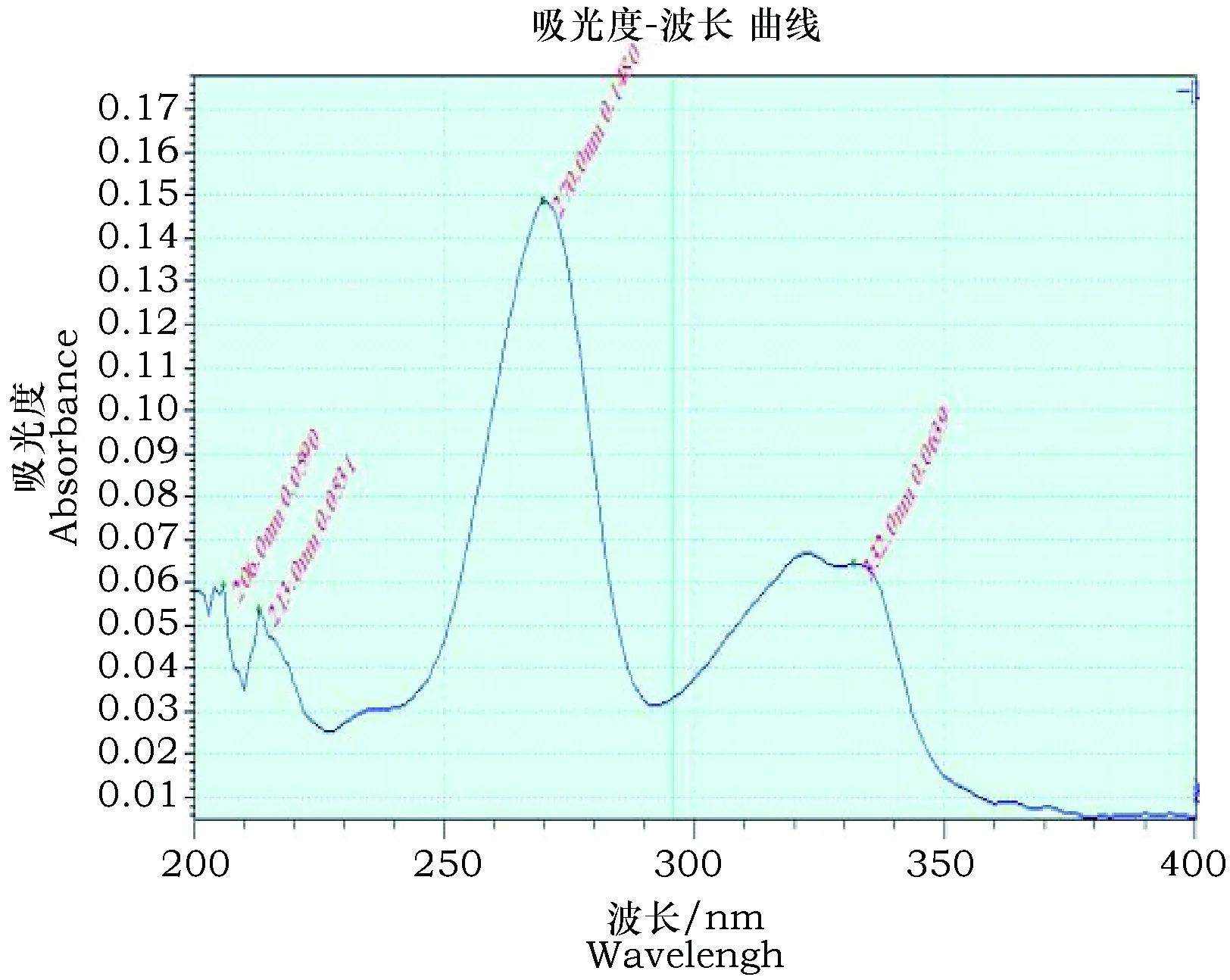
图2 恩诺沙星明胶微囊紫外吸收图谱Fig.2 Enrofloxacin microcapsule UV absorption
2.2 专属性试验
由辅料紫外吸收图谱(见图3)可得辅料在270 nm处几乎无吸收,不干扰恩诺沙星的测定。

图3 空白辅料紫外吸收图谱Fig.3 Accessories UV absorption
2.3 恩诺沙星明胶微囊溶解时间的测定
恩诺沙星微囊溶解3、4、6、8、10 h,溶液中恩诺沙星含量均显著高于1h和2h,而3~10 h时,溶液中药物含量无显著差异(见表1),说明恩诺沙星微囊在胰酶液中3h即溶解完全。
表1 不同溶解时间恩诺沙星微囊溶液的吸光度
Table 1 The Absorbance of Enrofloxacin Microcapsule solution with different dissolution Time
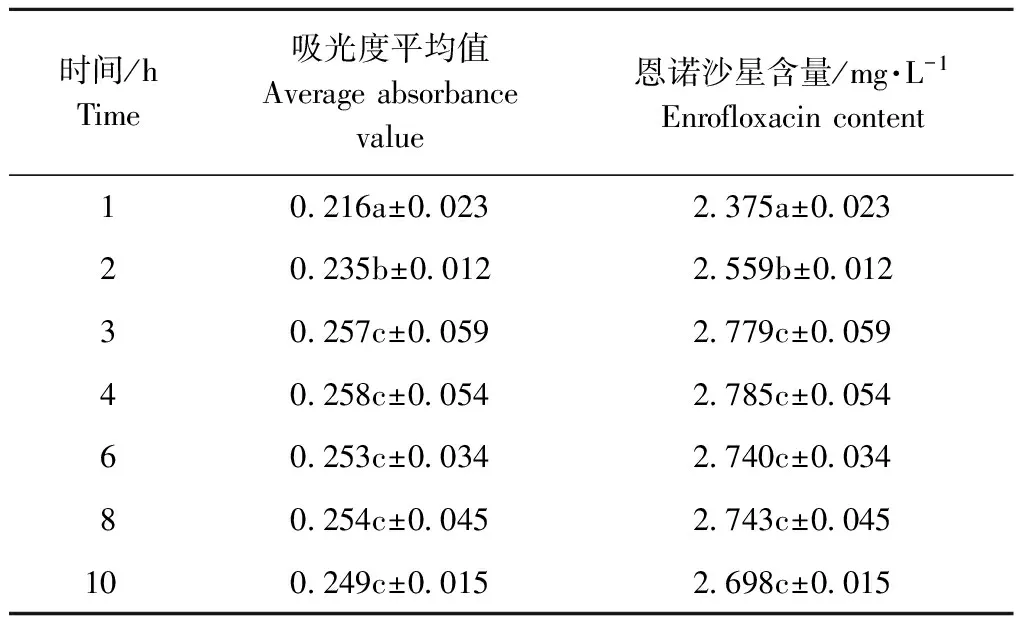
时间/hTime吸光度平均值Averageabsorbancevalue恩诺沙星含量/mg·L-1Enrofloxacincontent10216a±00232375a±002320235b±00122559b±001230257c±00592779c±005940258c±00542785c±005460253c±00342740c±003480254c±00452743c±0045100249c±00152698c±0015
注:同一列数字字母不同,表示差异显著(P<0.05)
Note:Different capital letters show significant difference at the 0.05 level in the same row
2.4 标准曲线
以吸光度值(A)为纵坐标,对照品浓度(C)为横坐标,通过线性回归求得测定恩诺沙星对照品的标准曲线方程为:A=0.103 0C-0.028 0(r=0.998 7),试验表明恩诺沙星在 2.0~16.0 mg·L-1检测浓度范围内线性关系良好,见图4。

图4 恩诺沙星对照品标准曲线Fig.4 Enrofloxacin standard curve
2.5 精密度试验
精密度三个不同浓度下的RSD为0.00%、0.14%、0.11%,表明该方法的精密度高,详见表2。
2.6 回收率试验
三个浓度下平均回收率分别为101.53%、98.03%、98.07%,RSD为0.25%、0.05%、0.00%,符合要求,说明此方法准确度良好,详见表3。
表2 不同浓度恩诺沙星微囊溶液吸光度
Table 2 The Absorbance of Enrofloxacin Microcapsule solution with different density
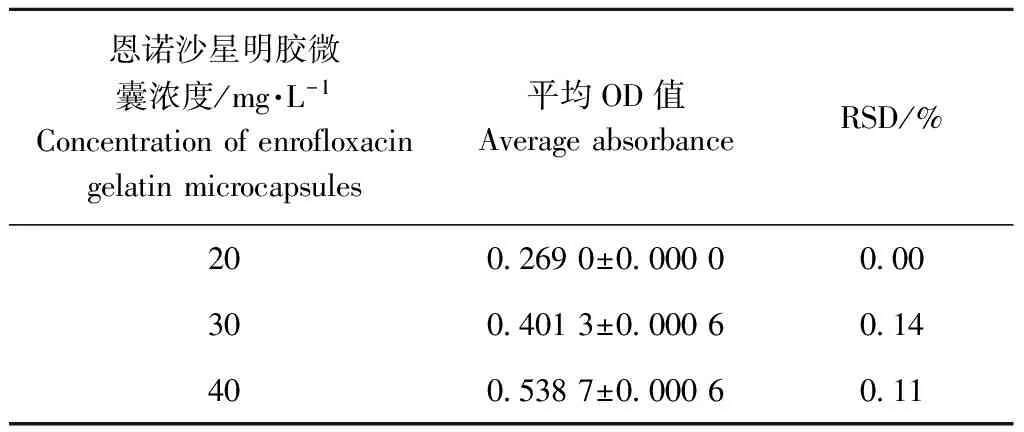
恩诺沙星明胶微囊浓度/mg·L-1Concentrationofenrofloxacingelatinmicrocapsules平均OD值AverageabsorbanceRSD/%2002690±000000003004013±000060144005387±00006011
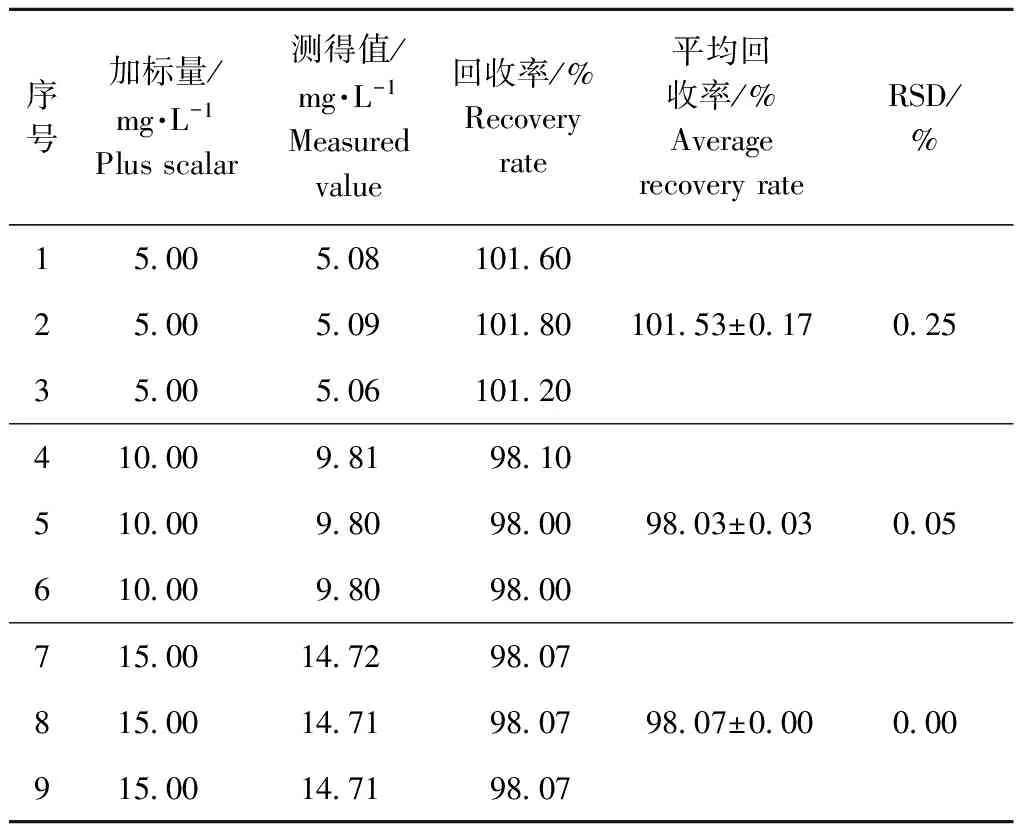
表3 回收率试验结果
3 讨论与小结
测定药物含量时须先对微囊制剂中的药物进行提取,需先将明胶基质水解,使药物游离出来。经查阅《中国兽药典》及农业部制定的相关技术指导原则,均未见微囊含量测定时提取药物的方法。微球中药物含量测定一般有几种常用的方法:酶解法、微球溶解法(溶剂提取法)、超声处理、研磨提取法等。明胶微球常用酶解法,即用酶(胃酶、胰酶)将载体材料的网状结构破坏后使药物完全释放出来,然后再进行测定[11]。赵世华[12]等人在测定单凝聚法制备的阿维菌素明胶微囊的载药量时,先用1%的胰蛋白酶溶液,在37 ℃消化24 h,之后转入有机溶剂中提取药物,方法简单易行且准确度好;张莎[13]等人进行了缓释型药物载体明胶微球的制备及降解性能研究,试验比较了加入1%的胰蛋白酶与不加入胰酶的人工肠液(pH7.6)的降解能力,结果表明加入胰酶的人工肠液降解能力明显优于后者,且通过比较加了酶的人工肠液和人工胃液的降解能力,表明人工肠液(pH7.6)降解能力优于人工胃液(pH1.3);葛庆华[9]等人研究采用胰酶-超声联用法可使微球基质全部降解,药物又不被破坏。他曾用胰酶法和胰酶-超声法在水解不同时间后测定甲氨蝶呤明胶微囊的相对含量,可见胰酶法在水解3、6、24 h后的测定值呈上升趋势,而后者在上述各时间测得的含量基本不变,说明此方法可靠准确。由于胰酶体外酶解反应的最适pH为8.0~9.0,温度为40~50 ℃,所以葛庆华将胰酶液pH调为8.0,胰酶液浓度为0.5%,在水解微囊时,于(48±2) ℃恒温水浴3 h,每30 min超声震荡一次,取样前再超声震荡15 min。为此,本试验以葛庆华的胰酶-超声联用法水解明胶微囊,并将其中胰酶浓度修改为1%,测定其1、2、3、4、6、8、10 h对药物水解情况,结果表明1~3 h时溶液中药物含量逐渐升高,而3~10 h测得的溶液中药物含量差异不显著,说明使用胰酶-超声联用法溶解微囊3 h即将药物释放完全。
本试验结果表明紫外分光光度法在测定恩诺沙星明胶缓释微囊含量时,专属性、线性、精密度、准确度均符合要求。《中国兽药典》[7]2010版中规定的恩诺沙星含量测定方法为高效液相色谱法,徐长举[14]等人曾采用紫外分光光度法和 HPLC 法测定了恩诺沙星原料药含量,且对两种方法进行对比,结果表明,紫外分光光度法测定恩诺沙星原料药含量时线性关系良好、精密度、回收率均符合要求,稳定性试验的OD值在9 h内无显著变化,与利用 HPLC 法的测定结果相比差异不显著(P>0.05),而在临床应用中紫外分光光度法更加的简便、快速。李锐[6]等人建立了恩诺沙星肺靶向微球中药物含量测定的紫外分光光度法且对该方法进行了考察,结果表明各项指标均符合要求;马丽萍[15]等人申请的“复凝聚法制备的恩诺沙星明胶微囊”专利中也是使用紫外分光光度计法进行的含量测定,结果表明此方法准确可靠,本试验结果与之相一致。
综上所述,紫外分光光度法操作简便、准确可行,可以用于测定恩诺沙星微囊制剂的药物含量,适用于生产中恩诺沙星明胶微囊的质量控制。
[1]中国兽药典委员会.中华人民共和国兽药典兽药使用指南(化学药品卷)[S].北京:中国农业出版社,2010:1-872.
[2]Xie Shuyu, Zhu Luyan, Dong Zhao, et al. Preparation, characterization and pharmacokinetics of enrofloxacin-loaded solid lipid nanoparticles : influences of fatty acids [J]. Colloids and Surfaces. B:Biointerfaces,2011,83(2):382-387
[3]龚露旸.恩诺沙星壳聚糖纳米粒的制备、体外评价及其在银鲫体内的生物学效应研究[D].上海:上海海洋大学,2009.
[4]Tang S, Zhou Y, Li R, et al. Pharmacokinetics and lung-targeting characterization of a newly formulated enrofloxacin preparation[J]. Journal of Veterinary Pharmacology and Therapeu-tics,2007,30(5):443-450.
[5]于莲,胡海权,张玉.恩诺沙星β-环糊精包合物的制备[J].黑龙江医药科学,2011,34(1):32-33.
[6]李锐.恩诺沙星肺靶向微球的研究[D].北京.中国农业大学,2005.
[7]中国兽药典委员会.中华人民共和国兽药典[M].北京:中国农业出版社,2010:222-223.
[8]中华人民共和国农业部.兽药质量标准[S].北京:中华人民共和国农业部,2003:66.
[9]葛庆华,何雯.胰酶-超声法测定甲氨蝶呤明胶微球的药物含量[J].中国医药工业杂志,1990,21(12):553-555.
[10]黄晓龙.含量测定分析方法验证的可接受标准简介[EB/OL].(2006-01-20)[2015-12-28]http://www.cde.org.cn/dzkw.do?method=largePage&id=1462.
[11]王德智.酒石酸泰乐菌素明胶微球制备及药动学研究[D].黑龙江.东北农业大学,2007.
[12]赵世华,刘晓松,朱宪光,等.阿维菌素缓释明胶微囊制备工艺及其体外释药特性[J].畜牧与饲料科学,2010(6):32-33
[13]张莎.缓释型药物载体明胶微球的制备及降解性能研究[D].西安.陕西科技大学,2010.
[14]徐长举,杨雪峰,柳东阳,等.紫外分光光度法测定恩诺沙星原料药含量的试验[J].黑龙江畜牧兽医,2014(5):191-193.
[15]柯学,马丽萍.恩诺沙星微囊及其制备方法[P].中国专利:201510066901,2015-04-29.
(编辑:武英耀)
Determination of enrofloxacin gelatin microcapsules content by UV spectrophotometry
Su Xiaoqing, Zhang Liqi, Zheng Mingxue, Dai Haonan, Shi Chenjie, Bai Rui, Xi Rou, Gong Xin, Zhang Li, Xu Zhiyong
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]The aim of this paper was to establish an UV spectrophotometry method for the determination of enrofloxacin content in enrofloxacin gelatin microcapsules.[Methods]The specificity, linearity, accuracy and precision were tested in this study. [Results]A good linearity was obtained for enrofloxacin in the range of 2~16 μg/mL and the standard curvilinear equation was A=0.103 0C-0.028 0(r=0.998 8). The relative standard deviation(RSD) of precision test was 0.00%、0.14%、0.11%(n=3), the average recovery rate was 101.53%、98.03%、98.07%(n=3)and its RSD was 0.25%、0.05%、0.00%(n=3),respectively.[Conclusion] The specificity, linearity, precision and recovery rate were all consistent with the request. The method could be used for the quality control of enrofloxacin gelatin microcapsules.
UV spectrophotometry, Enrofloxacin, Gelatin microcapsules
2016-11-23
2016-12-12
苏晓晴(1992-),女(汉),山西忻州人,硕士研究生,研究方向:动物传染病诊断与防治
*通信作者:郑明学,教授,博士生导师,Tel:0354-6289829;E-mail:zhengmingxue288@163.com
山西省现代农业鸡产业技术体系项目(2016-11-03)
S85
A
1671-8151(2017)04-0258-05
