氨基质子转移MRI对脑胶质瘤分级及预测肿瘤细胞增殖的诊断价值
2017-05-11李欣蓓宋玉坤朱筱磊王玉亮赵静严序王婧妍初建平
李欣蓓, 宋玉坤, 朱筱磊, 王玉亮, 赵静, 严序, 王婧妍, 初建平
·中枢神经影像学·
氨基质子转移MRI对脑胶质瘤分级及预测肿瘤细胞增殖的诊断价值
李欣蓓, 宋玉坤, 朱筱磊, 王玉亮, 赵静, 严序, 王婧妍, 初建平
目的:探讨氨基质子转移(APT)MRI对脑胶质瘤分级的诊断价值及其与肿瘤细胞增殖标记物Ki-67表达水平的相关性。方法:经病理证实的21例脑胶质瘤患者术前行常规MR平扫、增强及APT扫描,其中低级别胶质瘤8例(WHO Ⅰ~Ⅱ级),高级别胶质瘤13例(WHO Ⅲ~Ⅳ级)。在肿瘤实质区选取5~10个ROI,测量并计算MTRasym值。采用Mann-Whitney-Wilcoxon 检验比较高低级别胶质瘤间MTRasym值的差异,采用Spearman相关分析来分析MTRasym值与肿瘤Ki-67表达水平的相关性。结果:高级别胶质瘤的MTRasym值(4.41%±2.23%)明显高于低级别胶质瘤(3.83%±2.02%),差异有统计学意义(W=5816,Z=-3.01,P<0.05)。高级别胶质瘤的Ki-67的表达水平(38.85%±21.03%)明显高于低级别胶质瘤(4.13%±2.64%),差异有统计学意义(W=2606,Z=-11.54,P<0.05)。胶质瘤的MTRasym值与Ki-67表达水平呈正相关(r=0.25,P<0.001)。结论:MR氨基质子转移成像可用于鉴别高低级别胶质瘤,对预测肿瘤细胞增殖有潜在价值。
脑肿瘤; 胶质瘤; 氨基质子转移成像; 磁共振成像; Ki-67
胶质瘤占颅内肿瘤40%以上[1]。随着精准医疗概念的提出,越来越多的研究发现,相同病理类型及WHO分级的胶质瘤,采用相同的治疗手段,但其疾病的转归及预后相差甚大[2-3]。2016年新的脑肿瘤WHO分型已引入分子病理的相关信息[4],而其中一个重要的病理标志物就是Ki-67抗原的表达。Ki-67抗原是存在于增殖细胞核中的一种非组蛋白性核内蛋白,能反映肿瘤细胞的增殖速度及侵袭能力[1],对胶质瘤的预后有重要的提示意义。
氨基质子转移(amide proton transfer,APT)成像是一种新的磁共振分子成像技术,可以无创性地探测组织内源性游离蛋白质及多肽,从而反映细胞内的代谢变化及病理生理信息[5-8]。APT技术应用至今,在神经系统方面除了在脑卒中和帕金森病方面的研究外,大部分研究集中在对脑内肿瘤的鉴别诊断、胶质瘤放疗疗效及肿瘤的复发评估等方面[7-9]。有研究显示随着肿瘤级别的增高,瘤组中内游离蛋白质及多肽会相应增加[10],而Ki-67又与肿瘤细胞增殖有关,因此本研究基于APT成像能预测胶质瘤分级并与Ki-67有一定相关性,通过分析21例不同级别脑胶质瘤的不对称磁化转移率(asymmetric magnetization transfer ratio,MTRasym),探讨其对胶质瘤分级和预测肿瘤细胞增殖的诊断价值。
材料与方法
1.一般资料
将2014年3月-2015年12月在本院行MR检查的21例胶质瘤患者纳入研究,其中男12例、女9例,年龄26~76岁,中位年龄50岁。所有患者在MRI检查前未接受任何治疗或干预,最终诊断均经手术或穿刺病理证实,其中低级别胶质瘤(WHO Ⅰ~Ⅱ级)8例,包括少突胶质细胞瘤、星形细胞瘤及肥胖型星形细胞瘤;高级别胶质瘤(WHO Ⅲ~Ⅳ级)13例,包括间变性星形细胞瘤、胶质母细胞瘤、小细胞胶质母细胞瘤、横纹肌样胶质母细胞瘤及多形性胶质母细胞瘤。
2.检查方法
使用Siemens Magnetom Trio 3.0T MR扫描仪和16通道头线圈。常规扫描包括横轴面T1WI、T2WI和冠状面FLAIR序列。对比剂为Gd-DTPA(拜耳公司),剂量0.1 mmol/kg,对比剂注射后行横轴面T1WI扫描。T1WI扫描参数:TR 500 ms,TE 8.9 ms,层厚6 mm,层间距0 mm,矩阵205×320,视野230 mm×184 mm;T2WI扫描参数:TR 4000 ms,TE 100 ms,层厚6 mm,矩阵346×384,视野230 mm×230 mm;T2-FLAIR扫描参数:TR 9000 ms,TE 111 ms,层厚6 mm,矩阵205×320,视野230 mm×184 mm。APT成像在增强扫描前进行,选择病灶显示最大的层面进行单层扫描,化学饱和转移(chemical exchange saturation transfer,CEST)成像序列采用施加了一定时间预饱和照射的2D T1-GRE序列;扫描参数:TR 1340 ms,TE 2.46 ms,层厚6 mm,矩阵104×128,视野250.0 mm×203.1 mm;1.6uT的预饱和照射脉冲由5个100 ms的高斯脉冲组成,脉冲照射范围选择±4.5ppm的频率带宽,并采取平均每Δ=0.225 ppm扫描一次、对该范围分别进行40次扫描(预饱和照射),其中采集一个不施加饱和脉冲的基线数据M0用于信号标准化,得到的40组不同频率的数据图像经由CEST序列自带的后处理算法进行计算,得到相应的MTRasym图及Z谱。整个序列在扫描前均通过施加B0 GRE Mapping对B0场图像的均匀度进行校正。
3.APT成像的数据处理及分析
使用Siemens工作站。在肿瘤病灶的实质区域随机选取5~10个感兴趣区(ROI),测量MTRasym值,MTRasym计算公式如下[11-13]:
(1)
4.病理检查及免疫组织化学分析
对脑胶质瘤标本行HE染色及Ki-67免疫组化染色,并对胶质瘤进行定性和分级。Ki-67抗原位于细胞核,肿瘤细胞核出现棕黄色染色颗粒为阳性结果。每例患者随机观察5个高倍视野(200倍),在Ki-67染色最密集的区域对阳性表达细胞进行计数,重复3次取均值,然后根据5个高倍镜视野的平均阳性细胞率,以百分数表示Ki-67抗原标记指数,代表细胞的增殖指数。
5.统计学分析
使用SPSS 20.0统计软件(IBM,Armonk, NK)进行Mann-Whitney-Wilcoxon检验,比较高低级别胶质瘤的MTRasym值及Ki-67表达水平的差异。采用Spearman相关分析研究各参数值与Ki-67的相关性。P<0.05为差异有统计学意义。
结 果
高级别胶质瘤的MTRasym值为4.41%±2.23%,低级别胶质瘤的MTRasym值为3.83%±2.02%,高低级别胶质瘤MTRasym值的差异有统计学意义(W=5816,Z= -3.01,P<0.05)。
高级别胶质瘤的Ki-67标记指数为38.85%±21.03%,低级别胶质瘤为4.13%±2.64%,高级别胶质瘤的Ki-67的表达水平明显高于低级别胶质瘤,差异有统计学意义(W=2606,Z=-11.54,P<0.05)。MTRasym值与胶质瘤的Ki-67标记指数具有相关关系(r=0.25,P<0.001)。高、低级别胶质瘤的常规MRI、APT图及Ki-67图如图1、2所示。
讨 论
胶质瘤是最常见的原发性恶性脑内肿瘤,由神经上皮组织起源,2016年WHO中枢神经系统肿瘤分类将胶质瘤分为Ⅰ~Ⅳ级,其中Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为为高级别胶质瘤[14]。采用MRI对胶质瘤进行准确的术前分级,将有利于临床治方案的选择,并且能更好地评估预后。
APT成像是基于化学饱和转移成像(CEST)的一种磁共振成像新技术,其成像原理是利用特定频率的脉冲来饱和细胞内游离蛋白质和多肽上的氨基质子,由于这些氨基质子本身的活泼性质,能够与组织环境中的自由水质子之间产生化学交换,因此使得组织中部分水的信号也被饱和掉,进而可以通过组织环境中信号的变化来无创性的探测组织内源性低浓度的游离蛋白及多肽,从而可间接地反映活体细胞内的代谢变化和生理病理信息[5-7]。这种化学交换饱和转移的速率与组织内氨基质子的活泼性、温度以及pH值相关。当有肿瘤等组织存在时,某些蛋白质和多肽代谢物的含量在这一区域显著增加,进而引起可交换的氨基质子浓度的升高,即表现为CEST效应的增强,其相对的磁化传递率(MTRasym值)增高。而当组织环境中pH值较低时,氨基质子电负性增大,其交换速率加快,组织环境中自由水被饱和的信号越高,MTRasym值越高[5,8]。
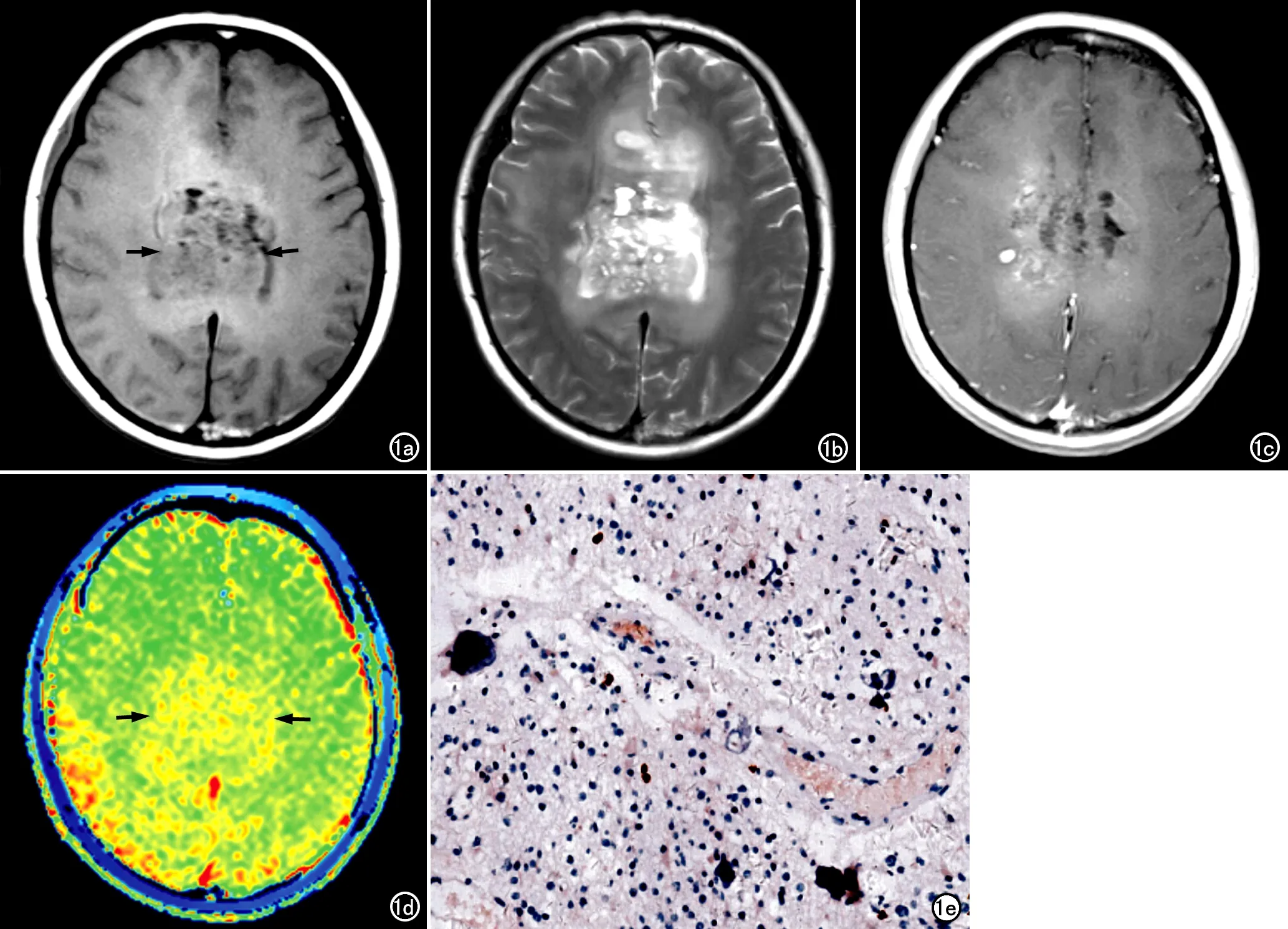
图1 胼胝体少突胶质细胞瘤(Ⅱ级)。a) T1WI示肿瘤呈不规则等~低混杂信号(箭); b) T2WI示肿瘤呈稍高-高混杂信号; c) 增强扫描示肿瘤呈轻度不均匀强化; d) APT图示肿瘤呈稍高信号(黄色,箭); e) 免疫组化染色病理片,镜下示肿瘤Ki-67抗原标记指数为2%(×200)。
在常规MRI扫描中,增强扫描仅能反映血脑屏障的破坏情况,不能很好地提示肿瘤的性质及范围。约20%的低级别胶质瘤在增强扫描时也表现为明显强化,而有1/3的恶性胶质瘤增强扫描时未见明显强化[15-16],且肿瘤强化显著的部分与细胞分化差的部分并不完全一致[17],因此依赖传统的MRI平扫及增强扫描来诊断胶质瘤具有较大的局限性。但进行APT成像,根据病灶的信号强度及MTRasym值可对胶质瘤的病理分级进行较准确的术前评估。APT成像上信号的变化与蛋白质、多肽含量及pH值有关,但在脑肿瘤中细胞内pH值的变化通常小于0.1个单位,故其对APT成像的影响可忽略不计,则APT图像上信号的改变可近似地认为仅由细胞内蛋白质和多肽的浓度改变所导致[6,18]。质子谱研究表明,随着肿瘤级别的增高,其内的蛋白质含量也会随之增加[10]。通过APT技术,根据其信号的强弱,MTRasym值的高低,可间接得知肿瘤细胞内蛋白质和多肽的含量,进一步对高低级别胶质瘤进行鉴别,提供更准确的诊断。
另外,本研究还探讨了MTRasym值与Ki-67抗原表达水平的相关性。Ki-67抗原是存在于增殖细胞核中的一种非组蛋白性核内蛋白,定位于10号染色体,由相对分子量395kD和345kD两条多肽链组成,是与增殖相关的核蛋白,能可靠的反映肿瘤细胞的增殖速度及侵袭能力。研究表明,Ki-67与肿瘤的侵袭、转移及增殖特性有关,对胶质瘤的预后有着重要的提示意义[1]。Ki-67抗原表达水平越高往往提示胶质瘤级别越高,细胞数量增多,细胞增殖活跃,细胞密度增大,细胞内复合蛋白质分子增多,其合成的蛋白质和多肽量也会增多[19-21]。而APT成像能探测组织内的游离蛋白及多肽,其浓度增高则APT成像时信号增高,MTRasym值增高,因此APT成像能间接反映肿瘤细胞的增殖程度,预测肿瘤的恶性程度,对临床治疗方案的选择及预后评估能提供非常有价值的信息。

图2 左侧颞叶间变型星形细胞瘤(Ⅲ级)。a) T1WI示肿瘤呈类圆形(箭),部分囊变,实性部分呈稍低信号; b) T2WI示肿瘤实性部分呈稍高信号; c) 增强扫描示肿瘤实性部分不均匀强化,囊壁轻度强化; d) APT图示肿瘤呈明显高信号(红色); e) 免疫组化染色病理片,镜下示肿瘤Ki-67抗原标记指数为60%(×200)。
APT成像的优势在于不需要特殊的硬件配备,不依赖对比剂,也不受血脑屏障的限制,可无创性探测组织内的内源性游离蛋白和多肽,反映细胞增殖情况[22]。但是,APT技术也有一定的不足,2D扫描序列一次扫描仅能获得单层图像,不能获取肿瘤的完整信息。且由于APT图像的分辨率及信噪比较低,即使参考常规MRI平扫及增强图像,若肿瘤病灶较小,在选择感兴趣区时可能欠精准,在一定程度上会影响测量结果的准确性。另外,本研究中样本量较小,尤其是低级别胶质瘤患者的病例数偏少,需要更大样本量的相关研究来证实本研究结果的准确性。
总的来说,APT技术能较准确地鉴别高低级别胶质瘤并可反映胶质瘤细胞的增殖活跃程度,在胶质瘤的诊断及临床治疗中能提供非常有价值的信息。
[1] 张磊,张学新,苏君.Ki-67和MMP-2在胶质瘤中表达的研究进展[J].实用肿瘤学杂志,2015,22(5):470-473.
[2] Pignatti F,Bent MVD,Curran D,et al.Prognostic factors for survival in adult patients with cerebral low-grade glioma[J].Off J Am Soc Clin Oncol,2002,20(8):2076-2684.
[3] Siegal T.Clinical relevance of prognostic and predictive molecular markers in gliomas[J].Advan Tech Stand Neurosurg,2016,43(1):91-108.
[4] 苏昌亮,李丽,陈小伟,等.2016年WHO中枢神经系统肿瘤分类总结[J].放射学实践,2016,31(7):570-579.
[5] 李春媚,王蕊,周进元,等.酰胺质子转移磁共振成像在帕金森病诊断中的应用价值[J].功能与分子医学影像学(电子版),2014,3(3):428-431.
[6] Jiang SS,Yu H,Wang XL,et al.Molecular MRI differentiation between primary central nervous system lymphomas and high-grade gliomas using endogenous protein-based amide proton transfer MR imaging at 3 Tesla[J].Eur Radiol,2016,26(1):64-71.
[7] 郑阳,王晓明.酰胺质子转移成像研究进展[J].中国医学影像技术,2014,30(8):1256-1259.
[8] Sakata A,Okada T,Yamamoto A,et al.Grading glial tumors with amide proton transfer MR imaging:different analytical approaches[J].J Neuro Oncol,2015,122(2):339-348.
[9] Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
[10] Zhou JY,Hong XH.Molecular imaging using endogenous cellular proteins[J].Chin J Magn Reson,2013,30(3):310-320.
[11] Tee YK,Harston GWJ,Blockley N,et al.Comparing different analysis methods for quantifying the MRI amide proton transfer (APT) effect in hyperacute stroke patients[J].NMR Biomed,2014,27(9):1019-1029.
[12] Yuan J,Chen SZ,King AD,et al.Amide proton transfer-weighted imaging of the head and neck at 3T:a feasibility study on healthy human subjects and patients with head and neck cancer[J].NMR Biomed,2014,27(10):1239-1247.
[13] Togao O,Hiwatashi A,Keupp J,et al.Scan-rescan reproducibility of parallel transmission based amide proton transfer imaging of brain tumors[J].J Magn Reson Imaging,2015,42(5):1346-1353.
[14] Louis DN,Perry A,Reifenberger G,et al.The 2016 World Health Organization classification of tumors of the central nervous system:a summary[J].Acta Neuropathol,2016,131(6):803-820.
[15] Law M,Yang S,Wang H,et al.Glioma grading: sensitivity,specificity,and predictive values of perfusion MR imaging and proton MR spectroscopic imaging compared with conventional MR imaging[J].AJNR,2003,24(10):1989-1998.
[16] Schäfer ML,Maurer MH,Synowitz M,et al.Low-grade (WHO Ⅱ) and anaplastic (WHO Ⅲ) gliomas:differences in morphology and MRI signal intensities[J].Eur Radiol,2013,23(10):2846-2853.
[17] 范兵,杜华睿,王霄英,等.MRI动态增强扫描定量参数对脑胶质瘤分级诊断价值的研究[J].放射学实践,2014,29(8):893-895.
[18] Zhou JY,Blakeley JO,Hua J,et al.A practical data acquisition method for human brain tumor amide proton transfer (APT) imaging[J].Magn Reson Med,2008,60(4):842-849.
[19] 张格,王显龙,路世龙,等.脑胶质瘤MR氨基质子转移成像与病理学特性相关性研究[J].中国放射学杂志,2014,48(9):736-740.
[20] 殷悦,佟丹,刘晓云,等.表观弥散系数值与Ki-67在胶质瘤诊断中的相关性[J].中国医学科学院学报,2012,34(5):503-508.
[21] 姜振富,李梅,韦鸿,等.脑胶质瘤中Ki-67、Kras和Braf蛋白的表达及临床意义[J].现代肿瘤医学,2013,21(3):507-510.
[22] 赵旭娜.氨基质子饱和转移磁共振成像方法研究[J].中国医疗器械信息,2015,1(4):17-21.
Diagnostic efficacy of amide proton transfer MRI in the grading of gliomas and predicting tumor cell proliferation
LI Xin-bei,SONG Yu-kun,ZHU Xiao-lei,et al.
Department of Radiology,the First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China
Objective:To evaluate the diagnostic efficacy of amide proton transfer (APT) MRI in the grading of brain glioma and to study its correlation with the expression of cell proliferation bio-marker (Ki-67) level.Methods:Twenty-one patients with pathology proven brain glioma, including low-grade glioma (LGG,WHO gradeⅠ~Ⅱ) in 8 patients and high-grade glioma (HGG,WHO grade Ⅲ~Ⅳ) in 13 patients,underwent routine plain and contrast-enhanced MRI as well as APT MRI.Five to ten regions of interest (ROIs) were manually drawn within the tumor parenchyma,the asymmetric magnetization transfer ratio (MTRasym) was calculated and analyzed.Mann-Whitney-Wilcoxon test was used to compare the MTRasymvalue between LGG and HGG and its correlation with the level of Ki-67 was analyzed using Spearman correlation analysis.Results:The mean value of MTRasymof HGG (4.41%±2.23%) was significantly higher than that of LGG (3.83%±2.02%),with statistical difference (W=5816,Z=-3.01,P<0.05),and the HGG also showed higher expression level of Ki-67 (38.85%±21.03%) than that of LGG (4.13%±2.64),with statistical difference (W=2606,Z=-11.54,P<0.05).The MTRasymwas positively correlated with Ki-67 value (r=0.25,P<0.001).Conclusion:Amide proton transfer MRI might provide helpful information in the differentiation of HGG and LGG,and may have potential significance in predicting tumor cell proliferation.
Brain neoplasm; Glioma; Amide proton transfer imaging; Magnetic resonance imaging; Ki-67
510080 广州,中山大学附属第一医院放射科(李欣蓓、宋玉坤、王玉亮、赵静、王婧妍、初建平);上海,西门子医疗东北亚科研合作部(朱筱磊、严序)
李欣蓓(1990-),女,辽宁丹东人,住院医师,主要从事神经和功能影像学诊断和研究工作。
初建平,E-mail: truechu@hotmail.com
国家自然科学基金青年基金项目(81201074);中央高校基本科研业务费(中山大学青年教师培育计划,13ykpy14)
R445.2;R739.41
A
1000-0313(2017)04-0355-05
10.13609/j.cnki.1000-0313.2017.04.013
2016-10-01
2017-02-01)
