黄精多糖对高脂饲料诱发糖尿病小鼠糖代谢功能的影响
2017-05-11贾璐石洁段志倩董瑞萍万盟郑建勇
贾璐+石洁+段志倩+董瑞萍+万盟+郑建勇

[摘要] 目的 建立小鼠高血糖模型,在此模型上考察黃精多糖(PSP)对于糖尿病小鼠体重、血糖、胰岛素、糖耐量、一氧化氮(NO)水平的影响。 方法 小鼠按照体重随机建立正常对照组和模型组(Model组),Model组以高脂饲料喂养50周,造成糖尿病小鼠模型。造模成功后,从正常对照组中随机选取10只小鼠作为Control组,将Model组按照体重随机分为高脂饲料组(HFD组)和黄精多糖组(PSP组),每组各10只。PSP组用25 g/L黄精多糖水溶液、500 mg/kg剂量、每日1次灌胃给药8周,同时Control组和HFD组给予等量蒸馏水,通过血糖仪、胰岛素酶联免疫吸附测定(ELISA)试剂盒、Western-blot法检测各组血糖值、糖耐量、胰岛素水平、肝脏胰岛素受体(IRS-2)表达以及肝脏NO水平的影响。 结果 Model组小鼠空腹血糖值、体重显著高于Control组,提示模型成功。PSP组小鼠与HFD组相比,空腹血糖值和胰岛素水平显著降低(P < 0.05),同时胰岛素受体IRS-2的表达量明显增加(P < 0.05),并在一定程度上降低了肝组织NO水平。 结论 该糖尿病小鼠模型稳定,同时具有空腹高胰岛素血症的特点,对研究胰岛素抵抗的发病尤为适用。通过PSP对该模型的干预,显示PSP可以降低高血糖小鼠空腹血糖值、空腹胰岛素水平,同时提高胰岛素受体的表达,并对高血糖环境下的高氧化应激状态有一定的抑制作用。
[关键词] 高脂饲料;糖尿病;小鼠;黄精多糖;胰岛素;氧化应激
[中图分类号] R587;R285.5 [文献标识码] A [文章编号] 1673-7210(2017)03(b)-0024-05
The influence of polygonatum polysaccharide on function of glucose metabolism of high-fat-diet-fed diabetic mice
JIA Lu1 SHI Jie1 DUAN Zhiqian1 DONG Ruiping1 WAN Meng2 ZHENG Jianyong1▲
1.Department of Quality Control, Nanjing Red Cross Blood Center, Jiangsu Province, Nanjing 210003, China; 2.Department of Pharmacy, Nanjing Hospital Affiliated to Nanjing Medical University, Jiangsu Province, Nanjing 210006, China
[Abstract] Objective To establish mice model with hyperglycemia, and to investigate the effects of polygonatum polysaccharide (PSP) on the body weight, blood glucose, insulin, glucose tolerance and nitric oxide (NO) in this mice model. Methods Mice were randomly divided into normal control group and model group by weight. Model group was given high-fat diet for 50 weeks, resulting in diabetic mice. Then 10 mice were selected as control group from normal control group, and the model group was randomly divided into high fat diet (HFD) group and PSP group by weight, with 10 mice in each group. PSP group was administrated with 25 g/L PSP solution, 500 mg/kg. once per day, for 8 weeks. Control group and HFD group were given the same volume of distilled water. Then the glucose levels, glucose tolerance, insulin levels, hepatic insulin receptor (IRS-2) expression and NO levels in the liver were investigated using blood glucose meter, insulin enzyme-linked immunosorbent assay (ELISA) kits or Western-blot assay. Results The fasting blood glucose levels and weights of model group were significantly higher than those of control group, suggesting that the model was successful. Compared with that of HFD group, the fasting glucose levels and insulin levels of PSP group were significantly reduced (P < 0.05), and the IRS-2 expression was showed significantly increased (P < 0.05) and NO was decreased to a certain degree by PSP intervention. Conclusion The diabetic mice model is stable, and it has the characteristics of fasting hyperinsulinemia, which is applicable for the study of the incidence of insulin resistance. PSP intervention can decrease the fasting blood glucose level, fasting insulin level, increase insulin receptor expression, and inhibit oxidative stress to a certain extent under high glucose environments in diabetic mice.
[Key words] High fat diet; Diabetes; Mice; Polygahatous polysaccharides; Insulin; Oxidative stress
我国传统药物黄精有补气养阴、健脾润肺益肾之功效。黄精多糖(polygahatous polysaccharides,PSP)是黄精中的重要成分,有研究表明,PSP具有调血脂、抗缺氧损伤、抗肿瘤、调节免疫、抗动脉粥样硬化等作用[1-2]。糖尿病是一组以高血糖为特征的代谢性疾病,目前尚无完全根治糖尿病的方法,严重危害人类的健康,且近年来随着全球老龄化趋势的加剧,患病人数呈现逐年递增趋势。据文献报道,黄精多糖对糖尿病及其并发症也有明确的疗效[3],但其机制尚未有定论。因此,本文着重探讨黄精多糖对高脂饲料喂食诱发的糖尿病小鼠模型的影响,并初步探讨其作用机制。
1 材料与方法
1.1 实验动物
2月龄BALB/c小鼠(北京维通利华实验动物技术有限公司,许可证编号:SCXK2008-0011),雄性,SPF级,(18±2)g。实验过程中小鼠的饲养环境稳定,保持室温在(22±2)℃,相对湿度50%~70%。
1.2 药物及仪器
PSP(江苏省中医院制剂部提供20151123);血糖试纸(德国罗氏诊断有限公司,批号:3907441);NO测定试剂盒(南京建成生物工程研究所150915);胰岛素酶联免疫吸附测定(ELISA)试剂盒(上海朗顿生物技术有限公司BPE10113)。TP-5000A电子天平(湘仪天平仪器厂);血糖检测仪(德国罗氏诊断有限公司);台式高速冷冻离心机(ThermoElectron);T25超声匀浆机(德国IKA);Bio-rad电泳及成像系统(美国Bio-rad)。
1.3 动物模型的建立与分组给药
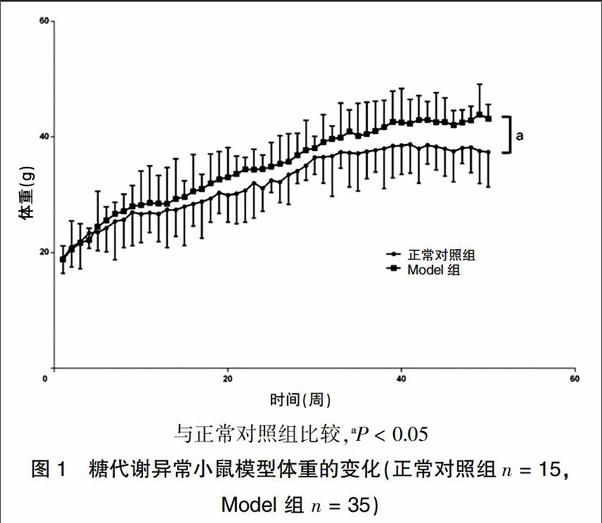
模型建立:据文献报道,雌激素对小鼠胰岛素敏感性及脂肪因子有影响[4],故选用雄性BALB/c小鼠50只,饲养于SPF级动物房,自由饮水取食。适应性喂养1周后,随机分为两组:①正常对照组15只,予以普通饲料喂养。②模型组(Model组)35只,予以高脂饲料喂养。高脂饮食的配方参照胰岛素抵抗模型饲料配方,所含热量成分为碳水化合物35%、脂肪45%、蛋白质20%[5]。每周称重并记录,两组以相应饲料喂养50周后,尾尖取血,血糖仪检测血糖值,Model组血糖值≥10 mmol/L并且显著高于正常对照组,判定为造模成功。
分组给药:从正常对照组中随机选取10只小鼠作为Control组。从模型组中随机选取10只小鼠为高脂饲料组(HFD组),随机选取10只小鼠为PSP组,PSP组配制25 g/L黄精多糖水溶液,按照500 mg/kg剂量灌胃给药,其余两组灌胃给予等量蒸馏水。三组给药时间均为8周。
1.4 小鼠糖耐量的检测
连续给药7周后,禁食16 h,一次性腹腔注射10%葡萄糖溶液,注射容积为0.2 mL/10 g,于0、15、30、60、120 min时,取尾尖血测定血糖值,进行糖耐量检测并记录。
1.5 小鼠空腹血糖与胰岛素水平的检测
给药第8周结束后,禁食16 h,取眼球后静脉丛血测空腹血糖值。通过眼球后静脉丛取血100 μL,在4℃条件下4000 r/min离心10 min,离心半径9.2 cm。冰上分离血清。采用新鲜血清尽快进行胰岛素的ELISA检测。
1.6 小鼠血清NO水平的检测
给药第8周结束,空腹血糖与胰岛素水平的检测结束后。处死小鼠,取肝脏,称重,置于其重量5倍的4℃组织匀浆缓冲液匀浆,匀浆经18 000 r/min离心15 min,离心半径6.2 cm。取上清液备用,采用ELISA检测肝组织NO水平,然后以Control组数值为基值,其余各组与其进行比较,结果作为相对的NO水平,进行统计分析。
1.7 胰岛素受体-2(IRS-2)表达的检测
肝脏中IRS-2蛋白的表达采用Western-blot检测,取50 mg肝脏组织加入蛋白裂解液,得到肝脏组织蛋白质;取变性后的蛋白样品50 μg电泳3 h,采用湿式电转移法转膜,5% BSA溶液封闭过夜;洗涤后先后与一抗抗体、过氧化物酶标志的二抗及显色底物孵育;用ECL底物化学发光显色、显影、定影、扫描。然后以Control组数值为基值,其余各组与其进行比较,结果作为相对的IRS-2蛋白表达量,进行统计分析。
1.8 统计学方法
使用SPSS 15.0进行数据分析,计量资料数据以均数±标准差(x±s)表示,两组比较采用t检验,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 結果
2.1 糖代谢异常小鼠模型的建立
2.1.1 糖代谢异常小鼠模型体重的变化 设置正常对照组、Model组,分别以普通饲料和高脂饲料喂养,其他生长条件一致。期间密切关注小鼠的生长状态,每周称量体重。在模型建立的42周时,两组体重比较差异有统计学意义(P < 0.05),并且稳定保持至50周。见图1。
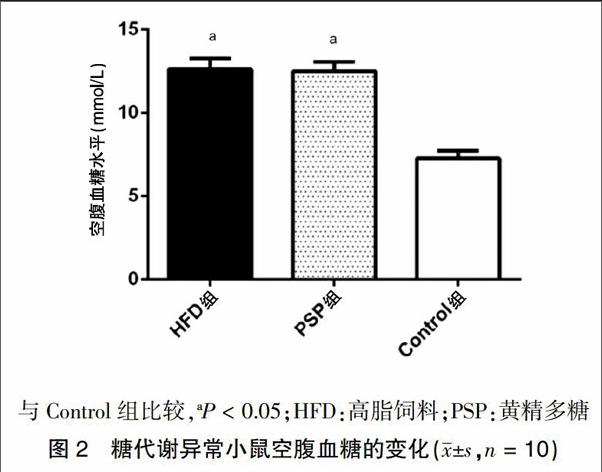
2.1.2 糖代谢异常小鼠空腹血糖的变化 正常对照组与Model组小鼠持续以高脂饲料喂养50周后,禁食16 h,取尾尖血检测空腹血糖并再次分组,记录初始血糖值。PSP组与HFD组血糖水平显著高于Control组,差异有统计学意义(P < 0.05)。见图2。
2.2 PSP对糖代谢异常小鼠的影响
2.2.1 PSP对糖代谢异常小鼠体重的影响 分组后,各组小鼠持续给予药物8周并记录体重变化,结果显示,PSP组与HFD组显著高于Control组(P < 0.05),但PSP组与HFD组间差异无统计学意义(P > 0.05)。见图3。
2.2.2 PSP对糖代谢异常小鼠糖耐量的影响 药物干预7周后,进行糖耐量试验。腹腔注射10%葡萄糖溶液后,三组小鼠血糖均先升高,30 min时检测到最高点,60 min开始检测出逐步下降。初始血糖值HFD组、PSP组均显著高于Control组(P < 0.05)。与HFD组比较,PSP组显著降低15、30、60、120 min时间点的血糖值(P < 0.05)。见图4。
2.2.3 PSP对糖代谢异常小鼠空腹血糖与胰岛素水平的影响 各组小鼠持续给予药物8周后,禁食16 h,取眼球后静脉丛血检测空腹血糖及血清胰岛素水平。PSP组与HFD组血糖水平均显著高于Control组(P < 0.05)。与HFD组比较,PSP组小鼠空腹血糖值显著降低(P < 0.05)。见图5。与HFD组比较,PSP组血清胰岛素水平显著降低(P < 0.05)。见图6。
2.2.4 PSP对糖代谢异常小鼠肝组织NO水平的影响 采用ELISA试剂盒检测各组小鼠肝组织匀浆中NO水平,并以Control组数值为基值,取比较后比值分析。HFD组与Control组比较差异有统计学意义(P < 0.05);PSP组与Control组比较差异也有统计学意义(P < 0.05)。PSP组比值低于HFD组,但差异无统计学意义(P > 0.05)。见图7。
2.2.5 PSP对胰岛素受体IRS-2表达的影响 与Control组比较,HFD组、PSP组的IRS-2蛋白表达量均有显著降低(P < 0.05),但PSP组显著高于HFD组(P < 0.05)。见图8。
3 讨论
本研究首先通过高脂饲料喂养的方式建立糖尿病小鼠动物模型,再以PSP干预的方式,考察其对于糖尿病小鼠的影响。目前文献多采用化学试剂诱导的方式造成2型糖尿病模型[6],但是此为化学方法所致,存在局限性。课题组用高脂饲料喂食小鼠42周,正常对照组与Model组体重出现差异,但是空腹血糖没有差异。而继续高脂喂食到50周,出现显著的空腹血糖异常,同时表现出空腹高胰岛素血症。高胰岛素血症被认为是胰岛素抵抗的主要血清学标志[7]。此模型有助于2型糖尿病病理发生的研究,尤其对胰岛素抵抗的探究较为适用。
黄精有补气养阴、健脾润肺益肾之功效,主要含有多糖、甾体皂苷、蒽醌类化合物等化合物[8],其中PSP是其主要药效活性物质。前期报道PSP可以降低2型糖尿病大鼠血糖及胰岛素抵抗,同时,PSP可能为糖基化损伤的抑制剂,其能抑制链脲佐菌素所致胰腺的免疫损伤及自由基损伤,从而改善胰岛的分泌功能[9]。对于糖尿病的并发症,PSP也有一定的作用[10-11]。本研究发现,PSP可以减轻高脂饲料引起的空腹血糖及胰岛素水平的异常升高。IRS-2通过类固醇调节元件结合蛋白(SREBP)调控脂质合成,IRS-2下调可使SREBP-1脂肪酸合成酶基因表达增加。SREBP还可干扰与IRS-2启动子结合的反式因子,直接抑制IRS-2的转录,导致肝糖原合成减少,脂肪合成增加[12]。陈世清等[13]通过长期喂食大鼠高脂饲料,发现动物肝脏IRS-2的mRNA表达和蛋白水平分别降低了30%和27%。本研究结果与其一致,而PSP可以上调IRS-2的表达,提示PSP可以改善肥胖和高血糖引起的胰岛素抵抗。
在病理状态下,过量的NO主要发挥细胞抑制与毒性效应。近年来研究表明,高血糖对细胞组织中NO的合成与释放有明显影响[14-15]。前期文献报道2型糖尿病、代谢综合征及胰岛素抵抗患者体内氧化应激水平升高[16]。糖尿病的发病与机体的抗氧化水平密切相关,而PSP能够在一定程度上纠正四氧嘧啶诱导的糖尿病小鼠血清和肝脏中超氧化物歧化酶以及丙二醛含量的异常变化[17]。本研究中的糖尿病模型小鼠NO水平也显著升高,造成了氧化水平的异常,与文献相符;而PSP可以降低NO水平,但是没有显著差异。
综上所述,PSP可以改善血糖与胰岛素水平,并提高IRS-2的表达量,对治疗2型糖尿病有积极的意义,同时,其对机体氧化应激水平也有影响,可能与抑制NF-κB-iNOS-NO氧化应激通路相关[18],结果尚需进一步研究证明。
[参考文献]
[1] 李丽,田丽娜,任振兴,等.黄精多糖的结构分析及功能活性研究进展[J].中国实验方剂学杂志,2015,21(15):231-234.
[2] 时晓娟,李朋收,魏颖,等.黄精多糖提取工艺及药理作用研究进展[J].中医药导报,2015,21(23):103-105.
[3] 付婷婷,王国贤,陈婷婷,等.黄精多糖对糖尿病肾病大鼠肾脏的保护作用[J].中药药理与临床,2015,31(4):123-126.
[4] 袁涛,李娟,赵维纲,等.雌激素对小鼠胰岛素敏感性及脂肪因子的影響[J].中国医学科学院学报,2015,37(3):269-273.
[5] 苑红,牛燕媚,刘彦辉,等.mTOR/S6K1信号通路与有氧运动改善小鼠高脂饮食诱导胰岛素抵抗间的关系[J].中国康复医学杂志,2009,24(4):297-302.
[6] 黄建军,何胜,银彩林,等.糖尿病小鼠模型建立方法的比较[J].当代医学,2011,17(31):21-23.
[7] Amine H,Benomar Y,Haimeur A,et al. Odontella aurita-enriched diet prevents high fat diet-induced liver insulin resistance [J]. J Endocrinol,2016,228(1):1-12.
[8] 未小明,王爱梅,罗朝辉,等.黄精对AD模型大鼠空间学习记忆及α7 nAChR表达的影响[J].神经解剖学杂志,2016,32(3):391-396.
[9] 闫鸿丽,陆建美,王艳芳,等.黄精调节糖代谢的活性及作用机制研究进展[J].中国现代中药,2015,17(1):82-85.
[10] 张忠英,王国贤,陈婷婷,等.黄精多糖对糖尿病大鼠心肌纤维化影响[J].中国公共卫生,2016,32(6):807-810.
[11] 王艺,彭国庆,陈迪,等.PSP对STZ诱导的糖尿病大鼠眼保护作用的临床动态观察[J].国际眼科杂志,2016,16(3):428-434.
[12] 于竹芹,帅莉,李晓丹,等.海带多糖对糖尿病小鼠胰岛素受体表达的影响[J].青岛大学医学院学报,2015,51(2):141-145.
[13] 陈世清,黎华,刘杞,等.高脂饮食对大鼠脂肪肝胰岛素受体底物1、2表达的影响[J].中国糖尿病杂志,2008, 16(7):409-412.
[14] Radika MK,Viswanathan P,Anuradha CV. Nitric oxide mediates the insulin sensitizing effects of β-sitosterol in high fat diet-fed rats [J]. Nitric Oxide,2013,32:43-53.
[15] Chong CR,Liu S,Licari G,et al. Reversal of hyperglycemia:effects on nitric oxide signaling [J]. Am J Med,2015,128(4):427-430.
[16] Das P,Biswas S,Mukherjee S,et al. Association of Oxidative Stress and Obesity with Insulin Resistance in Type 2 Diabetes Mellitus [J]. Mymensingh Med J,2016,25(1):148-152.
[17] 徐茂紅,李卫平,公惠玲,等.黄精多糖对四氧嘧啶糖尿病模型小鼠糖脂代谢的影响[J].安徽医药,2009,13(3):263-265.
[18] Yin H,Miao J,Ma C,et al. β-Casomorphin-7 cause decreasing in oxidative stress and inhibiting NF-κB-iNOS-NO signal pathway in pancreas of diabetes rats [J]. J Food Sci,2012,77(2):C278-C282.
