光电化学生物分析研究进展
2017-05-10阮弋帆张楠朱圆城赵伟伟徐静娟陈洪渊
阮弋帆 张楠 朱圆城 赵伟伟 徐静娟 陈洪渊
(南京大学化学化工学院,生命分析化学国家重点实验室,南京210023)
光电化学生物分析研究进展
阮弋帆 张楠 朱圆城 赵伟伟*徐静娟*陈洪渊
(南京大学化学化工学院,生命分析化学国家重点实验室,南京210023)
光电化学生物分析是近年来新出现并发展迅速的一种分析技术,其检测原理是基于在光照下识别元件和目标分子之间的生物识别作用造成光电活性物质产生的电信号的改变,以实现对待测物的定量测定。由于其灵敏选择性检测的优点及其在生物分析中的巨大潜力,该方法吸引了较多的关注,并且在检测性能和生物传感应用等方面也取得了较大进步。本文针对光电化学生物分析中常见的四种应用领域,即直接光电化学检测、光电化学酶检测、光电化学核酸检测以及光电化学免疫分析,综述了近年来国内外在光电化学生物分析研究领域的最新进展,并对其未来发展进行了展望。
光电化学;生物分析;酶;核酸;免疫
1 引言
光电化学过程指光电活性物质在光照作用下经由电子激发及电荷转移产生的光电转换过程1-6。当一束能量大于或等于半导体带隙(Eg)的光照射在半导体光电材料上时,电子(e-)受激发由价带跃迁至导带,并在价带上产生空穴(h+);电子与空穴有效分离,一定条件下在电极上发生相应的电化学反应产生电信号。光电化学分析是近年建立起来的一种基于物质的光电转换特性进行检测的新型分析方法,它具有灵敏度高、设备简单、易于微型化等特点。在光电化学检测中,光作为激发源激发光电活性物质,而通过光激发所产生的电信号则作为检测信号。由于光电化学过程的激发信号和检测信号分属于不同的能量形式,其传感信号的背景将低于传统的电化学方法,较低的信噪比将有利于检测限的进一步降低。待测物与光电活性物质之间直接或间接的相互作用过程所产生的光电流(或光电压)的变化数值与待测物浓度间的关系,是光电化学定量分析的基础。光电化学生物分析则是将光电化学分析应用于生物分析领域;其基本原理是通过光电活性物质在光照条件下将检测体系中发生的高特异性识别反应转变为电信号的变化,以实现对待测物的定量测定7,8。目前的光电化学生物分析一般集中于电流型生物分析,也即将光电流数值变化作为检测信号的光电化学生物传感研究。而诸多生物大分子甚至细胞所具备的生物光电活性9-12,也使得光电化学检测技术在生物分析领域具有广阔的应用前景。本文针对光电化学生物分析中常见的四种应用领域即直接光电化学检测,光电化学酶检测,光电化学核酸检测以及光电化学免疫分析进行了总结。

阮弋帆,1993年生。2015年本科毕业于南京大学化学化工学院,2015年至今就读于南京大学化学化工学院分析化学专业。主要研究方向为光电化学生物传感新方法与应用。

张楠,1992年生。2013年本科毕业于吉林大学化学院,2013年至今就读于南京大学化学化工学院分析化学专业。主要研究方向为光电化学生物传感新方法与应用。

朱圆城,1993年生。2014年本科毕业于南阳师范学院化学与制药工程学院,2014年至今就读于南京大学化学化工学院分析化学专业。主要研究方向为光电化学生物传感新方法与应用。

赵伟伟,1983年生。2005年和2008年于南京航空航天大学分别获得学士和硕士学位,2012年于南京大学获理学博士学位并留校担任助理研究员。2014年晋升副教授。现主持国家自然科学基金青年项目和面上项目、江苏省自然科学基金等项目。主要研究方向:光电化学DNA传感、光电免疫分析、生物催化及细胞相关检测。

徐静娟,1968年生。1990年获武汉大学学士学位,1997、2000年获南京大学硕士和博士学位。2000年起在南京大学化学系任教,2006年被聘为教授。主要研究方向:各类电化学、电致化学发光和光电化学纳米传感器、生物分析微流控芯片。

陈洪渊,1937年生。1961年毕业于南京大学化学系。现为南京大学教授,中国科学院院士(2001年当选)。主要研究方向:仿生催化、生物电化学、化学生物学、纳米和超分子电化学、超微电极与生物分子电子器件、微全分析系统等。
2 光电化学生物分析系统
光电化学生物分析需要在光电检测系统中实现。如图1所示4,此系统主要包括激发光源、吸收池以及包含光电换能器(一般是光电活性物质构成的基底)作为工作电极的三电极电化学体系。在光激发条件下,光电活性材料的表面将发生电荷-空穴的分离与电荷转移,进而在电极表面发生一定的氧化还原反应,并在外电路产生电流。这一过程产生的电信号及其变化由电化学装置记录并用于特定检测对象的测定。在一个典型的光电化学检测中,探针分子(例如特异性的抗原抗体)首先被固定于光电换能器表面作为识别原件,之后待测物在电极表面与探针分子间相互作用,导致光电流信号的增强或降低。光电化学生物分析即是通过特异性识别反应前后光电流的信号变化来实现定量检测。
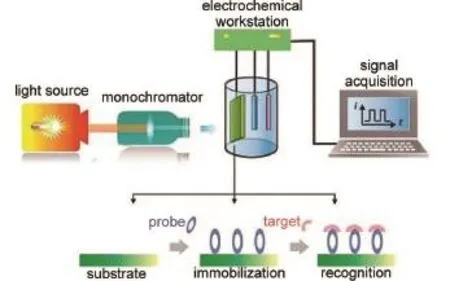
图1 光电化学生物检测机理示意图Fig.1 Schematic of thegeneral instrumentation and working p rincipleof photoelectrochem ical(PEC) bioanalysisAdapted from Ref.4,Copyright©2016Royal Society ofChemistry.
以光电活性物质为主的光电换能器作为光电化学分析的核心部分,在检测系统中起到信号发生作用。光电活性材料的选择与生物分析的性能密切相关,理想的光电活性材料应该具有较低的电子空穴复合率,以便获得稳定的光电流密度;目前常见的光电活性材料集中于各类无机、有机半导体及其复合材料13。例如,SnO2、TiO2和CdS等无机半导体纳米材料通常被用于各种光电化学生物检测中,而具有制备简单、稳定性高、吸收谱范围较宽、表面修饰的多样化等特点的量子点(QDs)使用的尤其广泛14-18;有机半导体材料同样被用于光电化学生物分析,其中钌联吡啶配合物由于其可见光吸收强、激发态稳定等特点使用较为广泛3;复合半导体材料则作为两种不同禁带宽度的半导体复合物,其受激产生的电子和空穴能够在两种半导体材料之间发生快速的电荷转移,从而有效阻止两者之间的复合,使得光电转换效率得到大幅度提高19。图2表示了典型的半导体纳米粒子光电流产生过程3。当半导体纳米粒子吸收的光子能量高于其能带间隙时,电子从价带跃迁
至导带,因此产生了电子空穴对(e--h+);这一过程通常伴随电子-空穴的复合或电荷转移。如存在有效的电子供体/受体时,电子-空穴的复合将被抑制,使得电荷得以快速转移从而产生稳定的阳极或阴极光电流。
3 光电化学生物分析应用
3.1 直接光电化学检测
直接光电化学检测不借助于酶或其他物质的辅助,而是将待检测物质直接作为电子供体/受体参与电极表面的光电化学反应来实现检测。当电解质溶液中存在适当的电子供体/受体时,光电活性物质自身的电子-空穴复合过程被减弱,使得电荷转移能够持续稳定地发生,表观上将使得光电流信号相对于溶液中不存在待测物质时增强。该方法简单方便,常被用于生物体系中大量存在且具有重要研究意义的生物分子检测,如烟酰胺腺嘌呤二核苷酸(NADH)、半胱氨酸、谷胱甘肽、葡萄糖和抗坏血酸等;这些待测分子在特定的光电极上能够发生氧化还原反应产生电信号,从而实现检测。但是,因为仅仅依赖于直接氧化还原过程,这种方法通常对目标分子的响应特异性较差。
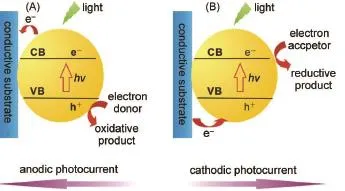
图2 典型的无机半导体材料的阳极(A)和阴极(B)光电流产生机理示意图Fig.2 Anodic(A)and cathodic(B)photocurrent generationmechanism of inorganic sem iconductor in connection with electrodesCB:conduction band;VB:valenceband.Adapted from Ref.3,Copyright©2014 American Chem ical Society.
如图3所示,徐静娟课题组20利用多巴胺敏化TiO2膜,增强了该基底在可见光区域的信号响应,该工作对NADH实现了检测限为1.4×10-7mol·L-1的灵敏检测。戴宏课题组21通过构建p-n节结构敏化g-C3N4基底实现了对于胆碱的检测。沈清明课题组22通过对CdS量子点敏化的Au-SnO2纳米结构实现了对于半胱氨酸的信号响应。郑耿峰课题组23利用氯高铁血红素(hem in)敏化构建IrO2-hem in-TiO2NWs array(纳米线阵列)复合结构,实现了对谷胱甘肽的灵敏检测,检测限达200 nmol·L-1。宋宏伟课题组24构建了类似的CdS/CuO基底实现了对于葡萄糖的检测。张跃课题组25,26分别利用Cu2O/ZnO NRsarray(纳米管阵列)及CdS/RGO(还原型氧化石墨烯)/ZnO NWs array(纳米线阵列)实现了对于谷胱甘肽的响应。上述的工作通过半导体材料的敏化,使两种或多种半导体材料之间的复合,使得材料对于待测物质的响应更加灵敏,降低了传感器的检测限。而针对使用的电极基底材料进行结构修饰,也可以在敏化基底的基础上通过位阻或吸附特性等其他物理性质增加检测设计的选择性。如图4所示,匡勤和孔祥建课题组27构筑的在ZnO NRs array外包裹ZIF-8MOFs(金属有机框架材料)的纳米异质结构,利用充当电子供体的待测物的分子尺寸不同,实现了对于H2O2和抗坏血酸(AA)的检测,并同时将其运用于血浆检测。
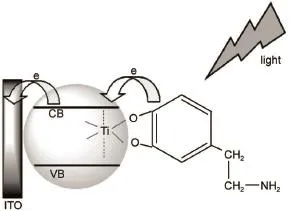
图3 ITO电极上多巴胺敏化TiO2光电化学检测NADH示意图Fig.3 Schematic illustration of PEC sensing ofNADH via dopam ine sensitized TiO2on the ITO electrodeNADH:dihydronicotinam ide adenine dinucleotide,ITO:indium tinoxide.Adapted from Ref.20,Copyright©2016 Elsevier B.V. All rights reserved.
总的来说,直接光电化学生物分析简单地将待测物质作为电子供体/受体在材料表面与光生空穴/电子发生光电化学反应,进而利用所产生光电流实现定量分析。这种检测机制可以作为对于一类特定生物分子的检测手段,也为更为复杂的检测体系奠定了基础。
3.2 光电化学酶检测
利用酶作为催化剂,光电化学酶催化检测具有对待测物的高特异性。该方法的一种常见模式是依赖酶催化反应过程中的底物或产物作为电子供体/受体;另一种模式则基于酶催化反应中酶与光电活性材料两者间的直接或间接电荷转移来产生光电流。

图4 ZnO@ZIF-8纳米棒阵列对H2O2和AA的光电化学检测机理示意图Fig.4 Schematic illustration of ZnO@ZIF-8 nanorodsand PEC detection of H2O2and ascorbic acid(AA)FTO:fluorine-doped tinoxide.Adapted from Ref.27,Copyright©2013American Chemical Society.
Willner课题组28最早将酶传感机制引入光电化学生物分析体系,通过将乙酰胆碱酯酶(AChE)以酰胺键的形式固定于CdS量子点表面,特异性催化硫代乙酰胆碱反应产生电子供体,使得光电流强度相对在未经催化时有较大的提升,从而实现了对AChE酶活性及其抑制剂的分析。如图5所示,Tanne等29则使用O2同时作为CdSe/ZnS量子点的电子受体以及葡萄糖氧化酶(GOD,glucose oxidaseenzyme)催化反应的底物之一,利用两者对O2的竞争实现了对葡萄糖的检测。如图6所示,陈洪渊课题组30利用碱性磷酸酶(ALP,alkaline phosphatase)将抗坏血酸磷酸盐氧化为抗坏血酸,后者能够同时敏化TiO2基底导致光电流的增强,该方法被成功应用于酶抑制剂的检测。Choi课题组31通过引入葡萄糖氧化酶,借助酶催化反应和辅酶FAD+/FADH2,将葡萄糖氧化反应在graphene-WO3-Au(石墨烯-氧化钨-金纳米粒子)复合电极材料上最终转移为H2O2/O2(或H2O/O2)的反应,实现了对于葡萄糖在0.5-7mmol·L-1浓度区间的检测。鞠熀先课题组32利用乳酸盐脱氢酶(LDH)修饰于TiONT-PANI-GNP(二氧化钛纳米管-聚苯胺-金纳米粒子)复合电极,经由辅酶NAD+/NADH实现了对于L-乳酸盐的检测,检测范围为0.5-210 μmol·L-1,检测限达到0.15μmol·L-1。
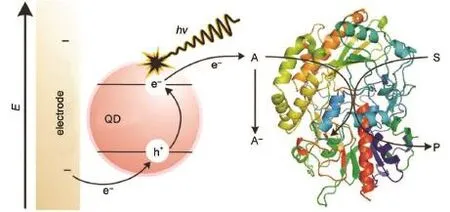
图5 基于葡萄糖氧化酶催化的光电生物检测机理示意图Fig.5 Schem atic of PEC detection based on the use of glucose oxidase enzymeQD:quantum dot;A:acceptor;S:substrate;P:product.Adapted from Ref.29,Copyright©2011American Chem ical Society.
酶与光电活性基底进行电子交换的检测模式也被广泛运用。一些含有亚铁血红素(heme)的酶,其活性中心能够与电极进行直接电子交换,可以通过将其直接固定于光电极上来开发酶传感器。郑耿峰课题组33通过将辣根过氧化物酶(HRP)固定在二氧化钛纳米线阵列上,现了对于过氧化氢的特异性检测,并且进一步通过检测过氧化氢浓度评定了细胞的代谢水平。其检测过氧化氢的最低浓度达7.7 nmol·L-1,并通过一系列可以分辨的实时刺激-信号产生曲线,获得了在受到外源刺激下细胞产生过氧化氢浓度的不同变化趋势,实现对于几种细胞类型的分辨。HRP属于酶活性中心相对暴露的类型,因此检测中不需要借助其他的介质来完成电子转移。但是,大部分的酶的活性中心通常都深埋于酶蛋白质结构的内部,导致其与外界进行电子传输的速率较低,使得通常情况下酶活性中心很难与电极直接进行电子交换。在这种情况下,可借助外界的电子媒介体在酶活性中心与光电极之间传递电子,间接地完成这一电子交换过程。Willner课题组34借助[Ru(bpy)3]2+作为固定在酶附近的电子媒介体,在光照条件下作为GOD与金电极之间电子传递的桥梁,实现了对葡萄糖的检测;刘绍琴课题组35则在GOD与CdSe@CdS敏化的TiO2电极之间以([Co(Phen)3]2+/3+作为电子媒介体参与电子转移,同样实现了葡萄糖的检测。
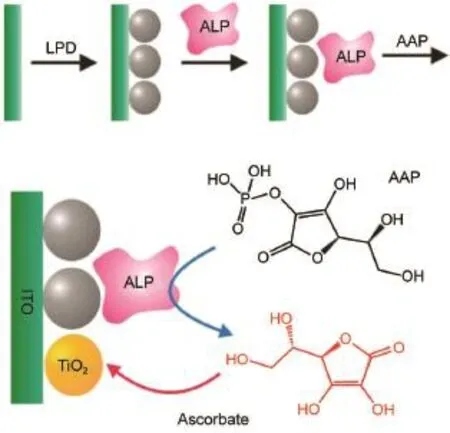
图6 基于ALP酶催化的光电化学生物检测示意图Fig.6 Schematic representation of PEC bioanalysisbased on theALPcatalysisALP:alkaline phosphatase;AAP:ascorbic acid 2-phosphate; LPD:liquid phase deposition.Adapted from Ref.30, Copyright©2013American ChemicalSociety.
基于酶催化的光电化学生物检测解决了直接检测的特异性问题,但这种基于特异性酶催化反应的检测过程的适用范围依然较窄,一般只能针对一些特定的小分子开发相应的传感体系。此外,部分酶催化过程需要相应的辅酶分子或媒介分子,这在一定程度上增加了整个检测体系的复杂程度,对于研究实际体系较为不利。但不可否认的是,酶的引入使光电流信号得以有效放大,显著增加了检测的灵敏度和特异性。
3.3 光电化学核酸检测
核酸(nucleic acid)是核苷酸聚合成的生物大分子化合物,其中运用较为广泛的是脱氧核糖核酸(DNA),其具有独特的A-T和C-G碱基配对原则,可以通过链杂交反应实现对于核酸链的特异性检测;同时部分经体外筛选得到的寡核苷酸序列作为适配体(aptamer),能与相应的配体(特异性蛋白或离子)进行高亲和力和强特异性的结合,实现对于特定生物分子或离子的检测。基于DNA或适配体的特异性识别能力,一系列的光电化学生物传感方法被开发出来3,36-41。
周玉祥课题组42首先通过在双链DNA(dsDNA)中嵌入Ru(bpy)2(dppz)2+,实现对dsDNA的定量检测。唐波课题组43通过DNA杂化形成双链后,利用DNA杂交进行双链增长,再将[(ppy)2Ir(dppz)]+PF6-作为嵌入物嵌入双链沟壑,实现光电信号的放大和目标DNA的灵敏检测,线性范围为0.025-100 pmol·L-1,检测限达9.0 fmol·L-1。同样利用Ru(bpy)2(dppz)2+,张书圣课题组44通过引入磁珠分离的竞争方法实现对于ATP的检测,检测限达到3.2 nmol·L-1。郭良宏课题组45则利用Ru(bpy)2(dppz)2+实现了对于外源性DNA甲基化损伤的检测与修复。该工作在使用DNA修复酶对具有甲基化腺嘌呤的dsDNA进行修复后去除了其甲基化基团,使得具有光电响应活性的Ru化合物能嵌入双链结构,通过作为嵌入剂的Ru化合物定量地标定产生的光电流大小。不同于直接嵌入具有光电化学活性的信号分子,鞠熀先课题组46选择替代光源的化学发光化合物作为嵌入分子。嵌入dsDNA的FeTMPyP作为化学发光物质提供光电检测体系所需的光照条件,借由光照强度与光电流正相关的原则,成功构筑了化学发光-光电化学检测系统。
Willner课题组47通过将适配体标记具有光电活性的CdS量子点,使得识别反应前后光电流信号从无到有,实现了对可卡因的特异性检测。胡成国课题组48在基底探针捕获目标DNA的基础上,再利用一条标记有全碳基结构光电活性物质的互补链与被捕获的目标DNA分子末端尚未互补配对的部分相结合,实现了在同一片电极的不同检测区域对于多种待检测DNA分子的检测。郭良宏课题组49尝试在8-oxodGuo损伤的双链DNA的受损部分共价性连接上标记有生物素(biotin)的精氨酸衍生物,而标记有链霉亲和素(streptavidin)的Ru化合物则通过生物素-亲和素(biotin-avidin)特异性亲和,使得光电活性物质标记在受损的dsDNA上。修复后的dsDNA失去光电活性物质的标记,从而实现对于DNA损伤程度和修复效果的定量分析。朱俊杰课题组50通过分别位于基底和DNA标记末端的具备光电活性的半导体或染料分子之间的复合作用,增强原有的光电流信号,实现了对特定序列DNA的检测。
借助量子点与贵金属纳米粒子之间的能量共振转移(ET)或激子-等离子体相互作用,可以高效抑制量子点的光电转换,利用此现象可以开发新颖的光电化学生物分析模式。如图7所示,陈洪渊课题组51通过在互补DNA单链的末端修饰Au纳米粒子,利用CdS量子点与其之间的能量转移过程实现了对目标DNA的检测,检测限达2.0 fmol· L-1。利用量子点及Au纳米粒子间距离的关系,该课题组随后实现了对于TATA序列特异性结合蛋白(TBP)的信号放大检测52。如图8所示,TBP蛋白与dsDNA的结合会导致粒子间间距的变化,导致光电流的变化,从而实现对目标蛋白TBP的检测,检测限达到了0.05 pg·m L-1。类似地,该课题组还报道了对于DNA53及凝血酶54的检测。戴志晖课题组55则在以癌胚抗原作为模型分子进行检测时引入竞争机制,通过适配体竞争结合的方式定量地确定溶液中目标蛋白的含量,从而实现高灵敏的生物分析。雷建平课题组56使用Pb2+的适配体形成G-四联体(G-Quadruplex),实现了基于能量转移过程的信号放大光电化学Pb2+检测。朱俊杰课题组57利用T-Hg2+-T的特异性结合作用,使得原本被互补链上Au纳米粒子的激子能量转移猝灭的染料分子靠近并敏化光电活性基底,实现对于Hg2+的检测。

图7 基于能量转移过程的光电化学DNA检测示意图Fig.7 Schem atic diagram of the energy transfer-based PEC system for DNA detectionEDC:1-ethyl-3-[3-dimethylaminopropyl]carbodiimidehydrochloride;NHS:N-hydroxysuccinimide;MEA:mono ethanolamine.Adapted from Ref.51,Copyright2016©RoyalSociety of Chemistry.
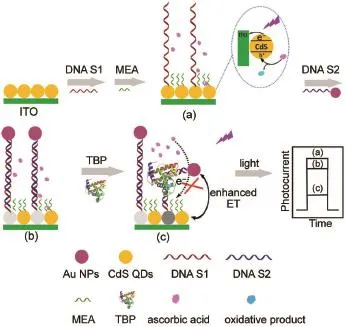
图8 基于能量转移效应信号放大的光电化学TBP生物传感Fig.8 Schematicsof theenergy transfer-based PEC TBP(TATA binding protein)biosensingAdapted from Ref.52,Copyright©2016 American Chem ical Society.
酶联信号放大也被应用于光电化学核酸检测。鞠熀先课题组58利用DNA杂交及MboI酶切割光电极上的探针DNA,未被切割的探针DNA通过末端修饰的生物素连接亲和素修饰的HRP,竞争消耗作为电子受体的H2O2,实现了目标DNA的检测。朱俊杰课题组59的工作则利用DNA链末端修饰酶产生电子供体实现检测信号的放大。该工作在已经捕获的待测物DNA链上通过TdTase(末端脱氧核酸转移酶)催化扩增连接上经过生物素修饰的dUTP碱基,进而利用biotin-avadin反应连接亲和素修饰的ALP酶产生抗坏血酸作为电子供体,实现了对待测DNA分子的检测。王光丽课题组60则通过形成G-四联体结构包裹hem in酶进行催化,产生光诱导电子转移效应,使得体系的光电效率提升,并以此为基础实现了对特定DNA以及凝血酶的检测。
从基于核酸的光电化学生物检测体系的构建来看,通过嵌入或标记的形式引入信号分子来影响光电流的变化,可以实现放大特异性识别反应造成的信号放大;通过借助各类核酸酶改变核酸链的长度、末端碱基修饰以及对特定序列进行循环切割或延伸,也可以实现对检测信号的高效放大。核酸本身的结构、性质及丰富的修饰可能性,拓展了基于核酸构建的光电化学分析体系的构建和应用领域,使之成为光电化学生物分析的重要组成部分61-66。
3.4 光电化学免疫分析
抗体与抗原作为一对特异性结合的分子,能够实现相互间的特异性识别。基于抗原-抗体特异性结合的光电化学免疫分析也迅速发展。按照标记与否,光电化学免疫分析体系可以分为无标记和标记型两种类型。
无标记的光电免疫分析体系通常仅利用抗原-抗体结合时产生的位阻效应,结构相对简单。例如,徐静娟课题组67设计的基于位阻效应的光电化学免疫传感器即实现了对于小鼠免疫球蛋白G (mouse IgG)的特异性检测。如图9所示,当目标抗原被俘获到固定有抗体的电极基底上时,电极表面的位阻效应增大,阻碍了电子供体向电极的扩散,造成光电流信号下降,从而实现对目标抗原的定量检测。其他的无标记光电免疫传感器也与该工作类似,在不引入其他信号放大机制的前提下单纯利用免疫相互作用实现对于待测抗原或抗体的检测。

图9 小鼠IgG抗原无标记光电化学检测示意图Fig.9 Schematicsof the label-free PEC immunosensor for mouse IgG detectionPDDA:poly dially ldimethylammonium chloride;TGA:thioglycollic acid;BSA:bovine serum albumin.Adapted from Ref.67,Copyright©2009American ChemicalSociety.
标记型免疫分析体系由于可以修饰更多的信号放大基团而被更为广泛地运用。基于酶催化信号放大,陈洪渊课题组开发了一系列该类型的光电化学免疫分析体系。如图10所示,该课题组通过引入酶催化沉积作用产生沉淀阻碍电子供体的传输来抑制光电流信号68;或者通过标记酶来催化电解质溶液中的底物产生相应的电子供体增强光电流信号69-73。这两种检测模式都在一定程度上放大了检测信号,提高了光电化学免疫分析的性能。在此基础上,该课题组还建立了一种将信号放大与检测分离的新型免疫传感模式,实现了对HIV-1 p24蛋白的免疫检测74。朱俊杰课题组75对于α-胎蛋白的标记型光电化学免疫分析通过其合成的AFP-CdTe-GOD生物复合结构实现。利用竞争结合机理,该工作实现了对于待测抗原间接的双重信号放大检测。同时,该课题组通过三明治免疫反应,在二抗上修饰SiO2纳米粒子,进一步增大了结构的位阻,使得信号的下降更为明显76。此外,戴志晖课题组77通过在基底上固定一定量的CEA抗原分子,利用竞争反应测定溶液中的抗原含量。基于相似的原理,魏琴课题组78利用修饰包被有Cd2+的TiO2纳米粒子实现了对于抗体标记,通过加入S2-将Cd2+转化为CdS与基底复合产生更强的光电流,实现了对于溶液中地塞米松的检测。
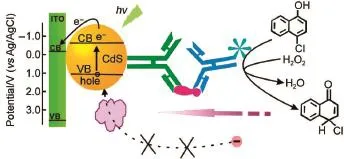
图10 HRP标记催化沉积的光电化学免疫检测示意图Fig.10 Schemeof theam plified QD-Based sandw ich PEC immunoassay w ith HRP-catalyzed BCPHRP:horse radish peroxidase;BCP:biocatalytic deposition.Adaptedfrom Ref.68,Copyright©2011American Chemical Society.
相较无标记的检测模式,标记型的信号放大机制在一定程度上使得免疫检测的检测限降低;同时竞争型的免疫设计也使得简单的抗原-抗体结构能够实现信号放大。但由于免疫结构相较核酸体系更为简单的特点,目前针对光电化学免疫分析的着眼点更多地放在了信号放大方法的改进以及新机制的引入上;一些新颖的体系也使得光电化学免疫分析的方式更为多样化79-83。
4 结语
光电生物分析系统的高灵敏性及其丰富的信号放大机制,已经在生物分析领域引起了广泛关注。近年来,其研究范围从简单的生物小分子,迅速拓展到酶传感、核酸检测、免疫分析及细胞相关检测等领域84,其传感模式也不断创新。目前,光电化学生物分析的发展趋势包含如下几个方面:(1)新型光电活性材料的运用。纳米技术及材料科学的发展为光电化学生物分析的材料选择提供了新的机遇。选择具备更低电子空穴复合率、更高光电转化率的光电活性材料可以获得更稳定的检测信号。(2)新生物分析体系的构建。各类探针分子(如affibodies,nanobodies以及anticalins等)、细胞及组织的引入,为开发各类新颖光电化学生物分析体系提供了可能,更进一步拓宽了其应用范围。(3)生物分子与半导体纳米的材料的结合。各类生物分子-半导体纳米材料的巧妙结合将进一步促进电子转移过程,提高信号传导效率,从而使得光电化学生物分析传感具有更好的性能。(4)检测系统的微型化、阵列化、便携化。微流控、纸芯片、化学发光等技术的引入85-88使光电化学生物分析的检测速度及自动化程度的提高,阵列化设计在提供多通道检测的同时更会进一步降低检测成本。(5)单细胞及更小尺度的检测。光电化学生物分析技术与电化学扫描显微镜等其它技术的结合89,90,有望在单细胞甚至单分子层面上实现对待测物精准测量,并进一步将此技术拓展到活体检测领域。伴随着近年来的纳米科技的快速发展,检测技术的不断提高和相关研究的不断深入,我们相信光电化学生物分析将会在未来的临床诊断、环境监测、食品安全和医药研究等诸多领域发挥出更加重要的作用。
(2)Hagfeldt,A.;Boschloo,G.;Sun,L.;K loo,L.;Pettersson,H. Chem.Rev.2010,110(11),6595.doi:10.1021/cr900356p
(3)Zhao,W.W.;Xu,J.J.;Chen,H.Y.Chem.Rev.2014,114(15), 7421.doi:10.1021/cr500100j
(4)Zhao,W.W.;Xu,J.J.;Chen,H.Y.Chem.Soc.Rev.2015,44 (3),729.doi:10.1039/C4CS00228H
(5)Zhao,W.W.;Xiong,M.;Li,X.R.;Xu,J.J.;Chen,H.Y. Electrochem.Commun.2014,38,40.doi:10.1016/j. elecom.2013.10.035
(6)Zhao,W.W.;Wang,J.;Zhu,Y.C.;Xu,J.J.;Chen,H.Y.Anal. Chem.2015,87(19),9520.doi:10.1021/acs.analchem.5b00497
(7)Peng,F.;Zhu,D.R.;Si,S.H.;Xiao,H.Prog.Chem.2008,20 (4),586.[彭芳,朱德荣,司士辉,肖辉.化学进展,2008, 20(4),586.]doi:1005-281X(2008)04-0586-08
(8)Zhao,W.W.;Ma,Z.Y.;Xu,J.J.;Chen,H.Y.Chin.Sci.Bull. 2014,59(2),122.[赵伟伟,马征远,徐静娟,陈洪渊.科学通报,2014,59(2),122.]doi:10.1360/972013-446
(9)Zhang,C.Y.;Feng,J.;Ci,Y.X.;Lang,A.D.;Huang,C.H. Bioelectrochem.Bioenerg.1998,46(1),145.doi:10.1016/ S0302-4598(98)00128-7
(10)Qingwen,L.;Guoan,L.;Jun,F.;Dawen,C.;Qi,O.Analyst 2000,125(11),1908.doi:10.1039/B006699K
(11)Ci,Y.X.;Zhang,C.Y.;Feng,J.Bioelectrochem.Bioenerg. 1998,45(2),247.doi:10.1016/S0302-4598(98)00097-X
(12)Feng,J.;Zhang,C.Y.;Ottova,A.L.;Tien,H.T. Bioelectrochemistry 2000,51(2),187.doi:10.1016/S0302-4598 (00)00071-4
(13)Zhang,X.;Guo,Y.;Liu,M.;Zhang,S.RSC Adv.2013,3(9), 2846.doi:10.1039/C2RA22238H
(14)Zhou,H.;Liu,J.;Zhang,S.Trends Anal.Chem.2015,67,56. doi:10.1016/j.trac.2014.12.007
(15)Yue,Z.;Lisdat,F.;Parak,W.J.;Hickey,S.G.;Tu,L.;Sabir,N.; Dorfs,D.;Bigall,N.C.ACSAppl.Mat.Interfaces2013,5(8), 2800.doi:10.1021/am3028662
(16)Freeman,R.;Girsh,J.;W illner,B.;W illner,I.Isr.J.Chem. 2012,52(11-12),1125.doi:10.1002/ijch.201200079
(17)Gill,R.;Zayats,M.;W illner,I.Angew.Chem.Int.Ed.2008,47 (40),7602.doi:10.1002/anie.200800169
(18)Katz,E.;Willner,I.;Wang,J.Electroanalysis2004,16(1-2), 19.doi:10.1002/elan.200302930
(19)Wang,G.L.;Xu,J.J.;Chen,H.Y.;Fu,S.Z.Biosens. Bioelectron.2009,25(4),791.doi:10.1016/j.bios.2009.08.027
(20)Wang,G.L.;Xu,J.J.;Chen,H.Y.Biosens.Bioelectron.2009, 24(8),2494.doi:10.1016/j.bios.2008.12.031
(21)Dai,H.;Zhang,S.;Xu,G.;Peng,Y.;Gong,L.;Li,X.;Li,Y.; Lin,Y.;Chen,G.RSCAdv.2014,4(102),58226.doi:10.1039/ c4ra09841b
(22)Shen,Q.;Jiang,J.;Liu,S.;Han,L.;Fan,X.;Fan,M.;Fan,Q.; Wang,L.;Huang,W.Nanoscale 2014,6(12),6315. doi:10.1039/C4NR00520A
(23)Tang,J.;Kong,B.;Wang,Y.;Xu,M.;Wang,Y.;Wu,H.;Zheng, G.Nano Lett.2013,13(11),5350.doi:10.1021/nl4028507
(24)Xia,L.;Xu,L.;Song,J.;Xu,R.;Liu,D.;Dong,B.;Song,H. Sci.Rep.2015,5,10838.doi:10.1038/srep10838
(25)Kang,Z.;Yan,X.;Wang,Y.;Bai,Z.;Liu,Y.;Zhang,Z.;Lin,P.; Zhang,X.;Yuan,H.;Zhang,X.;Zhang,Y.Sci.Rep.2015,5, 7882.doi:10.1038/srep07882
(26)Zhao,K.;Yan,X.;Gu,Y.;Kang,Z.;Bai,Z.;Cao,S.;Liu,Y.; Zhang,X.;Zhang,Y.Small2016,12(2),245.doi:10.1002/ sm ll.201502042
(27)Zhan,W.W.;Kuang,Q.;Zhou,J.Z.;Kong,X.J.;Xie,Z.X.; Zheng,L.S.J.Am.Chem.Soc.2013,135(5),1926. doi:10.1021/ja311085e
(28)Pardo-Yissar,V.;Katz,E.;Wasserman,J.;W illner,I.J.Am. Chem.Soc.2003,125(3),622.doi:10.1021/ja028922k
(29)Tanne,J.;Schäfer,D.;Khalid,W.;Parak,W.J.;Lisdat,F.Anal. Chem.2011,83(20),7778.doi:10.1021/ac201329u
(30)Zhao,W.W.;Ma,Z.Y.;Xu,J.J.;Chen,H.Y.Anal.Chem.2013, 85(18),8503.doi:10.1021/ac402523p
(31)Devadoss,A.;Sudhagar,P.;Das,S.;Lee,S.Y.;Terashima,C.; Nakata,K.;Fujishima,A.;Choi,W.;Kang,Y.S.;Paik,U.ACS Appl.Mat.Interfaces2014,6(7),4864.doi:10.1021/ am4058925
(32)Zhu,J.;Huo,X.;Liu,X.;Ju,H.ACSAppl.Mat.Interfaces 2016,8(1),341.doi:10.1021/acsami.5b08837
(33)Wang,Y.;Tang,J.;Zhou,T.;Da,P.;Li,J.;Kong,B.;Yang,Z.; Zheng,G.Small2014,10(23),4967.doi:10.1002/ sm ll.201401059
(34)Tel-Vered,R.;Yildiz,H.B.;Yan,Y.M.;W illner,I.Small2010, 6(15),1593.doi:10.1002/sm ll.201000296
(35)Zheng,M.;Cui,Y.;Li,X.;Liu,S.;Tang,Z.J.Electroanal. Chem.2011,656(1-2),167.doi:10.1016/j. jelechem.2010.11.036
(36)Tel-Vered,R.;Kahn,J.S.;Willner,I.Small2016,12(1),51. doi:10.1002/sm ll.201501367
(37)Chao,J.;Zhu,D.;Zhang,Y.;Wang,L.;Fan,C.Biosens. Bioelectron.2016,76,68.doi:10.1016/j.bios.2015.07.007
(38)Freeman,R.;Girsh,J.;W illner,I.ACSAppl.Mat.Interfaces 2013,5(8),2815.doi:10.1021/am303189h
(39)Willner,I.;Patolsky,F.;Wasserman,J.Angew.Chem.Int.Ed. 2001,40(10),1861.doi:10.1021/ja028922k
(40)Xu,J.P.;Weizmann,Y.;Krikhely,N.;Baron,R.;Willner,I. Small2006,2(10),1178.doi:10.1002/sm ll.200600200
(41)Chen,Q.L.;Zhou,J.Z.;Liang,J.L.;Lin,L.L.Acta Phys.-Chim.Sin.2008,24(5),749.[陈巧琳,周剑章,梁金玲,林玲玲,林仲华.物理化学学报,2008,24(5),749.] doi:10.3866/PKU.WHXB20080503
(42)Liu,S.;Li,C.;Cheng,J.;Zhou,Y.Anal.Chem.2006,78(13), 4722.doi:10.1021/ac052022f
(43)Li,C.;Wang,H.;Shen,J.;Tang,B.Anal.Chem.2015,87(8), 4283.doi:10.1021/ac5047032
(44)Zhang,X.;Zhao,Y.;Li,S.;Zhang,S.Chem.Commun.2010,46 (48),9173.doi:10.1039/C0CC03595E
(45)Wu,Y.;Zhang,B.;Guo,L.H.Anal.Chem.2013,85(14),6908. doi:10.1021/ac401346x
(46)Zang,Y.;Lei,J.;Ling,P.;Ju,H.Anal.Chem.2015,87(10), 5430.doi:10.1021/acs.analchem.5b00888
(47)Golub,E.;Pelossof,G.;Freeman,R.;Zhang,H.;Willner,I. Anal.Chem.2009,81(22),9291.doi:10.1021/ac901551q
(48)Wang,J.;Liu,Z.;Hu,C.;Hu,S.Anal.Chem.2015,87(18), 9368.doi:10.1021/acs.analchem.5b02148
(49)Zhang,B.;Guo,L.H.;Greenberg,M.M.Anal.Chem.2012,84 (14),6048.doi:10.1021/ac300866u
(50)Fan,G.C.;Han,L.;Zhang,J.R.;Zhu,J.J.Anal.Chem.2014, 86(21),10877.doi:10.1021/ac503043w
(51)Zhao,W.W.;Wang,J.;Xu,J.J.;Chen,H.Y.Chem.Commun.2011,47(39),10990.doi:10.1039/C1CC13952E
(52)M a,Z.Y.;Ruan,Y.F.;Xu,F.;Zhao,W.W.;Xu,J.J.;Chen,H. Y.Anal.Chem.2016,88(7),3864.doi:10.1021/acs. analchem.6b00012
(53)Zhao,W.W.;Yu,P.P.;Shan,Y.;Wang,J.;Xu,J.J.;Chen,H.Y. Anal.Chem.2012,84(14),5892.doi:10.1021/ac300127s
(54)Xu,F.;Zhu,Y.C.;Ma,Z.Y.;Zhao,W.W.;Xu,J.J.;Chen,H.Y. Chem.Commun.2016,52(14),3034.doi:10.1039/ C5CC09963C
(55)Zeng,X.;Ma,S.;Bao,J.;Tu,W.;Dai,Z.Anal.Chem.2013,85 (24),11720.doi:10.1021/ac403408y
(56)Zang,Y.;Lei,J.;Hao,Q.;Ju,H.ACSAppl.Mat.Interfaces 2014,6(18),15991.doi:10.1021/am503804g
(57)Zhao,M.;Fan,G.C.;Chen,J.J.;Shi,J.J.;Zhu,J.J.Anal. Chem.2015,87(24),12340.doi:10.1021/acs. analchem.5b03721
(58)Wang,W.;Hao,Q.;Wang,W.;Bao,L.;Lei,J.;Wang,Q.;Ju,H. Nanoscale 2014,6(5),2710.doi:10.1039/C3NR04777F
(59)Shen,Q.;Han,L.;Fan,G.;Zhang,J.R.;Jiang,L.;Zhu,J.J. Anal.Chem.2015,87(9),4949.doi:10.1021/acs. analchem.5b00679
(60)Wang,G.L.;Shu,J.X.;Dong,Y.M.;Wu,X.M.;Zhao,W.W.; Xu,J.J.;Chen,H.Y.Anal.Chem.2015,87(5),2892. doi:10.1021/ac5043945
(61)Zang,Y.;Lei,J.;Zhang,L.;Ju,H.Anal.Chem.2014,86(24), 12362.doi:10.1021/ac503741x
(62)Yan,Z.;Wang,Z.;M iao,Z.;Liu,Y.Anal.Chem.2016,88(1), 922.doi:10.1021/acs.analchem.5b03661
(63)Yan,K.;Liu,Y.;Yang,Y.;Zhang,J.Anal.Chem.2015,87(24), 12215.doi:10.1021/acs.analchem.5b03139
(64)Zhuang,J.;Lai,W.;Xu,M.;Zhou,Q.;Tang,D.ACSAppl.Mat. Interfaces2015,7(15),8330.doi:10.1021/acsami.5b01923
(65)Li,J.;Tu,W.;Li,H.;Han,M.;Lan,Y.;Dai,Z.;Bao,J.Anal. Chem.2014,86(2),1306.doi:10.1021/ac404121c
(66)Ge,L.;Wang,P.;Ge,S.;Li,N.;Yu,J.;Yan,M.;Huang,J.Anal. Chem.2013,85(8),3961.doi:10.1021/ac4001496
(67)Wang,G.L.;Yu,P.P.;Xu,J.J.;Chen,H.Y.J.Phys.Chem.C 2009,113(25),11142.doi:10.1021/jp902069s
(68)Zhao,W.W.;Ma,Z.Y.;Yu,P.P.;Dong,X.Y.;Xu,J.J.;Chen, H.Y.Anal.Chem.2012,84(2),917.doi:10.1021/ac203184g
(69)Zhao,W.W.;Ma,Z.Y.;Yan,D.Y.;Xu,J.J.;Chen,H.Y.Anal. Chem.2012,84(24),10518.doi:10.1021/ac3028799
(70)Zhao,W.W.;Liu,Z.;Shan,S.;Zhang,W.W.;Wang,J.;Ma,Z. Y.;Xu,J.J.;Chen,H.Y.Sci.Rep.2014,4,4426.doi:10.1038/ srep04426
(71)Zhao,W.W.;Shan,S.;Ma,Z.Y.;Wan,L.N.;Xu,J.J.;Chen,H. Y.Anal.Chem.2013,85(24),11686.doi:10.1021/ac403691a
(72)Zhao,W.W.;Chen,R.;Dai,P.P.;Li,X.L.;Xu,J.J.;Chen,H. Y.Anal.Chem.2014,86(23),11513.doi:10.1021/ac503969e
(73)Zhang,N.;Ma,Z.Y.;Ruan,Y.F.;Zhao,W.W.;Xu,J.J.;Chen, H.Y.Anal.Chem.2016,88(4),1990-1994.doi:10.1021/acs. analchem.5b04579
(74)Zhao,W.W.;Han,Y.M.;Zhu,Y.C.;Zhang,N.;Xu,J.J.;Chen, H.Y.Anal.Chem.2015,87(11),5496.doi:10.1021/acs. analchem.5b01360
(75)Li,Y.J.;Ma,M.J.;Zhu,J.J.Anal.Chem.2012,84(23),10492. doi:10.1021/ac302853y
(76)Fan,G.C.;Zhao,M.;Zhu,H.;Shi,J.J.;Zhang,J.R.;Zhu,J.J. J.Phys.Chem.C 2016,120(29),15657.doi:10.1021/acs. jpcc.5b08131
(77)Zeng,X.;Tu,W.;Li,J.;Bao,J.;Dai,Z.ACSAppl.Mat. Interfaces2014,6(18),16197.doi:10.1021/am5043164
(78)Wang,X.;Yan,T.;Li,Y.;Liu,Y.;Du,B.;M a,H.;Wei,Q.Sci. Rep.2015,5,17945.doi:10.1038/srep17945
(79)Jin,L.Y.;Dong,Y.M.;Wu,X.M.;Cao,G.X.;Wang,G.L. Anal.Chem.2015,87(20),10429.doi:10.1021/acs. analchem.5b02728
(80)Shu,J.;Qiu,Z.;Zhuang,J.;Xu,M.;Tang,D.ACSAppl.Mat. Interfaces2015,7(42),23812.doi:10.1021/acsami.5b08742
(81)Zhuang,J.;Tang,D.;Lai,W.;Xu,M.;Tang,D.Anal.Chem. 2015,87(18),9473.doi:10.1021/acs.analchem.5b02676
(82)Da,P.;Li,W.;Lin,X.;Wang,Y.;Tang,J.;Zheng,G.Anal. Chem.2014,86(13),6633.doi:10.1021/ac501406x
(83)Hu,C.;Zheng,J.;Su,X.;Wang,J.;Wu,W.;Hu,S.Anal.Chem. 2013,85(21),10612.doi:10.1021/ac4028005
(84)Zhao,W.W.;Zhang,L.;Xu,J.J.;Chen,H.Y.Chem.Commun. 2012,48(76),9456.doi:10.1039/C2CC34543A
(85)Wang,P.;Ge,L.;Ge,S.;Yu,J.;Yan,M.;Huang,J.Chem. Commun.2013,49(32),3294.doi:10.1039/C3CC00149K
(86)Sun,G.;Zhang,Y.;Kong,Q.;M a,C.;Yu,J.;Ge,S.;Yan,M.; Song,X.J.Mater.Chem.B 2014,2(44),7679.doi:10.1039/ C4TB01119H
(87)Wang,Y.;Ge,L.;Wang,P.;Yan,M.;Ge,S.;Li,N.;Yu,J.; Huang,J.Lab on a Chip 2013,13(19),3945.doi:10.1039/ C3LC50430A
(88)Sun,G.;Zhang,Y.;Kong,Q.;Zheng,X.;Yu,J.;Song,X. Biosens.Bioelectron.2015,66,565.doi:10.1016/j. bios.2014.12.020
(89)Jiang,Y.;Qin,D.D.;Fan,Y.R.;Guo,H.X.;Wang,S.X.;Ning, X.M.;Lu,X.Q.RSCAdv.2015,5(70),56697.doi:10.1039/ C5RA08485G
(90)Aaronson,B.D.B.;Byers,J.C.;Colburn,A.W.;M cKelvey,K.; Unw in,P.R.Anal.Chem.2015,87(8),4129.doi:10.1021/acs. analchem.5b00288
New Developments in Photoelectrochemical Bioanalysis
RUANYi-Fan ZHANG Nan ZHU Yuan-Cheng ZHAOWei-Wei*XU Jing-Juan*CHEN Hong-Yuan
(SchoolofChemistry and ChemicalEngineering,Nanjing University,Nanjing 210023,P.R.China)
Photoe lectrochem ical(PEC)bioana lysis is a new ly emerged and rapidly developing ana lysis technique thatprovides an elegant route for sensitive bioanalysis.The sensingm echanism of PEC bioanalysis is based on the fact thatvariations in photocurrent signalcan be p roduced by biologicalinteractions between various recognition elements and their corresponding targets.Owing to its excellentsensitivity,selectivity,and great potential for future bioanalysis,PEC bioana lysis has drawn increasing research attention and substantial progress has beenmade in its analyticalapplications.Currently,ithas become a hot research topic and its recent momen tum has grow n rapid ly,as dem onstrated by the increased number of published research articles.Given the pace ofadvances in this area,this review first introduces the fundamentals and genera linstrumentation of this methodo logy.Then,with recent illustrative exam ples,we summarize the new deve lopments in PEC bioanalysis according to itsmain bioanalyticalapp lications,i.e.,direct PEC detection of biomo lecules,PEC enzymatic bioanalysis,PEC DNA detection,and PEC immunoassay.The future challenges and developments in this field a re also d iscussed.
Photoelectrochem istry;Bioana lysis;Enzym e;Nucleic acid;Imm uno
O 646;O 657.1
eter,L.M.Chem.Rev.1990,90(5),753.
10.1021/ cr00103a005
doi:10.3866/PKU.WHXB201611141
www.whxb.pku.edu.cn
Received:October 12,2016;Revised:November 14,2016;Published online:November 14,2016.
*Corresponding authors.ZHAOWei-Wei,Email:zww@nju.edu.cn;Tel:+86-25-89684862.XU Jing-Juan,Email:xujj@nju.edu.cn; Tel:+86-25-89687294.
The projectwas supported by the National Natural Science Foundation of China(21327902,21135003,21305063,21675080).
国家自然科学基金(21327902,21135003,21305063,21675080)资助项目©Editorialofficeof Acta Physico-Chim ica Sinica
