紫苏叶化学成分、抗炎作用及其作用机制研究进展
2017-04-28杨慧马培林明宝侯琦
杨慧,马培,林明宝,侯琦
(中国医学科学院北京协和医学院药物研究所,北京100050)
紫苏叶化学成分、抗炎作用及其作用机制研究进展
杨慧,马培,林明宝,侯琦
(中国医学科学院北京协和医学院药物研究所,北京100050)
紫苏叶为我国传统清热解毒中药,具有解表散寒、宣肺化痰、行气和胃之功效,临床广泛应用于炎症性疾病的治疗。为明确紫苏叶药理活性的物质基础及其抗炎活性机制,本文依据近年来紫苏叶提取物及主要化学成分药理活性的相关文献,对紫苏叶中挥发油类、黄酮和花色苷类、酚酸类、苷类、三萜类和甾体等主要化学成分、紫苏叶提取物的抗炎活性及其调控固有免疫细胞活性和功能、调节辅助性T细胞平衡等主要作用机制进行了综述,旨在为研发以紫苏叶为原料的抗炎新药提供参考。
紫苏叶;化学成分;炎症
紫苏(Perilla frutescens)是原卫生部公布的药食同源植物之一,其不同药用部位紫苏叶(Folium Perillae)、紫苏梗和紫苏子均被《中国药典》收载。紫苏叶应用历史悠久,具有解表散寒、宣肺化痰、行气和胃等功效[1],主要临床适应证为炎症性疾病,包括急慢性支气管炎、胃炎、肾炎和体表化脓性炎症[2]。药理学研究表明,紫苏叶提取物对大、小鼠的急、慢性炎症,局部组织和全身炎症有良好的缓解作用,这与其调控免疫细胞的活性和功能、抑制炎症介质的释放和活性、调控活性氧簇(reactive oxy⁃gen species,ROS)和一氧化氮(nitric oxide,NO)水平等作用机制有关[3-4],抗炎作用活性物质为挥发油、黄酮和酚酸等化合物[5-7]。本文对紫苏叶化学成分和抗炎药理活性研究进展进行综述,以期明确其发挥抗炎作用的物质基础和抗炎机制,为临床用药和开发新药提供理论基础。
1 紫苏叶的化学成分
1.1 挥发油
挥发油是紫苏叶主要成分和特异香气的来源,含有单萜、倍半萜、二萜、芳香类和脂肪族类等多种化合物,成分的种类和含量因品种、产地等因素而差异较大[8]。无环单萜的基本骨架是月桂烷(dodecane),包括芳樟醇、乙酸芳樟酯、乙酸橙花酯、乙酸香叶酯、枸橼醛、香叶醛、香草醇、白苏酮、异白苏酮、紫苏酮、紫苏烯和香薷酮[2,9-10]。单环单萜有薄荷烷(menthane)型的左旋柠檬烯、γ-松油烯、异松油烯、乙酸松油酯、1-甲基-4-(1-甲基亚乙基)环己烷、对聚伞花素、α-松油醇、4-萜烯醇、紫苏醛、紫苏醇、二氢紫苏醇、薄荷醇、薄荷酮、1,8-桉叶素和反式-2-对-薄荷烯-7-醇[1,2,9-12];还包括环香叶烷(cyclogera⁃niane)型的4-羟基-α-紫罗兰酮和(+)-异黑麦草内酯(isololiolide)和(-)-黑麦草内酯(loliolide)[1,13]。双环单萜有蒎烷(pinane)型的蒎烯。侧柏烷(thu⁃jane)型的香桧烯和莰烷(camphane)型的樟烯[9-10]。无环倍半萜的基本骨架为金合欢烷(farne⁃sane),包括金合欢烯、法呢醇和橙花叔醇[1,9,12,14]。单环倍半萜有蛇麻烷(humulane)型的α-蛇麻烯、没药烷(bisabolane)型的β-红没药烯、榄香烷(elemane)型的榄香烯、megastimane型的去氢催吐萝芙木醇和吉马烷(germacrane)型的吉马烯[9,13-14]。双环倍半萜有桉叶烷(salinane)型的β-芹子烯,丁香烷(caryophyllane)型的石竹烯和石竹酮,杜松烷(cadinane)型的杜松醇、δ-杜松烯和表位-双环倍半水芹烯,檀香烷(santalane)型的β-檀香烯以及菖蒲烷(acorane)型的去氢白菖烯[9-10,12,14]。三环倍半萜有荜澄茄烷(cubebane)型的α-荜澄茄油烯、长叶烷(longfolane)型的刺柏烯和异长叶烯、香木兰烷(aromadendrane)型的蓝桉醇及胡椒烷(copane)型的α-胡椒烯[9-10,14]。二萜化合物有植醇和穿心莲内酯[1-2]。芳香类成分有甲基丁香酚、芹菜脑、肉豆蔻醚、细辛脑、莳萝油脑、黄樟素、苯乙烯、邻苯二甲酸二甲酯和1,3-二甲基苯[1-2,11,14-15]。脂肪族类成分有新植二烯、7-辛烯-4-醇和茉莉酮[1,10]。挥发油类成分基本骨架见图1。
1.2 黄酮(flavone)和花色苷(anthocyanin)类
紫苏叶中黄酮类成分包括芹菜素、芹菜素-7-葡萄糖苷、芹菜素-7-O-双葡萄糖酸苷、芹菜素-7-咖啡酰葡萄糖苷、木犀草素、木犀草素-7-葡萄糖苷、木犀草素-7-O-双葡萄糖酸苷、木犀草素-7-咖啡酰葡萄糖苷、金圣草黄素、高黄芩素、高黄芩素-7-O-双葡萄糖酸苷、野黄芩苷和黄芩素-7-甲醚[2,13,16]。黄酮醇(flavonol)类成分有槲皮素[16]。黄烷酮类(flava⁃none)成分有8-羟基-6,7-二甲氧基黄烷酮和5,8-二羟基-7-甲氧基黄烷酮[17]。花色苷类成分包括天竺葵素、天竺葵苷、矢车菊素、芍药素、芍药素-3-葡萄糖苷、芍药素-3-(6’-乙酰)葡萄糖苷、咖啡酰基花色素苷、紫苏宁、顺式-紫苏宁、丙二酸单酰紫苏宁、丙二酸单酰-顺式-紫苏宁、咖啡酰基丙二酸单酰花色素苷、矮牵牛素、矮牵牛素-3,5-二葡萄糖苷、矮牵牛素-3-(6’-酰基)葡萄糖苷、飞燕草色素、飞燕草素-3-阿拉伯糖苷、锦葵花素和锦葵花素-3-(6’-酰基)葡萄糖苷[2,16,18-19]。丰富的黄酮和花色苷类化合物及其含量差异是紫苏颜色多样性的主要原因,也是紫苏显著的抗氧化活性、抑制炎症和慢性疾病的物质基础。黄酮类成分基本骨架见图2。
1.3 酚酸类
紫苏叶中含有丰富的酚酸成分,已报道的有迷迭香酸(rosmarinic acid)衍生物(迷迭香酸、迷迭香酸甲酯、迷迭香酸乙酯和3,3’-乙氧基迷迭香酸),肉桂酸(cinnamic acid)衍生物〔三甲氧基肉桂酸、阿魏酸、阿魏酸甲酯、咖啡酸、咖啡酸甲酯、咖啡酸乙烯酯、(Z,E)-2-(3,5-二羟苯基)-乙烯咖啡酸酯和(Z,E)-2-(3,4-二羟苯基)-乙烯咖啡酸酯〕,咖啡酰奎尼酸(caffeoylquinic acid)类(3-咖啡酰奎尼酸、4-咖啡酰奎尼酸和5-咖啡酰奎尼酸),和其他化合物(丹参素、3,4-二羟基苯甲酸甲酯、原儿茶醛、原儿茶酸、苯丙酸、对羟基苯甲醛和对羟基苯乙酮)[2,12-13,17,20]。多数酚酸成分具有儿茶酚(邻二苯酚)结构,因此有较多的活性作用包括抗氧化、抗菌和消炎等[16]。代表性酚酸类成分结构见图3。

图1 紫苏叶单萜与倍半萜的基本骨架.

图2 紫苏叶中黄酮和花色苷类的基本骨架.
1.4 苷类
紫苏叶中含有多样的苷类化合物,包括单萜苷〔紫苏苷(perilloside)A~D〕[2],苯丙素苷(紫苏苷E和citrusin C)[2,21],氰苷〔苦杏仁苷异构体、野樱苷(prunasin)和接骨木苷〕[2],醇苷〔苯甲醇葡萄糖苷(苄基葡萄糖苷,benzyl glucoside),苯戊酸-3-β-D-吡喃葡萄糖苷和胡萝卜苷〕[2,18]和8个其他苷类(香草酸-氧-葡萄糖苷、茉莉酸-5’-氧-葡萄糖苷、3-β-D-吡喃葡萄糖氧基-3-表-2-异戊酸、甲基-α-D-半乳糖苷、5’-β-D-吡喃葡萄糖氧基茉莉酸、对羟基肉桂酰葡萄糖苷、葵烯酸-5-吡喃葡萄糖苷和乙酸芳樟醇-β-D-吡喃葡萄糖苷)[2,20-21]。代表性苷类化合物结构见图4。
一点看不出变化。王树林语无伦次地赞赏起来,和你二十岁的时候一样,光滑结实,没有赘肉。王树林当然说的是腿,他很久没有亲近它们了。他再次表现出少年郎的轻狂劲来,隐秘的内心深处开始回放起那晚的停车场,激烈,缠绵而持久。
1.5 三萜类和甾体
紫苏叶中含有常见的三萜和甾体类化合物,包括齐墩果烷(oleanane)型三萜(齐墩果酸、3-表山楂酸、马斯里酸、香树脂醇、augustic acid和绢毛榄仁苷[2,13,22],熊果烷(ursane)型三萜(熊果酸、委陵菜酸、果树酸、山香二烯酸和科罗索酸)[2]及甾醇类化合物(20-异戊基-孕甾-3β,14α-二醇、β-谷甾醇、豆甾醇和菜油甾醇)[2,22]。代表性三萜类和甾体成分化合物结构见图5。
1.6 其他
紫苏叶中还含有香豆素类化合物(6,7-二羟基香豆素和七叶内酯)[2,16]和新木脂素类化合物(柳叶玉兰脂素和andamanicin)[2]。此外,含有有机酸(柠檬酸和茉莉酸)[20],类胡萝卜素(色素类叶黄素、新黄素、百合黄素、堇菜黄素和β-胡萝卜素)[2,16],脂肪酸(棕榈酸、油酸、亚麻酸和亚油酸)[16]和多种维生素和金属元素等化学成分[16]。

图3 紫苏叶中代表性酚酸类化合物.
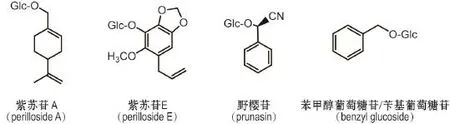
图4 紫苏叶中代表性苷类化合物.
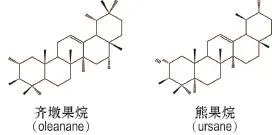
图5 紫苏叶中三萜类的基本骨架.
2 紫苏提取物抗炎作用及机制
紫苏具有丰富的种质资源,包括紫苏原变种(紫苏和白苏)、野生紫苏、回回苏和耳齿紫苏。研究结果表明,紫苏原变种、野生紫苏和回回苏的水提物对耳炎、特应性皮炎、肝炎、结肠炎和肾炎有广泛而有效的抑制作用,而其不同浓度乙醇和甲醇提取物的抗炎活性研究主要集中在耳炎、皮肤过敏及呼吸系统炎症(过敏性鼻炎、哮喘、慢性支气管炎和急性肺损伤等)。
2.1 调控固有免疫细胞的活性和功能
固有免疫细胞发挥非特异性抗感染效应,能对入侵的病原体迅速产生免疫应答,亦可清除体内损伤、衰老或畸变的细胞。单核/巨噬细胞和中性粒细胞主要通过吞噬作用对病原体进行处理,产生组织细胞损伤并推动炎症反应放大。嗜酸/嗜碱性粒细胞与肥大细胞通过产生并与趋化因子和炎症介质相互作用,促使各类免疫细胞被募集、黏附并迁移到病灶而形成炎症浸润,进而发生免疫和组织损伤作用[23]。
有研究表明,紫苏水提物表现出很强的抗特应性皮炎的活性,可迅速降低2,4-二硝基氟苯诱导的小鼠耳肿胀,相邻皮肤组织嗜酸性粒细胞水平可降低73.7%[24]。兔抗大鼠胸腺细胞血清诱导的肾小球肾炎大鼠饮用100和500 mg·kg-1回回苏水提物8 d,单核/巨噬细胞数及肾小球细胞增殖都显著降低[25]。野生紫苏30%乙醇提取物保护性腹腔注射10 d,可减轻卵清蛋白(ovalbumin,OVA)诱导过敏性鼻炎小鼠鼻黏膜嗜酸性粒细胞、中性粒细胞和肥大细胞浸润,降低血清、脾和鼻黏膜的IgE水平[26]。OVA诱导的哮喘小鼠灌胃给予紫苏95%乙醇提取物80或320 μg 3周,支气管肺泡灌洗液中炎症细胞减少及浸润减轻,嗜酸性粒细胞和内皮细胞之间的黏附减少[3]。紫苏乙醇提取物可通过调节Src-家族酪氨酸激酶信号传导通路并减少Ca2+动员,调节N-甲酰-L-甲硫氨酰-L-白氨酰-L苯丙氨酸刺激的中性粒细胞的激活[27]。
2.2 调控免疫球蛋白
IgA肾病小鼠饮用回回苏水提物50或500 mg·kg-124 h后,血清IgA水平降低,蛋白尿和肾小球IgA沉积显著减少[28]。紫苏95%乙醇提取物可降低哮喘小鼠血清IgE水平,恢复免疫系统辅助性T淋巴细胞(T helper cells,Th)1/Th2平衡[3]。
2.3 调控组胺和花生四烯酸代谢物
炎症反应时,细胞膜磷脂中的花生四烯酸可通过环氧合酶(cyclooxygenase,COX)和脂氧化酶转变为具有生物活性的前列腺素(prostaglandins,PG)、血栓素和白三烯(leukotriene,LT),引起血管扩张和血管通透性增加、水肿和疼痛等反应。此外,肥大细胞和嗜碱性粒细胞活化后脱颗粒释放组胺等,可通过结合组胺H1受体引起毛细血管扩张和血管通透性增加、平滑肌收缩和瘙痒等过敏反应[26]。
佛波醇-12-十四烷酰-13-乙酸酯、花生四烯酸或噁唑酮诱导的耳炎小鼠灌胃给予1 kg·L-1野生紫苏水提物0.4 mL,可抑制花生四烯酸、PG和LT的产生和组胺释放,显著缓解耳肿胀[29]。紫苏水提物浓度依赖性抑制大鼠腹腔肥大细胞释放组胺和脱颗粒,IC50为0.42 g·L-1[30-31]。灌胃回回苏70%乙醇提取物0.28 g·kg-17 d,可拮抗组胺所致大鼠皮肤毛细血管通透性增加[32]。野生紫苏30%乙醇提取物可降低过敏性鼻炎小鼠的组胺水平和COX-2的表达[26]。紫苏100%甲醇提取物50和100 mg·L-1和紫苏70%乙醇提取物100 mg·L-1均可抑制脂多糖(lipopolysaccharides,LPS)刺激的巨噬细胞RAW264.7活化P38丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)和NF-κB,产生COX-2和前列腺素E2(prostaglandin E2,PGE2)[33-34]。
2.4 调控炎症细胞因子和辅助性T细胞平衡
细胞因子是一类重要的炎症介质,可分为促炎因子〔白细胞介素1(interleukin-1,IL-1)、IL-2、IL-6、IL-8、IL-12、IL-17、干扰素γ(interferon-γ,IFN-γ)、单核细胞趋化蛋白1(monocyte chemoattractant⁃protein-1,MCP-1)和肿瘤坏死因子α(tumor ne⁃crosis factor-α,TNF-α)等〕和抑炎因子〔IL-4、IL-5、IL-10和转化生长因子β(transforming growth fac⁃tor-β,TGF-β)等〕2类。Th细胞是重要的细胞因子来源,Th1细胞和Th2细胞受各类细胞因子的作用并调控细胞因子的进一步分泌,它们功能的平衡和消长是免疫调节的核心环节。
紫苏水提物3 g·kg-1灌胃可显著降低动物酒精性肝炎肝组织IL-6表达,并抑制IL-6与其受体作用,阻断信号转导和转录激活子3(signal transducer and activator of transcription-3,STAT-3)反式信号传导,从而减轻炎症细胞浸润,改善肝细胞变性及坏死[35]。葡聚糖硫酸钠诱导的结肠炎小鼠饮用0.54%紫苏水提物溶液10 d,显著减少血清IL-17A,TNF-α和IL-10的水平,并抑制NF-κB的激活、IL-17A和TNF-α mRNA在远端结肠的表达[36]。野生紫苏70%乙醇提取物(10~100 μmol·L-1)抑制IL-1β诱导的肺上皮细胞A549生成IL-6[37]。紫苏100%甲醇提取物50 mg·L-1抑制尘螨主要变应原Der p2刺激的支气管上皮细胞BEAS-2B中MAPK和NF-κB活性及促过敏因子(IL-4、IL-5、IL-13和粒细胞-巨噬细胞集落刺激因子)和促炎因子(IL-6,IL-8和MCP-1)的生成[38]。
2.5 调控ROS和NO水平
抗原抗体复合物等激活的炎症细胞产生ROS,造成细胞膜氧化性损伤,产生疼痛介质和炎症因子,并通过脂质过氧化产生的次级ROS级联放大使细胞功能降低、丧失或死亡。ROS可通过2条途径产生,一条是NADPH氧化酶反应,其激活包括膜磷脂酶、Ca2+激活和蛋白激酶C等核心事件;另一条是髓过氧化物酶反应。炎症反应中单核巨噬细胞和血管平滑肌细胞等产生的NO,参与细胞因子的调节,具有细胞毒性和抗炎保护的双重作用,可降低血小板的聚集和黏附,抑制肥大细胞诱发的炎症反应,减少急性炎症灶内的白细胞聚集。
紫苏醇提物30 g·kg-1灌胃20 d,可降低慢性支气管炎大鼠的内皮素-1、丙二醛(malondialde⁃hyde,MDA)含量,提高超氧化物歧化酶(superox⁃ide dismutase,SOD)活性和NO含量,清除机体自由基,提高机体抗氧化损伤能力,减轻气道炎症反应[4,39]。紫苏乙醇提取物(1~10 mg·L-1)浓度依赖性地抑制N-甲酰-L-甲硫氨酰-L-白氨酰-L苯丙氨酸刺激的中性粒细胞ROS产生,弹性蛋白酶释放,CD11b表达和细胞迁移[27]。紫苏70%乙醇提取物50或100 mg·L-1降低LPS刺激的RAW 264.7细胞内ROS水平,增加SOD、过氧化氢酶和谷胱甘肽过氧化物酶等抗氧化酶活性[34]。紫苏99.5%甲醇提取物10 mg·L-1抑制低密度脂蛋白刺激的巨噬细胞脂毒性细胞凋亡和未折叠蛋白反应,拮抗巨噬细胞内质网应激与动脉粥样硬化脂毒性信号[40]。
3 紫苏叶主要成分的抗炎作用
紫苏叶提取物显著的抗炎抗过敏活性使其抗炎活性成分成为新的研究关注点,其丰富的挥发油成分、黄酮类和酚酸类化合物是其抗炎活性的主要物质基础。已明确的活性成分有紫苏醛、异紫苏酮、木犀草素和迷迭香酸。
3.1 紫苏醛
紫苏醛(perillaldehyde)8.54 mg·kg-1灌胃21 d可显著升高小鼠腹腔巨噬细胞活性、脾和胸腺免疫器官指数,显著提高脾IL-2和IFN-γ mRNA水平,增加血清中IgG,降低IgM,增强非特异性和特异性免疫[5]。给抑郁样行为小鼠灌胃紫苏醛60或120 mg·kg-17 d可改善抑郁行为,小鼠单胺应答改变,前额叶5-羟色胺和去甲肾上腺素的浓度增加,且TNF-α和IL-6水平降低[6]。给大脑中动脉闭塞大鼠灌胃紫苏醛36或72 mg·kg-17 d,大鼠神经功能缺损和脑梗死面积减少,脑缺血再灌注诱导的细胞凋亡减少,诱导型NOS活性、NO水平及炎症细胞因子IL-1β,IL-6和TNF-α水平显著降低,这与蛋白激酶B磷酸化增加、c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)磷酸化减少、细胞凋亡相关基因Bax和胱天蛋白酶3表达降低有关[7]。
3.2 异紫苏酮
异紫苏酮(isoegomaketone)通过诱导血红素氧合酶1、抑制STAT-1磷酸化和IFN-β产生,抑制NF-κB与激活蛋白-1的活化,浓度依赖性地抑制LPS刺激的RAW 264.7细胞NO的生成;LPS刺激的小鼠腹腔注射异紫苏酮5~20 mg·kg-1,血清NO水平呈剂量依赖性降低[41]。
3.3 木犀草素
给小鼠灌胃木犀草素(luteolin)每只0.5 mg可抑制血清TNF-α和细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)表达及NO和ROS的产生,缓解小鼠耳肿胀[42]。小鼠腹腔注射木犀草素0.2 mg·kg-1,可抑制TNF-α和ICAM-1表达,降低组织白细胞浸润,显著提高LPS致死小鼠的存活率[43]。木犀草素可浓度依赖性地抑制人肥大细胞HMC-1中TNF-α和IL-1β的分泌,对皮肤炎症疾病具有治疗作用[44]。木犀草素可抑制3T3-L1脂肪细胞中NF-κB和MAPK的活化,抑制PGE2,NO和IL-6,减弱炎症反应并提高胰岛素敏感性[45]。
3.4 迷迭香酸
迷迭香酸25 mg·kg-1可缓解>60%大鼠足爪肿胀,抑制中性粒细胞活性;通过调节NF-κB和MMP-9,减少促炎细胞因子的全身性释放,减轻肝肾肺等多器官功能障碍[46]。OVA诱导的过敏性哮喘小鼠腹腔注射迷迭香酸(5,10和20 mg·kg-1),可剂量依赖性地抑制细胞外调节蛋白激酶、JNK、P38蛋白的磷酸化和NF-κB活化,减少气道黏液高分泌,抑制支气管肺泡灌洗液中炎症细胞和Th2细胞因子的增加,改善气道高反应性并延缓气道炎症[47]。迷迭香酸呈浓度依赖性地抑制血小板衍生生长因子诱导的肾小球系膜细胞中TGF-β1、MCP-1和纤连蛋白分泌,促进SOD活性升高,降低MDA含量[48-49]。
4 结语
紫苏叶中含有丰富的生物活性成分,其传统的解表散寒、宣肺化痰、行气和胃等功效正逐渐被现代药理学科学评价和证实。目前对紫苏叶的开发研究主要集中在不同溶剂的提取物,已从机体、细胞、分子水平多个层面上证实了紫苏叶提取物的抗炎作用和机制。紫苏叶提取物中单体成分的活性研究已阐明部分主要抗炎活性成分,如挥发油、黄酮类、酚酸类化合物。然而紫苏叶提取物的组成成分和含量受产地、季节、提取方式等影响而差异巨大,提取物除含有一些特定成分外还有其他多种生物活性物质,这使其药效物质、构效关系和作用机制等研究受到极大地限制。因此,紫苏叶抗炎作用机制的研究还有较大可深入探索的空间。通过对紫苏叶提取物尤其是其有效单体抗炎作用机制的研究,有望为进一步研究与开发以紫苏叶为原料的抗炎新药和功能食品提供依据。
[1]Yu ST,Xiong GX,Cheng H,Cheng SF,Xiao LE,Wu Z,et al.Influence of different extraction meth⁃ods on Perilla frutescens leaf volatile components[J].J Southern Agr(南方农业学报),2014,45(1):108-111.
[2]Huang LH.Studies on the chemical constituents and quality control of Perrilla frutescens(L.)Britt.(紫苏化学成分药材质量分析研究)[D].Xi’an:Northwest University(西北大学),2011.
[3]Chen ML,Wu CH,Hung LS,Lin BF.Ethanol extract of Perilla frutescens suppresses allergens pecific Th2 responses and alleviates airway inflammation and hyperreactivity in ovalbumin-s ensi⁃tized murine model of asthma[J].Evid Based Complement Alternat Med,2015,2015:324265.
[4]Wang FY,Li SC,Li L,Wang XR,Chu HY,Xi SY. Effect of Dunhuang ancient prescription“Zisu Jian”on SOD,MDA and NO contents in serum and lung tissue of rats with chronic bronchitis[J].J Gansu Coll Tradit Chin Med(甘肃中医学院学报),2003,20(02):14-17.
[5]Zhou ML.Effect of Perilla frutescens volatile oil and its main components(perillaldehyde and limo⁃nene)on growth and immune function of mice(紫苏挥发油及其主要成分紫苏醛和柠檬烯对小鼠生长和免疫功能的影响)[D].Yangzhou:Yangzhou University(扬州大学),2014.
[6]Ji WW,Wang SY,Ma ZQ,Li RP,Li SS,Xue JS,et al.Effects of perillaldehyde on alternations in serum cytokines and depressive-like behavior in mice after lipopolysaccharide administration[J].Pharmacol Biochem Behav,2014,116:1-8.
[7]Xu L,Li Y,Fu Q,Ma S.Perillaldehyde attenu⁃ates cerebral ischemia-reperfusion injury-triggered overexpression of inflammatory cytokines via modulating Akt/JNK pathway in the rat brain cortex[J]. Biochem Biophys Res Commun,2014,454(1):65-70.
[8]Liu J,LEI YL,Tang YH,Huang BK.Advances of the chemical constituents and bioactivities of Perilla frutescens[J].Lishizhen Med Mater Med Res(时珍国医国药),2010,21(07):1768-1769.
[9]Lei Y.Extract and GC analysis of essential oil from Perilla leaf(中药紫苏叶挥发油的提取与气相色谱分析)[D].Changchun:Jilin University(吉林大学),2006.
[10]Cui XQ,Zhao SP,Yang XZ,Tian WY.Analysis of essential oil from Perilla frutescens by GC-MS[J].J Beijing Univ Tradit Chin Med(北京中医药大学报),2002,25(04):46-47.
[11]Feng J,Wang W,Yu CH.Chemical composition and anti-inflammatory effects of the essential oils from Perilla frutescens leaf[J].Strait Pharm J(海峡药学),2011,23(5):45-48.
[12]Tang Y,Chen X,Shen PN.Research on the fin⁃gerprint of the volatile oil in Folium Perillae[J]. Shang J Tradit Chin Med(上海中医药杂志),2013,47(9):82-86.
[13]Huo LN,Wang W,Liu Y,Liu XH,Zhang L,Cheng K,et al.Chemical constituents from leaves of Perilla frutescens[J].Chin Tradit Herb Drugs(中草药),2016,47(1):26-31.
[14]Meng Q,Feng YF,Liang HM,Chen GF.The essential oil of Perilla frutescens(L.)Britt.analyzed by GC/MS[J].Acad J Guangdong Coll Pharm(广东药学院学报),2004,20(6):590-591.
[15]Wei CL,Guo BL.Advances in research of volatile oil and its different chemotypes in leaves of Perilla frutescens[J].China J Chin Mater Med(中国中药杂志),2015,40(15):2937-2944.
[16]Dai S.Study on extraction,content determination and antioxidative activity of antioxidative sub⁃stance from Perilla frutescens leaves(紫苏叶抗氧化物质提取、含量测定及抗氧化活性研究)[D]. Yaan:Sichuan Agriculture University(四川农业大学),2013.
[17]Nakajima A,Yamamoto Y,Yoshinaka N,Namba M,Matsuo H,Okuyama T,et al.A new flavanone and other flavonoids from green perilla leaf extract inhibit nitric oxide production in interleukin 1β-treated hepatocytes[J].Biosci Biotechnol Biochem,2015,79(1):138-146.
[18]Cai NC.Study on identification and functions of anthocvanins from leaves of Perilla frutescents(紫苏叶花色苷的提取分析及其功能的研究)[D].Hangzhou:Zhejiang University(浙江大学),2013.
[19]Zhang XB,Jiang WX,Zhang L,Wang XF,Cui LY. Research progress of Perilla frutescens[J].Food Res Dev(食品研究与开发),2015,36(7):140-143.
[20]Chen YK,Zhao ZG,Sun LJ.Rapid identification of the chemical constituents of Perilla frutescens leaves by liquid chromatography-time of flight mass spectrometry[J].Her Med(医药导报),2013,32(03):371-374.
[21]Wang YP,Yang JS,Zhao YJ,Zhu ZY.Research overview of chemistry and pharmacology of Perilla frutescens[J].Chin Pharm J(中国药学杂志),2003,38(04):250-253.
[22]Sun YP.Study on antibacterial activity of extractive and active constituent of Perilla frutescens(紫苏叶提取物及其有效成分的抗菌活性研究)[D].Yanji:Yanbian University(延边大学),2014.
[23]He W.Innate Immunity[M]//Yu YL,Wang FP,Tian ZG.Medical Immunology(医学免疫学). Beijing:People′s Medical Publishing House,2005:139-169.
[24]Heo JC,Nam DY,Seo MS,Lee SH.Alleviation of atopic dermatitis-related symptoms by Perilla frute⁃scens Britton[J].Int J Mol Med,2011,28(5):733-737.
[25]Makino T,Nakamura T,Ono T,Muso E,Honda G. Suppressive effects of Perilla frutescens on mesan⁃gioproliferative glomerulonephritis in rats[J].Biol Pharm Bull,2001,24(2):172-175.
[26]Oh HA,Park CS,Ahn HJ,Park YS,Kim HM. Effect of Perilla frutescens var.acuta Kudo and rosmarinic acid on allergic inflammatory reactions[J]. Exp Biol Med(Maywood),2011,236(1):99-106.
[27]Chen CY,Leu YL,Fang Y,Lin CF,Kuo LM,Sung WC,et al.Anti-inflammatory effects of Perilla frutescens in activated human neutrophils through two independent pathways:Src family kinases and calcium[J].Sci Rep,2015,5:18204.
[28]Makino T,Ono T,Matsuyama K,Nogaki F,Miy⁃awaki S,Honda G,et al.Suppressive effects of Perilla frutescens on IgA nephropathy in HIGA mice[J].Nephrol Dial Transplant,2003,18(3):484-490.
[29]Ueda H,Yamazaki M.Anti-inflammatory and antiallergic actions by oral administration of a perilla leaf extract in mice[J].Biosci Biotechnol Biochem,2001,65(7):1673-1675.
[30]Shin TY,Kim SH,Kim SH,Kim YK,Park HJ,Chae BS,et al.Inhibitory effect of mast cell-mediated immediate-type allergic reactions in rats by Perilla frutescens[J].Immunopharmacol Immunotoxicol, 2000,22(3):489-500.
[31]Asada M,Fukumori Y,Inoue M,Nakagomi K,Sugie M,Fujita Y,et al.Glycoprotein derived from the hot water extract of mint plant,Perilla frutescens Britton[J].J Agric Food Chem,1999,47(2):468-472.
[32]Huang L.The research of antiallergic activity of Perilla frutescens(紫苏叶抗过敏活性物质的研究)[D]. Nangning:Guangxi University(广西大学),2005.
[33]Huang BP,Lin CH,Chen YC,Kao SH.Anti-inflam⁃matory effects of Perilla frutescens leaf extract on lipopolysaccharide-stimulated RAW264.7 cells[J]. Mol Med Rep,2014,10(2):1077-1083.
[34]Lee HA,Han JS.Anti-inflammatory effect of Perilla frutescens(L.)Britton var.frutescens extract in LPS-stimulated RAW 264.7 macrophages[J].Prev Nutr Food Sci,2012,17(2):109-115.
[35]Shi JJ,Liu CQ,Gao MX,Liu XQ.Inhibition of aqueous extract of Perilla frutescens leaves on interleukin-6/interleukin-6 receptor binding[J].Chin J New Drugs Clin Rem(中国新药与临床杂志),2009,28(9):703-708.
[36]Urushima H,Nishimura J,Mizushima T,Hayashi N,Maeda K,Ito T.Perilla frutescens extract amelio⁃rates DSS-induced colitis by suppressing proinflam⁃matory cytokines and inducing anti-inflammatory cytokines[J].Am J Physiol Gastrointest Liver Physiol,2015,308(1):G32-G41.
[37]Lim HJ,Woo KW,Lee KR,Lee SK,Kim HP.Inhi⁃bition of proinflammatory cytokine generation in lung inflammation by the leaves of Perilla frutescens and its constituents[J].Biomol Ther(Seoul),2014,22(1):62-67.
[38]Liu JY,Chen YC,Lin CH,Kao SH.Perilla frutescens leaf extract inhibits mite major allergen Der p 2-induced gene expression of pro-allergic and pro-inflammatory cytokines in human bronchial epithelial cell BEAS-2B[J].PLoS One,2013,8(10):e77458.
[39]Wang FY,Jia YX,Li SC,Wang XR,Liu FL,Chu HY.Effects of Zisujian that is ancient formula of dunhuang on the contents of NO and ET-1 in the serum and lung tissue of rats with chronic bron⁃chitis[J].J Gansu Coll Tradit Chin Med(甘肃中医学院学报),2006,23(2):13-16.
[40]Park SH,Shin D,Lim SS,Lee JY,Kang YH. Purple perilla extracts allay ER stress in lipid-laden macrophages[J].PLoS One,2014,9(10):e110581.
[41]Jin CH,Lee HJ,Park YD,Choi DS,Kim DS,Kang SY,et al.Isoegomaketone inhibits lipopoly-saccharide-induced nitric oxide production in RAW 264.7 macrophages through the heme oxygenase-1 induction and inhibition of the interferon-beta-STAT-1 pathway[J].J Agric Food Chem,2010,58(2):860-867.
[42]Ueda H,Yamazaki C,Yamazaki M.Luteolin as an anti-inflammatory and anti-allergic constituent of Perilla frutescens[J].Biol Pharm Bull,2002,25(9):1197-1202.
[43]Kotanidou A,Xagorari A,Bagli E,Kitsanta P,Fotsis T,Papapetropoulos A,et al.Luteolin reduces lipopolysaccharide-induced lethal toxicity and expres⁃sion of proinflammatory molecules in mice[J].Am J Respir Crit Care Med,2002,165(6):818-823.
[44]Jeon IH,Kim HS,Kang HJ,Lee HS,Jeong SI,Kim SJ,et al.Anti-inflammatory and antipruritic effects of luteolin from Perilla(P.frutescens L.)leaves[J].Molecules,2014,19(6):6941-6951.
[45]Nepali S,Son JS,Poudel B,Lee JH,Lee YM,Kim DK.Luteolin is a bioflavonoid that attenuates adipocyte-derived inflammatory responses via suppres⁃sion of nuclear factor-κB/mitogen-activated protein kinases pathway[J].Pharmacogn Mag,2015,11(43):627-635.
[46]Rocha J,Eduardo-Figueira M,Barateiro A,Fernandes A,Brites D,Bronze R,et al.Antiinflammatory effect of rosmarinic acid and an extract of Rosmarinus officinalis in rat models of local and systemic inflammation[J].Basic Clin Pharmacol Toxicol,2015,116(5):398-413.
[47]Liang Z,Xu Y,Wen X,Nie H,Hu T,Yang X,e t al.Rosmarinic acid attenuates airway inflamma⁃tion and hyperresponsiveness in a murine model of asthma[J].Molecules,2016,21(6):769.
[48]Li L,Huang SM,Zhao SL,Feng QC,Ding GX. Effect of rosmarinic acid on antioxidative systems in mesangial proliferative glomerulonephritis in rats[J].J Appl Clin Pediatr(实用儿科临床杂志),2007,22(15):1174-1175,1180.
[49]Li L,Huang SM,Zhao SL.Effect of rosmarinic acid on antioxidative systems and cytokines production induced by PDGF-BB in rat mesangial cells prolif⁃eration[J].J Pract Diagn Ther(实用诊断与治疗杂志),2007,21(12):888-890.
Research progress in chemical constituents,anti-inflammatory effect and mechanism of Folium Perillae
YANG Hui,MA Pei,LIN Ming-bao,HOU Qi
(Institute of Materia Medica,Chinese Academy of Medical Sciences&Peking Union Medical College, Beijing 100050,China)
Folium Perillae(FP)is a traditional Chinese materia medica,which has been used for treating inflammatory diseases.In order to clarify the material basis of FP′s pharmacological activity and anti-inflammatory mechanism,we presented a review about some of the primary chemical components in FP,such as volatile oils,flavonoids,anthocyanins,phenolic acids,glycosides,triterpenes and steroids, and about the anti-inflammatory activity of FP extract and its major mechanism,such as regulating the viability and function of innate immune cells,controlling the balance of helper T cells,based on related research in recent years.This study aims to provide reference for further research and development of new drugs based on FP.
Folium Perillae;chemical constituents;inflammation
LIN Ming-bao,E-mail:mingbaolin@imm.cams.cn,Tel:(010)63165192;HOU Qi,E-mail: houq@imm.ac.cn,Tel:(010)63165191
R285
:A
:1000-3002-(2017)03-0279-08
10.3867/j.issn.1000-3002.2017.03.012
Foundation item:The project supported by National Natural Science Foundation of China(81473398);and CAMS Initia⁃tive for Innovative Medicine(CAMS-I2M:2016-I2M-2-006)
2016-10-27接受日期:2017-03-22)
(本文编辑:齐春会)
国家自然科学基金(81473398);中国医学科学院医学与健康创新工程-重大协同创新项目(2016-I2M-2-006)
杨慧,女,硕士研究生,主要从事抗炎免疫药理学研究,Tel:(010)63165192,E-mail:yanghui@imm.ac.cn
林明宝,E-mail:mingbaolin@imm.cams.cn,Tel:(010)63165192;侯琦,E-mail:houq@imm.ac.cn,Tel:(010)63165191
