逍遥散对肝郁脾虚证模型大鼠海马TPH2与IDO1的调节作用
2017-04-27焦海燕严志祎马庆宇李晓娟潘秋霞王亭晔刘玥芸陈家旭
焦海燕 严志祎 马庆宇 周 岩 李晓娟 潘秋霞 王亭晔 刘玥芸 陈家旭
(北京中医药大学基础医学院,北京,100029)
逍遥散对肝郁脾虚证模型大鼠海马TPH2与IDO1的调节作用
焦海燕 严志祎 马庆宇 周 岩 李晓娟 潘秋霞 王亭晔 刘玥芸 陈家旭
(北京中医药大学基础医学院,北京,100029)
目的:观察肝郁脾虚证模型大鼠海马色氨酸羟化酶2(TPH2)与吲哚胺-2,3-双加氧酶1(IDO1)表达的变化并探讨逍遥散的调节作用。方法:雄性SD大鼠随机分成4组,分别是正常组、模型组、逍遥散组、氟西汀组,每组6只。采用慢性束缚应激的方法制备大鼠肝郁脾虚证模型,造模持续21 d。通过荧光定量PCR与Western-blot方法检测各组大鼠海马TPH2与IDO1的表达情况。结果:模型组大鼠海马TPH2 mRNA的表达水平低于其余3组大鼠(P<0.05),逍遥散与氟西汀对TPH2 mRNA的表达有一定的上调作用;模型组大鼠海马IDO1 mRNA的表达显著增加(P<0.01),逍遥散与氟西汀对IDO1 mRNA表达的下调作用明显(P<0.01),且逍遥散对IDO1 mRNA的下调作用更明显。模型组、逍遥散组、氟西汀组大鼠海马TPH2的蛋白的表达低于正常组(P<0.01),逍遥散组TPH2蛋白表达高于模型组(P<0.05);模型组大鼠海马IDO1的蛋白表达显著高于其余3组(P<0.01)。结论:肝郁脾虚证模型大鼠海马TPH2的表达减少,IDO1的表达增多,逍遥散可能通过调节海马TPH2与IDO1的表达水平进而影响5-HT的含量,起到治疗作用。
肝郁脾虚证;逍遥散;TPH2;IDO1
肝主疏泄、调畅气机,肝脏是人体应激机制的调节中心[5],许多实验也证明了肝脏疏泄功能对于机体应激调节起到关键作用,与神经内分泌免疫调节网络密切相关[6],海马是与情感、情绪密切相关的重要脑区,富含各种神经递质及受体,对应激最为敏感,且是应激反应的高位调节中枢,慢性应激可引起海马结构和功能的变化。本实验通过慢性束缚应激的方法复制大鼠21 d肝郁脾虚证模型[7],观察模型大鼠海马中TPH2与IDO1表达的改变,同时以疏肝健脾的经典复方逍遥散为治疗药物[8],研究肝郁脾虚证发生的生物学机制,为逍遥散治疗肝郁脾虚证的临床应用提供实验基础,以此探讨逍遥散与肝郁脾虚证的方证关联性。
1 材料与方法
1.1 材料
1.1.1 动物 健康雄性SD大鼠,体质量(200±20)g,清洁级,共24只。动物许可证号:SCXK(Beijing)2012-0001。全部大鼠在实验前适应性饲养1周,饲养于北京中医药大学实验动物中心三级实验室。实验室温度为(22±2)℃,湿度60%±5%,正常光照昼夜节律,维持安静环境。
1.1.2 药物 实验中所用方剂选用《太平惠民和剂局方》中的逍遥散(北柴胡30 g、当归30 g、白芍30 g、白术30 g、茯苓15 g、炙甘草15 g、生姜10 g、薄荷10 g)。由北京同仁堂(毫州)饮片有限责任公司提供,根据《北京市中药炮制规范》,按原书配伍比例由中日友好医院中药制剂室煎煮、浓缩制成药粉备用,1 g药粉含生药量3.18 g,使用时用去离子水溶解配制成混悬液。实验中使用的盐酸氟西汀胶囊,Patheon France,由礼来苏州制药有限公司分包装,20 mg/粒。
1.1.3 试剂与仪器 TRZOL Reagent(Sigma),DEPC(Sigma),氯仿(国产分析纯),异丙醇(国产分析纯),RevertAidTM第一链cDNA Synthesis试剂盒(Thermo Scientific),2×SYBR Green Mix(Biomiga),手持电动匀浆器(KONTES,ΜSA),荧光定量PCR仪(BIO-RAD),BCA蛋白定量试剂盒,RIPA裂解液(Biomiga),过硫酸铵(Sigma),30%丙烯酰胺,10×TBST(Solarbio),PBS盐酸缓冲液,5×Tris-甘氨酸电泳缓冲液,10×电转液,4×SDS-PAGE分离胶缓冲液,4×SDS-PAGE浓缩胶缓冲液(Solarbio),甲醇(北京化工厂),TEMED(北京拜尔迪生物技术有限公司),Anti-Indoleamine2,3-dioxygenase抗体(ab106134),Anti-TPH2抗体(ab121013),辣根酶标记山羊抗兔IgG(H+L)(中杉金桥),β-actin(Thermo Scientific),超敏化学发光液(Thermo Scientific),Tanon-5200分析系统(上海天能科技有限公司),PVDF膜(0.45 μm,Thermo Scientific),电泳仪(BIO-RAD),全波长扫描酶标仪(Thermo Scientific)。
1.2 方法
1.2.1 模型制备与分组 24只SD大鼠随机分为4组,每组6只,分别为:正常组、模型组、逍遥散组、氟西汀组,采用大鼠束缚架(自制)制备慢性束缚应激的方法大鼠21 d肝郁脾虚证模型,大鼠束缚架为木质结构,底座宽10 cm、长20 cm、厚1 cm。上面束缚台长22 cm,宽6.6 cm,前端有小架可固定大鼠头部,束缚台两侧分别为两条可调节的粘贴软带,用于束缚大鼠的胸部和腹部。
心脏彩超为无创伤性,不会损伤患者,同时可将心脏舒张和收缩功能直观体现,患者的心腔结构、心脏搏动和血流动力学变化会动态显示,与心功能分级结合后可对病情的判定奠定基础,从而使诊断准确率显著提升。此次数据中,研究组患者LVM、LIMI、LVESD、LVEDD、LAD显著高于参照组LVEF、LVFS和E/Ea低于参照组,组间数据比对判定有统计学意义(P<0.05)。说明左心衰竭会将心肌损害和重构程度加重,从而损害心功能。
实验中,正常对照组大鼠不加任何实验条件常规饲养,其余3组大鼠每天束缚3 h。在束缚前1 h,正常组和模型组大鼠灌服去离子水,逍遥散组灌服逍遥散混悬液,按人体用药量换算成大鼠等效剂量,给药量为0.61 g/100 g体质量(相当于生药量1.927 g/100 g),氟西汀组灌服氟西汀溶液,给药量为0.2 mg/100 g体质量,大鼠的灌胃容积为1 mL/100 g体质量。造模持续21 d。
1.2.2 取材 造模结束后进行取材,采用2%戊巴比妥钠腹腔注射深度麻醉大鼠(40 mg/kg),冰上取出脑组织,分离海马,然后一半置于有RNA保存液的冻存管中4 ℃储存,另一半放入普通冻存管中后置于液氮中,待取材全部结束后将装有海马的RNA保存液的冻存管放置于-80 ℃冰箱保存备用。
1.2.3 实时荧光定量PCR
1.2.3.1 下丘脑总RNA的提取 将每个海马组织加入500 μL预冷Trizol的离心管中快速研磨,室温放置5 min;以每1 mL Trizol加入0.2 mL的比例加入氯仿,盖紧离心管,剧烈摇荡离心管15 s,然后室温静置3 min,后4 ℃、12 000 r/min离心15 min,样品分为三层,取上层水相于另一干净离心管中,按之前每1 mLTrizol液加入0.5 mL异丙醇的比例加入异丙醇,室温放置10 min,然后4 ℃,12 000 r/min离心10 min;弃去上清液,按每1 mLTrizol加入1 mL的比例加入75%乙醇,混匀后4 ℃,7 500 r/min离心5 min;小心弃去上清液,然后室温或真空干燥5~10 min,后将RNA溶于无RNA酶水中,保存于-80 ℃备用。
1.2.3.2 总RNA的质量和浓度检测 取出1 μLRNA样品稀释50倍,应用紫外分光光度计测定RNA的浓度和纯度。根据A260的值计算RNA浓度(单位:μg/μL),并根据A260/A280比值计算纯度,要求为1.8~2.0,比值低于1.5或高于2.2者弃去。
1.2.3.3 合成第一链cDNA 按RevertAidTM第一链cDNA Synthesis试剂盒说明书操作,20 μL反应体系,在置于冰上的无菌无核酸酶的PCR管中,按照顺序加入总RNA、随机六聚体引物1 μL,然后补充无核酸酶的高纯水至12 μL;短暂离心后,65 ℃孵育5 min,冰上冷却,离心,再置于冰上冷却;按照顺序加入4 μL 5X Reaction Buffer、1 μL RiboLockTMRNA酶抑制剂(20 μ/μL)、2 μL 10 mM dNTP Mix、1 μL RevertAidTMM-MuLV逆转录酶(200 μ/μL),共20 μL;轻轻混匀,离心,25 ℃孵育5 min,随后42 ℃孵育60 min;70 ℃加热5 min终止反应,-80 ℃保存。
1.2.3.4 PCR实验引物 本实验采用由上海生工生物工程有限公司设计的引物进行实验。
TPH2 REVERSE(TTGGAAGGTGGTGATTAGGC),FORWARD(CCATCGGAGAATTGAAGCAT);IDO1 REVERSE(GCTTCCCATTCTCAATCAGC),FORWARD(GGGCTTTGCTCTACCACATC);GAPDH REVERSE(TGGTCCAGGGTTTCTTACT),FORWARD(CCATTCTTCCACCTTTGAT)。
1.2.3.5 实时荧光定量PCR 按照试剂盒说明书配制PCR反应体系(50 μL),2×SYBR Mixture(With Rox)25 μL,Forward Primer 10 μM,Forward Primer 10 μM,cDNA样品2 μL(1~10 ng),补充至50 μL。
在荧光定量PCR仪上设置运行参数(预变性95 ℃ 10 min,变性95 ℃ 15 s,退火/延伸,60 ℃ 1 min,溶解曲线分析65 ℃至95 ℃,每5 s增长0.5 ℃),然后进行两步法PCR反应。
1.2.4 Western-blot
1.2.4.1 蛋白提取和蛋白含量测定 每20 mg海马组织加入100 μLRIPA裂解液,用手动匀浆器匀浆,然后冰上放置30 min,后4 ℃,12 000 r/min离心15 min;所得上清液即为总蛋白,转存于-20 ℃冰箱备用。采用BCA蛋白定量试剂盒测定总蛋白含量,用酶标仪于562 nm处测定吸光度,然后绘制标准曲线,计算出蛋白浓度。
1.2.4.2 实验步骤 1)配置10%分离胶与5%浓缩胶,然后蛋白上样,体积为20 μL,上样量为50 μg;2)电泳:先以80V电泳30 min,然后120V电泳1 h;3)转膜:转膜采用200 ma,1.5 h,选用PVDF膜;4)封闭:用膜封闭液将转好的PVDF膜室温摇床封闭2 h;5)孵育一抗:用膜封闭液稀释一抗(TPH2为1∶500,IDO1为1∶50,β-Actin为1∶3 000),膜置于杂交袋中4 ℃孵育过夜;6)孵育二抗:第二天将杂交袋取出放置至室温,后TBST摇床水洗3×10 min,然后杂交袋摇床孵育二抗1 h,然后TBST摇床水洗3×10 min;7)显影:将膜正面向下放入配置好的显影液中2 min,然后通过Tanon-5200分析仪进行曝光拍照。
1.3 统计学方法 运用SPSS 21.0软件,对数据做正态性检验和方差齐性检验,两项均符合,采用单因素方差分析(One-Way,ANOVA)进行统计计算。若数据不正态或方差不齐,则采用K个独立样本的非参数检验逐项统计。以P<0.05为差异有统计学意义。
2 结果
2.1 各组海马TPH2与IDO1基因表达结果 采用2-△△Ct相对定量法计算各组大鼠基因的相对扩增效率,其公式为:F=2[(待测组目的基因平均Ct值-待测组内参基因平均Ct值)-(正常组目的基因平均Ct值-正常组内参基因平均Ct值)],其结果如下。
与正常组相比,21 d慢性束缚应激能够明显下调其余3组大鼠海马TPH2 mRNA的表达水平(P<0.05),并且逍遥散与氟西汀对TPH2 mRNA的表达有一定的上调作用;同样相比于正常组,造模能够明显上调模型组大鼠海马IDO1 mRNA的表达水平(P<0.01),而逍遥散与氟西汀对IDO1 mRNA表达的下调作用明显(P<0.01),且逍遥散对IDO1 mRNA的下调作用更明显。见表1、图1。
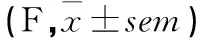
表1 各组大鼠TPH2和IDO1 mRNA表达情况
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
2.2 各组海马TPH2与IDO1蛋白表达结果 采用Tanon Gis软件对所得各组WB条带图像灰度值进行分析,通过比较各组目标条带灰度值/内参灰度值的数值,得出各检测指标蛋白表达的相对含量值,然后进行统计分析。见图2。

图1 各组大鼠TPH2和IDO1 mRNA表达比较

图2 各组大鼠TPH2和IDO1 Western-blot条带比较
与正常组相比,模型组、逍遥散组、氟西汀组3组大鼠海马TPH2的蛋白的表达明显减少(P<0.01),并且逍遥散对TPH2蛋白表达有一定的上调作用,这一作用优于氟西汀(P<0.05);同样的,造模能够明显上调模型组大鼠海马IDO1的蛋白表达水平(P<0.01),并且逍遥散与氟西汀对IDO1的蛋白表达有明显的下调作用(P<0.01)。见表2、图3。

表2 各组大鼠TPH2和IDO1蛋白表达情况(灰度比,
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与逍遥散组比较▲P<0.05,▲▲P<0.01。

图3 各组大鼠TPH2和IDO1 Western-blot灰度值比较
3 讨论
本实验通过慢性束缚应激的方法,复制了21 d肝郁脾虚证大鼠模型,实验中采用了逍遥散作为干预药物,西药氟西汀作为对照药物。在实验中,大鼠海马TPH2与IDO1的基因表达与蛋白水平发生了变化,造模使TPH2的表达下调的同时上调了IDO1的表达,且基因与蛋白表达结果基本一致。研究显示,5-HT系统紊乱与情绪抑郁、食欲减退、失眠、昼夜节律紊乱、内分泌功能紊乱、性功能障碍、焦虑不安、活动减少等密切相关。TPH的活性直接决定5-HT含量的变化,因此有学者提出TPH调控影响的研究比5-HT本身含量的研究更有价值[9]。TPH-2主要控制着中枢5-HT的合成,其基因的异常可能导致各类情感障碍,严重者能导致自杀行为。研究表明,TPH2基因在脑内海马、中缝核中表达丰富[10],而海马作为边缘系统的重要组成部分,是与情感、情绪密切相关的重要脑区,富含各种神经递质及受体,对应激最为敏感,是应激反应的高位调节中枢,慢性应激可引起海马结构和功能的变化[11],这是目前研究肝郁脾虚证的重要靶点之一。IDO1作为在情感障碍疾病的发病及治疗过程中都具有重要作用,与单胺类递质、细胞因子及神经元可塑性密切相关[12]。IDO1的过度激活可以使色氨酸更多的代谢为犬尿氨酸,而色氨酸作为必需氨基酸和5-HT的前体物质,在没有大量外界摄入的情况下,其含量的减少会导致5-HT水平下降。此外,激活的IDO1还可以加速5-HT的代谢,使5-HT进一步减少。IDO1同时也是炎性反应诱导型酶,且细胞因子间具有协同效应,机体免疫系统的激活可以引起细胞因子过度分泌,诱导激活IDO1,影响神经递质的代谢。情绪脑区神经生成减少或退化增加导致了情感障碍,而IDO1作用下的色氨酸-犬尿氨酸通路的部分代谢产物,如3-羟基犬尿氨酸、喹啉酸等具有神经毒性作用,可以导致神经元的退化而影响神经可塑性[13]。J Mao等[14]应用IDO1阻断剂1-MT及SSRI类抗抑郁药对抑郁模型小鼠进行干预,结果显示模型组小鼠海马IDO1较正常组升高,TPH2与正常组无显著性差异,IDO1/TPH2显著升高;单独应用1-MT及联合用药对各指标有调节作用,而单独应用SSRI组IDO1/TPH2较模型组没有统计学意义。TPH2作为5-HT合成过程中的关键酶直接调控5-HT生成,IDO1则通过降解色氨酸为犬尿氨酸间接影响5-HT含量。当IDO1表达过多导致色氨酸含量减少而TPH2催化功能的改变不能弥补由色氨酸不足导致的5-HT合成减少时,机体对应激刺激的敏感性增加,可能会导致多种情感类障碍。因此,TPH2与IDO1作为色氨酸代谢生成5-HT途径的重要调控指标,能够导致5-HT合成不足,这与肝郁脾虚证的发生密切相关。实验结果表明,逍遥散与氟西汀对TPH2与IDO1均有一定的调节作用,且逍遥散的调节作用更为明显。有文献报道,抑郁模型大鼠海马TPH mRNA表达减少,而氟西汀能够上调TPH的表达[15],且长期的氟西汀治疗对海马TPH2 mRNA表达具有上调作用[16]。因此氟西汀虽作为本实验的阳性对照药物,其本身为SSRI类药物虽能增加突触间隙内5-HT的含量,但可能会因色氨酸的减少导致突触前膜5-HT合成和贮存不足而产生快速抗药反应,减弱其疗效[17]。而逍遥散具有疏肝解郁、养血健脾的功效,早期主要应用于妇科疾病的治疗中。随着中医学的现代发展,有利的情绪能够促进疾病的恢复,情志与临床疾病关系研究的深入,逍遥散的应用范围也随之增大,几乎涵盖了人体的所有系统。逍遥散治疗肝郁脾虚证,因其整体调节、辨证论治、个体化诊疗等理念的渗透,显示了明显的优越性。
综上所述,本实验观察了慢性束缚应激大鼠海马TPH2与IDO1基因蛋白表达情况,逍遥散作为治疗肝郁脾虚证最常用的经典名方之一,其作用靶点较多,也对TPH2与IDO1的含量变化有一定的调节作用,它们均通过作用于5-HT前体物质—色氨酸来调节5-HT的含量,研究它们之间的相互作用关系是进一步为肝郁脾虚证的中枢机制与逍遥散治疗肝郁脾虚证提供实验依据。
[1]罗和古,丁杰,岳广欣,等.大鼠肝郁脾虚证的代谢组学研究[J].Journal of Integrative Medicine[结合医学学报(英文)],2007,5(3):307-313.
[2]田喜梅,胡西,暴学祥.昆虫色氨酸羟化酶的研究进展[J].神经解剖学杂志,2005,21(5):557-560.
[3]Gutknecht L,Popp S,Waider J,et al.Interaction of brain 5-HT synthesis deficiency,chronic stress and sex differentially impact emotional behavior in Tph2 knockout mice[J].Psychopharmacology,2015,232(14):2429-2441.
[4]王红梅,周慧容,刘燕玲,等.IDO1,IDO2在荷黑色素瘤大鼠及正常大鼠组织中的表达[A].中国免疫学会(Chinese Society for Immunology).第九届全国免疫学学术大会论文集[C].中国免疫学会,2014:1.
[5]陈家旭,杨维益.神经—内分泌—免疫网络研究概况及其与中医肝脏关系的探讨[J].北京中医药大学学报,1995,18(4):7-12.
[6]陈家旭.中医脾虚证的研究进展与展望[J].中医药导报,1998,4(8):14-16.
[7]岳利峰,丁杰,陈家旭,等.肝郁脾虚证大鼠模型的建立与评价[J].北京中医药大学学报,2008,31(6):396-400.
[8]陈家旭,李伟,赵歆,等.三种中药复方对慢性束缚应激大鼠行为及皮层和海马NT3的影响[J].北京中医药大学学报,2004,27(2):19-23.
[9]Xu CX,Liu HT,Wang J.Changes of 5-hydroxytryptamine and tryptophan hydroxylase expression in the ventral horn of spinal cord[J].Neurosci Bull,2008,24(1):29-33.
[10]Walther DJ,Peter JU,Bashammakh S,et al.Synthesis of se-rotonin by a second tryptophan hydroxylase isoform[J].Sci-ence,2003,299(5603):76.
[11]赵宏波,陈家旭,李静.逍遥散与慢性应激焦虑海马JNK通路的关系[J].环球中医药,2013,6(8):600-602.
[12]管西婷,林文娟.抑郁症发病机理中的重要调节因子:吲哚胺2,3-双加氧酶[J].心理科学进展,2013,21(06):951-957.
[13]Clarke G,Fitzgerald P,Cryan J F,et al.S1804 Altered Kynurenine Pathway Metabolism in Irritable Bowel Syndrome(IBS)Evidence of Indoleamine 2,3Dioxygenase(IDO)Activation in a Male Cohort[J].Gastroenterology,2008,134(4):A-273-A-273.
[14]J Mao,H Kim.Method for concurrent treatment of pain and depression.FreepatentsOnline,Wipo Patent Application WO/2014/008118 Kind Code:A2.
[15]袁翔,张斌.氯胺酮联合氟西汀对抑郁大鼠模型行为学指标及相关基因表达的影响[J].海南医学院学报,2015,21(11):1470-1473.
[16]Shishkina G T,Kalinina T S,Dygalo N N.Up-regulation of tryptophan hydroxylase-2 mRNA in the rat brain by chronic fluoxetine treatment correlates with its antidepressant effect.[J].Neuroscience,2008,150(2):404-412.
[17]郑莉明,史亚飞,吴皓萌,等.中枢5-HT能系统在早发性抑郁中的作用研究[J].中国药理学通报,2015,31(1):19-23.
(2017-02-20收稿 责任编辑:洪志强)
Influence of xiaoyaosan on the expression of TPH2 and IDO1 in hippocampus of rat with syndrome of liver depression and spleen deficiency
Jiao Haiyan, Yan Zhiyi, Ma Qingyu, Zhou Yan, Li Xiaojuan, Pan Qiuxia, Wang Tingye, Liu Yueyun, Chen Jiaxu
(SchoolofBasicMedicalScience,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To observe the expression of TPH2 and IDO1 in hippocampus of rat with syndrome of liver depression and spleen deficiency, and to explore the regulating effect of xiaoyaosan. Methods:Male SD rats were randomly divided into 4 groups:normal group, model group, xiayaosan group and fluoxetine group, each including 6 rats. The liver depression and spleen deficiency model was established by chronic immobilization stress for 21 days. The expression of TPH2 and IDO1 were detected by Fluorescent quantitative PCR and Western-blot method. Results:The mRNA expression of TPH2 in hippocampus of model group decreased significantly compared with the other groups (P<0.05); xiaoyaosan and fluoxetine could increase the TPH2 mRNA expression. The mRNA expression of IDO1 in hippocampus of model group increased significantly (P<0.01); xiaoyaosan and fluoxetine had the down-regulatory effect on IDO1 mRNA expression (P<0.01), which is more obvious in xiaoyaosan group. The protein expression of TPH2 in normal group was higher than the other groups (P<0.01), which of xiaoyaosan group was higher than model group (P<0.05); the protein expression of IDO1 in model group increased significantly compared with the other groups (P<0.01). Conclusion:The expression of TPH2 decreases and IDO1 increases in liver depression and spleen deficiency model rats, and xiaoyaosan has a therapeutic effec by regulating TPH2 and IDO1 in hippocampus to influence the content of 5-HT.
Syndrome of liver depression and spleen deficiency; Xiaoyaosan; TPH2; IDO1
国家自然科学基金面上项目(编号:81473597);国家自然科学基金重点项目(编号:81630104);北京中医药大学自主课题(编号:2016-JYB-XS012)
陈家旭,男,教授,博士研究生导师,北京市朝阳区北三环东路11号北京中医药大学中医学院中医诊断系83号信箱,邮编:100029,Tel:(010)64286656,E-mail:chenjx@bucm.edu.cn
R228
A
10.3969/j.issn.1673-7202.2017.03.004
