1株产淀粉酶嗜盐细菌X50的分类鉴定及其粗酶活特性研究
2017-04-27王传旭于慧瑛曹建斌高文庚
王传旭, 于慧瑛, 曹建斌, 高文庚, 李 新
(运城学院 生命科学系,山西 运城 044000)
1株产淀粉酶嗜盐细菌X50的分类鉴定及其粗酶活特性研究
王传旭, 于慧瑛, 曹建斌, 高文庚, 李 新*
(运城学院 生命科学系,山西 运城 044000)
从运城盐湖分离获得一株可产淀粉酶的嗜盐细菌菌株X50,对其进行分类鉴定及酶学特性分析。采用底物平板法进行菌株X50产胞外淀粉酶活性检测。通过16S rRNA基因序列分析对其进行分类鉴定。研究不同因素对菌株X50所产淀粉酶活性的影响。16S rRNA基因序列分析结果表明,该菌为Thalassobacillus属成员,命名为Thalassobacillussp. X50。对其所产淀粉酶酶特性进行了初步研究,结果发现该酶最适pH值为6.0,在较宽pH范围内(4.0~12.0)可保持高活力,具有较强的耐酸碱能力。无盐条件下,酶活性最强,且该酶具有良好的耐热性,高温处理后仍可保持较高活性。除Mg2+对酶的抑制作用较为显著外,其他金属离子基本无影响。PMSF可明显抑制该酶活性,而DEPC和EDTA作用不明显,表明该酶活性中心不含金属离子,可能为丝氨酸蛋白酶。本文的研究结果将为促进运城盐湖极端微生物资源的开发利用提供参考。
嗜盐细菌;Thalassobacillus;分类鉴定;淀粉酶;酶学特性
淀粉酶是水解淀粉和糖原的一类酶的统称,其产量约占工业酶总产量的85%以上。淀粉酶在食品加工、焙烤、发酵、纺织、轻工业和医药产业中应用广泛[1-2]。然而,工业生产过程中的高温、酸碱和重金属等严苛条件,制约着淀粉酶的应用。在这些条件下,淀粉酶的稳定性下降,酶的活力大幅度损失或者完全丧失,使用寿命及使用效率降低。因此,开发具有高稳定性的生物酶,使其可以适应高温、高酸碱等苛刻的工业环境,是近年来亟待解决的重要课题。嗜盐细菌对外界自然环境具有极强的适应性,是一类重要的极端微生物资源。噬盐菌可以在较高的盐浓度环境中生存,其最适盐浓度一般为0.5%~36%[3]。同嗜盐细菌的生存条件相适应,这类细菌产生的各种酶往往具有一些独特的生物学特性,如耐盐、耐高/低pH、耐有机溶剂等。在一些外部条件变化较大时,嗜盐细菌产生的酶往往可以保持较高的活性,这种特性特别适合于工业生产,也是普通的微生物酶无法比拟的[4-5]。近年人们将研究的注意力转向嗜盐微生物,其产生的多种功能酶也相继报道[6-8],但相关报道仍然较少。本课题组采用稀释涂布平板法,从运城盐湖中分离获得了一批嗜盐微生物菌株,采用底物平板法筛选得到一株高产胞外淀粉酶的菌株。在此基础上,克隆该菌株的16S rRNA基因并测序,对该基因序列进行对比分析,利用分析结果进行简单的分类学鉴定,同时对其产生的胞外淀粉酶的酶活特性进行初步研究。
1 材料与方法
1.1 材料
1.1.1 菌种、培养基及培养条件 菌株X50分离自运城盐湖所采的黑泥样品,由本实验室保存。CM液体培养基(g/L):酸水解酪蛋白7.5,柠檬酸三钠3.0,酵母浸出物10.0,FeSO4·7H2O 0.01,KCl 2.0, MgSO4·7H2O 20.0, NaCl 100.0,pH 7.5。CM固体培养基:在CM液体培养基基础上加入质量分数2%琼脂。筛选固体培养基:在CM固体培养基基础上加入质量分数1%的可溶性淀粉。菌株X50于37 ℃、150 r/min振荡培养3 d。
1.1.2 主要试剂及仪器 配置培养基所需要的蛋白胨、酵母粉、琼脂糖等及实验中需要的常见药品如PMSF、EDTA等购自北京奥博星生物技术有限公司;DNA marker、DNA聚合酶、PCR引物等购自大连TaKaRa公司;PCR扩增仪(美国Bio-Rad公司);高速台式冷冻离心机(湖南湘仪);立式压力蒸汽灭菌锅LDZX-50K(上海申安医疗器械厂);电泳仪DYY-6C(北京市六一仪器厂);电热鼓风干燥培养箱101-51ES(汗诺仪器)。
1.2 方法
1.2.1 菌株X50的16S rRNA基因序列比对分析 利用提取的菌株X50的总DNA作为模板,选用细菌通用引物进行16S rRNA基因的PCR扩增。其中采用的正向引物(27f):5′-GAGTTTGATCCTGGTCAG-3′,反向引物(1540r):5′-AAGGAGGTGATCCAGCCGCA-3′。PCR体系:基因组总DNA(约50 mg/L) 1 μL,PCR Buffer 2 μL,dNTPs (20 mmol/L) 1.6 μL, 正反向引物(5 μmol/L)各1 μL,TaqDNA聚合酶0.125 μL,加水至20 μL。针对该菌株,PCR扩增条件:95 ℃ 6 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 45 s,共35个循环;72 ℃ 10 min。PCR产物送交北京三博远志生物技术公司完成测序。测序结果提交至GenBank获得基因登录号并进行Blast比对分析,在分析结果中选取同源性较高的相关序列进行多重序列比对(所用软件为Bioedit),之后利用MEGA 5.0软件制作系统发育树,对菌株X50进行系统发育分析。
1.2.2 菌株X50产淀粉酶检测 将菌株X50在CM筛选固体培养基上37 ℃划线培养2 d后,将卢戈氏碘液(0.4 mol/L)均匀喷洒至平板上,观察透明圈大小。
1.2.3 粗酶液的制备 菌株X50在液体CM培养基中培养48 h,将发酵液离心 (4 ℃, 10 000 r/min, 10 min),离心所得上清液即为粗酶液,保存于4 ℃,或立即用于之后的实验分析。
1.2.4 淀粉酶活性测定 ①淀粉酶活力检测方法:筛选固体CM培养基(加入1%可溶性淀粉)倒入培养平板中待其凝固,用镊子将牛津杯摆放在培养基上,将制备好的粗酶液200 μL注入牛津杯中,28 ℃培养2~3 d,观察有无透明圈。②淀粉酶粗酶特性研究:最适作用温度:在不同温度下(0、20、40、60、80、100、120 ℃)利用杯碟法检测透明圈直径,以测得的透明圈直径与最大直径的比值为该淀粉酶的相对活性,绘制温度-相对活性曲线。最适作用pH:利用不同pH (4、6、8、10、12)缓冲液配制反应液,检测酶活力,采用杯碟法检测透明圈直径,以测得的透明圈直径与最大直径的比值为该淀粉酶的相对活性,绘制pH-相对活性曲线。最适盐度:于不同盐浓度(NaCl质量分数分别为0、5%、10%、15%、20%、25%)下,利用杯碟法检测透明圈直径,以测得的透明圈直径与最大直径的比值为该淀粉酶的相对活性,绘制盐浓度-相对活性曲线。不同金属离子及其他物质对粗酶活性的影响:将粗酶液分别与不同金属离子(Fe2+、Hg2+、Cu2+、K+、Ca2+、Fe3+、Mg2+、Zn2+, 10 mmol/L)、EDTA (10 mmol/L)、DEPC (10 mmol/L)和PMSF (10 mmol/L)溶液混合后,静置20 min,取1 mL酶液在最适条件下检测粗酶活力,采用杯碟法检测透明圈直径,以测得的透明圈直径与最大直径的比值为该淀粉酶的相对活性,绘制离子/化合物-相对活性曲线。
2 结果与分析
2.1 菌株X50的分类学鉴定
经PCR扩增菌株X50的16S rRNA基因,获得大小为1462 bp的基因片段并提交测序结果至GenBank (登录号:KM974802)。将比对结果利用mega 5.0软件构建系统进化树,结果表明,菌株X50与Thalassobacillus属内各种的同源性很高,可以达到98.0%~99.0%,系统发育分析归于同一分枝(图1),由此确定其为Thalassobacillus属成员,命名为Thalassobacillussp. X50。

图1 基于16S rRNA基因序列构建的菌株X50的系统进化树Fig.1 Phylogenetic tree of strain X50 based on 16S rRNA gene sequence
2.2 菌株X50产胞外淀粉酶活性检测
将菌株X50划线接种于含淀粉的CM筛选固体培养基,培养2 d,将筛选培养基用卢戈氏碘液显色并观察透明圈。结果显示菌株X50的菌落周围出现明显的无色透明圈(图2),表明其产生了胞外淀粉酶。

图2 菌株X50产胞外淀粉酶活性检测Fig.2 Detection of extracellular amylase produced by strain X50
2.3 粗酶特性研究
2.3.1 淀粉酶最适温度、pH和盐度 温度对粗酶活力的影响如图3所示,菌株X50所产淀粉酶的活性受温度影响不大。该酶在低于40 ℃的条件下活性最强,60 ℃对该淀粉酶的活性有较小的影响,但随着温度的升高,甚至在100 ℃以上时该酶仍然具有很高的活性。结果表明,X50所产淀粉酶具有良好的耐热性,可以在较高的温度下表现较好的酶活性。pH对粗酶活力的影响见图4,该淀粉酶最适反应pH为6.0,但在pH 4.0~12.0范围内均可保持高活力,说明该酶在强酸和强碱环境下均不影响其酶活性的发挥。此外,菌株X50所产淀粉酶在无NaCl条件下,酶活力最强,且在较宽的盐浓度范围内(0~25%),NaCl的浓度不影响该淀粉酶的活性(图5)。以上结果表明,X50菌株所产的淀粉酶具有很强的稳定性,可以在高温、强酸碱以及不同的盐浓度条件下保持较高的活性,这种特点预示该酶可以广泛地应用到工业生产中。

图3 温度对粗酶活力的影响Fig.3 Effect of temperature on the activity of crude amylase.
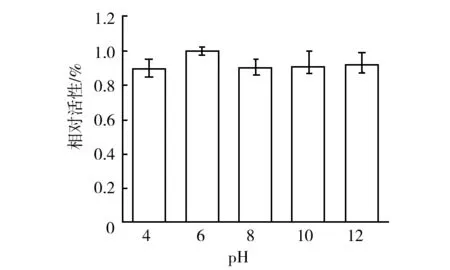
图4 pH对粗酶活力的影响Fig.4 Effect of pH on the activity of crude amylase.

图5 NaCl质量分数对粗酶活力的影响Fig.5 Effect of NaCl concentration on the activity of crude amylase
2.3.2 金属离子等对粗酶活性的影响 在最适酶反应条件下,不同的金属离子和化合物对该淀粉酶活性有不同的影响。除了Hg2+不影响该淀粉酶的活性之外,其余金属离子对酶活都有不同程度的抑制作用。在这些金属离子或者抑制剂中,Mg2+和PMSF对酶的抑制作用最为明显,但该淀粉酶仍具有一定的活性(图6)。总体上,除Mg2+和PMSF外,大部分金属离子、DEPC和EDTA对该淀粉酶活力的影响不明显,说明该菌株X50产生的胞外淀粉酶对金属离子和部分酶抑制剂不敏感,具有活性非常稳定的特点。

图6 属离子及化合物对粗酶活性的影响注Fig.6 Influence of metal ions or compounds on the activity of crude amylase
3 讨 论
淀粉酶可以将淀粉水解成葡萄糖、麦芽糖、麦芽三糖和其他寡糖,已被广泛应用于焙烤、纺织、造纸和啤酒酿造等工业生产中,具有广阔地应用前景。利用微生物资源获得高稳定性及易提取纯化的淀粉酶,是淀粉酶生产的重要方向。 近年来,本课题组针对运城盐湖嗜盐微生物资源开展了一系列的科研工作,在盐湖中分离了一批嗜盐菌株,开发其潜在的应用价值。本研究利用底物平板法,获得一株高产胞外淀粉酶的嗜盐细菌X50,通过16S rRNA基因序列分析及系统发育分析,鉴定该菌株为Thalassobacillus属成员。随着人们对嗜盐微生物的研究逐渐增多,目前已获得了大量具有潜在应用前景的新型生物酶[10-12]。Amoozegar等通过对来源于Halobacillussp. strain MA-2菌株的淀粉酶进行研究,发现其最适作用条件为50 ℃和pH 7.5~8.0[13],这与我们报道的菌株X50所产淀粉酶最适条件(40 ℃,pH 6.0)比较接近。然而,金属离子等可以显著影响菌株MA-2所产淀粉酶的活性[13],这一点同我们所分离的菌株X50不同。另外,和MA-2菌株相比,菌株X50所产的胞外淀粉酶可以很好地抵抗酸碱的影响,并具有耐热及耐盐等特点,在高温条件和pH 4.0~12.0的范围内,X50依然保持着较高的酶活性。此前有文献报道嗜盐微生物所产的淀粉酶需要钙离子参与[14-15],但是,本研究结果显示,EDTA并没有降低该淀粉酶的活性,说明其催化活性可能不依赖金属离子的存在。这一点与之前的报道明显不同。本研究发现,PMSF可显著抑制该酶活性,说明该酶结构中存在丝氨酸残基。综合以上实验结果,认为Thalassobacillussp. X50所产胞外淀粉酶与其他微生物淀粉酶相比,存在共性,同时其结构上的某些差异可能使其产生了更稳定的特性。
大量研究表明,由嗜盐微生物产生的各种功能酶可以广泛应用于现代生物工程领域。然而迄今为止,人们对这一方面的研究还不深入,关于嗜盐细菌产淀粉酶的报道相对较少,对嗜盐细菌所产的淀粉酶酶学特性及作用机理的了解还远远不够。因此开发具有产淀粉酶能力的功能性嗜盐微生物,将对其在食品、医药等领域的潜在应用奠定基础。
本研究利用选择CM固体培养基,在运城盐湖黑泥中筛选到一株产胞外淀粉酶的噬盐菌并将其命名为X50。16S rRNA进化树分析显示该菌株为Thalassobacillus属成员,命名为Thalassobacillussp. X50。对其产生的淀粉酶活性进行研究,结果表明该菌株所产淀粉酶具有良好的稳定性,可以耐受较为苛刻的外部条件,在较宽的pH范围,较大的温度变化及金属离子和部分化合物的作用下,可以保持稳定的活性。该嗜盐菌株X50的分类鉴定和粗酶活性分析可以为运城盐湖的生物资源开发提供参考。
[1] Van der Maarel MJ, van der Veen B, Uitdehaag JC, et al. Properties and applications of starch-converting enzymes of the α-amylase family[J]. Biotechnol, 2002, 94(2): 137-155.
[2] Sivaramakrishnan S, Gangadharan D, Nampoothiri KM, et al. α-Amylases from microbial sources-an overview on recent developments[J]. Food Technol Biotechnol, 2006, 44(2): 173-184.
[3] Ventosa A, Nieto JJ, Oren A. Biology of moderately halophilic aerobic bacteria[J]. Microbiol Mol Biol Rev, 1998, 62(2): 504-544.
[4] 罗志刚, 杨景峰, 罗发兴. α-淀粉酶的性质及应用[J]. 食品研究与开发, 2007, 28(8): 163-167.
[5] Karbalaei-Heidari HR, Amoozegar MA, Hajighasemi M, et al. Production, optimization and purification of a novel extracellular protease from the moderately halophilic bacteriumHalobacilluskarajensis[J]. J Ind Microbiol Biotechnol, 2009, 36(1): 21-27.
[6] Antranikian G. Extreme environments as a resource for microorganisms and novel biocatalysts[J]. Adv Biochem Eng Biotechnol, 2005, 96: 219-262.
[7] 陈绍兴, 刘朝茂, 杨建, 等. 嗜盐古菌Halorubrumsp. CY 的分离、鉴定及胞外淀粉酶特性初步研究[J]. 微生物学通报, 2009, 36(7): 949-955.
[8] Van der Maarel MJ, van der Veen B, Uitdehaag JC, et al. Properties and applications of starch-converting enzymes of the α-amylase family[J]. J Biotechnol,2002, 94(2): 137-155.
[9] Yoon JH, Kang SJ, Jung YT, et al.Halobacilluscampisalissp. nov., containing meso-diaminopimelic acid in the cell-wall peptidoglycan, and emended description of the genusHalobacillus[J]. Int J Syst Evol Microbiol,2007, 57(Pt 9): 2021-2025.

[11] Lv XY, Guo LZ, Song L, et al. Purification and characterization of a novel extracellular carboxylesterase from the moderately halophilic bacteriumThalassobacillussp. strain DF-E4[J]. Ann Microbiol, 2010, 61(2): 281-290.
[12] Karbalaei-Heidari HR, Amoozegar MA, Hajighasemi M, et al. Production, optimization and purification of a novel extracellular protease from the moderately halophilic bacteriumHalobacilluskarajensis[J]. J Ind Microbiol Biotechnol, 2009, 36(1): 21-27.
[13]Amoozegar MA, Malekzadeh F, Khursheed AM. Production of amylase by newly isolated moderate halophile,Halobacillussp. strain MA-2[J]. J Microbiol Methods, 2003, 52(3): 353-359.
[14]Shafieia M, Ziaeea A-A, Amoozegar MA. Purification and biochemical characterization of a novel SDS and surfactant stable, raw starch digesting, and halophilic α-amylase from a moderately halophilic bacterium,Nesterenkoniasp. strain F[J]. Process Biochem, 2010, 45(5): 694-699.
[15] Prakash B, Vidyasagar M, Madhukumar MS, et al. Production, purification, and characterization of two extremely halotolerant, thermostable, and alkali-stable α-amylases fromChromohalobactersp. TVSP101[J]. Process Biochem, 2009, 44(2): 210-215.
Characterization of a Halophilic Bacterium X50 and Analysis of Its Amylase Activity
WANG Chuan-xu, YU Hui-ying, CAO Jian-bin, GAO Wen-geng, LI Xin
(Coll.ofLifeSci.,YunchengUni.,Yuncheng044000)
A halophilic bacterium strain X50 that could produce amylase was isolated from Yuncheng salt lake, and carried out its classification and characterizations, and enzymological properties analysis. The activity of extracellular amylase produced by strain X50 was determined adopting substrate plate method. And studied the effects of different factors on the amylase activity produced by the strain X50. The results of 16S rRNA gene sequence analysis showed that the strain wasThalassobacillus, and named it asThalassobacillussp. X50. The results of initial study on the enzymology of the amylase showed the optimal pH of the amylase was 6.0, and maintained its high activity at fairly wide range of pH at 4.0~12.0, and possessing fairly strong resistance capacity against acid-base. Under salt-free condition, the amylase activity was the strongest, furthermore, it has fine property of heat resistance, even after high temperature treatment. Except for Mg2+that significantly inhibited the amylase, basically no effects of other metal ions on it. PMSF could significantly inhibit its activity, however, the effect of DEPC and EDTA on the amylase activity was not significant, indicated that the center of the enzyme activity contained no metal ion, probably was serine protease. The results of this study provide theoretical foundation and will promote the development and utilization of the extreme microbial resources in Yuncheng salt lake.
halophilic bacterium;Thalassobacillus; classification characterization; amylase; enzymological properties
山西省青年科技研究基金项目(2015021141);运城学院博士启动基金项目(YQ-2016015)
王传旭 男,讲师,博士。研究方向为微生物学。Tel:0359-2508575,E-mail:wangchuanxu1985@163.com
* 通讯作者。男,副教授,博士。研究方向为微生物学。Tel:0359-2508575,E-mail:lixin-eva@163.com
2016-04-11;
2016-06-20
Q939
A
1005-7021(2017)01-0078-05
10.3969/j.issn.1005-7021.2017.01.012
