中国甘薯双生病毒外壳蛋白基因分子变异及遗传多样性分析
2017-04-26张成玲孙厚俊杨冬静赵永强谢逸萍
张成玲,孙厚俊,杨冬静,徐 振,赵永强,谢逸萍
(江苏徐淮地区徐州农业科学研究所, 农业部甘薯生物学与遗传育种重点实验室,江苏 徐州221131)
中国甘薯双生病毒外壳蛋白基因分子变异及遗传多样性分析
张成玲,孙厚俊,杨冬静,徐 振,赵永强,谢逸萍*
(江苏徐淮地区徐州农业科学研究所, 农业部甘薯生物学与遗传育种重点实验室,江苏 徐州221131)
甘薯双生病毒是中国甘薯上一类重要病毒,其外壳蛋白(coat protein,CP)基因具有介体传毒、基因包被等多功能。揭示其分子变异,可以为病毒防治及育种工作提供理论依据。利用PCR方法扩增获得了24个甘薯双生病毒分离物的cp基因,采用SDT、DnaSP、RDP3、MEGA等软件对其进行分子变异分析。结果表明:24个分离物核苷酸序列均为765个碱基,一致率为88.3%~100%,编码254个氨基酸,一致率为94.5%~100%。中国甘薯双生病毒分离物系统进化树分为2个组,组I包括大部分分离物及本研究获得的22个分离物,又分为了2个亚组;组Ⅱ含有29个分离物,包括本研究中的XU8_2和XU8_3,这2个分离物与其他分离物可能为不同的种。非同义突变与同义突变比值大于1,说明cp基因处于正向选择即多样化选择。错配分布图除亚组1相对比较平滑外,其余组或亚组分离物均为多峰锯齿状,表明除亚组1种群呈突然暴发的状态外,其他组或亚种群已经存在很长时间,处于动态平衡状态。
甘薯双生病毒;外壳蛋白基因;分子变异;遗传多样性
甘薯双生病毒(Sweetpovirus)可在全球多个国家甘薯种植区发生危害,尤其是甘薯卷叶病毒(Sweetpotatoleafcurlvirus,SPLCV)[1-4],是近几年中国甘薯的一种重要病毒[5]。甘薯双生病毒可引起甘薯叶片上卷、黄化等症状,严重时导致植株矮化,造成甘薯产量损失20%~80%[6]。甘薯双生病毒基因组多为单组分、环状DNA分子,约2.8 kb,编码6个开放阅读框架(ORF),其中,病毒链上2个,分别为V1和V2,互补链上4个,分别为C1、C2、C3和C4。V1开放阅读框编码的蛋白即为病毒的外壳蛋白(coat protein,CP),约为29.4 ku,位于植物细胞核内[7],是多功能蛋白,参与了病毒DNA组分包装、病毒介体传毒及病毒运动等[8-10],常用来进行双生病毒种类鉴定[11]。研究cp基因分子变异及遗传多样性,可以为有针对性地为甘薯双生病毒检测和防治提供理论依据。目前,已有大量有关甘薯双生病毒发生、基因组分子特性分析、抗体制备等的报道[5,12-15]。Reynoso[13]通过在大肠埃希菌中表达SPLCV外壳蛋白,制备了抗体,并利用质谱进行验证。Arkorful等[15-16]通过观察病毒侵染甘薯后的症状,利用不同分级标准和PCR技术检测了SPLCV的发生及危害,并通过茎尖分生组织培养技术获得了甘薯脱毒苗。Zhang等[17]通过滚环PCR方法获得了52个甘薯双生病毒全基因组,分为10个基因型,其中8个基因型50个分离物属于SPLCV;重组分析发现,SPLCV有2个重组热点,分别在复制起始点和C2与C4 2个基因之间。Albuquerque等[18]通过对巴西甘薯双生病毒遗传多样性及重组分析发现,双生病毒的重组热点是在基因间隔区(intergenic region,IR)和C1开放阅读框中间区域,病毒通过重组可产生适应性更强的新病毒种类或株系。
尽管已有大量甘薯双生病毒遗传多样性的报道,但有关中国甘薯双生病毒具体分布及变异情况还不是很清楚,尤其是单个功能基因如cp基因的分子变异研究较少。本试验利用PCR技术扩增了中国甘薯双生病毒分离物的外壳蛋白基因序列,通过一系列分子生物学软件,分析了中国甘薯双生病毒外壳蛋白基因分子变异及遗传多样性,为有针对性地检测和防治甘薯双生病毒提供理论依据。
1 材料与方法
1.1 试验材料
2013—2015年,从江苏徐州甘薯研究中心品种资源库及育种苗床随机采集叶片上卷、黄化、植株矮化等症状的甘薯苗样品。称取1 g叶片组织放到2 mL灭菌离心管中,每个样品称取2~3份,编号后于-80 ℃冰箱保存备用。
根据Genbank登录的序列,设计扩增SPLCV接近全长基因序列的引物,由生工生物(上海)有限公司合成;DNA提取试剂盒,天根生化科技有限公司;TaqDNA聚合酶,宝生物工程(大连)有限公司。
1.2 基因克隆
利用DNA提取试剂盒提取甘薯样品总DNA。以总DNA为模板,利用DNA聚合酶进行PCR扩增。PCR体系50 μL: 10 × PCR buffer 5 μL,2.5 mmol·L-1dNTP Mix 1.5 μL,上下游引物各2 μL,DNA模板2 μL,Taq酶0.5 μL,ddH2O定容到50 μL。PCR反应条件为:94 ℃ 3 min;94 ℃ 1 min,60 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
PCR扩增产物用1%琼脂糖凝胶电泳进行检测,分离回收目的片段,并连接到pMD18-T载体。连接产物转化大肠埃希菌感受态细胞,经蓝白斑筛选,提取质粒并进行PCR鉴定[19]。阳性克隆送生工生物工程(上海)股份有限公司进行核苷酸序列测定,每个分离物选取3~5个重组子进行序列测定,确定其核苷酸序列。
1.3 数据处理
获得的序列利用SDT(http://web.cbio.uct.ac.za/~brejnev/)及DNAMAN软件进行序列比对,获得序列一致率。在NCBI上将获得的序列进行BLAST(http://www.ncbi.nlm.nih.gov/),并下载相关序列,利用重组分析软件RDP3(包含7个软件,分别是RDP、GENECONV、BOOTSCAN、MAXCHI、CHIMAERA、3SEQ及SISCAN)进行重组分析。利用MEGA 6.0(http://www.megasoftware.net)中的最大简约法(maximum likelihood,ML)和邻接法(neighbour-joining,NJ)对中国甘薯双生病毒构建系统进化树,并分组。利用DnaSP软件及Composite maximum-likelihood(CML)法[20-21]进行多态性及选择压力分析,根据ω值(非同义突变dN和同义突变dS的比率dN/dS)判断选择方向,ω>1,说明为正向(多样性)选择,反之,ω<1,为负向(纯化)选择,ω=1,为中性选择。
2 结果与分析
2.1 外壳蛋白基因的克隆
PCR扩增后共获得24个甘薯双生病毒分离物,分别为:XU1-3、XU2-1、XU2-3、XU3-1、XU3-17、XU3-18、XU4-2、XU5-3、XU7-2、XU7-3、XU8-2、XU8-3、XU9-1、XU9-2、XU10-6、XU10-11、XU10-12、XU11-2、XU11-3、XU12-2、XU12-4、XU13-1、XU14-2、XU17-5。其完整的外壳蛋白基因核苷酸长度均为765 bp,编码254个氨基酸。SDT及DNAMAN核苷酸两两比对结果(图1)表明,24个分离物的核苷酸一致率为88.3%~100%;氨基酸一致率为94.5%~100%。其中,XU8_3与XU8_2核苷酸和氨基酸一致率最高,均为100%,XU10_6与XU8_3、XU8_2核苷酸和氨基酸一致率最低,分别为88.3%和94.5%。
24个分离物的氨基酸相对比较保守,254个氨基酸共有22个突变位点,分别为第5位的异亮氨酸I突变为甲硫氨酸M,表示为I5M,以此类推,V6P、S8T、R9P、F11Y、R17I、V51(152)A、M53T、R55(56、57)K、V71(108、152)I、K77T、T83S、G115V、N148T、G150A、S189N(A)、I196V、Q220H。其中152(缬氨酸,V)及189(丝氨酸,S)位氨基酸突变为2种不同氨基酸,分别为异亮氨酸(I)/丙氨酸(A)及天冬氨酸(N)/丙氨酸(A),其余位点均为2种氨基酸之间突变。非极性氨基酸之间突变位点7处,非极性氨基酸与极性氨基酸之间突变位点有7处,极性氨基酸之间突变位点9处。所有的核苷酸变异均是碱基置换,不存在碱基插入/缺失现象。
2.2 甘薯双生病毒外壳蛋白基因重组及系统进化
将NCBI上登录的多个国家和地区的224个及本研究获得24个甘薯双生病毒分离物的外壳蛋白基因,利用RDP软件进行重组分析,结果表明,外壳蛋白基因未发现明确重组,但有3个分离物出现“暂定的”重组位点,有3个软件支持其可能性,且p<10-6,Z>3,3个分离物均为中国分离物,而本研究获得的分离物未发生重组(表1)。
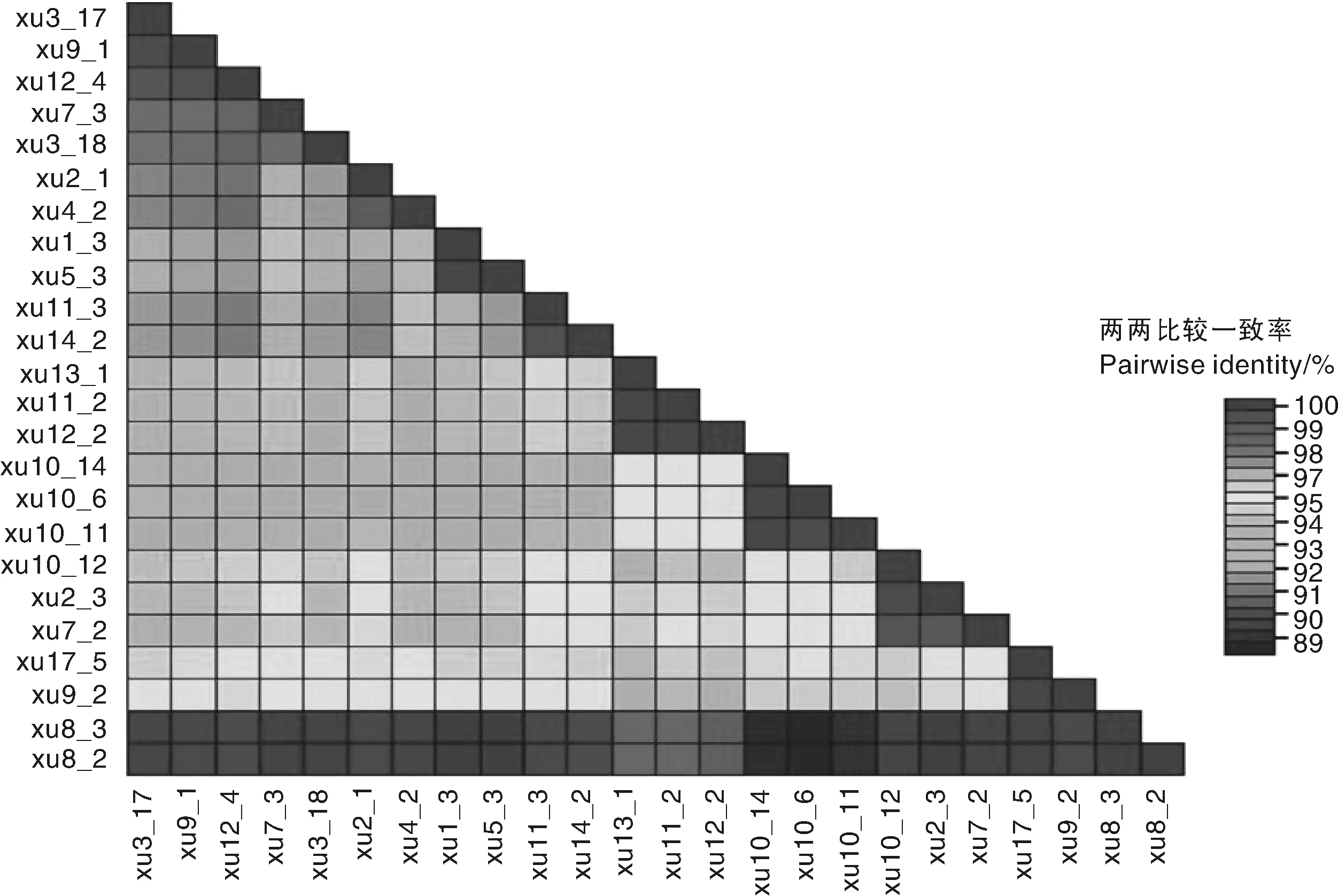
图1 二十四个分离物核苷酸一致率分析Fig.1 Nucleotide sequence identity matrix generated from coat protein gene of 24 isolates
以番茄黄化曲叶病毒(Tomatoyellowleafcurlvirus,TYLCV)外壳蛋白基因为外围,利用MEGA 6.0软件NJ及ML法将中国的101个分离物构建系统进化树。结果显示,甘薯双生病毒中国分离物外壳蛋白基因分为2个组,组Ⅰ和组Ⅱ,其中组Ⅰ分离物包括中国的大部分分离物,本研究获得的分离物有22个属于组Ⅰ。组Ⅰ又分为2个亚组,亚组1和亚组2。组Ⅱ含有29个分离物,来自四川、河南、湖北、江苏及广西等地,本研究仅有XU8_2和XU8_3属于组Ⅱ(图2)。
2.3 甘薯双生病毒中国分离物种群多态性及选择压力分析
为了明确甘薯双生病毒中国分离物外壳蛋白基因的变异及其承受的选择压力,我们计算了ω值。结果表明,该基因dN和dS分别为0.112(标准偏差为0.008)和0.029(标准偏差为0.006),dN/dS为3.86>1,说明该基因处于多样化选择,即正向选择,基因所承受的选择压力大。外壳蛋白基因片段的平均核苷酸距离为0.084(标准偏差为0.006),表明其多样性值较高。
外壳蛋白基因的错配分布结果表明,甘薯双生病毒分离物cp基因的组及亚组错配分布图为多峰锯齿状(图3-A,B,D),表明种群或者亚种群已经存在很长时间,并非新出现的谱系,并且种群长时间处于动态平衡,为低频率的多态性。但亚组1相对比较平滑,有1个单峰,说明该组的甘薯双生病毒种群呈突然暴发的状态(图3-C)。
中性检测结果表明,组Ⅰ及其2个亚组的3个参数Tajima′s D、Fu & Li′s D和Fu & Li′s F均为负值(表2),说明种群或亚种群处于扩张趋势。组Ⅱ分离物的Tajima′s D、Fu & Li′s D和Fu & Li′s F值为正值,说明种群可能处于一个收缩状态或者选择平衡状态,但是P值均大于0.10,因此,结论不确定。所有组和亚组的单倍体标本多样性均≥0.99,核苷酸多样性值低,但是不同的组或亚组之间的核苷酸多样性值不同,组Ⅱ的值最高,亚组1的值最低(表2)。
3 讨论
本研究获得的24个甘薯双生病毒分离物的外壳蛋白核苷酸和氨基酸序列一致率较高,分别在88.3%和94.5%以上。两两核苷酸一致率分析表明,XU8_2和XU8_3分离物与其他分离物的一致率均在90%以下,而其他分离物之间一致率较高,均在90%以上。根据ICTV及最新的分类标准[22],XU8_2和XU8_3可能与其他分离物属于不同的种,可补充与抗原反应差别实验,或扩增其全基因组序列以明确XU8_2和XU8_3的分类地位。甘薯双生病毒中国分离物构建的系统进化树分为2个组,本研究的22个分离物位于组Ⅰ,只有XU8_2和XU8_3分离物位于组Ⅱ。中国各地区分离物在2个组中都有分布,因此,甘薯双生病毒分离物没有明确的地域相关性,可能与种质资源交流频繁及该病毒与种子传毒[23]、粉虱持久性传毒有关。
表1 甘薯双生病毒外壳蛋白基因重组分析
Table 1 Tentative recombination sites and possible parent-like isolates of Sweetpovirus-cp
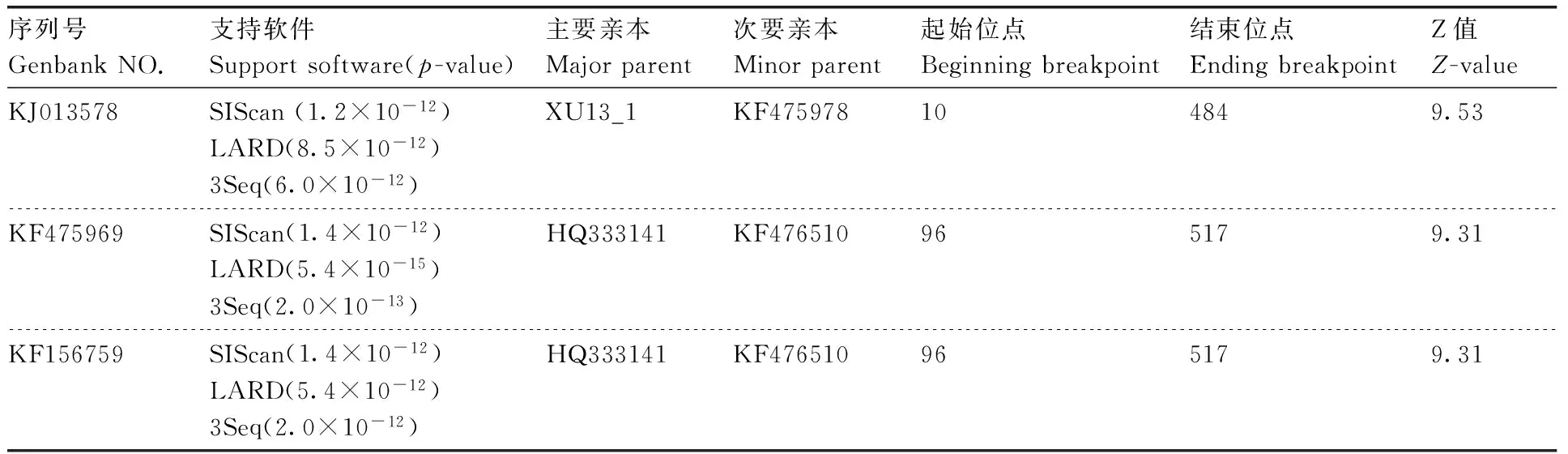
序列号GenbankNO.支持软件Supportsoftware(p-value)主要亲本Majorparent次要亲本Minorparent起始位点Beginningbreakpoint结束位点EndingbreakpointZ值Z-valueKJ013578SIScan(1.2×10-12)LARD(8.5×10-12)3Seq(6.0×10-12)XU13_1KF475978104849.53KF475969SIScan(1.4×10-12)LARD(5.4×10-15)3Seq(2.0×10-13)HQ333141KF476510965179.31KF156759SIScan(1.4×10-12)LARD(5.4×10-12)3Seq(2.0×10-12)HQ333141KF476510965179.31
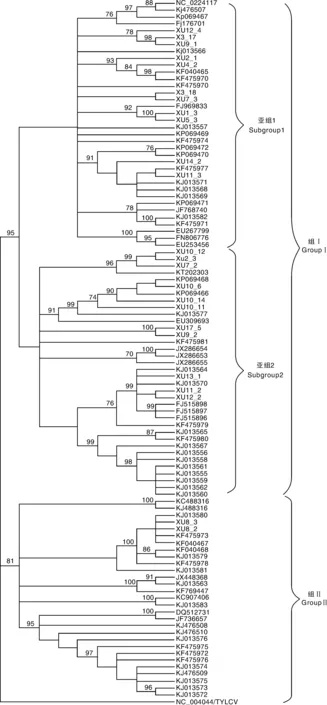
图2 甘薯双生病毒中国分离物cp基因的系统进化树Fig.2 Phylogenetic tree of coat protein genes of Sweetpovirus islated from China
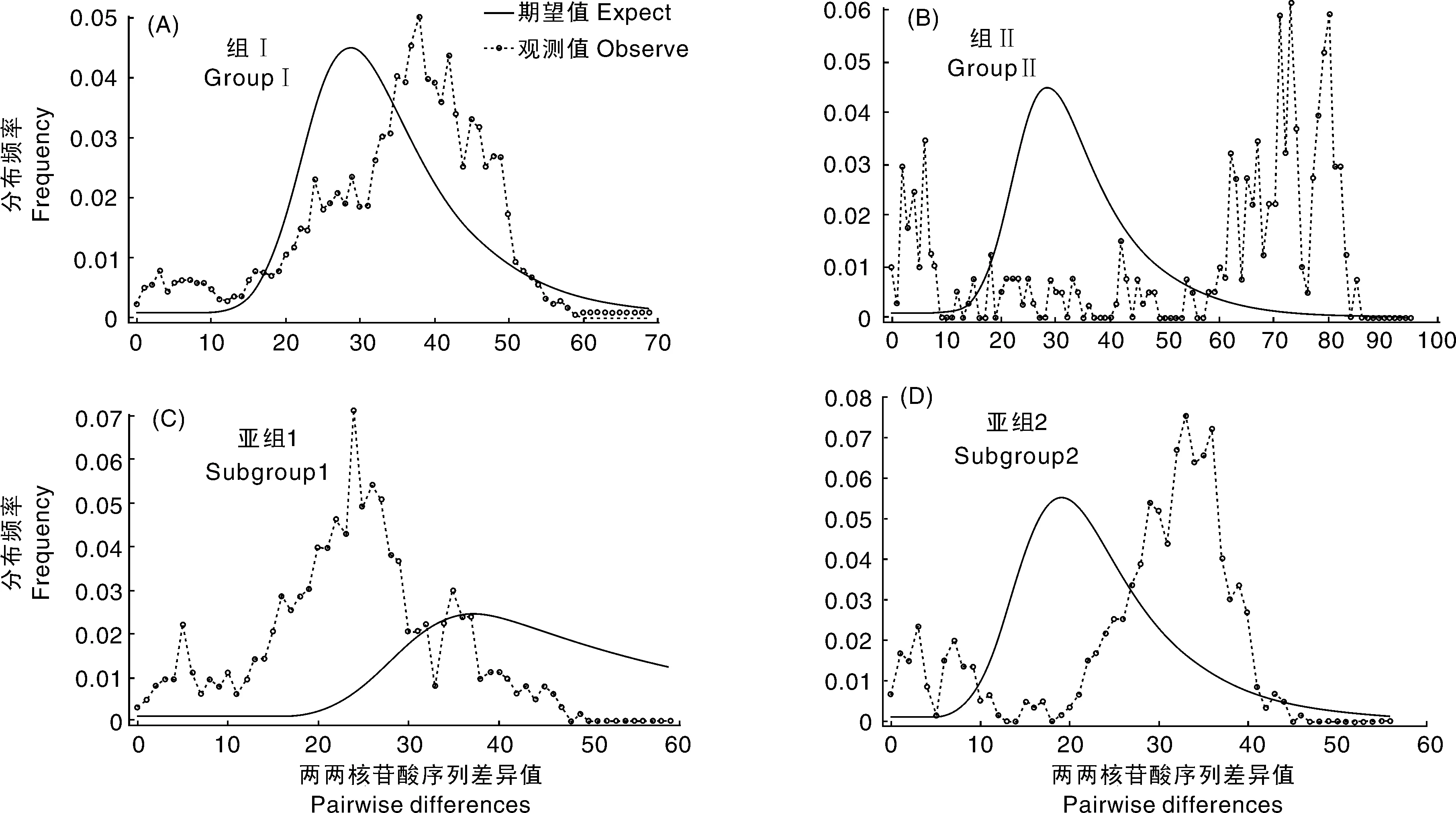
图3 中国甘薯双生病毒分离物组或亚组的核苷酸序列错配分布Fig.3 The frequency distribution of the number of pairwise nucleotide differences for groups or subgroups of Sweetpovirus isolates obtained from China
表2 甘薯双生病毒种群的中性检测、单倍体标本和核苷酸多样性检测
Table 2 Neutrality tests, haplotype and nucleotide diversity of each population of Sweetpovirus
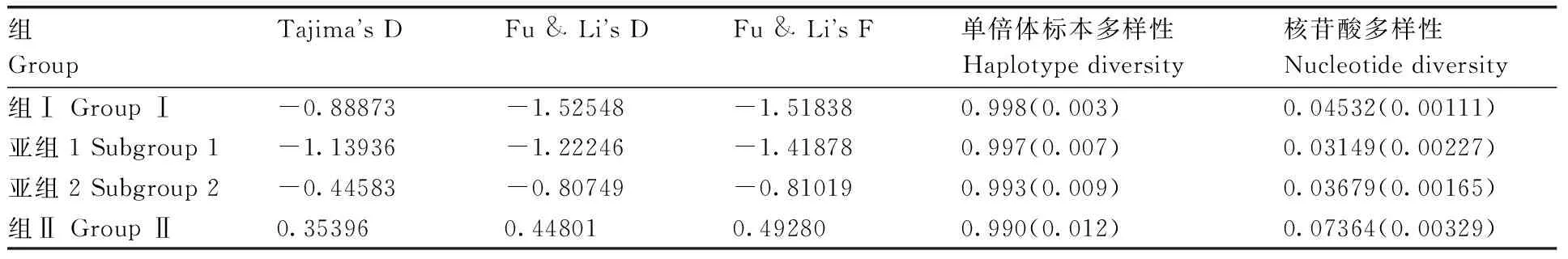
组GroupTajimasDFu&LisDFu&LisF单倍体标本多样性Haplotypediversity核苷酸多样性Nucleotidediversity组ⅠGroupⅠ-0.88873-1.52548-1.518380.998(0.003)0.04532(0.00111)亚组1Subgroup1-1.13936-1.22246-1.418780.997(0.007)0.03149(0.00227)亚组2Subgroup2-0.44583-0.80749-0.810190.993(0.009)0.03679(0.00165)组ⅡGroupⅡ0.353960.448010.492800.990(0.012)0.07364(0.00329)
重组和突变在植物病毒中发生较普遍,是影响病毒变异和进化的主要原因[17,18,24],不同植物病毒的重组热点不同。研究表明,甘薯双生病毒重组热点主要集中在C1/C2/C4及IR区域[17-18]。本研究也表明,外壳蛋白基因区域并非甘薯双生病毒的重组热点,即重组对甘薯双生病毒cp基因分子变异及遗传多样性影响不大。突变才是引起cp基因分子变异的主要原因,氨基酸的非同义突变远大于同义突变,dN/dS大于1,基因所承受的选择压力大,处于正向(多样化)选择。
2006年,Luan等[14]首次报道了甘薯双生病毒SPLCV在中国甘薯上的侵染。本研究表明,甘薯双生病毒在中国甘薯上并不是一种新出现的病毒,而是已经存在较长时间,并且该病毒长时间处于中性平衡模式,地域内的分离物核苷酸多样性高,一直处于扩张状态。这可能是因为SPLCV引起的田间症状表现不明显,随气温升高,植物表现隐症,未引起人们的重视。随着研究的深入,甘薯双生病毒逐渐引起人们的重视。本研究通过分子变异及遗传多样性分析,明确了其变异机制,为针对性地设计防治策略和选育抗病品种提供了理论依据。
[1] LOTRAKUL P, VALVERDE R A, CLARK C A, et al. Detection of a geminivirus infecting sweet potato in the United States [J].PlantDisease, 2007, 82(11): 1253-1257.
[2] BRIDDON R W, BULL S E, BEDFORD I D. Occurrence ofSweetpotatoleafcurlvirusin Sicily [J].PlantPathology, 2006, 55(2): 286-286.
[3] OSAKI T, INOUYE T. Transmission characteristics and cytopathology of a whitefly-transmitted virus isolated from sweet potato leaf curl disease [J].BulletinoftheUniversityofOsakaPrefecture.ser.bAgriculture&Biology, 1991, 43: 11-19.
[4] PARDINA P R, LUQUE A, NOME C, et al. First report ofSweetpotatoleafcurlvirus, infecting sweet potato in Argentina [J].AustralasianPlantDiseaseNotes, 2012, 7(1): 157-160.
[5] 乔贞贞, 秦艳红, 乔奇, 等. 甘薯卷叶病毒江苏分离物基因组全长序列测定及其外壳蛋白基因在大肠杆菌中的表达[J]. 河南农业科学, 2012, 41(4): 86-89. QIAO Z Z, QIAN Y H, QIAO Q, et al. Sequencing ofSweetpotatoleafcurlvirusgenome and expression of coat protein gene inE.coli[J].JournalofHenanAgriculturalSciences, 2012, 41(4): 86-89. (in Chinese with English abstract)
[6] CLARK C A, HOY M W. Effects of common viruses on yield and quality of beauregard sweetpotato in Louisiana [J].PlantDisease, 2006, 90(1): 83-88.
[7] BI H, ZHANG P. Molecular characterization of two sweepoviruses from China and evaluation of the infectivity of cloned SPLCV-JS inNicotianabenthamiana[J].ArchivesofVirology, 2012, 157(3): 441-454.
[8] UNSELD S, FRISCHMUTH T, JESKE H. Short deletions in nuclear targeting sequences ofAfricancassavamosaicviruscoat protein prevent geminivirus twinned particle formation [J].Virology, 2004, 318(1): 90-101.
[9] LIU S, BRIDDON R W, BEDFORD I D, et al. Identification of genes directly and indirectly involved in the insect transmission of African cassava mosaic geminivirus byBemisiatabaci[J].VirusGenes, 1999, 18(1): 5-11.
[10] ROJAS M R, JIANG H, SALATI R, et al. Functional analysis of proteins involved in movement of the monopartite begomovirus,Tomatoyellowleafcurlvirus[J].Virology, 2002, 291(1): 110-125.
[11] 张成玲, 赵永强, 孙厚俊, 等. 甘薯卷叶病毒复制相关蛋白部分基因克隆及分析[J]. 江苏农业学报, 2015, 31(2): 298-303. ZHANG C L, ZHAO Y Q, SUN H J, et al. Cloning and sequence analysis of replication-associated protein partial genes of sweet potato leaf curl virus isolates[J].JiangsuJournalofAgriculturalSciences, 2015, 31(2): 298-303. (in Chinese with English abstract)
[12] FIALLOOLIVÉ E, KATIS N I, NAVASCASTILLO J. First report ofSweetpotatoleafcurlviruson blue morning glory in Greece [J].PlantDisease, 2014, 98(5): 700.
[13] REYNOSO D L G, VALVERDE R A, MURAI N.Sweetpotatoleafcurlvirus: coat protein gene expression in and product identification by mass spectrometry [J].AmericanJournalofPlantSciences, 2015, 6(19): 3013-3024.
[14] LUAN Y S, ZHANG J, LIU D M, et al. Molecular characterization ofsweetpotatoleafcurlvirusisolate from China (SPLCV-CN) and its phylogenetic relationship with other members of the Geminiviridae [J].VirusGenes, 2007, 35(2): 379-385.
[15] ARKORFUL E, APPIAH A S, DZAHINI-OBIATEY H. Screening for sweet potato (IpomoeabatatasL.) leaf curl virus (SPLCV) and its elimination using thermotherapy-meristem tip culture technique [J].TheJournalofAgriculturalSciences, 2015, 10(1): 1-9.
[16] ADDAE-FRIMPOMAAH F. Detection of sweet potato (IpomoeabatatasL.)Leafcurlvirus(SPLCV) in Ghana using visual symptomatology and PCR technique [J].InternationalJournalofPlantBreedingandGenetics, 2015, 9 (3): 106-115.
[17] ZHANG S C, LING K S. Genetic diversity of sweet potato begomoviruses in the United States and identification of a natural recombinant betweensweetpotatoleafcurlvirusand sweet potato leaf curl Georgia virus [J].ArchivesofVirology, 2011, 156(6): 955-968.
[18] ALBUQUERQUE L C, INOUENAGATA A K, PINHEIRO B, et al. Genetic diversity and recombination analysis of sweepoviruses from Brazil [J].VirologyJournal, 2012, 9(1): 241.
[19] SAMBROOK J, RUSSEL D W, 分子克隆实验指南(上、下册)[M]. 3版.黄培堂, 译. 北京: 科学出版社, 2002: 492-509.
[20] TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J].MolecularBiologyandEvolution, 2007, 24(8): 1596-1599.
[21] ROZAS J, S
NCHEZ-DELBARRIO J C, MESSEGUER X, et al. DnaSP, DNA polymorphism analyses by the coalescent and other methods [J].Bioinformatics, 2003, 19(18): 2496-2497.
[22] ADAMS M J, KING A M Q, CARSTENS E B. Ratification vote on taxonomic proposals to the International Committee on Taxonomy of Viruses (2013) [J].ArchivesofVirology, 2009, 154(7):1181-1188.
[23] KIM J, KIL E, KIM S, et al. Seed transmission ofSweetpotatoleafcurlvirusin sweet potato (Ipomoeabatatas) [J].PlantPathology, 2015, 64(6): 1284-1291.
[24] ROOSSINCK M J. Mechanisms of plant virus evolution [J].AnnualReviewofPhytopathology, 1997, 35(35): 191.
(责任编辑 侯春晓)
Molecular variation and genetic diversity analysis of coat protein gene in Sweetpoviruses in China
ZHANG Chengling, SUN Houjun, YANG Dongjing, XU Zhen, ZHAO Yongqiang, XIE Yiping*
(XuzhouInstituteofAgriculturalSciencesinJiangsuXuhuaiArea,KeylaboratoryofBiologyandGeneticImprovementofSweetpotato,MinistryofAgriculture,Xuzhou221131,China)
The objectives of this study were to study the gene and gene variation of Sweetpoviruses infectingIpomoeabatatasin China. Sweetpovirus coat protein gene fragments of 24 isolates from sweet potato were amplified by PCR using the infected leaf samples randomly collected from sweet potato research center and SDT, DnaSP, RDP3, MEGA and other software were used to analysis testifies. The result showed that, the nucleotide sequences and amino acid sequences showed similarieties of 88.3%-100% and 94.5%-100%, respectively for the 24 isolates containing 765 base pairs and 254 amino acids. Phylogenetic trees constructed with all Chinese isolates revealed that the isolates were divided into 2 groups. Group I included most of the isolates collected from China, and 22 isolates obtained in this study, and divided into 2 subgroups. Group Ⅱ included only 27 isolates from Genbank and 2 isolates, XU8_2 and XU8_3 obtained in this study, so these 2 isolates might be new species. The ratio between mutations in the nonsynonymous and synonymous sites (dN/dSratio) ofcpwas>1, implying the coat protein gene was under positive selection. The shapes of mismatch distribution of Sweetpoviruses for all groups and subgroups except subgroup I were multimodal and ragged, indicating that all these population/subpopulations were long-existing ones.
Sweetpovirus; coat protein gene; molecular variation; genetic diversity
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.14
2016-11-28
江苏省自然科学基金(BK20140230);国家甘薯产业技术体系北方病害岗位专家项目(CARS-11-B-09)
张成玲(1983—),女,山东淄博人,副研究员,博士,主要从事甘薯病虫害研究。E-mail:zhchling5291@163.com
*通信作者,谢逸萍,E-mail:xieyiping6216@163.com
S432.4+1
A
1004-1524(2017)04-0611-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 611-617
张成玲, 孙厚俊, 杨冬静, 等. 中国甘薯双生病毒外壳蛋白基因分子变异及遗传多样性分析[J]. 浙江农业学报, 2017, 29(4): 611-617.
