通过外源氢气固定二氧化碳提纯沼气技术的研究进展
2017-04-20汪昱昌江皓郝文川丁江涛李叶青周
汪昱昌+江皓+郝文川+丁江涛+李叶青+周红军
摘要:指出了厌氧发酵甲烷化过程中存在两条甲烷生成路径:以乙酸为底物的食酸产甲烷路径及以二氧化碳和氢气为底物的食氢产甲烷路径。有研究表明,沼气中仅30%的甲烷通过食氢路径生成,通常厌氧发酵过程中氢气不易检测到,因此氢不足很可能是造成该路径贡献小的重要原因,引入外源氢气可以在一定程度上解决这个问题。综述了通过外源氢气提纯沼气的技术原理、国内外研究进展以及氢气的引入对于整个厌氧发酵过程的影响,以期为沼气提纯技术的发展及拓展研究思路提供参考。
关键词:厌氧发酵;外源氢气;二氧化碳;沼气提纯
中图分类号:S216.4
文献标识码:A 文章编号:1674-9944(2017)6-0149-04
1 引言
中国经济的高速增长和快速发展,使得能源需求和环境保护压力日益增加。国家统计局2011年发布的报告显示,2010年全国共产生8.27亿t农作物秸秆(其中大米、玉米以及小麦占71.1%)以及36亿t畜禽粪便[1,2]。如果采取传统的处理方式,在对资源造成极大浪费的同时,耗费大量能源。有机质厌氧发酵生产沼气这一产业作为目前可再生资源的重要组成部分之一,对于治理环境,缓解能源压力,提高经济效益都有着重要的意义。
厌氧发酵工艺能够对有机废弃物进行有效处理并生产生物能源,已被广泛应用于世界各个国家。沼气中一般含有50%~70% CH4,30%~50% CO2,少量的水和H2S等成分[3]。CO2作为存在于沼气中的惰性气体,会降低沼气的能量,阻碍其成为可再生天然气并入现存的天然气管网设施。当沼气中的CO2的含量为30%~50% 时,其能量密度较低,仅为18~23 MJ/m3,而天然气的能量密度约为37 MJ/m3[4]。
为了克服沼气热值低的问题,研究者提出3种沼气提纯途径使其品质达到可再生天然气标准:①通过后续处理技术将CO2从沼气中脱除[5,6];②通过后续处理技术将CO2转化为CH4[7];③通过向有机废弃物厌氧消化池中引入其他基质(如氢气)将CO2原位转化为CH4[8-10]。不同的国家对于生物甲烷入网及作车用燃料的标准不同,例如丹麦要求天然气中CO2的含量最高不得超过2.5 mol%,而瑞典要求CH4的纯度必须高于95%[11]。对于第一种提纯策略,可以采用物理吸收法、化学吸收法、变压吸附法、膜分离法、低温分离法等[12]去除CO2。遗憾的是这些方法存在投资高或CH4损失大的缺点,削弱了提纯沼气作为生物燃气的竞争力[13]。策略②和③都是通过转化CO2达到提纯沼气的目的,可以避免上述问题的发生。近年来越来越多的学者开始研究利用外源H2固定系统中内源CO2,以此来提高沼气中CH4含量。本文将对这些研究工作进行整理,介绍该技术的原理、方法以及最终取得的结果,并对这个方向的研究前景进行展望。
2 利用外源氢气强化产甲烷过程原理
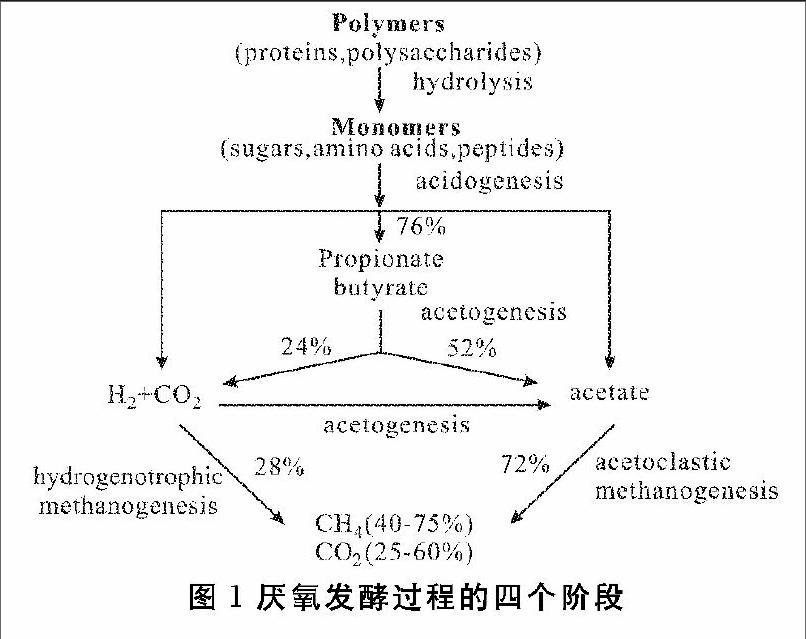
厌氧发酵通常包括4个阶段:水解、酸化、乙酸化和甲烷化。如图1所示,在乙酸化和乙酸营养型甲烷化的过程中会产生部分CO2,而这些CO2可以被氢营养型产甲烷菌利用,通过氢营养型甲烷化转化成CH4[14]。
从反应方程式来看,H2与CO2按照4∶1的比例进行反应,生成的气相产物中只有CH4,如果能加强这一反应路径,沼气的质量能在很大程度上得到改善。然而在实际情况中,由此路径生成的甲烷比例不足30%[15]。由于在沼气中通常不易检测到H2的存在,因此氢不足被认为是该反应的主要限制性因素[16]。通过向发酵罐中通入H2,可以解决这个问题。H2作为一种清洁能源,其较低的分子质量导致其体积能量密度仅为10.88 MJ/m3,远低于 CH4的 36 MJ/m3[3]。与其同时,H2在储存和运输方面还存在诸多问题尚待解决。相较于H2,CH4的运输可利用现有的天然气管网,且因具有较高的沸点和能量密度,所以储存成本仅为H2的1/3[17]。目前工业制氢主要是化石燃料的热分解,包括天然气重整、碳氢化合物的部分氧化和煤汽化等[18,19],利用过剩的风力发电进行电解水也是获取氢源的有效途径之一[20]。在厌氧发酵过程中通入外源H2,在消耗CO2的同时,增加沼气中甲烷的浓度,使其达到生物燃气的标准,并入现有的天然气管网中,具有经济可行性。除此之外,研究者发现,沼气中混有少量未被完全转化的H2(5~30%),可以提高沼气的燃烧性能[21]。综上,向厌氧发酵体系中通入H2,可以在一定程度上缓解发酵工艺中存在的产气速率低和甲烷浓度低的“两低”问题[13]。
3 利用外源氢气强化产甲烷过程研究现状
近年来,Angelidaki 课题组以牛粪作为发酵底物,在这一领域进行了一系列探索性的研究,证明利用外源氢气强化产甲烷过程的可行性[3,8~10,23]。首先,采用批式实验研究不同氢分压(0.25、0.5、1 atm)以及混合强度(100、300 r/min)对于H2消耗率和CH4生成速率的影响[3]。当混合强度为100 r/min, H2在水中较差的溶解性使得此时气液传质阻力较大,导致气液传质成为整个过程的控制步骤,H2消耗率随着氢分压的减少而下降。而当混合强度增加至300 r/min,不同氢分压下的H2消耗率均为常数,气液传质不再是整个过程的控制步骤。为了进一步考察H2引入对于整个发酵体系的影响,实验人员采用连续通氢的方式,利用全混合厌氧反应器(continuous stirred tank reactor)在高温条件(55℃)下进行实验。实验组(Reactor A)沼气成分中依然存在20±2.5% H2,说明在反应过程中仍然存在气液传质限制,但是CO2的含量(15±2.1%)較对照组(38±3.2%)有显著下降,该结果表明了利用氢气提纯沼气的可行性。对反应器的液相性质进行监测,结果显示实验组中VFA浓度普遍高于对照组,应当注意H2的引入很可能会对VFA降解造成抑制。因为丙酸和丁酸的降解都是自由能升高的反应,只有当溶液中的H2浓度足够低该反应才是热力学可行。鉴于此,Angelidaki 课题组探究了氢分压对于VFA降解的的影响。实验结果显示当气液传质为发酵过程的控制因素时,即使高达1 atm的氢分压也不会对VFA的降解造成抑制,然而当混合强度增加,高的氢分压会对丙酸和丁酸的降解造成明显的抑制。因此如何在避免VFA降解抑制的同时提高氢气消耗率是科学家近期研究的重点。与此同时,作者认为氢气的消耗速率过快会导致发酵液中碳酸氢盐的大量消耗来不及补充,从而使得体系的pH增加,对产甲烷菌的生长造成抑制最终影响产气情况。
根据以上实验结果,可以得出H2较低的气液传质效率以及有机酸的积累是利用外源H2提纯升级沼气的主要限制因素,而pH值的升高则会对体系稳定性造成影响。对此,课题组采用牛粪与乳清共发酵的方法[9],控制系统pH<8,使得沼液中乙酸和丙酸的浓度较之前牛粪单一发酵体系有了明显下降。并且作者认为,溶解在液相中的H2如果能在很短的时间内被微生物利用,使得沼液中H2含量维持在一个较低的水平,依然可以保证VFA的降解不受抑制。通过计算反应器在不同阶段的氢气溶解度,可以发现ΔG均低于-30 KJ/mol,因此反应能够正常进行。另一方面,作者认为氢气转化成甲烷这一过程很可能发生在微生物絮凝表面,而丙酸是在其中心脱羧酸,因此不会受到氢分压升高的影响。为了削弱H2气液传质的限制,课题组利用中空纤维膜(hollow fiber membrane)组件进行实验[10]。当H2流率从930 mL(L/d) 增加到1440 mL (L/d) ,CH4含量由78.4% 增加至90.2%,当H2流率为1760 mL (L/d), 甲烷含量达到最高值96.1%。结果还显示负载在纤维膜上的生物会增加H2向沼液扩散的阻力从而对甲烷化过程有消极影响。除此之外,Díaz[24]等也利用HFM对H2和CO2进行生物转化,在一定条件下二者的转化率能达到95%,沼气中CH4含量可以提高至95%。
Martin等[11]利用单一食氢产甲烷优势菌种Methanothermobacter thermautotrophicus考察了以下四种情况下外源氢气的引入对于CO2转化为CH4的影响:①通入H2和CO2混合气;②在①的基础上进行加压操作;③在混合气中加入CH4;④通入未经处理的沼气和H2。在实验①中,CH4的容积产气率(volumetric methane production rate)随着H2通入量的增加而上升,当H2通入量为0.8 L/min时,VMPR达到最大值47.9 L/(L·d),之后随着氢通量的增加VMPR开始下降。造成此现象的原因可能是H2停留时间的减少使H2的传质效率成为反应的限制性因素,因此单纯的增加氢气的通入量并不能持续增加VMPR。鉴于以上结果,通过改变反应器内部压力,使其从101 kPa增加至122 kPa,以此来提高氢分压,此时VMPR达到本项研究中的最高值65.6 L/(L·d),因此加压的确能在一定程度上改善H2的气液传质限制。实验3采用含有CH4的混合气探究CH4对VMPR的影响,在氢通量为1.6 L/min的条件下,以0.4 L/min的流率通入CH4,VMPR由最大值50.5 L/(L·d) 降至16.9 L/(L·d),下降幅度最大,约为47%。此时原料气中CH4所占比例最低仅为17%,因此VMPR的下降并非由反应过程中CH4产物抑制造成,其很大程度上是由于CH4的引入降低了氢分压,导致H2传质效率的降低从而影响反应进行。实验4将未经处理的含有70% CH4和30% CO2的沼气和氢气按一定比例通入反应器中,氢通量为0.2 L/min,前5 d的VMPR达到21.4 L/(L·d),H2的转化率为89.1%。
北京建筑工程学院郝晓地课题组提出利用铁腐蚀析氢强化甲烷产率[14]。相较于普通的废弃铁片,纳米零价铁(nano-scale zero-valent iron)因具有较高的表面积和反应活性,在相同厌氧发酵条件下腐蚀后可析出更多的H2用于转化发酵过程中产生的CO2。相较于对照组(NZVI添加量为0),当NZVI添加量为0.5 g和1.0 g, 沼气中CH4含量分别提高27.5% 和37.4%,相对应的甲烷产量也增加42.3% 和60.5%。在整个实验过程中,添加的铁没有对发酵产生任何负面影响,同时因铁腐蚀而产生的Fe2+ 对存在于厌氧发酵上清液中的磷有很好的移除作用。
3Fe2+(l)+2PO3-4(l)Fe3(PO4)2(s)
Bukhardt等[25,26]利用固定有氢营养型产甲烷菌生物膜的滴流床反应器,研究CO2 和H2在三相厌氧发酵系统中的甲烷化作用。研究人员将H2和CO2按4∶1从反应器底部连续的通入,被生物膜上的氢营养型产甲烷菌捕获并转化,整个过程相当于平推流反应器,设置停留时间为4 h。实验结果表明反应过程中无需进行气体回流,沼气中CH4含量最高可达98 vol%,H2转化率受到H2流率和液体流率的双重影响。
Bassani等[27]利用2个CSTR反应器研究氢气对沼气的提纯作用。沼气在反应器1中产生后与H2一起直接通入到反应器2中。实验结果显示经反应器2加氢提纯后,中温条件下99%的H2被食氢产甲烷菌利用,使69%的CO2转化生成CH4,高温条件下这两个值分别为92%和77%。因此尽管高温条件下,H2的利用率较低,但CO2却表现出更高的转化率,其甲烷产量和产率也相对较高。
4 氢气对微生物群落结构的影响
Angelidaki 课题组对中温及高温条件下经H2驯化后的古菌群落进行变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis)测试[8],探究氢气对于微生物群落结构的影响。测序结果显示,中温及高温条件下接种物中的古菌均隸属于氢营养型产甲烷菌和乙酸营养型产甲烷菌,但是随着长时间的富集培养,微生物的群落结构会发生改变,在两种温度条件下都可观察到属于Methanobacteriales的微生物有明显的富集,其被认为与氢营养型产甲烷过程有关[28]。与该过程相关的微生物还包括Methanococcales、 Methanomicrobiales以及 Methanosarcinales[28],但是在此次富集培养中并未检测到。
在牛粪与乳清共发酵过程中[9],与Methanothermobacter thermautotrophicus相似性达到98%的DGGE条带仅在含氢的反应器中出现,在对照组中并未被检测到。图谱中相同的基因条带在不同的反应器中其亮度也存在差异,说明H2的添加还可能会对微生物的丰富度造成影响。
根据Bassani等[27]的研究,氢气的引入会使Methanoculleus作为优势种的古菌群落丰富度有显著的增加,这一點印证了Angelidaki 课题组的结论。与此同时氢营养型产甲烷菌的富集以及乙酸营养型产甲烷菌的减少都表明氢气的引入使产甲烷路径向食氢型转变。
在利用HMF对焦炉煤气模拟气(simulated coke oven gas)进行生物甲烷化处理过程中[29], Spirochaetes 和Treponema都有不同程度的富集。Spirochaetes曾被认为能够从碳水化合物或者氨基酸的发酵过程中获取能量[30],而本实验的结果说明此类细菌很可能还与H2和CO的转化有关。Treponema 的作用类似于同型产乙酸菌[31],它的富集说明实验中的H2可能并非被氢营养型产甲烷菌直接利用,而是通过同型产乙酸菌和乙酸营养型产甲烷菌共同作用进行转化。Methanosaeta作为一种食酸产甲烷菌[28],更适应低乙酸浓度,不能在高浓度的氨和硫化物下生存。随着SCOG的引入,Methanosaeta在群落中的主导地位开始削弱,与氢气利用有关的Methanoculleus则成为优势种。
5 结语
尽管厌氧发酵工艺已经被较为广泛的应用,但是厌氧发酵过程中产气速率低和甲烷含量低的“两低”问题依然没有得到很好地解决。利用H2转化沼气中的CO2对沼气进行原位升级纯化在一定程度上解决了这两个问题,但是目前的技术都使用了高强度的机械搅拌,这一点在工业化应用中并不适用。如何经济的提高H2气液传质效率是我们今后应该研究的重点。除此之外,能否获取廉价氢源也决定了该技术是否具有经济可行性。
参考文献:
[1]Wei Geng,Lin Hu,Jianyu Cui,et al. Biogas energy potential for livestock manure and gross control of animal feeding in region level of China[J]. Transactions of the Chinese Society of Agricultural Engineering,2013,29(1): 171~179.
[2]JT Ma. National Bureau of Statistics of China. China Statistical Yearbook[M].Beijing: China Statistics Press,2010.
[3]Gang Luo,Sara Johansson,Kanokwan Boe,et al. Simultaneous hydrogen utilization and in situ biogas upgrading in an anaerobic reactor[J]. Biotechnology and Bioengineering,2012,109(4): 1088~1094.
[4]Martina P?schl,Shane Ward,Philip Owende. Evaluation of energy efficiency of various biogas production and utilization pathways[J]. Applied Energy,2010,87(11): 3305~3321.
[5]A. Molino,M. Migliori,Y. Ding,et al. Biogas upgrading via membrane process: Modelling of pilot plant scale and the end uses for the grid injection[J]. Fuel,2013(107): 585~592.
[6]Pinghai Shao,Mauro Dal-Cin,Ashwani Kumar,et al. Design and economics of a hybrid membrane–temperature swing adsorption process for upgrading biogas[J]. Journal of Membrane Science,2012,413~414: 17~28.
[7]S. Kent Hoekman,Amber Broch,Curtis Robbins,et al. CO2 recycling by reaction with renewably-generated hydrogen[J]. International Journal of Greenhouse Gas Control,2010,4(1): 44~50.
[8]Gang Luo,Irini Angelidaki. Integrated biogas upgrading and hydrogen utilization in an anaerobic reactor containing enriched hydrogenotrophic methanogenic culture[J]. Biotechnology and Bioengineering,2012,109(11): 2729~2736.
[9]Gang Luo,Irini Angelidaki. Co-digestion of manure and whey for in situ biogas upgrading by the addition of H2: process performance and microbial insights[J]. Applied Microbiology and Biotechnology,2013,97(3): 1373~1381.
[10]Gang Luo,Irini Angelidaki. Hollow fiber membrane based H2 diffusion for efficient in situ biogas upgrading in an anaerobic reactor[J]. Applied Microbiology and Biotechnology,2013,97(8): 3739~3744.
[11]Matthew R. Martin,Jeffrey J. Fornero,Rebecca Stark,et al. A Single-Culture Bioprocess of Methanothermobacter thermautotrophicus to Upgrade Digester Biogas by CO(2)-to-CH(4) Conversion with H(2)[J]. Archaea,2013,2013: 157529.
[12]江 皓,吳全贵,周红军. 沼气净化提纯制生物甲烷技术与应用[J]. 中国沼气,2012,(02): 6~11+19.
[13]涂 睿,黎 军. 利用外源氢气纯化升级沼气的研究进展[J]. CIESC Journal,2014,65
[14]Yuansheng Hu,Xiaodi Hao,Dan Zhao,et al. Enhancing the CH4 yield of anaerobic digestion via endogenous CO2 fixation by exogenous H2[J]. Chemosphere,2015(140): 34~39.
[15]Peter Weiland. Biogas production: current state and perspectives[J]. Applied Microbiology and Biotechnology,2010,85(4): 849~860.
[16]Zoltán Bagi,Norbert ?cs,Balázs Bálint,et al. Biotechnological intensification of biogas production[J]. Applied Microbiology and Biotechnology,2007,76(2): 473~482.
[17]Mustafa Balat. Potential importance of hydrogen as a future solution to environmental and transportation problems[J]. International Journal of Hydrogen Energy,2008,33(15): 4013~4029.
[18]Rashmi Chaubey,Satanand Sahu,Olusola O. James,et al. A review on development of industrial processes and emerging techniques for production of hydrogen from renewable and sustainable sources[J]. Renewable and Sustainable Energy Reviews,2013(23): 443~462.
[19]张 轲,刘述丽,刘明明,等. 氢能的研究进展[J]. 材料导报,2011(9): 116~119.
[20]S. A. Sherif,F. Barbir,T. N. Veziroglu. Wind energy and the hydrogen economy—review of the technology[J]. Solar Energy,2005,78(5): 647~660.
[21]S. Orhan Akansu,Zafer Dulger,Nafiz Kahraman,et al. Internal combustion engines fueled by natural gas—hydrogen mixtures[J]. International Journal of Hydrogen Energy,2004,29(14): 1527~1539.
[22]Ranbin Liu,Xiaodi Hao,Yuansheng Hu. Comments on “Reduction in carbon dioxide and production of methane by biological reaction in the electronics industry” by Kim et al.,International Journal of Hydrogen Energy 2013;38:3488–3496[J]. International Journal of Hydrogen Energy,2013,38(31): 13842~13844.
[23]Ilaria Bassani,Panagiotis G. Kougias,Laura Treu,et al. Biogas Upgrading via Hydrogenotrophic Methanogenesis in Two-Stage Continuous Stirred Tank Reactors at Mesophilic and Thermophilic Conditions[J]. Environmental Science & Technology,2015,
[24]I. Díaz,C. Pérez,N. Alfaro,et al. A feasibility study on the bioconversion of CO2 and H2 to biomethane by gas sparging through polymeric membranes[J]. Bioresource Technology,2015,185(0): 246~253.
[25]M Burkhardt,T Koschack,G Busch. Biocatalytic methanation of hydrogen and carbon dioxide in an anaerobic three-phase system[J]. Bioresource Technology,2015,178(0): 330~333.
[26]Marko Burkhardt,Günter Busch. Methanation of hydrogen and carbon dioxide[J]. Applied Energy,2013,111(0): 74~79.
[27]Ilaria Bassani,Panagiotis G. Kougias,Laura Treu,et al. Biogas Upgrading via Hydrogenotrophic Methanogenesis in Two-Stage Continuous Stirred Tank Reactors at Mesophilic and Thermophilic Conditions[J]. Environmental Science & Technology,2015,49(20): 12585~12593.
[28]D. Karakashev,D. J. Batstone,I. Angelidaki. Influence of environmental conditions on methanogenic compositions in anaerobic biogas reactors[J]. Appl Environ Microbiol,2005,71(1): 331~8.
[29]Wen Wang,Li Xie,Gang Luo,et al. Performance and microbial community analysis of the anaerobic reactor with coke oven gas biomethanation and in situ biogas upgrading[J]. Bioresource Technology,2013,146(0): 234~239.
[30]Céline Delbès,René Moletta,Jean-Jacques Godon. Monitoring of activity dynamics of an anaerobic digester bacterial community using 16S rRNA polymerase chain reaction–single-strand conformation polymorphism analysis[J]. Environmental Microbiology,2000,2(5): 506~515.
[31]H. Zhang,J. E. Banaszak,P. Parameswaran,et al. Focused-Pulsed sludge pre-treatment increases the bacterial diversity and relative abundance of acetoclastic methanogens in a full-scale anaerobic digester[J]. Water Res,2009,43(18): 4517~26.
