哈巴苷在大鼠体内代谢产物的鉴定与分析Δ
2017-04-19王静哲刘广学尚明英蔡少青北京大学药学院北京100191
刘 震,徐 风,王静哲,刘广学,尚明英,蔡少青(北京大学药学院,北京 100191)
·实验研究·
哈巴苷在大鼠体内代谢产物的鉴定与分析Δ
刘 震*,徐 风,王静哲,刘广学,尚明英#,蔡少青(北京大学药学院,北京 100191)
目的:研究玄参活性成分哈巴苷在大鼠体内的代谢产物及其分布、代谢类型和其可能的活性。方法:4只SD大鼠随机分为空白组(超纯水)和给药组(哈巴苷对照品溶液),每组2只,ig给药,160 mg/kg,每日2次,连用3 d。于给药前及首次给药后每12 h收集各组大鼠尿液和粪便,最后1次给药后0.5、1 h穿心取血8 mL并取出心、肝、脾、肺、肾、胃和小肠等组织,分别制备血液、尿液、粪便及各组织样品溶液。采用高效液相色谱-质谱联用法检测和鉴定哈巴苷在大鼠体内的代谢产物并推测其代谢途径,采用Pharm Mapper软件预测代谢产物活性。结果:从大鼠体内鉴定出哈巴苷代谢产物12种,其原型及代谢产物主要分布在心、肝、脾、肺、肾、胃和小肠中,其代谢类型主要包括水解、脱水、还原、甲基化、硫酸酯化、葡萄糖醛酸结合、一级香豆酸结合等。12种化合物可能具有治疗癫痫、肌萎缩侧索硬化、糖尿病、脑中风等活性。结论:哈巴苷可能是以原型和代谢产物的形式发挥药效的。本研究为归属玄参体内代谢产物来源、研究玄参显效形式、阐明玄参药理作用机制和炮制机制提供了依据。
玄参;哈巴苷;液质联用;代谢产物;代谢途径;活性
玄参为我国传统常用中药材,为玄参科植物玄参Scrophularia ningpoensis Hemsl.的干燥根,具有清热凉血、滋阴降火、解毒散结之功效[1]。现代药理学研究表明,玄参具有抗炎[2]、免疫调节[3]、神经保护[4]和抗脑缺血等活性[5]。环烯醚萜类化合物为玄参中重要的化学成分类型,其中哈巴苷是玄参主要的环烯醚萜苷类成分之一。大量研究表明,哈巴苷的药理活性与玄参传统功效相关,哈巴苷可促进脾淋巴细胞-刀豆蛋白A诱导的增殖反应[6],具有神经保护作用[7]和抑制血小板凝聚作用[8]。据文献报道,传统的产地加工和炮制手段可降低玄参中的哈巴俄苷含量[9],升高哈巴苷含量[10]。2015年版《中国药典》(一部)规定玄参中哈巴俄苷和哈巴苷的总含量不得少于0.45%[1]。因此,进行哈巴苷的体内代谢研究有助于阐明其代谢产物及其分布、代谢途径以及代谢产物可能的活性,揭示其体内存在形式和发挥药效的机制,为归属玄参体内代谢产物来源、阐明药理作用机制和炮制机制提供依据。
1 材料
1.1 仪器
高效液相色谱-离子阱-飞行时间质谱联用(HPLCESI-IT-TOF-MS)仪,包含2个LC-20AD输液泵、1个LC-20AB输液泵、CBM-20A系统控制器、脱气单元DGU-20A3、可制冷自动进样器SIL-20AC、柱温箱CTO-20A、二极管阵列检测器SPD-M20A、ESI离子源、ESIIT-TOF-MS系统(日本Shimadzu公司);BP211D十万分之一电子天平(德国Sartorius公司)。
1.2 药材与试剂
哈巴苷对照品(成都曼思特生物科技有限公司,批号:15031605,纯度:>98.00%);甲醇、乙腈均为色谱纯;水为超纯水。
1.3 动物
清洁级SD大鼠4只,♂,体质量200~250 g,购于北京大学医学部动物科学部,动物合格证号:SCXK(京)11-00-0006。所有动物实验均得到北京大学医学伦理委员会的许可,伦理审查许可证号:LA2015-007。
2 方法与结果
2.1 色谱条件与质谱条件
2.1.1 色谱条件 色谱柱:Kromasil 100-5 C18(250 mm× 4.6 mm,5 μm);保护柱:Zorbax SBC18;流动相:纯水(A)-乙腈(B),梯度洗脱(洗脱程序:0~10 min,1%B;10~15 min,1%~2%B;15~20 min,2%~3.5%B;20~25 min,3.5%B;25~35 min,3.5%~6.5%B;35~40 min,6.5%B;40~48 min,6.5%~9%B;48~60 min,9%~11.5%B;60~70 min,11.5%B;70~75 min,11.5%~40.5%B;75~81 min,40.5%B;81~95 min,40.5%~100%B;95~105 min,100%B);柱温:35℃;检测波长:280 nm;进样量:10 μL;流速:1 mL/min。
2.1.2 质谱条件 检测范围:MS1~MS3m/z 100~1 000;离子累积时间:30 ms;N2流速:1.5 L/min;曲型脱溶剂装置温度:200℃;检测压力:1.7 kV;干燥器电压:98.0 kV;最大压力:30 MPa;检测模式:负离子切换检测。
2.2 哈巴苷对照品溶液的制备
称取哈巴苷对照品适量,用超纯水溶解,制成质量浓度为40 mg/mL的哈巴苷对照品溶液,备用。
2.3 分组与给药
4只SD大鼠随机分为空白组和给药组(“2.2”项下哈巴苷对照品溶液),每组2只。适应性饲养6 d后,给药组大鼠ig给药,160 mg/kg(给药剂量根据预实验确定),每日上午9:00、晚21:00各1次,连用3 d;空白组大鼠ig等体积超纯水。给药期间正常喂食、喂水。收集给药组大鼠给药前的尿液、粪便,冷藏保存于4℃冰箱,与给药后进行比较。
2.4 样品的收集与处理
首次给药后,每12 h收集1次大鼠尿液和粪便,冷藏保存于4℃冰箱。末次给药后,分别在给药0.5、1 h后ip水合氯醛麻醉(380 mg/kg),穿心取血8 mL。取血后迅速取出心、肝、脾、肺、肾、胃、小肠组织,以生理盐水灌洗,于-30℃冰箱冷冻保存。
将各组大鼠血液于4℃离心(离心半径为 20 cm,5 000 r/min)15 min,取上清液,加5倍量甲醇超声沉淀蛋白,离心(离心半径为20 cm,10 000 r/min)15 min,取上清液,N2吹至干,加入1/4倍量甲醇复溶,过0.45 μm微孔滤膜,进样分析。
将各组大鼠尿液样品浓缩,蒸干。取0.5 g尿液样品蒸干物,加2 mL 50%甲醇复溶,即得质量浓度为250 mg/mL的尿液样品溶液,过0.45 μm滤膜,进样分析。
将各组粪便样品于50℃烘干,研磨,取7 g研磨粉,用20倍50%甲醇于20℃超声提取30 min,过滤后浓缩,蒸干。取0.5 g粪便样品蒸干物,加入2 mL 50%甲醇复溶,即得质量浓度为250 mg/mL的粪便样品溶液,过0.45 μm滤膜,进样分析。
取各组大鼠内脏组织,用生理盐水洗净血液并去除周围脂肪组织,称取相同组织10 g,用50 mL 50%甲醇匀浆3 min,20℃超声30 min,离心(离心半径为20 cm,12 000 r/min)15 min,取上清液,减压浓缩,蒸干。取0.25 g内脏组织蒸干物,加1 mL甲醇复溶,即得质量浓度为250 mg/mL的内脏组织溶液,过0.45 μm滤膜,进样分析。
2.5 哈巴苷质谱裂解规律
哈巴苷具有4-去甲基环烯醚萜苷的典型结构特征,其HPLC-MS/MS裂解规律见图1[11]。哈巴苷在负离子模式(NI)下会出现更多质谱离子碎片信息,且在中等强度碰撞电压(120 V)下,质谱图中易观察到[M+HCOO]-的加合离子基峰;较高的碰撞电压(320 V)下,易出现[MH]-的基峰[10]。本研究以NI信息为主进行哈巴苷及其代谢产物的解析,发现本试验条件下的准分子离子多为[M-H]-峰,此外还发现了[M+Cl]-峰。哈巴苷典型的裂解方式可概括为丢失葡萄糖与水分子形成m/z 201、183特征性碎片离子;此外,结构中的半缩醛环易开裂形成m/z 157、139特征碎片离子。结合上述哈巴苷质谱裂解数据,笔者在大鼠血液、尿液、粪便和组织中都发现了哈巴苷,其具体裂解信息如下。
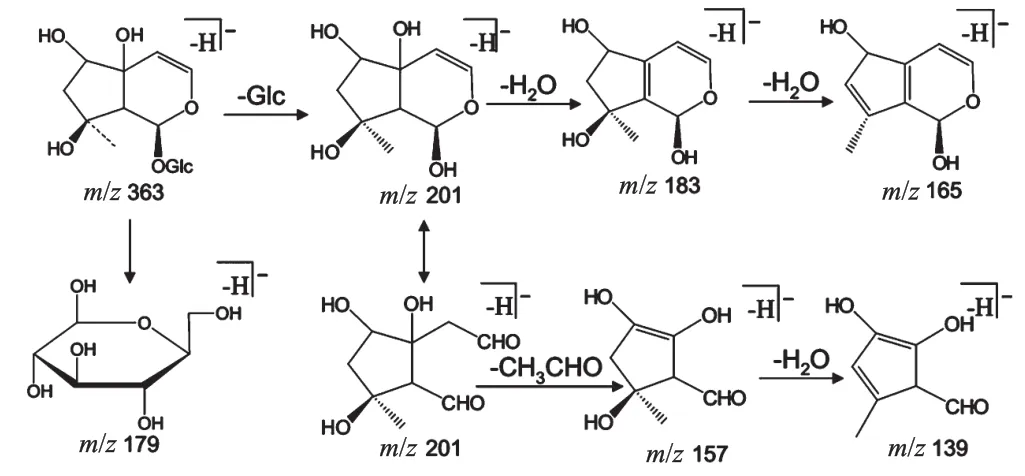
图1 哈巴苷的裂解规律Fig 1 Cracking rule of harpagide
哈巴苷(保留时间为29.925 min),负离子一级质谱中显示准分子离子峰[M-H]-为m/z 363.131 8,预测分子式为C15H24O10。二级质谱碎片主要有m/z 201.076 3、183.064 6、165.063 6、157.059 2、139.042 3。其中,m/z 201.076 3为[M-H-glucosyl]-,m/z 183.064 6为[M-H-glucosyl-H2O]-,m/z 165.063 6为[M-H-glucosyl-2H2O]-,m/z 157.059 2为[M-H-glucosyl-CH3CHO]-,m/z 139.042 3为[M-H-glucosyl-CH3CHO-H2O]-。
2.6 哈巴苷代谢产物的分析鉴定
采用HPLC-ESI-IT-TOF-MS分析技术对“2.4”项下样品在NI下进行检测,结果在NI模式下的基峰色谱(BPC)图中,发现了血液中代谢产物1种、尿中代谢产物10种、粪便中代谢产物3种。NI模式下各组织的BPC图见图2。去除重复代谢产物,共鉴定出代谢产物12种,详见表1。

图2 NI模式下各组织的BPC图Fig 2 Base peak chromatogram of each sample in negative ion mode
12种化合物均属首次报道,分别为哈巴苷水解形成的哈巴苷苷元(HM1)、哈巴苷水解并与香豆酸结合产物(HM2)、哈巴苷脱水并与葡萄糖醛酸结合产物(HM3)、哈巴苷苷元脱水硫酸酯化产物(HM4、HM5、HM7)、哈巴苷苷元还原甲基化产物(HM6、HM12)、哈巴苷水解并还原产物(HM8)、哈巴苷水解并脱水产物(HM9、HM10)、哈巴苷苷元裂解并与葡萄糖醛酸结合产物(HM11)。
HM1在小肠、肝和粪便中检测到,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 201.075 2,预测其分子式为C9H14O5。根据文献[10]中哈巴苷的裂解规律可知,m/z 201.075 2为哈巴苷脱去葡萄糖基后形成的特征性裂解碎片离子;二级质谱中可见m/z 157.135 4[M-HCH3CHO]-,与哈巴苷的特征裂解碎片离子[Harpagide-H-glucosyl-CH3CHO]-一致[11]。推测该代谢产物为哈巴苷脱去葡萄糖基后形成的水解产物哈巴素(Harpagenin),HM1既是哈巴苷的代谢产物,也是玄参中的原型成分[10],作为代谢产物未见文献报道。
HM2为给药大鼠尿液中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 347.141 3,预测其分子式为C19H24O6。二级质谱可见碎片离子m/z 319.155 6、201.113 6、145.120 2。其中m/z 319.155 6[MH-CO]-是准分子离子峰通过丢失CO形成的碎片离子,m/z 201.113 6[M-H-cumaric acid]-为哈巴苷苷元的特征性离子,m/z 145.120 2[Cumaric acid-H-H2O]-是香豆酸的特征性碎片离子。这表明该代谢产物含有香豆酸和哈巴苷苷元结构单元,且m/z 347可能为[8-O-courmaroyl harpagide-H-glucosyl]-,8-O-courmaroyl harpagide又是玄参中的化学成分[11],根据质谱信息并对比文献[11-12]推测该化合物可能为8-O-courmaroyl harpagenin。
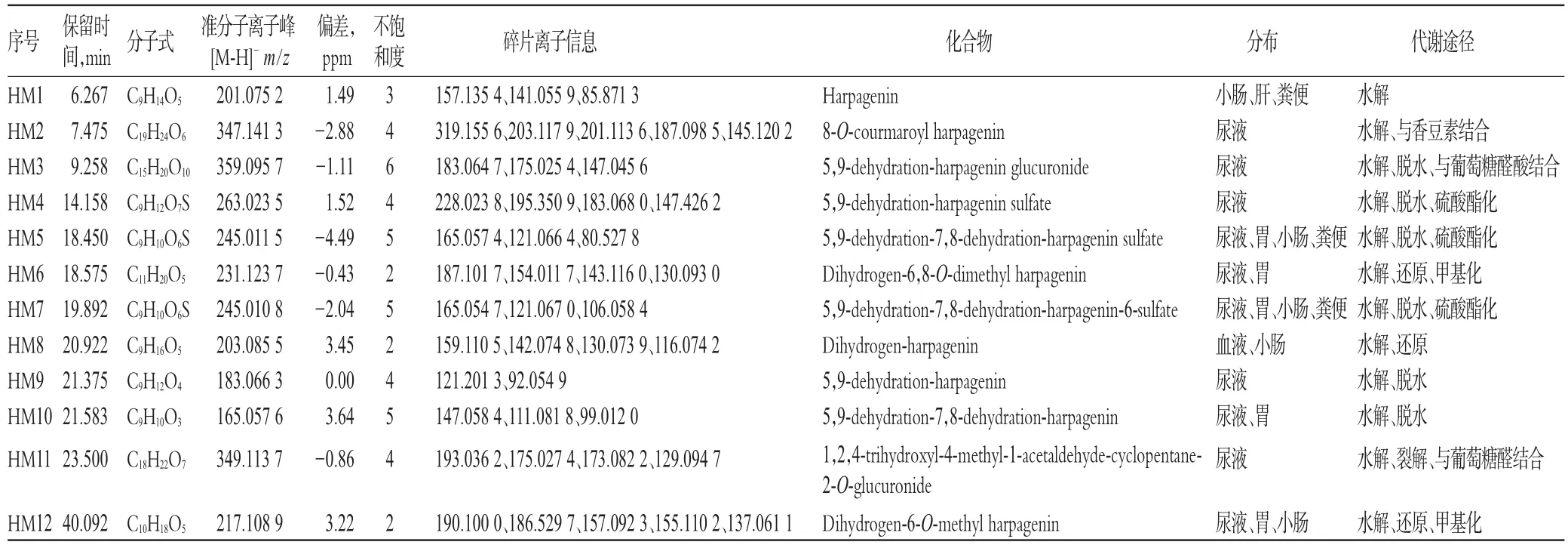
表1 哈巴苷在大鼠体内的代谢产物液质联用分析结果(负离子模式下)Tab 1 Results of LC-MS analysis of harpagide metabolites in rats in vivo(negative ion mode)
HM3为给药大鼠尿液中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 359.095 7,预测其分子式为C15H20O10。二级质谱中可见碎片离子m/z 183.064 7、175.025 4、147.045 6。其中,m/z 183.064 7为母离子中性丢失葡萄糖醛酸基(176 Da)形成的碎片离子,且与哈巴苷苷元脱水形成的碎片离子一致;m/z 175.025 4为[Glucuronicacid-H-H2O]-,m/z 147.045 6为[Glucuronic acid-H-H2O]-,均为葡萄糖醛酸的特征性碎片离子。根据哈巴苷的裂解规律[11],哈巴苷苷元母核上C-5位上羟基更容易脱水形成稳定的共轭结构,确定脱水的位置在5、9位,根据上述信息结合文献数据推测该代谢产物为哈巴苷苷元脱水后的葡萄糖醛酸化产物5,9-dehydration-harpagenin glucuronide。
HM4为给药大鼠尿液中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 263.023 5,预测其分子式为C9H12O7S。二级质谱中可见m/z 183.068 0[M-H-SO3]-碎片离子,说明该化合物可能为硫酸酯化的代谢产物。对比文献[11]发现该碎片离子与哈巴苷失去葡萄糖基后再脱去1分子的水所形成的特征性结构单元m/z 183[Harpagide-H-glucosyl-H2O]-一致,故推测该代谢产物为哈巴苷苷元脱水后形成的硫酸酯化产物5,9-dehydration-harpagenin sulfate。
HM5、HM7为给药大鼠尿液、粪便、胃和小肠中检测到的代谢产物,负离子一级质谱中均显示准分子离子峰[M-H]-为m/z 245.01,预测其分子式均为C9H10O6S。负离子模式下,二级碎片离子均可见m/z 165.05[M-HSO3]-和m/z 121.07[M-H-SO3-CO2]-。对比哈巴苷的裂解规律,m/z 165.05[M-H-SO3]-与哈巴苷失去葡萄糖基后再脱去2分子水所形成的结构单元m/z 165[Harpagide-H-glucosyl-2H2O]-一致。根据以上数据推测代谢产物HM5和HM7均为哈巴苷苷元脱去2分子水后的硫酸酯化产物,母核1位和6位均有羟基可发生硫酸酯化,但空间位阻1位羟基最小,其次为6位羟基,因此优势取代顺序为1位羟基>6位羟基。故推测峰面积较大的HM5为5,9-dehydration-7,8-dehydration-harpagenin sulfate,峰面积较小的HM7为5,9-dehydration-7,8-dehydration-harpagenin-6-sulfate。
HM6为给药大鼠尿液和胃中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 231.123 7,预测其分子式为C11H20O5。二级碎片离子可见m/z 187.101 7[M-H-CH3CHO]-和m/z 143.116 0[M-HCH3CHO-CO2]-。根据以上数据并结合文献[12],推测该代谢产物可能为Dihydrogen-6,8-O-dimethyl harpagenin。
HM8为给药大鼠血液和小肠中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 203.085 5,预测分子式为C9H16O5。在负离子模式的二级碎片离子可见m/z 159.110 5[M-H-CH3CHO]-。根据以上数据并结合文献[12-13]推测该代谢产物为哈巴苷苷元的还原产物Dihydrogen-harpagenin。
HM9为给药大鼠尿液中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 183.066 3,预测其分子式为C9H12O4。其准分子离子峰与哈巴苷脱去葡萄糖和水分子后形成的特征性裂解碎片m/z 183 [Harpagide-H-glucosyl-H2O]-一致,且二级质谱图中出现了哈巴苷苷元脱水后再失去-CH3CHO形成的碎片离子m/z 121.201 3。因此,推测该代谢产物为5,9-dehydration-harpagenin。
HM10为给药大鼠尿液和胃中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z165.057 6,预测其分子式为C9H10O3。其准分子离子峰与哈巴苷失去葡萄糖基后再脱去2分子水所形成m/z 165 [Harpagide-H-glucosyl-2H2O]-的碎片离子一致,且二级碎片离子可见m/z 147.058 4[M-H-H2O]-,哈巴苷苷元母核上C-5位的羟基更容易脱水形成稳定的共轭结构。综合上述信息及文献[11]推测该代谢产物为哈巴苷苷元的脱水产物5,9-dehydration-7,8-dehydration-harpagenin。
HM11为给药大鼠尿液中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 349.113 7,预测其分子式为C18H22O7。二级碎片离子可见m/z 193.036 2[Glucuronicacid-H]-、m/z 175.027 4[Glucuronic acid-H-H2O]-、m/z 173.082 2[M-H-glucuronyl]-和m/z 129.094 7[M-H-glucuronyl-CO2]-,其中m/z 173.082 2与哈巴苷苷元的碎片m/z 173[Harpagenin-H-CO]-一致,因此推测该代谢产物为哈巴苷苷元脱羰基后形成的1,2,4-三羟基-4-甲基-1-乙醛-环戊烷与葡萄糖醛酸生成的苷。苷元1、2、4位均有羟基可发生葡萄糖醛酸化,2位羟基空间位阻最小,因此羟基取代可能发生在2位上。根据以上数据信息推测HM11为1,2,4-trihydroxyl-4-methyl-1-acetaldehyde-cyclopentane-2-O-glucuronide。
HM12为给药大鼠尿液、小肠和胃中检测到的代谢产物,负离子一级质谱中显示准分子离子峰[M-H]-为m/z 217.108 9,预测其分子式为C10H18O5。二级质谱信息中可见m/z 199.100 0[M-H-H2O]-、m/z 186.529 7[M-HCH3O]-和m/z 157.092 3[Harpagide-H-glucose-2H2O]-。根据质谱信息及文献[12]推测该代谢产物可能为Dihydrogen-methyl-harpagide母离子中性丢失葡萄糖基(162 Da)形成;根据甲基取代基的空间位阻大小,甲基化最有可能发生在6位羟基。因此,推测该代谢产物为Dihydrogen-6-O-methylharpagenin。
2.7 哈巴苷在大鼠体内的代谢类型
本研究结果显示,哈巴苷采用液质联用技术,从大鼠含药尿液、血浆和粪便中共鉴定出12种哈巴苷代谢产物,发现哈巴苷在大鼠体内的代谢类型主要包括水解、脱水、还原、甲基化、硫酸酯化、葡萄糖醛酸结合、一级香豆酸结合等。根据代谢产物的结构特点及代谢反应类型,推测哈巴苷在大鼠体内的代谢类型见图3。
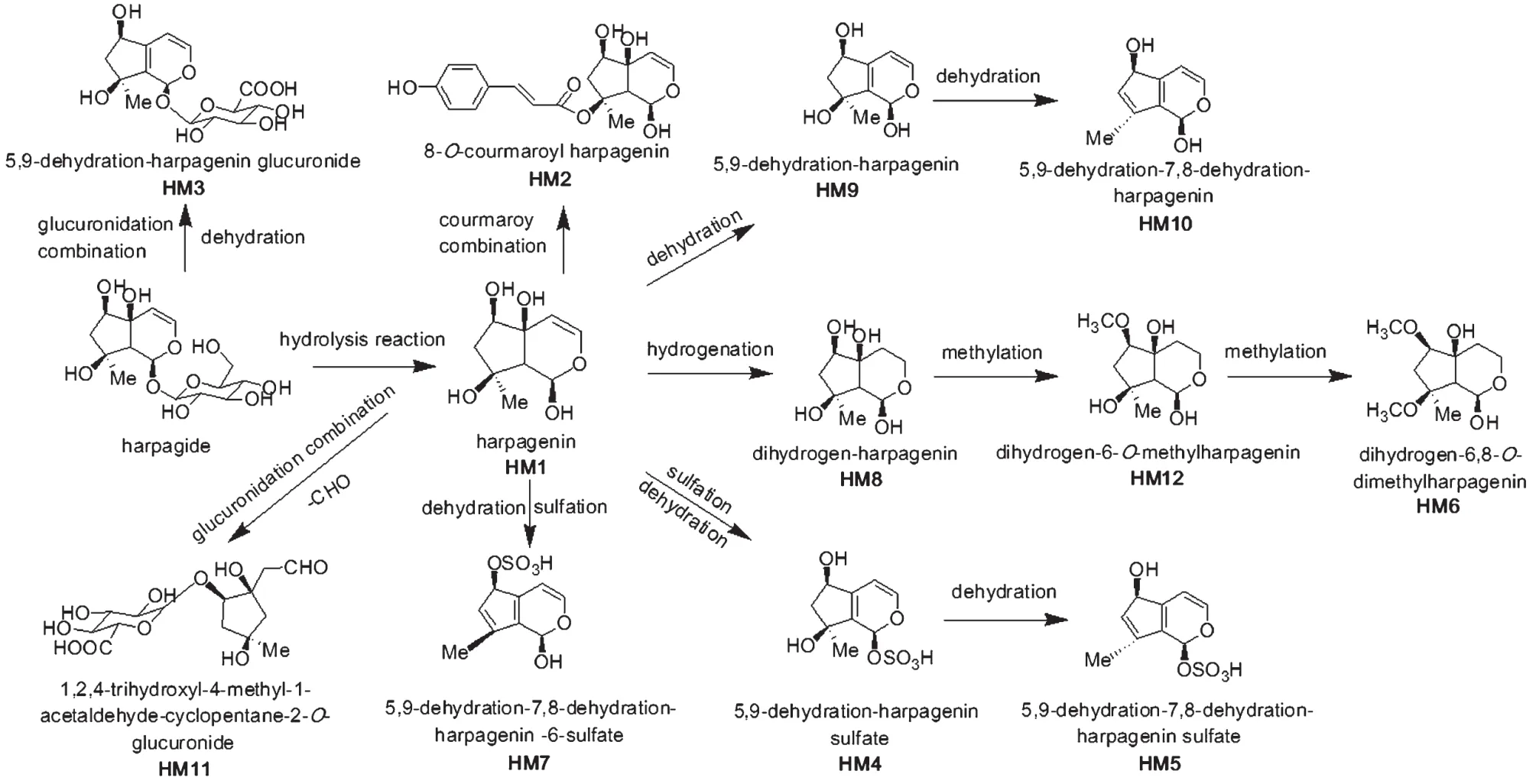
图3 哈巴苷在大鼠体内可能的代谢类型Fig 3 The possible metabolic type of harpagide in rats in vivo
2.8 哈巴苷原型及其代谢产物在大鼠体内的分布
哈巴苷原型及其代谢产物体内分布研究发现,哈巴苷原型在心、肝、脾、肺、肾、胃和小肠中均有分布;在小肠中检测到HM1、HM5、HM7、HM8和HM12共5种代谢产物;在胃中检测到HM5、HM6、HM7、HM10和HM12共5种代谢产物;在肝脏中检测到HM1。推测哈巴苷主要分布于胃、小肠和肝。
2.9 哈巴苷在大鼠体内代谢产物的活性预测
采用药物活性预测软件“Pharm Mapper”,对12种代谢产物进行活性预测分析。结果,多种代谢产物显示多种不同的潜在活性,且不同代谢产物可能具有相同的潜在靶点和潜在活性。HM1、HM3、HM9可能具有治疗癫痫的相关活性;HM1、HM6、HM9、HM12可能具有治疗肌萎缩侧索硬化(ALS)的相关活性;HM2、HM3、HM10可能具有治疗糖尿病的相关活性;HM5和HM8可能具有治疗脑中风的相关活性等。这些代谢产物活性与哈巴苷的免疫调节作用和神经保护作用[6,8],以及玄参的免疫调节、神经保护和调节血糖作用[3,14-15]有一定的相关性。哈巴苷代谢产物结构多相似,结构相似的代谢产物也预测出其具有相同的作用靶点,如HM1和HM9,HM6和HM12,这与徐风等[16]提出的多成分单靶点的中药显效形式新理论一致。哈巴苷代谢产物的主要活性预测结果见表2。

表2 哈巴苷在大鼠体内代谢产物的生物活性预测结果Tab 2 Prediction results of biological activity of harpagide metabolites in rats in vivo
3 讨论
环烯醚萜类成分的苷元结构相对稳定,因此哈巴苷在进入体内后通过各种代谢途径,产生了结构相似的代谢产物。经过活性预测,哈巴苷的多种代谢产物具有治疗癫痫、ALS、糖尿病和脑中风等疾病的潜在活性。这些代谢产物的潜在活性与哈巴苷的免疫调节作用和神经保护作用[6,8]以及玄参的免疫调节、神经保护和血糖调节作用有一定的相关性[3-4,15]。这说明采用PharmMapper软件预测代谢产物的生物活性具有一定参考价值。文献报道传统的产地加工炮制方法可使玄参中哈巴苷含量升高[9-10]。王静哲等[10]也发现,炮制玄参中哈巴苷含量为烘干玄参的124%。哈巴苷体内代谢研究有助于揭示玄参炮制机制,哈巴苷与其代谢产物可能为玄参发挥药效的重要物质基础。通过本研究发现的12种哈巴苷代谢产物及其可能代谢途径,为玄参“归胃经”、归属玄参在大鼠体内代谢产物的原型成分来源提供了重要依据,有助于揭示哈巴苷的体内显效形式及其作用机制。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:117.
[2] Qian J,Hunkler D,Safayhi H,et al.New iridoid-related constituents and the anti-inflammatory activity of Scrophularia ningpoensis[J].Planta Med,1991,57(S2):56.
[3] Benito P,Lanza A,Sen A,et al.Effects of some iridoids from plant origin on arachidonic acid metabolism in cellular systems[J].Planta Med,2000,66(4):324-328.
[4] Sohn S,Ko E,Jeon S,et al.The genome-wide expression profile of Scrophularia ningpoensis-treated thapsigarginstimulated U-87MG cells[J].Neuro Toxicology,2009,30(3):368-376.
[5] Huang Q,Gong Q,Yao M,et al.Protective effect of Scrophularia ningpoensis extracts on cerebral ischemia injury in rats[J].Chin J New Drugs Clin Ren,2004,23(6):323-327.
[6] 王建华,谢丽华,钱瑞琴,等.玄参中哈巴苷和哈巴俄苷滋阴作用的药理研究[EB/OL].(2001-07-01)[2016-03-21].http://kns.cnki.net/KCMS/detail/detail.
[7] 应夏丽,钟晓明,徐慕蝶,等.哈巴苷对急性脑缺血小鼠神经保护作用及线粒体保护机制的研究[J].中国药学杂志,2015,50(20):1026-1031.
[8] 李医明,曾华武.玄参中环烯醚萜苷和苯丙素苷对LTB4产生及血小板聚集的影响[J].第二军医大学学报,1999,20(5):301-303.
[9] 白云娥,袁鹏飞,王庆辉,等.HPLC-UV波长转换法测定玄参药材及饮片中哈巴苷与哈巴俄苷的含量[J].中国中药杂志,2011,36(19):2697-2702.
[10]王静哲,刘震,马立满,等.基于UPLC-Q-TOF-MS技术分析加工炮制对玄参化学成分的影响[J].质谱学报,2016,37(1):1-9.
[11] Wu Q,Yuan Q,Liu E,et al.Fragmentation study of iridoid glycosides and phenylpropanoid glycosides in Radix Scrophulariae by rapid resolution liquid chromatography with diode-array detection and electrospray ionization time-of-flight mass spectrometry[J].Bio Chrom,2010,24(8):808-819.
[12] 王静哲.炮制对玄参化学成分的影响及其体内代谢研究[D].北京:北京大学,2015.
[13] Yosioka I,Sugawara T,Yoshikawa K,et al.Soil bacterial hydrolysis leading to genuine aglycone.Ⅶ.Monoterpenoid glucosides of Scrophularia buergeriana MIQ.and Paeonia albiflora[J].Chemical&Pharmaceutical Bulletin,1972,111(20):2450-2453.
[14] 杜晓煌,方勇飞,李莉,等.玄参主要成分生物活性研究进展[J].中国药房,2015,26(15):2158-2160.
[15] 王浴生.中药药理与应用[M].北京:人民卫生出版社,1983:370.
[16] 徐风,杨东辉,尚明英,等.中药药效物质的“显效形式”、“叠加作用”和“毒性分散效应”:由中药体内代谢研究引发的思考[J].世界科学技术:中医药现代化,2014,16(4):688-703.
Identification and Analysis of Harpagide Metabolites in Rats in vivo
LIU Zhen,XU Feng,WANG Jingzhe,LIU Guangxue,SHANG Mingying,CAI Shaoqing(School of Pharmaceutical Sciences,Peking University,Beijing 100191,China)
OBJECTIVE:To study the metabolites,distribution,metabolic type and the possible activity of harpagide which is the active component from Scrophularia ningpoensis in rats in vivo.METHODS:4 SD rats were divided into blank group(ultrapure water)and administration group(harpagide reference solution),2 in each group,ig,160 mg/kg,twice a day,for 3 d.Urine and feces were collected every 12 h before administration and the first administration;sample blood 8 mL was taken after 0.5,1 hof last administration;heart,liver,spleen,lung,kidney,stomach and small intestine were taken.The blood,urine,feces and other tissue solutions were prepared,HPLC-MS was conducted to detect and identify the harpagide metabolites in rats in vivo and presume metabolic pathways,and PharmMapper software was used to predict metabolites activity.RESULTS:12 harpagide metabolites were identified in rats in vivo,the form of prototypes and metabolites were distributed in heart,liver,spleen,lung,kidney,stomach and small intestine.The metabolic type mainly included hydrolysis,dehydration,reduction,methylation,sulfation,glucuronic acid binding,grade A coumaric acid binding,etc.The 12 compounds may have activities in the treatment of epilepsy,amyotrophic lateral sclerosis,diabetes,stroke,etc.CONCLUSIONS:Harpagide may be effective in the form of prototypes and metabolites.The study has provided basis for attributing the origins of metabolite,studying the effective form of S.ningpoensis clarifying its pharmacological mechanism and processing mechanism.
Scrophularia ningpoensis;Harpagide;LC-MS;Metabolite;Metabolic pathway;Activity
R931.6
A
1001-0408(2017)10-1310-06
2016-05-28
2017-01-09)
(编辑:刘明伟)
国家自然科学基金资助项目(No.81274074)
*硕士研究生。研究方向:中药质量评价。电话:010-82802535。E-mail:386436070@qq.com
#通信作者:副教授,博士。研究方向:中药质量评价。电话:010-82802535。E-mail:myshang@bjmu.edu.cn
DOI10.6039/j.issn.1001-0408.2017.10.04
