一株Chitinophaga菌株的鉴定、优化及其活性蛋白的初步纯化
2017-04-14刘冰花蒲丽娟褚应文
刘冰花, 杨 林, 罗 玲, 蒲丽娟, 褚应文, 杨 港
(成都大学 医学院(护理学院), 四川 成都 610106)
一株Chitinophaga菌株的鉴定、优化及其活性蛋白的初步纯化
刘冰花, 杨 林, 罗 玲, 蒲丽娟, 褚应文, 杨 港
(成都大学 医学院(护理学院), 四川 成都 610106)
为确定前期获得的可产生抗血栓物质细菌的分类地位、优化发酵条件及对活性物质初步纯化.利用形态学特征、理化性质、脂肪酸含量、G+C含量、16S rRNA序列同源性及DNA-DNA杂交率等方法鉴定菌株MJM 38,利用纤维蛋白平板法检测溶栓活性,利用纤维蛋白原平板法检测抗凝活性,利用单因素法筛选菌株MJM 38产生抗血栓活性物质的最佳培养条件,利用盐析、超滤及分子筛层析等方法对其活性物质进行了初步分离.结果发现,菌株MJM 38属于Chitinophaga菌,初步确定抗血栓活性物质为蛋白质,其分子量大小在30 kDa~100 kDa之间,菌株MJM 38在培养时间为4 d、培养温度为25 ℃~30 ℃、发酵培养基初始pH值为7时产生的抗血栓物质的溶栓活性最大.
Chitinophaga;鉴定;优化;纯化;抗血栓;蛋白
0 引 言
Chitinophaga中文名为曼噬甲壳菌属或噬几丁质菌属,于1981年由Sangkhobol等首次提出,并根据其形态学和理化性质特征把Chitinophaga属归类为Myxobacteria[1-3].1999年,Sly等[4]在分子水平上发现Chitinophaga属更接近于鞘脂杆菌目的部分细菌,2006年,Kampfer等[5]将Chitinophaga属的菌株重新归类为拟杆菌门鞘脂杆菌纲鞘脂杆菌目泉发菌科.虽然Chitinophaga属的菌株大多为黄色或橙黄色[2,6],颜色特征比较明显,但它们普遍生长缓慢,很容易被其他杂菌污染,不容易分离纯化,相关研究主要集中在新菌种的发现方面,对其产生活性物质的研究较少[6-7].为寻找新的抗血栓药物资源,本研究对前期筛选到的一株可产生抗血栓活性物质的细菌做了进一步鉴定,优化了其发酵条件,并对其产生的抗血栓活性蛋白做了分离纯化.
1 材料与方法
1.1 材 料
1.1.1 培养基.
酵母膏蛋白胨培养基:0.3%酵母膏,0.5%蛋白胨,1.6%琼脂粉,pH值为7.22;酵母膏蛋白胨发酵培养基:0.5%酵母膏,1.0%蛋白胨,pH值为7.22;其他培养基按照文献[8]的配方配制.
1.1.2 试剂、菌株及仪器.
1)试剂.尿激酶(丽珠集团丽珠制药厂),凝血酶(湖南一格制药有限公司),纤维蛋白原1 g/瓶(sigma公司),脂肪酸标准品Mixture Me 82(Larodon公司),等.
3)仪器.PCR反应扩增仪(Thermo公司),凝胶成像系统(Gene Genius公司),GC-9A气相色谱仪(岛津公司),等.
1.2 菌株MJM 38的种属鉴定
1.2.1 菌株的形态学观察.
将菌株MJM 38接种在酵母膏蛋白胨平板上,于30 ℃孵箱培养4 d,观察菌落形态,同时对菌株进行革兰氏染色.
1.2.2 菌落的理化性质检验.
分别在温度范围为10 ℃~40 ℃的区间内、pH值在4~10的范围内、NaCl浓度为0%~2%的范围内检测菌株在酵母膏蛋白胨培养基中的生长情况,并进行糖同化作用实验、糖发酵实验、接触酶实验、淀粉水解实验、V-P测定、马尿酸盐水解实验、明胶水解实验、硝酸盐还原实验等[8].
1.2.3 16S rDNA的鉴定.
将细菌MJM 38在酵母膏蛋白胨培养基中培养3 d,收集菌体,采用冻融法[9]提取其基因组DNA.以通用引物7f(5′-CAGAGTTTGATCCTGGCT-3′)和1540r(5′-AGGAGGTGATCCAGCCGCA-3′)为引物,以目的细菌的基因组DNA为模板,扩增该菌株的16S rDNA.其反应条件为:25 μL反应体系,94 ℃预变性5 mim;35次循环(94 ℃ 30 s,55 ℃ 35 s,72 ℃ 1 min),72 ℃延伸8 min.将扩增产物送上海生物工程公司测序,得到目的细菌的16S rDNA序列.在NCBI GenBank中BLAST,用 MEGA 6软件以Neighbor-joining法构建系统发育树,并用DNAMAN 8软件比对其与其他菌株的相似度.
1.2.4 菌株的脂肪酸含量、(G+C)mol%含量及DNA同源性测定.
1)按照文献[10]的方法,采用气相色谱法测定目的菌株的脂肪酸含量.
2)采用熔解温度(Tm)法测定菌株基因组DNA的(G+C)mol%含量.以E.coliK12为参比菌株,采用冻融法[9]提取目的菌株和E.coliK12的基因组DNA,并制作目的菌株和E.coliK12的变性曲线,根据热变性曲线分别求出目的菌株和E.coliK12的熔链温度(Tm),根据公式,(G+C)mol%=(G+C)mol%E.coliK12+2.08(Tm未知-TmE.coliK12),计算目的菌株的(G+C)mol%含量.
1.3 菌株MJM 38抗血栓活性物质的检测及分离纯化
1.3.1 菌株MJM 38抗血栓活性物质的检测.
按照文献[12]的方法制备胞外浓缩液.采用纤维蛋白平板法[13]检测目的菌株的溶栓活性,采用纤维蛋白原平板法[13]检测目的菌株的抗凝活性.
1.3.2 菌株MJM 38抗血栓活性物质的分离纯化.
将目的菌株的胞外浓缩液6 mL,用等体积氯仿萃取,收集上层水相.在水相中加入硫酸铵粉末进行分步盐析.将盐析后的样品用不同截留分子量的超滤离心管进行超滤,超滤后得到200 μL样品(溶液Ⅰ).将溶液Ⅰ上葡聚糖凝胶G-150层析柱,收集各峰,并检测各峰的溶栓抗凝活性.
1.4 培养条件对菌株MJM 38生长的影响及发酵条件的优化
1.4.1 培养条件对菌株MJM 38生长的影响.
1)将菌株MJM 38由酵母膏蛋白胨斜面转接入装有100 mL酵母膏蛋白胨液体培养基的培养瓶中培养48 h,以此瓶菌液为种子菌液.以2%的接种量将种子菌液转接入200 mL新的酵母膏蛋白胨液体培养基中,以30 ℃、100 r/min培养,每24 h取出5 mL,以去离子水调零,测其在波长600 nm处的吸光度,连续测7 d.以培养时间为横坐标、以吸光度为纵坐标作图,确定培养时间对目的菌株生长的影响.
2)以同样接种量将种子菌液转接入7个装有100 mL新的酵母膏蛋白胨液体培养基的培养瓶中,将这7个瓶子分别放入20 ℃、25 ℃、28 ℃、30 ℃、33 ℃、35 ℃及40 ℃摇床中,均以100 r/min培养24 h,分别测其在波长600 nm处的吸光度.以温度为横坐标、以吸光度为纵坐标作图,确定温度对目的菌株生长的影响.
3)以同样接种量将种子菌液转接入7个pH值分别为4、5、6、7、8、9、10的100 mL酵母膏蛋白胨液体培养基中,均以30 ℃、100 r/min培养24 h,分别测其在波长600 nm处的吸光度.以pH值为横坐标、以吸光度为纵坐标作图,确定培养基初始pH值对目的菌株生长的影响.
1.4.2 菌株MJM 38发酵条件的优化.
1)用单因素法分别考察培养温度、培养时间及发酵培养基初始pH值对菌株MJM 38产生抗血栓活性物质的溶栓活性的影响.分别以5%的接种量将“1.4.1”项中的种子菌液转接入100 mL酵母膏蛋白胨发酵培养基中.检测培养时间对溶栓活性的影响,将培养瓶放入旋转摇床中以30 ℃、100 r/min培养,每24 h取出一瓶,连续取7次.
2)检测培养温度对溶栓活性的影响,将培养瓶放入旋转摇床中分别在20 ℃、25 ℃、30 ℃、35 ℃的温度下100 r/min培养4 d.检测发酵培养基初始pH值对溶栓活性的影响,将“1.4.1”项中的种子菌液以5%的接种量分别转接入pH值为4、5、6、7、8、9、10、11的100 mL酵母膏蛋白胨发酵培养基中,以30 ℃、100 r/min培养4 d.按照“1.3.1”项的方法检测每瓶发酵液的溶栓活性.
2 结果与分析
2.1 菌株MJM 38的形态特征和理化性质
菌株MJM 38好氧,在酵母膏蛋白胨平板上可滑动,10 d滑动0.9 cm.菌落橙黄色,表面黏湿,菌落周围的平板透明,菌落边缘呈纺织物的毛边,细杆状,两端钝圆,菌体大小为(0.06~0.11)μm×(0.5~1.25)μm,生长的温度范围为12 ℃~40 ℃,pH值范围为6~10,最适合的pH值为8.菌株MJM 38的理化性质如表1所示,同化作用及糖发酵实验结果如表2所示.

表1 菌株MJM 38的理化性质
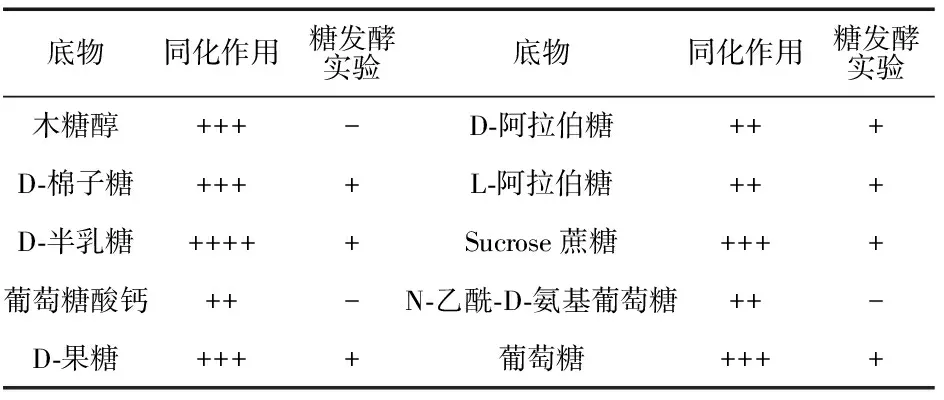
表2 菌株MJM 38的同化作用和糖发酵实验
菌株MJM 38和Chitinophaga属近缘模式菌株的鉴别特征如表3所示.
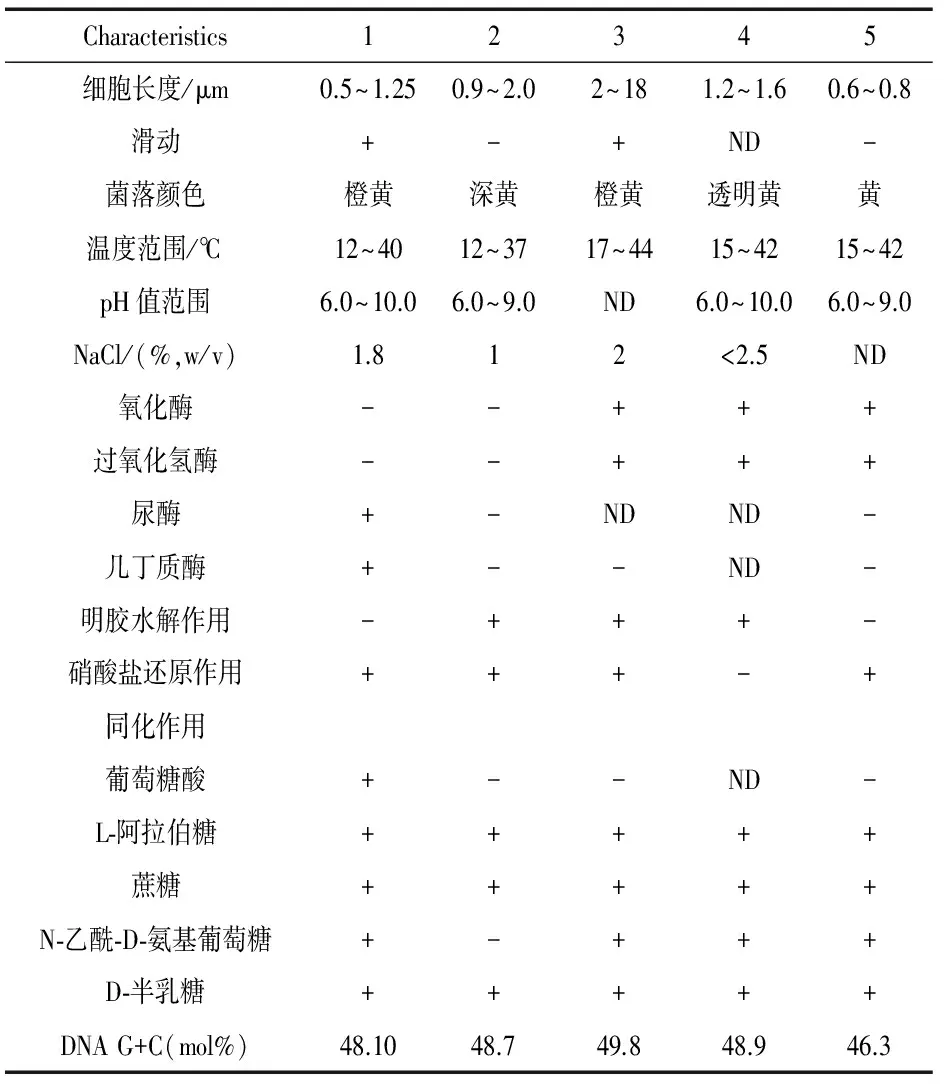
表3 菌株MJM 38和Chitinophaga属近缘模式菌株的鉴别特征
注:1.MJM 38;2.CS5-B1T;3.ChitinophagajaponensisT;4.ChitinophagaeiseniaeYC6729T; 5.ChitinophagaterraeT,第1,2列的数据来自于本研究;第3、4、5列的数据分别来自于参考文献[14]、[15]和[16];ND表示无数据来源.
2.2 16S rDNA序列分析及系统发育学分析
测序后,发现菌株MJM 38的16S rDNA共有1 515 bp,将其序列输入NCBI GenBank中blast,用MEGA 6.05软件构建系统发育树,发现菌株MJM 38与模式菌株Chitinophagarupissp.CS5-B1T(FM865977)聚到了同一个分支,亲缘关系最近(见图1).利用DNAMAN 8软件比对相似性,发现菌株MJM 38和模式菌株Chitinophagarupissp.CS5-B1T(FM865977)的相似度为99.79%,菌株MJM 38和模式菌株Flexibacter japonensis T(AB078055)的相似度为97.0%.
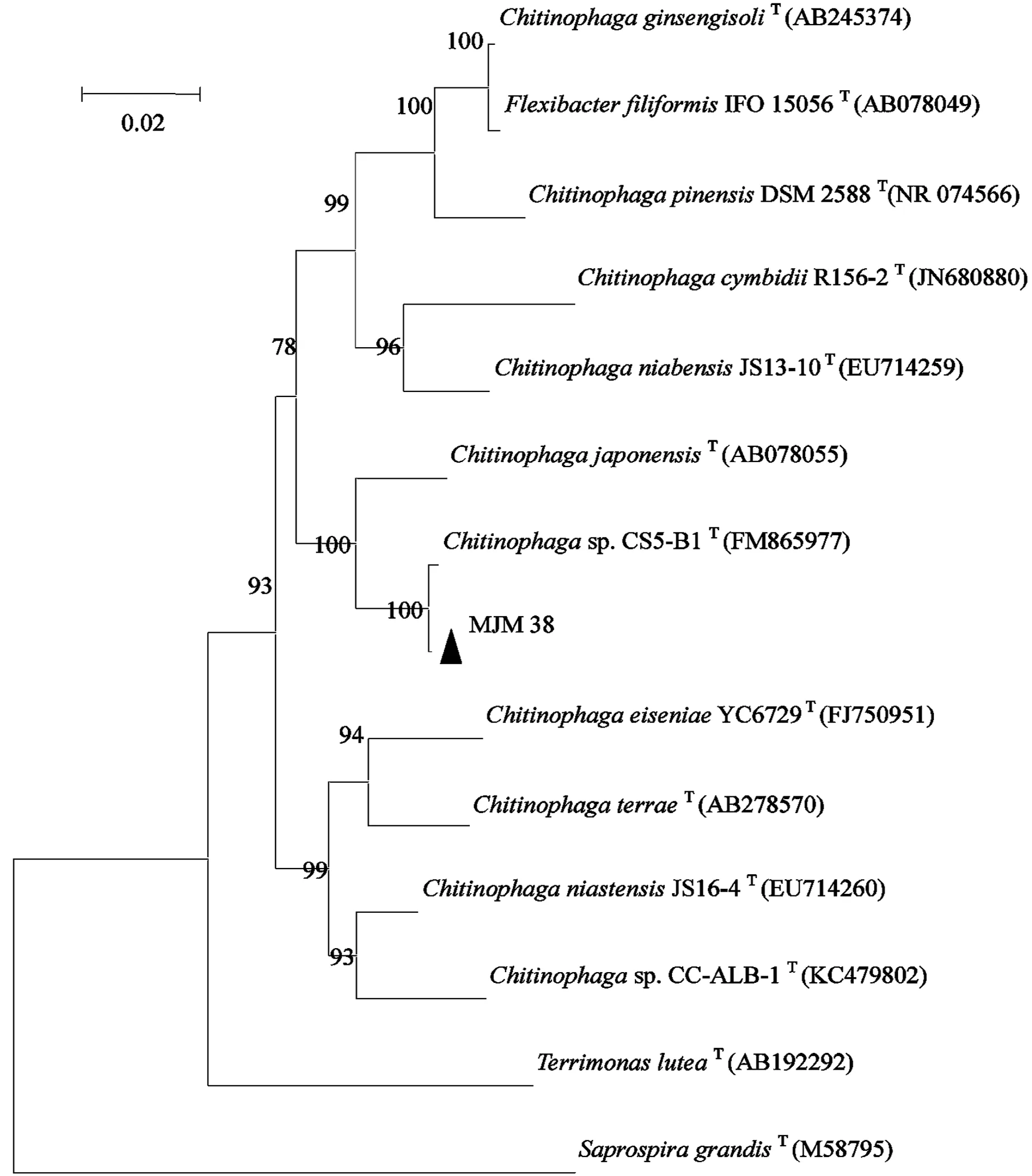
注:图中序列来自于GenBank数据库,括号中的数字为GenBank登陆号,Neighbor-joining法,反复抽样1 000次,分支点上的数值表示步长支持百分比,比例尺表示每100个核苷酸中有2个核苷酸不同.
图1 菌株MJM 38的基因同源性系统发育树
2.3 菌株的脂肪酸含量、G+C含量及DNA杂交率
实验测得菌株MJM 38所含的主要脂肪酸种类及含量如表4所示.
结合菌株的菌体及菌落形态、生理生化特性、进化树、16S rRNA 基因序列的比对结果、脂肪酸含量、G+C含量及DNA-DNA杂交率,确定菌株MJM 38为模式菌株Chitinophagarupissp. CS5-B1T(FM865977)的变种,即菌株MJM 38属于拟杆菌门鞘脂杆菌纲鞘脂杆菌目泉发菌科的曼噬甲壳菌属[17].
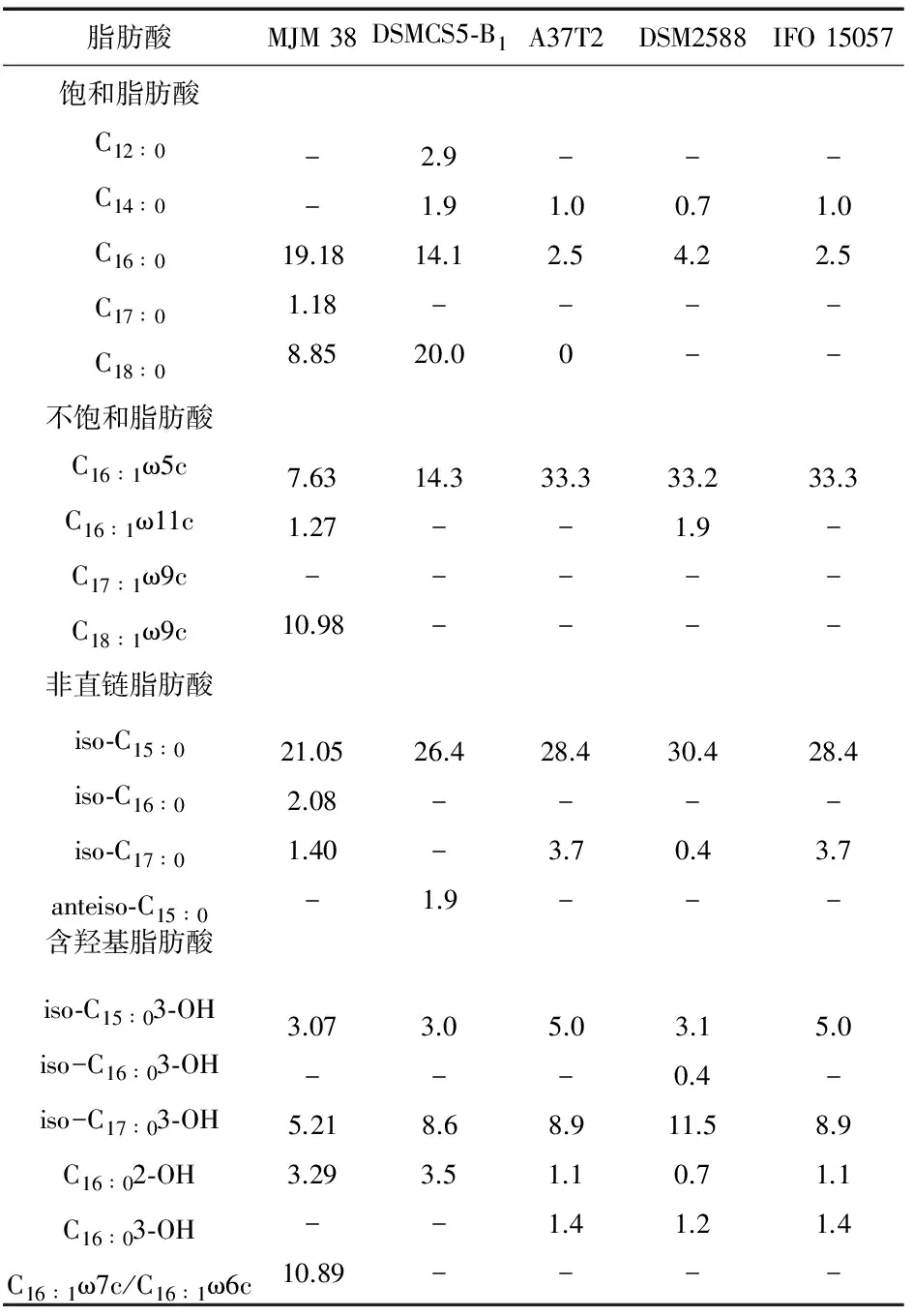
表4 菌株MJM 38和慢噬甲壳菌属其他模式菌株的脂肪酸组成比较
注:1.MJM 38(数据来自于本研究);2.C.rupisCS5-B1T(数据来自于本研究);3.C.costaiiA37T2T;4.C.pinensisDSM 2588T;5.C.(Flexibacter)sanctiIFO 15057T;表中的数值表示总脂肪酸的百分比;第3列的数据来自于Diogo Neves Proenca,et al.(2014);第4、5列的数据来自于Kmpfer et al.(2006),只列出了含量大于10%的脂肪酸;“-”表示含量小于总脂肪酸的1%.
2.4 菌株MJM 38胞外液的抗凝溶栓活性及活性成分的初步纯化
2.4.1 菌株MJM 38胞外液的抗凝溶栓活性.
纤维蛋白平板实验显示菌株MJM 38的胞外液有明显的溶栓活性,如图2所示.按照文献[12]的方法测得菌株MJM 38胞外浓缩液纤溶酶活力单位为5 649 U/mL.纤维蛋白原平板实验显示菌株MJM 38的胞外液也有一定的抗凝活性.

①表示3 U尿激酶;②表示15 U尿激酶;③表示30 U尿激酶;④表示75 U尿激酶;⑤表示150 U尿激酶;⑥表示30 μL菌株MJM 38的胞外浓缩液(37 ℃培育3 h).
图2 菌株MJM 38的胞外液在纤维蛋白平板上的透明圈
2.4.2 菌株MJM 38抗血栓活性物质的初步纯化.
硫酸铵分步沉淀的结果是硫酸铵饱和度为30%~70%之间的部分有抗血栓活性.超滤后发现分子量在30 kDa~100 kDa之间的部分(溶液Ⅰ)有抗血栓活性.溶液Ⅰ经过葡聚糖凝胶G-150柱的层析图谱如图3所示,经过纤维蛋白平板和纤维蛋白原平板检测,发现只有峰1具有溶栓抗凝活性.
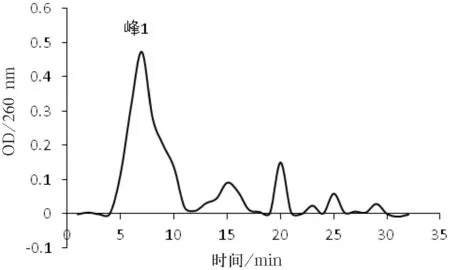
图3 溶液Ⅰ的葡聚糖凝胶G-150柱层析图谱
2.5 培养条件
培养条件对菌株MJM 38生长的影响,菌株MJM 38产生抗血栓活性物质的发酵条件的优化,培养时间、培养温度及培养基初始pH值对菌株MJM 38生长的影响及对所产生的抗血栓物质的溶栓活性的影响如图4~图6所示.
从图4可知,菌株MJM 38从第2 d开始进入对数生长期,第4 d末对数期结束,无明显稳定期,从第5 d开始进入衰亡期;当培养时间为4 d时,透明圈和加样孔直径的比值最大,表明菌株MJM 38产生溶栓活性物质的最佳培养时间为4 d.从图5可知,当温度为30 ℃时,菌株在波长600 nm处的光吸收值最大,表明菌株MJM 38生长的最适温度为30 ℃;菌株在25 ℃、28 ℃及30 ℃时透明圈和加样孔直径的比值最大,表明菌株MJM 38产生溶栓活性物质的最佳温度为25 ℃~30 ℃.从图6可知,菌株在pH值为7时的吸光度最大,表明菌株MJM 38生长的最佳pH值为7;同时,菌株在pH值为7时透明圈和加样孔直径的比值最大,表明菌株MJM 38产生溶栓活性物质的最佳pH值为7.
3 讨 论
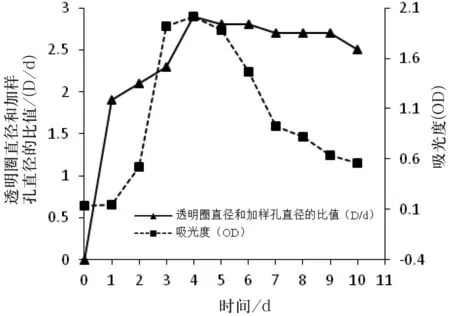
图4 培养时间对溶栓活性的影响及对MJM 38生长的影响
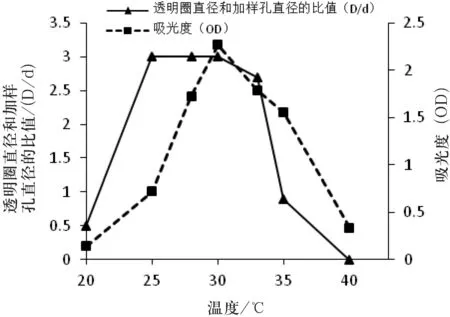
图5 培养温度对溶栓活性的影响及对MJM 38生长的影响
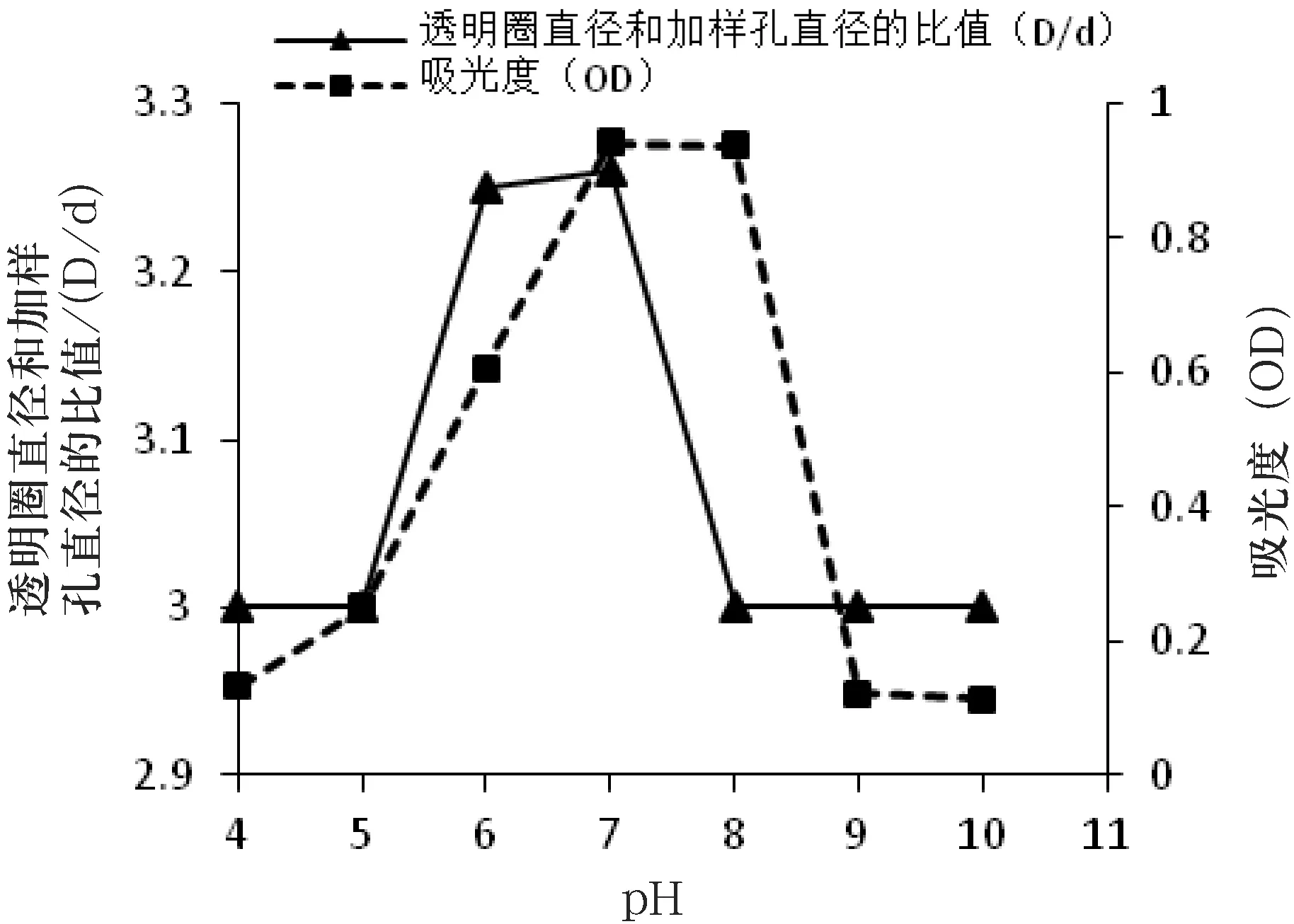
图6 发酵培养基初始pH值对溶栓活性的影响及对MJM 38生长的影响
[1]Sangkhobol V,Skerman V.Chitinophaga.Anewgenusofchitinolyticmyxobacteria[J].Int J Syst Bacteriol,1981,31(3):285-293.
[2]Lee D,Lee J,Lee S.Chitinophagarupissp.Nov.,isolatedfromsoil[J].Int J Syst Evol Microbiol,2009,59(11):2830-2833.
[3]Rio T,Abt B,Spring S,et al.CompletegenomesequenceofChitinophagapinensistypestrain(UQM2034T)[J].Stand Genom Sci,2010,2(1):87-95.
[4]Sly L,Taghavi M,Fegan M.PhylogeneticpositionofChitinophagapinensisintheFlexibacter-Bacteroides-Cytophagaphylum[J].Int J Syst Bacteriol,1999,49(2):479-481.
[5]Peter K,Young C,Sridhar K,et al.TransferofFlexibactersancti,Flexibacterfiliformis,FlexibacterjaponensisandCytophagaarvensicolatothegenusChitinophagaanddescriptionofChitinophagaskermaniisp.Nov.[J].Int J Syst Evol Microbiol,2006,56(9):2223-2228.
[6]Proenca D,Nobre M,Morais P.Chitinophagacostaiisp.Nov.,anendophyteofPinuspinaster,andemendeddescriptionofChitinophaganiabensis[J].Int J Syst Evol Microbiol,2014,64(4):1237-1243.
[7]Li L,Sun L,Shi N,et al.Chitinophagacymbidiisp.Nov.,isolatedfromCymbidiumgoeringiiroots[J].Int J Syst Evol Microbiol,2013,63(5):1800-1804.
[8]杨革.微生物学试验教程[M].北京:科学出版社,2005.
[9]冯广达,陈美标,羊宋贞,等.用于PCR扩增的细菌DNA提取方法比较[J].华南农业大学学报,2013,34(3):439-442.
[10]徐敏,王静,柴子涵,等.海洋细菌脂肪酸的气相色谱分析[J].海洋科学,2013,37(2):76-83.
[11]王玮,张志东,谢玉清,等.液相DNA-DNA杂交实验的研究[J].实验技术与管理,2010,27(11):104-106.
[12]刘冰花,罗亚雄,陶雪梅,等.产高活性抗凝溶栓双活性蛋白的短小芽孢杆菌的筛选及鉴定[J].微生物学报,2014,54(3):345-351.
[13]刘冰花,杨林,袁管明,等.抗凝溶栓双活性蛋白产生菌的选育及发酵条件优化[J].中国医药工业杂志,2014,45(9):822-825.
[14]Takashi F,Masanori O,Yoshimasa K,et al.Flexibacterjaponensissp.nov.,anewSpeciesthatproducesanovelinhibitorofhumanleukocyteelastaseisolatedfromsoil[J].Curr Microbiol,1996,33(2):89-93.
[15]Muhammad Y,Eu J,Geun C,et al.Chitinophagaeiseniaesp.nov.,isolatedfromvermicompost[J].Int J Syst Evol Microbiol,2011,61(10):2373-2378.
[16]Kim M,Jung H.Chitinophagaterraesp.nov.,isolatedfromsoil[J].Int J Syst Evol Microbiol,2014,64(4):1218-1222.
[17]Holt J,Krieg N,Sneath P.Bergey'smanualofdeterminativebacteriology[M].9th Ed. Baltimore:Williams & Wilkins Press,2004.
[18]袁慎亮,邢德明,窦少华,等.一株产纤溶酶菌株的分离鉴定及其纤溶组分分析[J].微生物学通报,2014,41(9):1843-1849.
Identification,Optimization and Preliminary Purification of Active Protein of Chitinophaga Strain
LIUBinghua,YANGLin,LUOLing,PULijuan,CHUYingwen,YANGGang
(School of Medicine, Chengdu University, Chengdu 610106, China)
The paper is going to determine the taxonomic status of the strain which can produce antithrombotic material,optimize the fermentation conditions and preliminarily purify the active substance.The strain MJM 38 is identified by morphological characteristics,physical and chemical properties,fatty acid content,G+C content,16S rRNA sequence homology, phylogenetic tree and DNA-DNA hybridization rate.The fibrinolysis activity is detected by the fibrin plate and the anticoagulant activity is detected by fibrinogen plate.The optimum culture condition for MJM 38 to produce antithrombotic substance is selected by single-factor method.The initial prefractionation of the active substance is done briefly by salting out,hyperfiltration and molecular sieve chromatography,etc.The results show that the strain MJM 38 belongs to Chitinophaga.The antithrombotic activity substance is initially identified as protein and its molecular weight is between 30~100 kDa.It is also found that when the optimum culture conditions for strain MJM38 to produce antithrombotic protein are 4 d,25~30 ℃,and pH 7,the fibrinolysis activity of the antithrombotic substance achieves the maximum.
Chitinophaga;identification;optimization;purification;antithrombotic;protein
2016-12-13.
四川省教育厅自然科学重点课题(12ZA207)资助项目.
刘冰花(1970 — ), 女, 硕士, 教授, 从事药用微生物研究.
1004-5422(2017)01-0001-06
Q939.124
A
