碱胁迫对山桃叶片形态结构及光合特性的影响
2017-04-13刘佳刘雅琴李靖孙淑霞王永清
刘佳,刘雅琴,李靖,孙淑霞,王永清
(1.四川省农业科学院园艺研究所,四川成都610066;2.四川农业大学园艺学院,四川雅安625014;3.四川省农业科学院,四川成都610066)
碱胁迫对山桃叶片形态结构及光合特性的影响
刘佳1,2,刘雅琴3,李靖1,孙淑霞1,王永清2*
(1.四川省农业科学院园艺研究所,四川成都610066;2.四川农业大学园艺学院,四川雅安625014;3.四川省农业科学院,四川成都610066)
为了对山桃的耐碱性进行探讨,本实验以山桃幼苗为材料,在正常管理和碱性土壤2个环境条件下,分别通过叶片结构显微观察、光合参数测定,研究土壤碱胁迫对山桃叶片形态发育特征及光合代谢的影响。结果表明:处理与对照相比,形态结构发生叶片厚度增加、结构更为紧凑、气孔密度增大、角质层增厚等保水性变化;碱胁迫处理12 d后,叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)都相比对照有所下降,而叶片水分利用效率(WUE)略微升高。从以上两个方面综合分析,表明山桃对碱胁迫具有一定的自我调节能力,以适应不良环境。
山桃;碱胁迫;形态结构;光合作用
盐碱土是地球上分布广泛的一种土壤类型,全世界约有9.55×108hm2的土地存在不同程度的盐碱化,中国是世界盐碱地大国,近1/5的耕地正在发生盐碱化及次生盐碱化现象。我国南方桃、李、杏等核果类果树通常以毛桃作为砧木,毛桃耐盐碱性较弱,当土壤pH达到7.5~9.0时,就会普遍表现出明显的缺铁黄化症状,这主要是由于土壤中植物可利用的铁多以Fe2+的形式存在,然而在土壤碱性较高的环境下,不仅使Fe2+氧化为Fe(OH)3沉淀,而且还影响其他铁的溶解途径,降低螯合铁的稳定性,以致铁元素不能被植物充分吸收利用。缺铁性黄化在碱性土壤地区容易发生,果树如果长时间处于碱胁迫状态会造成植株生长势衰弱、早期落叶、落果,对果树种植业造成严重影响。目前许多研究表明碱胁迫对植物造成的伤害要远远大于盐胁迫[1-2]。盐胁迫对植物的伤害主要有渗透胁迫、离子毒害及离子平衡造成营养亏缺等伤害,植物对盐胁迫的生理响应也以消除离子毒害和体内渗透调节为主;而碱胁迫除造成以上中性盐相同的胁迫外,还有高pH胁迫等[3-5]。植物在碱胁迫下最常见和最显著的生理表现是生长受到抑制,对于果树的直接影响就是导致果实产量及品质的降低。果树耐盐碱问题的实际是砧木的耐盐碱问题。优良的砧木品种直接影响果树结果早晚、产量高低及寿命长短,所以选择耐碱性强的砧木,是提高果树品种耐碱性的有效途径。因此,果树砧木耐盐碱性的研究一直是果树研究的重要课题。山桃,属蔷薇科桃属,分布于山西、山东、河南、河北、陕西、甘肃、四川及云南等省,具有良好的耐旱性和抗盐碱性,且与核果类果树嫁接亲和性好,结果早,产量高,是桃、李、杏、樱桃等核果类果树的优良砧木品种。目前,有关山桃逆境生理的研究,方向多集中在盐胁迫和水分胁迫方面,内容多集中于栽培技术、解剖结构、林地水分动态及耗水性能方面[6-8]。有关碱胁迫下,山桃生理适应性方面的相关研究报道很少。本实验以山桃幼苗为对象,研究碱胁迫对山桃形态结构及光合特性的影响,探讨山桃在逆境条件下的生理生态变化,以期为山桃碱胁迫的适应性机制研究提供参考依据。
1 材料与方法
1.1 供试材料与试验设计
2014年11月将山桃种子层积保存,2015年2月中旬将经沙藏萌动的山桃种子播种于直径25 cm的底部带孔瓦盆,装入等量的培养土,培养土由泥炭土∶草炭土=1∶1的比例充分混合而成。待砧木苗长至一定高度后(植株高度15 cm左右),选择大小、长势一致的120株盆栽实生苗进行碱胁迫处理。碱液配方为∶NaHCOs∶Na2CO3=9∶1,浓度为50 mmol/L,pH 9.11±0.104,处理组于晴天下午16∶00以该碱液浇灌土壤,以后每隔3 d用该碱液进行灌根处理,每次直至钵底流出液pH值达到9.0以上为止,另外30株盆栽的山桃实生苗同时用等量清水灌溉作为对照,并以透明塑料薄膜避雨棚遮挡[9]。处理持续12 d,叶片形态结构和光合作用指标于处理的第12天进行观测,每个指标的测定随机取样进行3次重复。
1.2 测定项目与方法
1.2.1 叶片形态结构的观测在碱胁迫处理0 d (对照)、12 d(处理)时,取植株中上部叶片立即进行显微观察:避开叶脉取叶片中央约0.5 cm2的部位进行徒手切片,连续切下数片后,将刀片放在培养皿的水中稍一晃动,切片即漂浮于水中,叶片上下表皮可用镊子撕下进行取样,当取样到一定数量后,可在培养皿内挑选透明的薄片置于载玻片上,滴蒸馏水后用盖玻片封好,在显微镜下镜检,选取叶片厚度、角质层厚度、栅栏组织、海绵组织、表皮细胞、气孔等为观测指标,进行测量、计数、照相。
1.2.2 叶片光合特性的测定采用LI-6400便携式光合测定仪测定光合数据,于晴天测定碱胁迫处理第12天山桃植株下部、中部、上部健康完整具有代表性的叶片(作好记号作为测定对象)的光合参数,重复测试3盆植株,全天观测的时段为7:00-19:00,每2 h观测1次,每片叶重复记录3组数据,观测结果存储于数据Data-log中,导出电脑取平均值。观测因子包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr),并按以下公式计算叶片水分利用效率(WUE)∶WUE=Pn/ T r。
1.3 数据处理
采用Excel 2003软件进行数据整理和图表制作,用SPSS 16.0数据分析软件进行统计分析,采用LSD法对数据进行方差分析和进行差异显著性检验(α=0.05)。
2 结果与分析
2.1 碱胁迫对山桃叶片形态结构的影响
2.1.1 叶片组织解剖结构由图1A~D可以看出:在山桃叶片的组织形态建成过程中,碱胁迫处理与对照相比,叶片厚度有所增加,上、下表皮有些大细胞略微变扁,近似扁平方形或扁圆形,纵/横径变小,细胞壁较厚,其中上表皮细胞较下表皮细胞大,外壁紧密相连,细胞间隙小;叶肉结构比对照较为紧凑,栅栏组织位于上表皮之下,细胞呈长柱形,细胞紧密排列、间隙较小,栅栏组织明显加厚,组织细胞层数基本没有增加,为1~2层,但是组织细胞变得细长,外层栅栏组织细胞比内层栅栏组织细胞相对较长,排列也更为紧密,横纵径比约为1∶4到1∶5。海绵组织细胞多数呈椭圆或近圆形,少数形状不规则,海绵组织细胞略微变小,海绵组织结构变得紧密,叶室空间减小十分明显,栅栏组织厚度与海绵组织厚度比增大。
对照叶片结构表现为厚度较小,上表皮细胞较大,下表皮细胞较小,叶肉结构有序,栅栏组织细胞横纵径比相对较大约为1/3~1/2,海绵组织排列松散,叶室空间较大,栅栏织厚度与海绵组织厚度比较小。

图1 对照和碱胁迫处理对山桃叶片显微结构的影响Fig.1 Effects of control and alkali stress treatments on leafmicrostructure of Prunus davidiana(Carr.)
2.1.2 叶片气孔特征由图1E、F可知,山桃叶片下表皮中散有大量气孔分布,对照与碱胁迫处理山桃叶片间气孔密度存在明显差异,碱胁迫处理的叶片气孔密度有较大程度的增加;叶片气孔大小(长度×宽度)也差异明显,碱胁迫下山桃叶片气孔长度和宽度都明显下降,气孔体积明显变小;胁迫处理还在一定程度上降低了山桃叶片的气孔开张比和开张度,碱胁迫下气孔几乎完全关闭,而对照中有少量的气孔处于半关闭状态。
2.1.3 叶片角质层厚度山桃叶片上下表皮细胞均被有角质层,上角质层厚度大于下角质层厚度,由图1G、H可以看出,与对照相比,碱胁迫下山桃叶片角质层厚度有不同程度的增加。
2.2 碱胁迫对山桃叶片光合特性的影响
2.2.1 光合速率(Pn)日变化由2A可以看出,对照山桃的净光合速率日变化呈现出明显的双峰曲线,处理双峰曲线相对不明显,净光合速率在上午和下午时段各出现1个最大值,上午时段最大值出现在9:00左右,下午时段出现在15:00左右,第2峰值比第1峰值稍高,在中午前后净光合速率下降,出现明显“午睡”现象;从7:00到19:00,碱胁迫处理的山桃净光合速率一直维持在低于对照的水平,处理的净光合速率日均值比对照降低了19.27 %。说明碱胁迫不利于山桃光合作用的进行,显著抑制了山桃叶片的光合碳同化能力。
2.2.2 气孔导度(Cs)日变化如图2B所示,气孔导度的变化规律与光合速率的日变化基本一致,呈平行变化趋势,对照气孔导度的日变化曲线呈明显双峰型,早晨气孔导度较低,随着气温和光合有效辐射的增强,气孔导度逐渐增大,9:00左右开始下降,13:00后又开始回升,到15:00左右出现次高峰,之后随着大气湿度的降低,诱导叶表气孔关闭,气孔导度减小。碱胁迫下山桃叶片气孔导度在上午9:00左右出现一个峰值后,一直维持在较低水平,各时间段均显著低于同期相应对照,最大值比对照降低了210.75%。以上结果表明,山桃气孔对碱胁迫的反应较为敏感,碱胁迫下气孔开度变小,山桃自身可以通过控制气孔开放程度以适应碱胁迫的不良环境;叶片气孔导度的日变化与光合速率的日变化有较强的正相关关系。
2.2.3 胞间CO2浓度(Ci)日变化如图2C所示,山桃叶片的胞间CO2浓度日变化类型与净光合速率的基本相反,整体表现出早上和晚上较高、中午较低的变化规律,从9:00至15:00变化较为平稳,处理和对照的胞间CO2浓度谷值均出现在13:00,15:00以后处理胞间CO2浓度略高于对照。结合气孔导度的变化趋势分析,说明碱胁迫条件下气孔在控制CO2出入叶片方面发挥着重要作用。
2.2.4 蒸腾速率(Tr)日变化蒸腾作用是一个复杂的生理过程和物理过程,受多种因素的控制,如图2D所示,山桃蒸腾速率的日变化和其它生理过程一样,表现出周期性变化:处理和对照蒸腾速率的日变化均呈“单峰”型曲线,对照蒸腾速率7:00-9:00变化不明显,之后迅速上升,9:00-11:00维持较高水平,之后直线下降,15:00以后下降幅度缓慢,随环境因子变化波动不明显;与对照相比,胁迫处理山桃叶片蒸腾速率一直低于对照,峰值明显降低,且峰出现的时间滞后。以上结果说明,在碱胁迫下,山桃蒸腾速率受到明显的抑制,山桃在碱胁迫下能够适当调整蒸腾速率来适应土壤水分亏缺,形成一种蒸腾生理调节机制,表现出对逆境较强的适应能力。
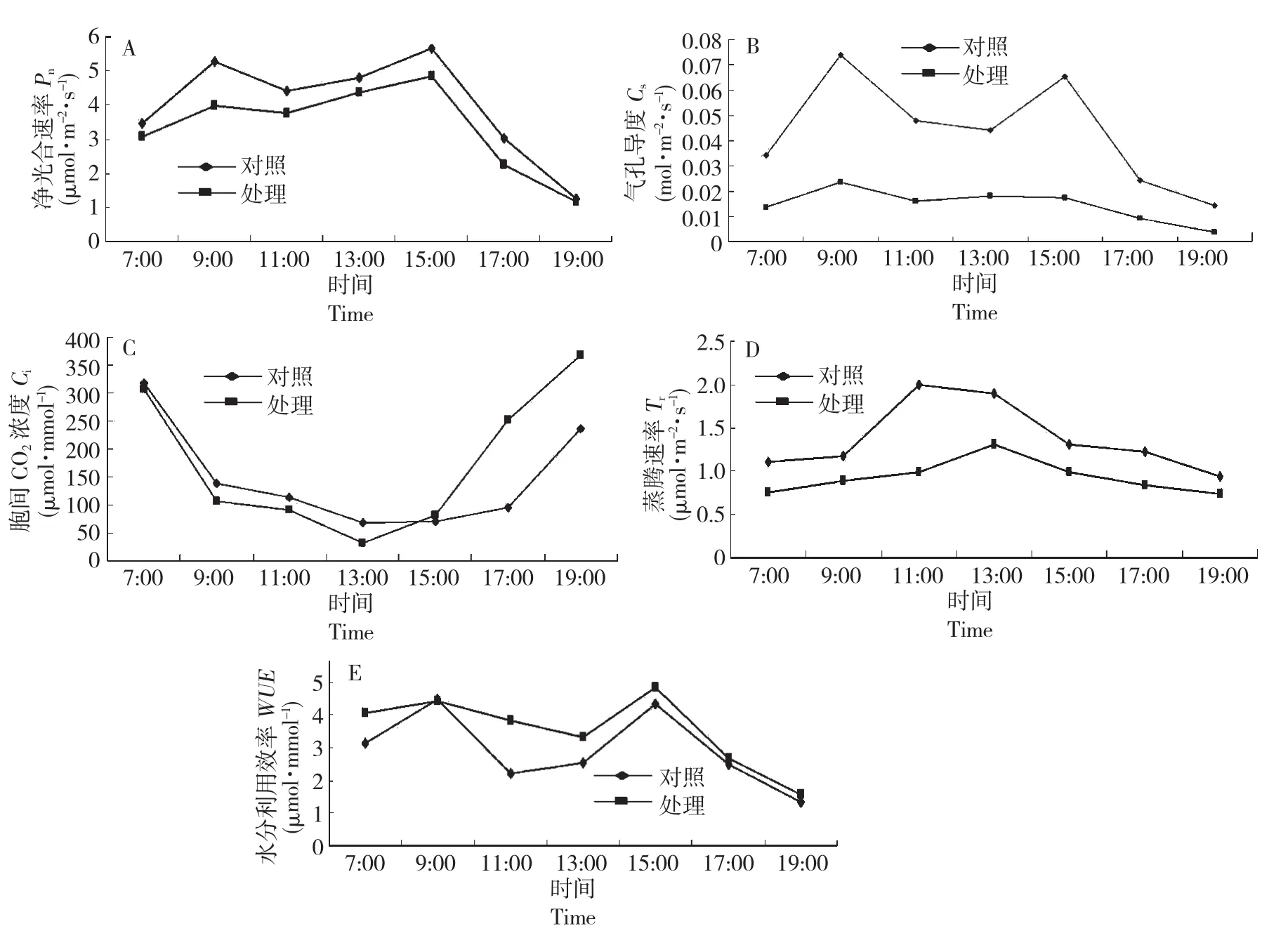
图2 对照和碱胁迫处理对山桃叶片光合特性的影响Fig.2 Effects of control and alkali stress treatments on photosynthetic characteristics of Prunus davidiana(Carr.)
2.2.5 水分利用率(WUE)日变化水分利用效率是植物光合与蒸腾特性的综合反映,反映了植物对水分的利用率,也是深入研究植物高效利用水资源、评价植物生长适宜程度的综合指标。如图2E所示,山桃水分利用效率在上午和下午时段各出现一个最大值,上午时段最大值出现在9:00,因为此时光合有效辐射较强,气孔的开度较大,净光合速率增加较快,空气相对湿度较大,蒸腾速率处于较低的水平,所以水分利用效率最高,下午时段最大值出现在15:00,第1峰值对照稍高于处理,第2峰值处理高于对照,其余时段处理水分利用效率均稍高于对照,碱胁迫下山桃的水分利用效率日均值与对照相差不大,是对照的1.22倍。可见山桃在一天中对水分的有效利用有明显时段性,碱胁迫在一定程度上提高了山桃对水分的利用率,山桃在保证不明显影响光合速率的同时,尽量降低自身蒸腾速率,导致水分利用效率升高,说明山桃对碱胁迫环境具有一定的调节适应能力。
3 讨论
3.1 碱胁迫对山桃叶片形态结构的影响
叶片通过光合作用将活跃的太阳能转化为稳定的化学能,为整个植物体提供赖以生存的能量基础,作为植物进行光合作用和蒸腾作用的主要器官,叶片的结构特征在一定程度上能反映植物抗逆性的大小。有学者认为在组织形态建成过程中,叶片会因土壤水分状况的变化而改变其建成方向,形成与水分条件相适应的显微结构,从而增强抗旱能力。本研究中也表现出叶片解剖结构的变化,在碱胁迫条件下,山桃叶片增厚、上表皮细胞大于下表皮细胞、栅栏组织发达、海绵组织紧密、角质层增厚等,这些结构上的改变可以较好地控制植物与环境之间的水分交换,调节植物体温,增强储水功能,在防止叶片水分流失的过程中起到了关键作用,这与曲桂敏等对苹果的研究结果基本一致[10]。
气孔是植物叶片上一个重要结构,叶面上气孔的数目及大小与蒸腾强度、光合作用和呼吸作用都有密切关系。植物在适应生存环境的过程中气孔分布会发生一些变化,本研究中山桃气孔均位于下表皮且居于表皮细胞水平下面,下陷较深,可造成较湿润的小环境,从而减少蒸腾造成的水分散失;气孔密度增大可能与碱胁迫使叶面积变小,从而提高了单位叶面积上的气孔数目有一定的关系;气孔体积及开张程度减小可减少水分蒸发。孟庆杰等的研究还揭示,气孔分布密度高可以把热量散开掉,从而避免因热害引起的原生质和叶绿体的变性[11]。
目前,在葡萄、核桃、桃、苹果、梨、荔枝等果树上已经有关于植物叶片结构在逆境中变化的报道,并且学术界对植物抗逆的一些典型结构特征已达成一致观点[12-13]。一些对蔷薇科果树研究表明,在不同水分胁迫处理水平下,新根皮层靠近内皮层的几层细胞均会出现细胞壁增厚现象,但其具体规律尚未弄清,有待进一步研究[14]。近年,对于叶片在逆境下超微结构的变化研究热点集中在叶绿体上,因为叶绿体的结构和功能对许多环境胁迫很敏感,简令成等研究指出,干旱、低温和盐胁迫均可引起叶绿体膨胀、类囊体腔扩大、基质片层空间增大、片层排列方向改变,类囊体排列出现“扭曲现象”等超微结构的变化[15]。武玉叶和于海秋等分别在小麦和玉米叶片的研究中也得出相似结论[16-17]。
3.2 碱胁迫对山桃叶片光合特性的影响
植物光合作用是对环境变化较为敏感的生理过程,受到光照强度、温度、水分等许多环境因素的影响,在逆境条件下中,植物自身会沿着有利于光合作用的方向发展以适应环境变化[18-19]。气孔是植物与外界联系的通道,它直接影响和控制着植物的蒸腾作用和光合作用。本研究结果表明,碱胁迫显著影响了山桃的光合作用、胞间CO2浓度、蒸腾作用、气孔导度及水分利用效率。本研究中,上午胞间CO2浓度随气孔导度下降而下降,下午胞间CO2浓度随气孔导度降低而升高,可见山桃午前光合速率的降低主要由气孔因素引起,随着光照环境的增强,逐渐由气孔限制为主向非气孔限制为主转变,期间可能还存在非气孔限制参与且作用不大的过渡阶段,这与Farquhar、Sharkey等的研究观点相吻合[20]。在重度干旱下,植物净光合速率的降低不仅仅是由于气孔的收缩,而且还有光合器官的结构受到损伤这一因素。许多研究表明,逆境胁迫引起植物光合速率下降,CO2同化减少,吸收光能过剩,加速活性氧形成,活性氧引起光合色素严重降解和膜脂过氧化,破坏光合机构膜系统和电子传递,降低表观量子效率和光化学效率[21-23]。表观量子效率和光化学效率是非气孔限制的显著标志,可通过测定这些指标进一步研究山桃在碱胁迫下非气孔限制形成的深层原因。
蒸腾速率午间降低是植物通过关闭气孔来适应叶片过度蒸腾失水的一种生态适应对策。碱胁迫对气孔导度产生明显影响,而H2O的气孔扩散速率是CO2的1.56倍,所以气孔导度的降低对蒸腾速率的影响比净光合速率要大,即水分散失对气孔开度的依赖程度大于光合作用对气孔的依赖[24]。本实验中,山桃在碱胁迫下,叶片Tr在中午出现下降趋势,说明山桃能够适当调整Tr以达到降低叶温的目的,山桃在不显著影响光合速率的前提下,尽可能地降低蒸腾速率,这是植物适应逆境的一种重要机制。
叶片水分利用效率是净光合速率与蒸腾速率的比值,它表征植物对自身蒸腾耗水的利用能力,WUE的变化是植物抗逆策略的重要组成部分。植物能否适应逆境胁迫环境,最主要是看它们能否很好地协调碳同化和水分消耗之间的关系,也就是说水分利用效率是其生存的关键因素。在一定的水分胁迫范围内,当叶片气孔开度减少,蒸腾速率下降时,净光合速率也随之下降,然而水分利用效率却有所升高。这在许多试验中有过报道[25-27],本研究结果也支持以上观点,即适度的碱胁迫能够提高山桃叶片的水分利用效率。提高水分利用效率是植物在水分胁迫下忍耐逆境的一个适应方式,逆境环境下,水分利用效率的高低取决于二者被影响的程度,植物对环境的适应使得水分利用效率达到最高,即气孔导度对植物在得到CO2和失去水分的调节中符合最优控制原则[28],以保持苗木生长与水分消耗的平衡。
4 结论
4.1 碱胁迫对山桃叶片形态结构的影响
叶片作为植物同化作用的主要器官,对环境的变化最为敏感,其变异性也相对较大,所以从叶解剖结构特征研究植物抗逆性具有重大意义,本实验中山桃在抵抗碱胁迫的过程中通过叶片结构的变化适应不良环境,说明山桃对碱胁迫具有一定的抵抗能力。植物对逆境的适应性生长,对植物本身的逆境生存和延续,以及保证农业生产丰收都具有重要意义,进一步证明了结构与功能相统一的观点。
4.2 碱胁迫对山桃叶片光合特性的影响
水分利用效率是反映植物生长发育过程中水分利用状况的重要指标之一,它与植物的抗逆性有很强的相关性,提高植物的水分利用效率可以延长生长季节和抵御致命的水分胁迫。WUE在碱胁迫下的变化说明山桃对碱胁迫的环境具有一定的生态适应性,但碱胁迫对光合作用的影响颇为复杂,涉及到植物本身的基因型差异、生长发育状况、土肥条件、生长环境以及光能和水分利用效率等,综合作用之间的相关性还需做更深入的研究。另外,在田间调查时也发现,山桃多分布于阳坡、半阳坡或土壤脊薄的开阔地上,而在土壤水分较为充足的阴坡生长势相对较弱,这也从另一方面证实山桃能够在适度水分胁迫下降低Pn和Tr以提高其WUE,最终增强抗逆性来适应环境。
[1]ShiD C,Sheng Y M.Effect of various salt-alkalinemixed stress conditions on sunflower seedling and analysis of their stress factors[J].Environmental and Experimental Botany,2005,54:8-21.
[2]Tang C,Turner N C.The influence of alkalinity and water stress on the stomatal conductance,photosynthetic rate and growth of Lupinus augustifolius L.and Lupinus pilosus Murr[J].Australian Journal of Experimental Agriculture,1999,39:457-464.
[3]Zhu JK.Regulation of ion homeostasis under salt stress[J].Current Opinion in Plant Biology,2003(6):441-445.
[4]Munns R,Tester M.Mechanisms of salinity tolerance[J].Annual Review of Plant Biology,2008,59:651-681.
[5]Zhu JK.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology,2002,53:247-273.
[6]程积民,万惠娥,王静.黄土丘陵区山桃灌木林地土壤水分过耗与调控恢复[J].土壤学报,2003,40(5):691-696.
[7]Wang QC,Sun ZH,Zhang Y D.Adaptive responsesof Acer ginnala,Pyrusus suriensis and Prunu davidiana seedlings to soil moisture stress[J].Journal of Forestry Research,2003,14(4):280-284.
[8]Ohta S,Nishttant C,Yamamoto T.Chloroplast microsatellites in Prunus Rosaceae[J].Molecular Ecology Notes,2005,5(4):837-840.
[9]赵丽君,阿布都外力·木米尼,曲艳华,等.山桃抗盐碱性评价[J].北京农学院学报,2014,29(4):87-90.
[10]曲桂敏,李兴国,赵飞,等.水分胁迫对苹果叶片和新根显微结构的影响[J].园艺学报,1999,26(3):147-151.
[11]孟庆杰,王光全,董绍锋,等.桃叶片组织解剖结构特征与其抗旱性关系的研究[J].干旱地区农业研究,2004,22(3):123-126.
[12]樊卫国,李迎春.部分梨砧木的叶片组织结构与抗旱性的关系[J].果树学报,2007,25(1):17-21.
[13]陈立松,刘星辉.水分胁迫对荔枝叶片超微结构的影响[J].福建农业大学学报,2001,30(2):171-174.
[14]Nii N.Yamaguchi and Nishimura.Changes in carbohydrate and ribulose bisphosphata carboxylase-oxygenase contents in peach leaves after applications of different amount of nitrogen fertilizer[J].J.Japan.Soc.Hort.Sci.,1997(66):505-511.
[15]简令成,王红.逆境植物细胞生物学[M].北京:科学出版社,2009:115-227.
[16]武玉叶,李德全.土壤水分胁迫对冬小麦叶片渗透调节及叶绿体超微结构的影响[J].华北农学报,2001,16(2):87-93.
[17]于海秋,王晓磊,蒋春姬.土壤干旱下玉米幼苗解剖结构的伤害进程[J].干旱地区农业研究,2008,26(5):143-147.
[18]S ILVIA A,MA RTA C,MONICA G,et al.Estimation of Mediterranean forest transpiration and photosynthesis through the use of an ecosystem simulation model driven by remotely sensed data[J].Global Ecology and Biogeography,2004,13(4):371-380.
[19]MELANIED J,THOM ASC H.Nickel toxicity in mycorrhizal birch seedlings infected with Lactar iusrufus or Scleroderma flavidum.I.Effects on growth,photosynthesis,respiration and transpiration[J].New Phytologist,1988,108(4):451-459.
[20]FA RQUH AR G D,SH ARKE Y T D.Stomatal conductance and photosynthesis[J].Annual Review of Physiology,1982,33:317-345.
[21]ASADA K.The water-water cycle in chloroplasts:scavenging of active oxygens and dissipation of excess photons[J].Annu.Rev.Plant-Physiol.Plant Mol.Biol.,1999,50:601-639.
[22]LIMA A L S,DAMATTA FM,PINHEIRO H A.Photochemical responses and oxidative stress in two clones of Coffea can phoraunder water deficit conditions[J].Environmental and Experimental Botany,2002,47:239-247.
[23]SOUZA R P,MACHADO E C,SILVA JA B,et al.Photosynthetic gas exchange,chlorophyll fluorescence and some associatedmetabolic changes in cowpea(Vigna unguiculata)during water stress and recovery[J].Environmental and Experimental Botany,2004,51:45-56.
[24]赵平,曾小平,彭少麟,等.海南红豆夏季叶片气体交换﹑气孔导度和水分利用率的日变化[J].热带亚热带植物学报,2000,8(1):35-42.
[25]C ENT RIT TO M,LO RETO F,MASSACCI A,et al.Improved growth and water use efficiency of cherry saplingsunder reduced light intensity[J].Ecological Research,2000,15(4):385-392.
[26]MONC LUSR,DREYER E,VILLARM,etal.Impactof droughton productivity and water use efficiency in 29 genotypes of Populus deltoides×Populus nigra[J].New Phytologist,2006,169(4):765-777.
[27]GAL L A,H ALDIMANN P,FE LLER U.Photosynthetic performance and water relations in young pubescentoak(Quercuspubescens) trees during drought stress and recovery[J].New Phytologist,2007,174(4):799-810.
[28]ELIZABET H A A,ALIS TAIR R.The response of photosynthesis and stomatal conduct ancesto rising CO2:Mechanisms and environmental interactions[J].Plant,Cell and Environment,2007,30(3): 25-270.
(责任编辑 李洁)
Effects of Alkali Stress on Prunus davidiana(Carr.)Leaf M orphological Structure and Photosynthetic Characteristics
LIU Jia1,2,LIU Ya-qin3,LIJing1,SUN Shu-xia1,WANG Yong-qing2*
(1.Horticulture Institute,Sichuan Academy of Agricultural Sciences,Sichuan Chengdu 610066,China;2.College of Horticulture,Sichuan Agricultural University,Sichuan Ya’an 625014,China;3.Key Laboratory of Horticultural Crops Biology and Germplasm Enhancement in Southwest,Ministry of Agriculture,Sichuan Chengdu 610066,China)
In order to research the alkali resistance of Prunus davidiana,taking Prunus davidiana(Carr.)seedling as testmaterial,through method of lightmicroscope observation and determination of the photosynthetic indexes,effect of lamina anatomical structure and photosynthetic characterwere analyzed under the normalmanagement and alkaline soil two environmental conditions.The results showed that:under alkali stress,leaf thickness increased,the structure wasmore compact,stomatal density increased,corneous layer thickened;Compared with control(CK),net photosynthetic rate(Pn),transpiration rate(Tr),stomatal conductance(Cs)and intercellular CO2concentration(Ci) were decreased under alkali stress after 12 days,while thewater use efficiency(WUE)was increased.Comprehensive analysis from the above two aspects,which indicates that Prunus davidiana(Carr.)to alkali stress had a certain self-adjustment ability,so as to adapt to bad environment.
Prunus davidiana(Carr.);Alkali stress;Morphological structure;Photosynthesis
S662.1
A
1001-4829(2017)2-0327-06
10.16213/j.cnki.scjas.2017.2.015
2016-04-12
成都市农业技术研发项目(2015-NY02-00026-NC);四川省财政创新能力提升工程专项资金项目(2015QNJJ-010)
刘佳(1983-),女,四川成都人,助理研究员,主要从事李、杏栽培、育种、生理与分子生物学研究,E-mail:nky_lj @163.com,*为通讯作者:王永清(1976-),男,研究员,主要从事果树栽培、育种与推广等科研工作。
