紫红叶油菜叶片花青素的含量变化及其稳定性
2017-04-13唐容黄泽素代文东李德珍王少铭
唐容,黄泽素,代文东,李德珍,王少铭
(贵州省油料研究所,贵州贵阳550006)
紫红叶油菜叶片花青素的含量变化及其稳定性
唐容,黄泽素,代文东,李德珍,王少铭
(贵州省油料研究所,贵州贵阳550006)
为紫红叶甘蓝型油菜花青素在食品与保健品生产应用上提供参考,在不同温度、遮光条件下研究紫红叶甘蓝型油菜叶片的花青素含量变化。结果表明:田间的紫红叶油菜花青素含量依次为苗期>抽苔期>花期,苗期花青素含量达4.90[(A530-0.25 ×A657)/g];在低温处理和遮光处理的条件下花青素的含量增加,在2℃处理12 d花青素含量最高,达7.49[(A530-0.25×A657)/ g]。说明,紫红叶甘蓝型油菜花青素可增加油菜的抗逆性;同时低温处理可提高紫红叶甘蓝型油菜的花青素含量。紫红叶油菜的花青素提取物在60、80、90℃煮1 h,花青素降解程度较小,说明,紫红叶甘蓝型油菜的花青素的稳定性较好;当在沸水煮1 h后,紫红叶甘蓝型油菜的花青素逐渐降解。紫红叶油菜花青素在pH 2.0、pH 3.6和pH 7.4的环境中较稳定。说明,紫红叶油菜的花青素有在食品生产中应用的特质。
油菜;紫红叶;花青素;pH;温度;稳定性
紫红叶甘蓝型油菜是甘蓝型油菜(Brassica napus L.)与红菜薹(B.campestris L.ssp.Chinensis L.var.utilis Tsen et Lee.2n=2 X=20)种间远缘杂交,从而将红菜薹紫红叶色基因导入油菜品种中,通过连续定向培育而成的甘蓝型油菜特殊标记基因材料[1]。甘蓝型紫红叶油菜含有较高的花青素,其苗期全株为紫红色,其他性状与甘蓝型油菜性状完全相似,苗期作食用蔬菜(炒、煮皆宜)口感较好。黄泽素等[2-3]对紫红叶甘蓝型油菜的研究主要在紫红叶色遗传研究和品种选育转育上,紫红叶油菜花青素含量及其稳定性尚未涉及。
花青素是由糖苷配基和糖组成的一类化合物,广泛存在于植物的花、果实、茎、叶和根器官的细胞液中,使其呈现由红、紫红到蓝等不同颜色。一般情况下为水溶性,但受pH影响会变色,酸性呈红色,碱性呈蓝色。在自然界中分布广泛,构成了植物王国中绝大多数品种的蓝色、红色、紫色和黄色等。其具有抗氧化和消除自由基、降低血清和肝脏中脂肪含量、抗突变、抗肿瘤、防止人体内过氧化、提高视力等功能。作为一种天然食用色素,花青素安全、无毒、资源丰富,具有一定营养和药理作用,在食品、化妆品和医药领域有着巨大应用潜力[4-5]。目前,国内研究者已申请专利的色素有萝卜红[6]、越橘红[7]、黑豆红[8]、红米红[9]和高粱红(Pg)[10]等。其中红米红、高梁红和甜菜红每年约产200、45和20 t[11],而紫红叶甘蓝型油菜提取花青素的利用却未见报道。
花青素的稳定性受环境影响很大,花青素在不同pH下,其结构在醌型碱、黄洋盐阳离子、假碱与查耳酮4种结构间发生转换[12]。随着对食品安全及健康的关注日益增加,花青素作为天然健康的植物色素,其在食品加工方面同样具有广阔的应用前景。尽管花青素在自然界含量丰富,但由于花青素的稳定性问题,至今还未能得到广泛应用。同时,近年来的研究发现,花青素的生物可利用度很低[13],这可能与其低稳定性有一定关系。要充分开发紫红叶甘蓝型油菜的花青素为天然色素的应用及深入研究其花青素的生物可利用度,对该花青素的稳定性研究必不可少。因此,笔者研究提升紫红叶甘蓝型油菜的花青素含量;比较紫红叶甘蓝型油菜的花青素在不同pH、不同温度条件下的稳定性,为紫红叶甘蓝型油菜花青素在食品与保健品的生产应用上提供参考。
1 材料与方法
1.1 试验材料
200份紫红叶材料叶色分4种类型(图1),各类型选择3个材料,紫色(紫05、紫39、紫84)、浅紫色(紫03、紫11、紫40),叶脉浅紫色(紫118、紫72、Q60),绿色(紫21、紫23、Q63)。
1.2 试验时间、地点
于2012年10月底种植于贵州省农业科学院试验田,研究试验于2012年10月至2014年6月在贵州省油料研究所实验室进行(图1)。
1.3 测定项目与方法

图1 苗期不同叶色的紫红叶油菜株系Fig.1 Leaf color of different rapeseed lineswith purple-red leaves at seedling stage
1.3.1 花青素提取及含量测定试验材料于田间现采现做,从每株心叶倒数第4片叶子采样,混合装样,3次重复。同时将12份材料分别取2苗栽入盆中,3次重复,在不同生育时期(苗期、蕾苔期、开花期)分别放在2、10、20、30℃和遮光20%、40%条件下处理12 d,然后研究其花青素的含量变化。花青素的提取方法参照Mehrtens[14],取0.3 g(混合样)的新鲜叶片放入1 mL 1%的HCl-甲醇溶液(1 %HCl,m/v)提取花青素,样品在室温下摇动(50 r/ min)18 h,样品材料通过离心(14 000 r/min),室温下沉淀1 min,取出0.4mL的上清液加至0.6mL的1%的HCl-甲醇溶液中。在530~657 nm吸收波长测定提取液(UV-2102C型紫外可见分光光度计)。以1%的HCl-甲醇溶液为空白对照。花青素的计算公式为QAnthocyanins=(ODA530-0.25×ODA657)/M,其中QAnthocyanins是花青素的含量,ODA530和ODA657是吸收的波长的OD值,M则为所取样品的重量(g)。所有样品均3次重复测量。
1.3.2 花青素在不同温度和紫外光照射条件下的稳定性将紫红叶甘蓝型油菜花青素的提取液分别滴入25、40、60、80、90、100℃等不同温度的双蒸水中1 h,然后测量其花青素含量;将紫红叶甘蓝型油菜花青素的提取液放置在紫外灯下4和52 h,然后测其花青素含量。
1.3.3 花青素在不同pH条件下的稳定性Passa-monti研究表明[15],花青素被人体摄入后要先经过胃部的吸收,而胃内的pH约为2.0,大多的果汁饮料的酸度约为pH 3.6,而人的正常生理pH为7.4,为此选取在pH分别为2.0、3.6与7.4这3个pH值条件比较研究紫红叶甘蓝型油菜花青素的稳定性。
分别配制pH 2.0、3.6和7.4的缓冲液:pH 2.0的缓冲溶液:甲液,磷酸16.6 mL用水稀释至1000 mL;乙液,称取7.16 g磷酸氢二钠,用100 mL蒸馏水溶解;分别取甲液72.5 mL与乙液27.5 mL混合。pH3.6的缓冲溶液:2.46 g醋酸钠加水定容至100 mL,用12 mol/L浓盐酸调至pH 3.6。pH 7.4的缓冲溶液:0.5928 g磷酸二氢钠和5.8019 g磷酸氢二钠加100 mL水溶解得到。
将紫红叶油菜花青素的提取物滴入上述不同pH的缓冲溶液中,配制成起始最大吸光度均为1.15A的溶液,放置于25℃的水浴中,设计不同的时间(0、7和14 d,0、12、48和96 h)用紫外分光光度计对花青素溶液进行全扫描(300~700 nm),根据其在可见光区的最大吸收波长λmax的变化和可见光区的最大吸收波长下的吸光度值衰减率。ΔA%和BI值对其稳定性进行比较。
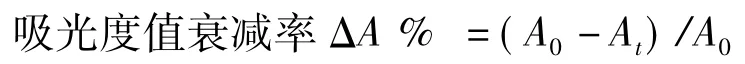
式中,A0起始时可见光区的最大吸光度;At为在t时在可见光区的最大吸光度。

式中,A430nm为430 nm的吸光度;Amax为可见光区的最大吸光度值。
据文献[16],吸光度值衰减率ΔA%越大说明花青素降解的越快,BI值越大,花青素的含量也就越低。
2 结果与分析
2.1 不同叶色、不同时期紫红叶油菜花青素的含量
由表1、图2可见,紫红叶油菜花青素的含量变化情况。
(1)大田。紫红叶油菜的花青素含量为苗期>抽苔期>花期,苗期花青素的含量达4.90[(A530-0.25×A657)/g],随着生育期的推进,在抽苔期和开花期其花青素的含量逐渐降低,这与大田观测的紫红叶油菜叶片随着植株长大叶色逐渐变淡,到开花期逐渐转绿相一致。紫红叶油菜叶片花青素的含量,紫叶最高,浅紫稍次之,叶脉浅紫仅稍高于绿叶,叶色越深花青素含量越高,绿叶的花青素含量很少,为0.39[(A530-0.25×A657)/g]。因此,选叶色较深的、苗期紫红叶甘蓝型油菜提取花青素,才能高产。紫红叶甘蓝型油菜从播种到大苗,只需30~45 d,生产周期较短。
(2)低温处理。低温条件下花青素的含量增加,故提取花青素时,可低温处理材料,从而提高花青素产量;花青素含量2℃条件下,最高可达7.49[(A530-0.25×A657)/g],紫红油菜的叶色在低温下变紫,说明油菜花青素可抗逆;随着处理温度的升高,被处理的紫红叶油菜的花青素含量逐下降,叶色越紫花青素含量下降得越多。而绿叶的花青素含量则变化不大。同在低温处理条件下,紫红油菜花青素的含量为紫叶>浅紫>叶脉浅紫>绿叶,紫红叶油菜的叶片紫色越深,其花青素含量增加越多。其中绿叶型的紫红叶油菜的花青素含量变化较小。
(3)遮光处理。不同生育时期的紫红叶油菜叶片的紫色越深,花青素含量越高,再次说明花青素具有抗逆的功效。在不同生育时期的紫红叶油菜的花青素含量逐渐下降,叶色越紫花青素含量下降越多。

表1 不同叶色的紫红叶油菜的花青素含量Table 1 Anthocyanin content in different leaf color of rapeseed with purple-red leaves
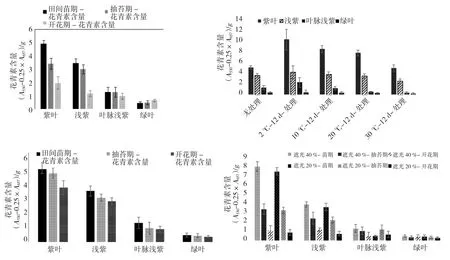
图2 不同处理条件下紫红叶油菜花青素的含量Fig.2 Anthocyanin content in rapeseed with purple-red leaves under different treatment conditions
(4)紫外光处理。紫红叶甘蓝型油菜的花青素放存放4和52 h,表明紫红叶甘蓝型油菜的花青素稳定性受光影响较少,在紫外光下放置52 h其相对保存率仍有75%以上,放置时间越长,花青素降越多。
2.2 不同处理紫红叶油菜花青素的稳定性
2.2.1 温度从图3可看出,当紫红叶甘蓝型油菜的花青素用25~90℃煮1 h时,紫红叶甘蓝型油菜的花青素含量从4.90~4.35[(A530-0.25×A657)/ g],花青素略有降解,但降解幅度较小大,当沸水浴1 h以内花青素保存率仍有100℃时,花青素含量为3.68[(A530-0.25×A657)/g],花青素的保存率为75%,紫红叶甘蓝型油菜的花青素降解速度加快,但生活中高温时间一般较短,紫红叶甘蓝型油菜的花青素保存率也能维持较高的水平。各叶色对比,浅紫叶油菜的花青素降解得较快。

图3 不同温度处理紫红叶油菜花青素的稳定性Fig.3 Anthocyanin stability of rapeseed with purple-red leaves under different temperature treatment
2.2.2 pH由表2可看出,在pH 2.0条件下,紫红叶油菜花青素提取物的ΔA%的值为负值,表明可见光区的最大吸光度值随时间的增加而增大,Revilla发现[17],当盐酸浓度达到0.12 mol/L时,葡萄花色苷的酰基化基团发生部分的断裂,故紫红叶油菜花青素在pH 2.0条件下最大吸光度值增加的现象可能是酰基花青素的的部分降解导致花青素结构改变,引起摩尔吸光系数的改变造成。在pH 2.0条件下,紫红叶油菜花青素提取物的λmax与BI值均无明显变化,对紫红叶油菜花青素提取物在该pH条件下的ΔA%比较发现,7和14 d后花青素的ΔA %值分别为-31.3%和-25.62%。pH 3.6的条件下,紫红叶油菜花青素提取物的λmax均无变化,紫红叶油菜花青素提取物7和14 d后花青素的ΔA%值分别为2.96%和8.70%,紫红叶油菜花青素提取物的BI值均<0.28,同时紫红叶油菜花青素提取物的BI值都随着时间而不断增大,但变化不明显。表明,紫红叶油菜花青素提取物在pH 3.6的条件下比在pH 2.0条件下稳定。
由表2可见,紫红叶甘蓝型油菜的花青素放置6、24、48和96 h后的ΔA%值分别为28.78%、41.13%、55.13%和65.13%,BI分别为0.27,0.30、0.36和0.45,紫红叶甘蓝型油菜的花青素放置24 h后,λmax由595 nm变为606 nm,BI值由0.24变为0.30,λmax变化不大。表明,在pH 7.4的条件下,紫红叶甘蓝型油菜的花青素的稳定性较好。pH 7.4的可见光区的最大吸光度值的变化率与最大吸收波长明显比pH 2.0与3.6大,BI值也是如此,从放置的时间看,紫红叶甘蓝型油菜的花青素在pH 2.0与3.6比pH 7.4时更加的稳定。

表2 紫红叶甘蓝型油菜花青素提取物在pH 2.0、pH 3.6和pH 7.4条件下的稳定性Table 2 Stability of athocyanin solution extracted from rapeseed with purple leaves at pH 2.0,pH 3.6 and pH 7.4
从图4可看出,紫红叶油菜花青素有一个吸收峰,吸收峰随放置时间变化从595~607 nm。在pH =7.4的条件下紫红叶油菜花青素在放置24 h后可见光区较明显。
3 小结

图4 紫红叶甘蓝型油菜花青素在pH 7.4时300~700 nm的吸光度Fig.4 Absorbancy of anthocyanin extracted from rapeseed with purple-red leaves under the conditions of 300-700 nm and pH 7.4
期短,低温可促进紫紫红叶甘蓝型油菜的花青素的合成,从而增加花青素的产量。紫红叶油菜的花青素在pH 2.0、3.6、7.4的条件下都较稳定,为开拓紫红叶油菜花青素的用途提供有效证据。总体来说,与其他天然色素相比,紫红叶甘蓝型油菜的花青素具有原料来源方便、廉价、低成本、无污染等特点,且稳定性好,抗光氧化性较强,开发应用前景广阔。
[1]代文东,黄泽素,唐容,等.优质甘蓝型紫红叶标记油菜的选育[J].贵州农业科学,2009,37(9):16-18.
[2]黄泽素,王通强,杨晓容,等.甘蓝型油菜紫红叶标记性状的遗传及利用探讨[J].种子,2006,25(3):47-49.
[3]代文东,黄泽素,唐容,等.优质甘蓝型紫红叶标记油菜的选育[J].贵州农业科学,2009,37(9):16-18.
[4]杨朝霞.紫甘薯花色普色素提取纯化工艺研究及组分分析[D].青岛:青岛大学,2004.
[5]方忠祥,倪元颖,李洪民.紫肉甘薯中花青素在不同环境条件下稳定性的研究[J].食品与发酵工业,2002,10:31-34.
[6]国家标准局.GB 6718-86,食品添加剂萝卜红[S].北京:中国标准出版社,1987-05-21.
[7]国家标准局.GB 6228-86,食品添加剂越橘红[S].北京:中国标准出版社,1986-12-01.
[8]中华人民共和国轻工业部.GB9992-88,食品添加剂黑豆红[S].北京:中国标准出版社,1989-07-01.
[9]中华人民共和国轻工业部.QB1228-91,食品添加剂红米红[S].北京:中国标准出版社,1992-04-01.
[10]中华人民共和国轻工业部.GB9993-88,食品添加剂高粱红[S].北京:中国标准出版社,1989-07-01.
[11]凌关庭天然食品添加剂手册[M].北京:化学工业出版社,2000(1):214-318.
[12]Cabrita,Fossen.Colour and stability of the six common anthocyanin 3-glucosides in aqueous solutions[J].Food Chemistry,2000,68:101-107.
[13]Prior R L,Wu X.Standardizedmethods for the determination ofantioxidant capacity and phenolics in foods and dietary supplements[J].Agricultural and Food Chemistry,2005,53:3101-3113.
[14]Methrtens F,Kranz H,Bednarek P,et al.The Arabidopsis transcription factor MYB12 is a flavonol-specific regulator of phenylpropanoid biosynthesis[J].Plant Physiol,2005,138:1083-1096.
[15]Passamonti S,Urska Vrhovsek,Andreja Vanzo,etal.The stomach as a site for anthocyanins absorption from food 1[J].Febs Letters,2003,544(1-3):210-213.
[16]Malien-Aubert C,Dangles O.Color stability of commercial anthocyanin-based extracts in relation to the phenolic composition.Protective effects by intra-and intermolecular copigmentation[J].Agricultural and Food Chemistry,2001,49:170-176.
[17]Revilla E,Ryan JM.Comparison of several proceduresused for the extraction of anthocyanins from red grapes[J].Agr.and Food Chem.,1998,847:4592-4597.
(责任编辑 刘忠丽)
Variation and Stability of Anthocyanin Content in Leaves of Rapeseed w ith Purple-red Leaves
TANG Rong,HUANG Ze-su,DAIWen-dong,LIDe-zhen,WANG Shao-ming
(Guizhou Institute of Oil Crops,Guizhou Guiyang 550006,China)
The variation of leaf anthocyanin content in rapeseed with purple-red leaveswas analyzed under different temperature and shading condition to provide a reference for application of anthocyanin extracted from rapeseed with purple-red leaves in production of food and health products.Results:The anthocyanin content in rapeseed with purple-red leaves in field at seedling stage is the highest,followed by atbolting stage and at flowering stage and the anthocyanin content in rapeseed with purple-red leaves reaches4.90[(A530-0.25×A657)/g]at seedling stage.Low temperature and shading treatment can increase anthocyanin content in rapeseed with purple-red leaves and the anthocyanin content in rapeseed with purple-red leavesat2℃for12 days is themaximum 7.49[(A530-0.25×A657)/g].The anthocyanin in rapeseed with purple-red leaves can increase its stress resistance and low temperature can improve anthocyanin content in rapeseed with purple-red leaves at the same time.The degradation degree of anthocyanin is less after anthocyanin extract from rapeseed with purple-red leaves stew at 60,80 and 90℃for1 hour,respectively,which indicates the anthocyanin in rapeseed with purple-red leaveshas a good stability.The anthocyanin in rapeseed with purple-red leaves degradesgradually after anthocyanin extract from rapeseed with purple-red leavesboilsat100℃for 1 hour.The anthocyanin in rapeseed with purple-red leaves is stable at pH 2.0,pH 3.6 and pH 7.4,which indicates the anthocyanin in rapeseed with purple-red leaves has the applied characteristics in food production.
Rapeseed;Purple-red leaf;Anthocyanin;pH;Temperature;Stability
S565.4
A
1001-4829(2017)2-0285-06
10.16213/j.cnki.scjas.2017.2.008
2016-04-14
贵州省农业攻关项目(20103009);贵州省农业科学院专项(2010022);贵州省农业科学院研究生基金项目(09008)
唐容(1980-),女,副研究员,硕士,从事油菜育种及生物技术研究工作,E-mail:trtwo@126.com。
