不同基质中水鳖对共存的穗花狐尾藻和金鱼藻的影响
2017-04-12曹前进
刘 娜 曹前进
(华中师范大学生命科学学院, 武汉 430079)
不同基质中水鳖对共存的穗花狐尾藻和金鱼藻的影响
刘 娜 曹前进
(华中师范大学生命科学学院, 武汉 430079)
研究设置了营养水平不同的3种基质, 在有或无浮水植物水鳖共存的情况下, 混合种植营养吸收方式不同的两种沉水植物(仅从水中吸收营养的金鱼藻和从水和基质都能吸收营养的穗花狐尾藻), 探讨在不同的基质中浮水植物对沉水植物的影响。结果显示: 实验中水鳖的存在均未对共存的两种沉水植物的生长产生抑制作用。当水鳖覆盖水面时, 与无根的金鱼藻竞争光照和水体营养, 促使其增加分枝数和茎长, 并增加叶生物量的分配, 最终导致水鳖的共存促进了金鱼藻的生物量积累。但与金鱼藻不同, 有根的穗花狐尾藻可通过基质吸收营养, 与共存的水鳖之间只存在光照竞争, 使穗花狐尾藻仅以改变植株形态来适应浮水植物的表层覆盖,生物量积累并未发生显著变化。与沙处理相比, 水鳖在营养水平较高的泥处理和泥沙混合处理中生长更旺盛, 基质没有显著影响沉水植物的生物量和分株数。因此, 在退化湿地生态系统中恢复水生植物时, 为了提高群落的物种多样性, 可以将沉水植物与少量的浮水植物组合配置, 少量的浮水植物不会对沉水植物的生长带来负面影响。
浮水植物; 沉水植物; 基质; 营养; 生物量
在富营养化湖泊中恢复水生植物, 沉水植物的恢复非常重要。只有成功恢复沉水植物, 才能实现全湖性的湖泊生态系统的修复, 达到湖泊水质改善的目标[1]。但是, 在湖泊污染很重或者氮磷负荷很高的情况下, 单纯恢复沉水植物是很难成功的[1]。因此, 将水生植物的不同生活型组合在一起是较好的方式, 其中“浮水植物+沉水植物”是常用组合, 它能更好地利用空间生态位[2], 增加群落的物种多样性。浮水植物的叶漂浮于水面, 不受富营养化湖泊中水下光照的限制, 相对于沉水植物较容易成活[3]。但是, 浮水植物的漂浮叶会降低透明度本来就偏低的富营养水体的光强[4], 可能对沉水植物的生长产生负面影响。另一方面, 浮水植物的根可悬垂于水中吸收营养, 能一定程度地降低重污染水体中的营养水平, 且浮水植物的覆盖能提高水中的CO2浓度,这些变化可能促进沉水植物的生长[5]。因此, 为了有效地恢复沉水植物, 研究在营养水平不同的基质中浮水植物对沉水植物的影响能为水生植被的恢复提供理论依据。
沉水植物金鱼藻(Ceratophyllum demersum L.)和穗花狐尾藻(Myriophyllum spicatum L.)、浮水植物水鳖[Hydrocharis dubia (Bl.) Backer]在我国的南部和北部都广泛分布[6], 常共存于同一自然群落中[7,8],是湖泊水生植被恢复中的常用物种[2,9]。金鱼藻对水体高浓度氮的耐受性强[10,11], 它无根, 因此只能通过茎叶从水体中吸收营养[12]。穗花狐尾藻有根,在通过茎叶从水中吸收营养的同时还可以通过根从基质中吸收营养[13,14], 它不仅能够能耐受营养限制, 同时也能适应富营养[15,16]。浮水植物水鳖有许多不定根, 这些根可以插入浅水区基质并从基质中吸收营养, 也可在深水区悬浮于水中并从水中吸收营养[17], 并能向水中释放CO2, 促进沉水植物的生长[18]。前人的研究发现, 当浮水植物和沉水植物共存于营养充足的条件下时, 无论这营养是直接来自于水体还是由基质释放进水体的, 浮水植物因具有较强的竞争阳光的能力而占优势地位[3,4]; 但当营养受限时, 沉水植物因具有较强的竞争水中营养的能力而抑制浮水植物的生长[4,19,20]。本研究设置了营养水平不同的3种基质, 在有或无浮水植物水鳖共存的情况下, 混合种植沉水植物金鱼藻和穗花狐尾藻, 主要回答以下问题: (1)不同营养水平的基质怎样影响两种沉水植物和浮水植物水鳖的生长?(2)与无水鳖的处理相比, 浮水植物水鳖的存在是否抑制沉水植物的生长? (3)沉水植物对水鳖共存的响应方式是否因沉水植物营养吸收方式的不同而存在差异?
1 材料与方法
1.1 实验材料
2014年10月, 于武汉东湖(N 30°33.747′, E 114°24.223′)采集金鱼藻、穗花狐尾藻和水鳖的植物材料, 带入华中师范大学生态园(N 30°33.997′, E 114°21.270′)的室外水池中预培养。水池中有高20 cm左右的底泥(TN: 5.460 g/kg, TP: 0.718 g/kg干重), 加入深50 cm的自来水。预培养期间, 水温为3.6—15.8℃, 水面上光强为201.2—624.9 μmol/ (m2·s)。
1.2 实验设计
实验中共设置两个变量, 即基质和有无水鳖共存。基质有3个水平: 泥处理(TN: 5.460 g/kg, TP: 0.718 g/kg干重)、泥和沙1∶1混合处理(TN: 2.846 g/ kg, TP: 0.422 g/kg)、沙处理(TN: 0.232 g/kg, TP: 0.125 g/kg)。有无水鳖共存有两个水平: 有水鳖和无水鳖。共6个处理。每个处理4个重复, 共使用24个桶(高度60 cm、直径42 cm)。
2015年3月8日, 我们将基质(泥和沙)按照实验设计装在每个桶里, 基质高度约为12 cm, 然后将长势良好的金鱼藻断枝[16个断枝/桶, 鲜重(1.620±0.129) g/断枝, 平均值±标准差]和穗花狐尾藻断枝[16个/桶,鲜重(1.570±0.126) g/断枝]扦插于基质中。两种沉水植物种植完后, 向每个桶里加晾晒3d的自来水,水位高度约为43 cm。再向有水鳖共存的处理组中的桶里放水鳖冬芽[20个/桶, 鲜重(0.440±0.023) g/冬芽]。实验于2015年5月24日结束。在实验期间, 水面下5 cm光强为157—590 μmol/(m2·s)、温度为12.5—30.1℃。
1.3 测量方法
基质和水中氮和磷的测量实验开始前, 从泥基质和沙基质中各取3个样, 每个样50 g, 用于测定总氮(凯氏定氮法)[21]和总磷(碱熔-钼锑抗分光光度法)[22]含量。
实验结束时, 每桶各取1个水样, 每个水样500 mL,以测定水中的总氮(过硫酸钾氧化紫外分光光度法)和总磷(过硫酸钾消解法)[23]含量。每个样总氮和总磷的测定分别重复3次。
植物的测量实验结束当天, 所有植物被小心收获。先统计出每个桶里的金鱼藻、穗花狐尾藻和水鳖的植物分株数。再用直尺测量每种植物的总茎长以及穗花狐尾藻和水鳖的根长(将每株植物的所有根一起捋直, 测量最长的根)。将水鳖的叶片扫描, 用ImageJ 1.42软件测量其叶面积。然后将植物的根、茎、叶等器官分开, 分别将其放在烘箱里(80℃)烘干至恒重, 称量干重。最后计算出每个桶里每种植物的各项参数的值。
1.4 数据处理
利用SPSS 16.0软件, 对每个参数, 分别进行正态检验和方差齐性分析, 所有参数均符合方差分析的要求。对水中总氮、总磷以及穗花狐尾藻和金鱼藻的相关参数, 以基质和有无水鳖共存为控制因子进行双因素方差分析; 为了便于比较, 无论交互作用是否显著, 只要方差分析结果显示基质或有无水鳖共存对某参数有显著影响(P<0.05), 则进一步利用多重比较(Turkey HSD)分别分析有水鳖或无水鳖共存情况下三种基质间的差异显著性、或利用独立样本t-检验分析相同基质中“有水鳖”和“无水鳖”两个处理间的差异显著性。对水鳖的各项参数, 仅以基质为控制因子进行单因素方差分析, 如果处理间有显著差异, 再进行多重比较(Turkey HSD)。用SigmaPlot 10.0做图。
2 结果
2.1 水体中的总磷、总氮含量
实验结束收获植株时, 不同基质处理间水中的总磷、总氮表现出显著差异(P<0.05); 有无水鳖共存对总氮的含量无显著影响(P>0.05), 对泥沙混合处理的水中总磷含量有显著影响(P<0.05)(图 1)。
2.2 金鱼藻的生长
生物量及其分配基质对金鱼藻的总生物量、茎生物量比率和叶生物量比率无显著影响(表1)。在生物量分配方面, 所有处理中金鱼藻的叶生物量所占的比率大于茎生物量所占的比率(图 2)。
有无水鳖共存对金鱼藻的总生物量、茎生物量比率和叶生物量比率都有显著影响(表 1)。在泥沙混合和沙处理中, 有水鳖共存的金鱼藻的总生物量显著大于无水鳖的处理。在泥沙混合处理中, 有水鳖共存的金鱼藻的叶生物量比率显著大于无水鳖的处理, 而茎生物量比率则趋于相反(图 2)。
外部形态的生长变化基质对金鱼藻的总分枝数、总茎长有显著影响, 但对植物分株数无显著影响(表 1)。不论有无水鳖共存, 总分枝数和总茎长的数值在沙处理中最小, 而泥处理与泥沙混合处理间无显著差异(图 2)。
有无水鳖共存对金鱼藻的总分枝数、总茎长有显著影响(表 1), 并且总分枝数和总茎长在有水鳖共存的处理大于无水鳖共存的处理(图 2)。
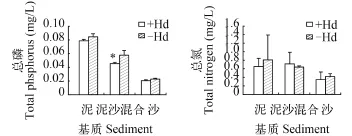
图 1 实验结束时水体的总磷、总氮的含量Fig. 1 The total N and total P content in water on the harvest day“+Hd”和“-Hd”分别表示有水鳖和无水鳖共存的处理; 柱子上的星号“*”表示相同基质中有水鳖和无水鳖处理之间有显著差异(P<0.05); 下同“+Hd” and “-Hd” indicate the treatments of the presence and the absence of Hydrocharis dubia, respectively. Asterisk (*) above the bars denote significant differences by H. dubia in the same sediment; the same applies below
2.3 穗花狐尾藻的生长
生物量及其分配基质对穗花狐尾藻的总生物量没有显著影响, 但对根生物量比率和叶生物量比率有显著影响(表 1), 并且根生物量比率在沙处理中的值最大, 在泥处理中的值最小(图 3)。
有无水鳖共存对穗花狐尾藻的总生物量没有显著影响, 但对根生物量比率、茎生物量比率、叶生物量比率有显著影响(表 1); 并且在泥沙混合处理和沙处理中, 茎生物量比率在有水鳖共存的处理中的值大于无水鳖共存的处理, 而叶生物量比率则有相反的趋势(图 3)。
外部形态的生长变化基质对穗花狐尾藻的总分枝数、总茎长、最长根的平均长度有显著影响, 但对植物分株数无显著影响(表 1)。其中总分枝数在有水鳖共存的泥沙混合处理中显著高于其他处理; 总茎长在沙处理中低于泥处理和泥沙混合处理; 最长根的平均长度在沙处理中的值最大,在泥处理中的值最小(图 3)。
有无水鳖共存对穗花狐尾藻的总分枝数、总茎长、植物分株数有显著影响, 但对最长根的平均长度无显著影响(表 1)。在泥处理和泥沙混合处理中, 总茎长和植物分株数在有水鳖共存的处理中的值大于无水鳖共存的处理(图 3)。
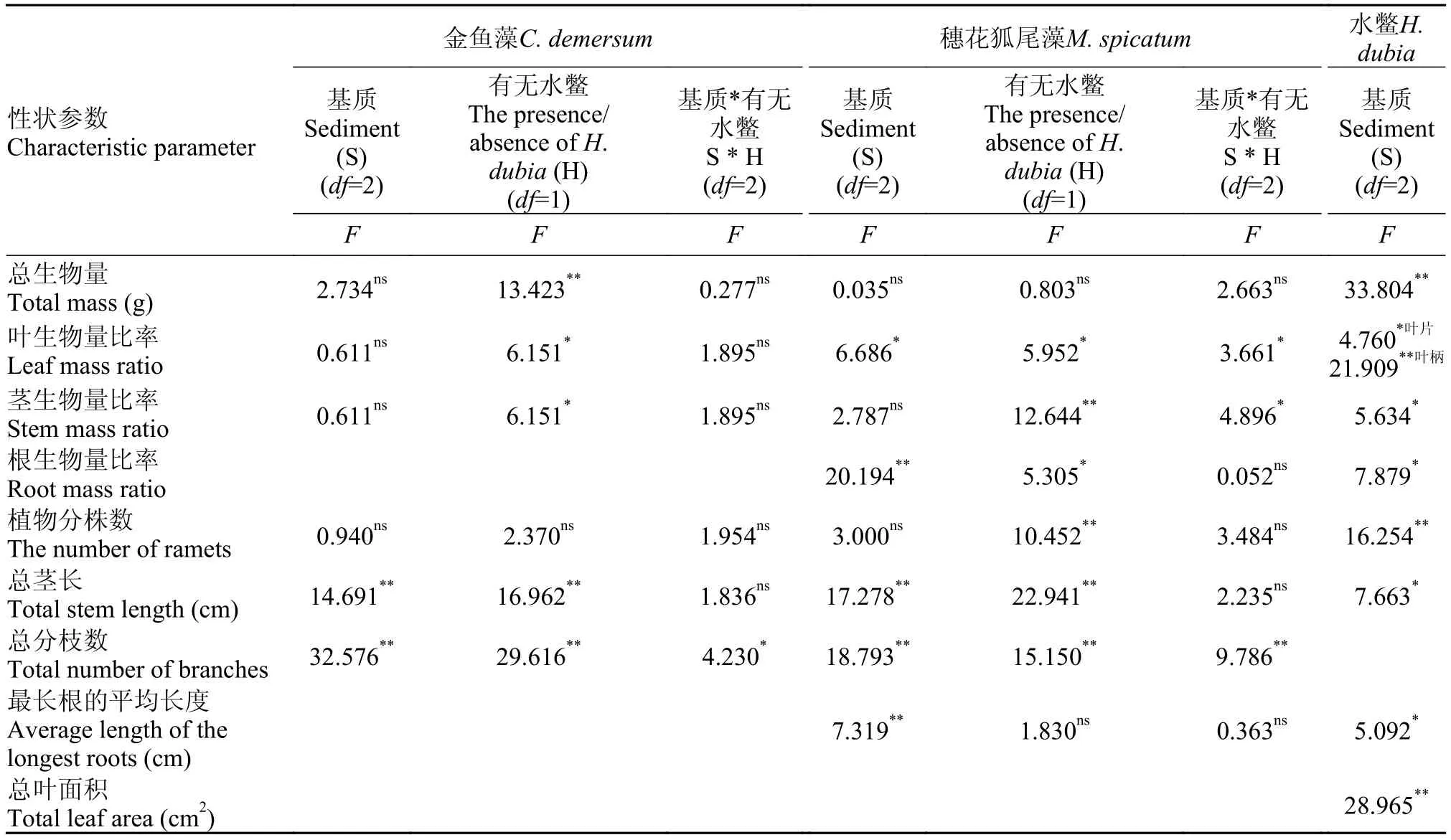
表 1 方差分析表: 基质、有无水鳖共存对金鱼藻、穗花狐尾藻和水鳖生长特征的影响Tab. 1 Effects of sediment and Hydrocharis dubia on the growth traits of Ceratophyllum demersum, Myriophyllum spicatum and H. dubia
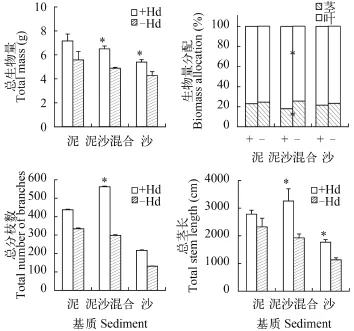
图 2 金鱼藻在不同基质和有无水鳖共存处理下的生长特征Fig. 2 The effect of different sediments and Hydrocharis dubia on the growth of Ceratophyllum demersum
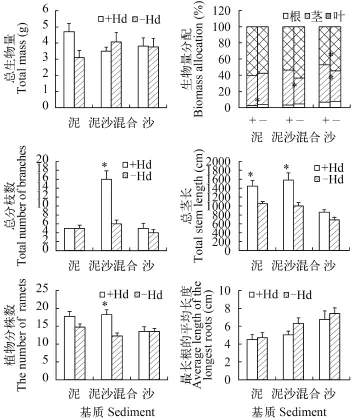
图 3 穗花狐尾藻在不同基质和有无水鳖共存处理下的生长特征Fig. 3 The role of different sediments and Hydrocharis dubia treatments on the growth of Myriophyllum spicatum
2.4 水鳖的生长
生物量及其分配本实验过程中, 水鳖一直以漂浮的状态生长。基质对水鳖的总生物量以及各器官的生物量分配比率均有显著影响(表 1)。沙处理中的总生物量显著低于其他两个基质处理(图4)。在生物量分配方面, 叶片生物量比率和叶柄生物量比率在沙处理中显著小于其他两个基质处理,而根生物量比率和茎生物量比率有相反的趋势。
外部形态的生长变化基质对水鳖的总茎长、植物分株数、最长根的平均长度、总叶面积均有显著影响(表 1)。其中总茎长、植物分株数和总叶面积的值在泥沙混合处理组中最大, 在沙处理组中的值最小, 而最长根的平均长度趋于相反(图 4)。
3 讨论
3.1 营养水平不同的基质对3种水生植物生长的影响
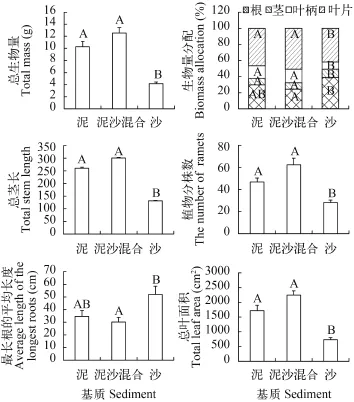
图 4 水鳖在不同基质处理下的生长特征Fig. 4 The growth traits of Hydrocharis dubia in different sediment treatments柱子上不同的大写字母表示不同的基质处理之间有显著差异(P<0.05)Different capital letters above the bars denote significant differences among the sediment treatments (P<0.05)
本研究结果显示: 与沙处理相比, 泥处理和泥沙混合处理更有利于浮水植物水鳖的生长; 而对于共存的沉水植物金鱼藻和穗花狐尾藻, 基质并没有显著影响生物量的积累和分株数, 只是沙处理中的分枝数和茎长比另两种基质处理中显著降低。沙处理的营养水平偏低, 水鳖的生长受到限制, 这种现象与前人的研究一致[13,20]。而沙处理中与水鳖共存的两种沉水植物却仍然能积累与其他两种基质处理中相似的生物量, 表明这两种沉水植物对营养限制的耐受能力和竞争营养能力比水鳖更强[4,19,20]。金鱼藻和穗花狐尾藻的叶裂片都为细丝状[6], 是重要的营养吸收器官[12,14], 叶裂片薄或缺少表皮, 有利于水和植物组织间的物质交换[12]。尤其是金鱼藻, 它没有根, 营养吸收几乎全靠叶[12], 也能在营养限制条件下维持生物量的积累, 这可能与它的高叶生物量比率(本实验中金鱼藻的叶生物量比率>74.5%)有关。高的叶生物量比率有利于植物竞争光[24], 使植物积累生物量。
相对于泥处理和泥沙混合处理, 在沙处理中穗花狐尾藻和水鳖都增加了根的生物量分配和根长。发达的根系有利于水生植物从环境中吸收营养[12,17], 根生物量比率和长度的增加既能够使根系的吸收能力增强, 又能使根系开拓更大空间范围内的营养资源[12], 以形态可塑性来适应营养受限的环境[25,26], 这与前人的研究一致[12,17,27]。
3.2 浮水植物水鳖对共存的两种沉水植物的生长没有表现出抑制作用
本研究发现: 与无水鳖的处理相比, 共存的沉水植物金鱼藻和穗花狐尾藻在有水鳖的处理中生长得更旺盛。此结果与我们的预期相反。前人的研究发现, 浮水植物能抑制沉水植物的生长[3,4,20,28],尤其是在营养丰富的环境中, 因为浮水植物在竞争阳光方面比沉水植物具有优势[3,4], 浮水植物覆盖在水面, 减弱了水下光强, 使沉水植物难以获得充足的阳光。但一定量水鳖覆盖水面使沉水植物生长更旺盛的现象也曾经在水鳖与黑藻[Hydrilla verticillata (L. f.) Royle]的共存实验中观察到过[29], 即当水鳖以0、30%、40%和100%的初始覆盖度生长于培养黑藻的桶中23d以后, 水鳖初始覆盖度为30%的处理中黑藻生物量增长最多, 超过了无水鳖处理。
沉水植物被浮水植物覆盖在水下时, 并不只是被动忍受浮水植物的影响, 它们还能做出积极主动的响应。本研究结果显示: 被水鳖遮阴时, 两种沉水植物能够伸长茎、增加茎生物量比率、增加分枝数和分株数。类似的形态可塑性变异在其他沉水植物中也被多次发现[28,29]。而且, 并不是所有的由浮水植物引起的环境变化都不利于沉水植物的生长, 如由于浮水植物阻碍空气-水交界面的气体交换, 水中CO2浓度提高可能有利于沉水植物的光合作用, 同时水中溶氧的降低可能有利于减少沉水植物的光呼吸[5]。水鳖覆盖水面还会使水和基质中溶氧下降, 在基质缺氧的条件下穗花狐尾藻具有更高的根系多孔性和径向泌氧的能力[30], 通过根系泌氧, 可以为需氧生物提供有利条件, 进而通过矿化作用氧化基质, 增加基质和水中营养; 即溶氧下降有利于增加可供沉水植物吸收利用的营养, 对两种沉水植物的生长可能有促进作用。
3.3 两种沉水植物对水鳖共存的响应方式的差异
金鱼藻和穗花狐尾藻虽然都是沉水植物, 但是两者的营养吸收方式有所不同: 金鱼藻无根, 只能通过茎叶从水中吸收营养[12]; 而穗花狐尾藻有根,既能通过茎叶从水中吸收营养, 也能通过根系从基质中吸收营养[13,14]。浮水植物水鳖在本实验的水深(43 cm)中, 以漂浮型生长, 只能通过悬垂于水中的根系从水中吸收营养。因此, 水鳖的存在, 除了减弱沉水植物获得的光照以外, 还与沉水植物竞争水中营养。同时, 共存的两种沉水植物之间也有竞争营养和光照的关系。
在本实验过程中, 无论有无水鳖的存在, 共存的两种沉水植物相比, 都是穗花狐尾藻的植株高度更高、生长得接近水面, 而金鱼藻的植株沉于水下,因此, 竞争光照时穗花狐尾藻在植株高度上比金鱼藻具有优势[31]; 而且穗花狐尾藻可以同时从基质和水中吸收营养, 在获取营养的途径上优于金鱼藻[12—14]。但是, 无论有无水鳖的存在, 金鱼藻的分枝数(111—613个)都远大于穗花狐尾藻(3—21个),金鱼藻的株型更铺散, 增加了其茎叶竞争光照和营养的机会; 而且金鱼藻植株还具有高表面积/体积比, 有利于营养吸收[32]。
金鱼藻获取光照和营养的主要器官都是叶[12]。由于获得这两种资源的器官相同, 当这些资源同时受限时, 植物做出的可塑性响应方式应该是一致的,就不会为获取某一种资源付出代价[27,33]。在本研究中, 当水鳖覆盖水面时, 金鱼藻与共存物种既竞争光照又竞争水中营养。为了获得更多的光照和营养, 金鱼藻趋于增加叶生物量比率、分枝数和茎长, 进行了过补偿性的生长, 使与水鳖共存的金鱼藻积累的生物量不但没有低于反而高于无水鳖覆盖的金鱼藻。当植物遭遇环境压力时, 它们可以通过形态和生理变化进行补偿, 这种现象在许多植物中都曾被观察到[29,34,35]。
穗花狐尾藻的叶也具有获取光照和营养的功能, 但不同于金鱼藻的是: 当水中的营养受限时, 穗花狐尾藻还能通过根系从基质获取营养, 并且某些营养在基质中比在水中的更为丰富[13]。在本研究中, 与无水鳖的处理相比, 当穗花狐尾藻与共存物种竞争水中营养时, 穗花狐尾藻可以通过根系吸收基质的营养, 进而减弱穗花狐尾藻与共存物种之间的营养竞争强度。因此, 光照(而不是营养)是穗花狐尾藻的主要限制资源, 穗花狐尾藻以增加分株数、分枝数、茎长和茎生物量比率或减少根生物量比率来响应水鳖的覆盖, 而根长没有受到水鳖的显著影响。像其他许多水生植物一样[20,28,29], 穗花狐尾藻以改变植物的形态来适应浮水植物的覆盖,没有受到水鳖的负面影响。
综上所述, 当浮水植物与沉水植物共存时, 少量的浮水植物覆盖在水面, 在一定程度上有利于沉水植物的生长。两种沉水植物可以通过形态的可塑性变异调整株型和生物量分配比率, 与水鳖竞争光照和水中营养。对于无根的沉水植物金鱼藻, 获取阳光和营养的器官都是叶, 与共存物种竞争光照和水中营养这两种资源时, 它的响应方式一致, 甚至过补偿地积累生物量。而对于有根的穗花狐尾藻, 能够从基质和水中同时获取营养, 其可塑性生长主要是为了获得更多的阳光。因此, 在退化湿地生态系统中恢复水生植物时, 为了提高群落的物种多样性, 可以将沉水植物与少量的浮水植物组合配置, 少量的浮水植物不会对沉水植物的生长带来负面影响。
[1]Qin B Q. Principles and approach for lake ecological restoration [J]. Acta Ecologica Sinica, 2007, 27(11): 4848—4858 [秦伯强. 湖泊生态恢复的基本原理与实现.生态学报, 2007, 27(11): 4848—4858]
[2]Zhang M, Liu Z G, Li X Q, et al. Studies of the selection and application of suitable hydrophyte species on lake restoration in the middle and lower reaches of Yangtze River [J]. Ecological Science, 2014, 33(2): 344—352 [张萌, 刘足根, 李雄清, 等. 长江中下游浅水湖泊水生植被生态修复种的筛选与应用研究. 生态科学, 2014, 33(2): 344—352]
[3]Scheffer M, Szabó S, Gragnani A, et al. Floating plant dominance as a stable state [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(7): 4040—4045
[4]Netten J J C, Arts G H P, Gylstra R, et al. Effect of temperature and nutrients on the competition between freefloating Salvinia natans and submerged Elodea nuttallii in mesocosms [J]. Fundamental & Applied Limnology, 2010, 177(2): 125—132
[5]Simpson P S, Eaton J W, Hardwick K. The influence of environmental factors on apparent photosynthesis and respiration of the submersed macrophyte Elodea canadensis [J]. Plant Cell & Environment, 1980, 3(6): 415—423
[6]Yan S Z. Illustrated Handbook of Chinese Vascular Aquatic Plants [M]. Beijing: Science Press. 1983, 91—240 [颜素珠. 中国水生高等植物图说. 北京: 科学出版社. 1983, 91—240]
[7]Ge J W, Cai Q H, Liu J K, et al. The present situation and evaluation of plant diversity of Lake Liangzihu wetland [J]. China Environmental Science, 2003, 23(5): 451—456 [葛继稳, 蔡庆华, 刘建康, 等. 梁子湖湿地植物多样性现状与评价. 中国环境科学, 2003, 23(5): 451—456]
[8]Li Z Q, Ren H, Hao M X, et al. Diversity variation and community succession of aquatic macrophytes in Lake Futou [J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1018—1026 [李中强, 任慧, 郝孟曦, 等. 斧头湖水生植物多样性及群落演替研究. 水生生物学报, 2012, 36(6): 1018—1026]
[9]Xu S, Zhang D, Wang Y Y, et al. Impacts of submerged macrophytes rehabilitation on the methanogenic community in the sediment of freshwater lakes [J]. Acta Hydrobiologica Sinica, 2015, 39(6): 1198—1206 [徐思, 张丹, 王艳云, 等. 沉水植物恢复对湖泊沉积物产甲烷菌的影响研究. 水生生物学报, 2015, 39(6): 1198—1206]
[10]Li H L, Wang Y Y, Li Y, et al. Effects of nitrogen concentration in water on the germination and growth of Myriophyllum spicatum and Ceratophyllum demersum fragments [J]. Plant Nutrition and Fertilizer Science, 2014, 20(1): 213—220 [李红丽, 王永阳, 李玉, 等. 水体氮浓度对狐尾藻和金鱼藻片段萌发及生长的影响. 植物营养与肥料学报, 2014, 20(1): 213—220]
[11]Xiong J, Huang J T, Nie L, et al. The effects of nutrient concentration on purification ability and eco-physiology of Ceratophyllum demersum [J]. Acta Hydrobiologica Sinica, 2013, 37(6): 1067—1072 [熊剑, 黄建团, 聂雷,等. 不同营养条件对金鱼藻净化作用及其生理生态的影响. 水生生物学报, 2013, 37(6): 1067—1072]
[12]Denny P. Sites of nutrient absorption in aquatic macrophytes [J]. Journal of Ecology, 1972, 60(3): 819—829
[13]Barko J W, Smart R M. Sediment-related mechanisms of growth limitation in submersed macrophytes [J]. Ecology, 1986, 67(5): 1328—1340
[14]Best M D, Mantai K E. Growth of Myriophyllum: Sediment or lake water as the source of nitrogen and phosphorus [J]. Ecology, 1978, 59(5): 1075—1080
[15]Zuo J C, Miao F P, Wang A Y, et al. Effects of apex cutting on re-growth of Myriophyllum spicatum cultured in buckets [J]. Chinese Journal of Ecology, 2009, 28(4): 643—647 [左进城, 苗凤萍, 王爱云, 等. 收割对穗花狐尾藻生长的影响. 生态学杂志, 2009, 28(4): 643—647]
[16]Wang J, Yu D, Wang Q. Growth, biomass allocation, and autofragmentation responses to root and shoot competition in Myriophyllum spicatum as a function of sediment nutrient supply [J]. Aquatic Botany, 2008, 89(4): 357—364
[17]Tsuchiya T. Growth and biomass turnover of Hydrocharis dubia L. cultured under different nutrient conditions [J]. Ecological Research, 1989, 4(2): 157—166
[18]Titus J E, Andorfer J H. Effects of CO2enrichment on mineral accumulation and nitrogen relations in a submersed macrophyte [J]. Freshwater Biology, 1996, 36(3): 661—671
[19]Szabo S, Scheffer M, Roijackers R, et al. Strong growth limitation of a floating plant (Lemna gibba) by the submerged macrophyte (Elodea nuttallii) under laboratory conditions [J]. Freshwater Biology, 2010, 55(3): 681—690
[20]Cao Q J, Wang L. Interactions between submerged and floating plant species with different types of nutrient uptake in sand and fertile sediments [J]. Fundamental & Applied Limnology, 2012, 181(1): 15—24
[21]Ministry of Environmental Protection. The Environmental Protection Standard of the People’s Republic of China [M]. Beijing: China Environmental Sciences Press. 2014, 1—7 [环境保护部.《中华人民共和国国家环境保护标准HJ717》. 北京: 中国环境科学出版社, 2014, 1—7]
[22]Ministry of Environmental Protection. The Environmental Protection Standard of the People’s Republic of China [M]. Beijing: China Environmental Sciences Press, 2011, 1—4 [环境保护部.《中华人民共和国国家环境保护标准 HJ632》. 北京: 中国环境科学出版社, 2011, 1—4]
[23]State Environmental Protection Administration Monitoring Analysis Method of Water and Wastewater [M]. Beijing: China Environmental Sciences Press. 2002, 244—257 [国家环境保护总局.《水和废水监测分析方法》(第四版). 北京: 中国环境科学出版社. 2002, 244—257]
[24]Van T K, Wheeler G S, Center T D. Competition between Hydrilla verticillata and Vallisneria americana as influenced by soil fertility [J]. Aquatic Botany, 1999, 62(4): 225—233
[25]Xiao K, Yu D, Wu Z. Differential effects of water depth and sediment type on clonal growth of the submersed macrophyte Vallisneria natans [J]. Hydrobiologia, 2007, 589(1): 265—272
[26]Cronin G, Lodge D M. Effects of light and nutrient availability on the growth, allocation, carbon/nitrogen balance, phenolic chemistry, and resistance to herbivory of two freshwater macrophytes [J]. Oecologia, 2003, 137(1): 32—41
[27]Shipley B, Meziane D. The balanced-growth hypothesis and the allometry of leaf and root biomass allocation [J]. Functional Ecology, 2002, 16(3): 326—331
[28]Janes R A, Eaton J W, Hardwick K, et al. The effects of floating mats of Azolla filiculoides Lam. and Lemna minuta Kunth on the growth of submerged macrophytes [J]. Hydrobiologia, 1996, 340(1): 23—26
[29]Li D H, Shi L X, Li G B, et al. Influence of the floating macrophyte Hydrocharis dubia on the growth of the submerged macrophyte Hydrilla verticillata and their effects on water quality [J]. Environmental Science and Management, 2007, 32(12): 54—58 [李敦海, 史龙新, 李根保,等. 漂浮植物水鳖对沉水植物黑藻生长及它们对水质的影响作用. 环境科学与管理, 2007, 32(12): 54—58]
[30]Lemoine D G, Mermillod-Blondin F, Barrat-Segretain M H, et al. The ability of aquatic macrophytes to increase root porosity and radial oxygen loss determines their resistance to sediment anoxia [J]. Aquatic Ecology, 2012, 46(2): 191—200
[31]Liu J C, Yu D, Liu C H. The physiological effects of spring low water level on four submerged macrophytes [J]. Acta Hydrobiologica Sinica, 2016, 40(3): 532—537 [刘俊初, 于丹, 刘春花. 春季不同程度低水位对四种沉水植物生理的影响. 水生生物学报, 2016, 40(3): 532—537]
[32]Lombardo P, Cooke G D. Ceratophyllum demersum phosphorus interactions in nutrient enriched aquaria [J]. Hydrobiologia, 2003, 497(1): 79—90
[33]Rubio G, Lavado R S. Acquisition and allocation of resources in two waterlogging-tolerant grasses [J]. New Phytologist, 1999, 143(3): 539—546
[34]Oesterheld M, Mcnaughton S J. Effect of stress and time for recovery on the amount of compensatory growth after grazing [J]. Oecologia, 1991, 85(3): 305—313
[35]Retuerto R, Woodward F I. Compensatory responses in growth and fecundity traits of sinapis alba L. following release from wind and density stress [J]. International Journal of Plant Sciences, 2001, 162(1): 171—179
EFFECTS OF FLOATING HYDROCHARIS DUBIA ON CO-CULTURED SUBMERGED MYRIOPHYLLUM SPICATUM AND CERATOPHYLLUM DEMERSUM IN DIFFERENT SEDIMENTS
LIU Na and CAO Qian-Jin
(School of Life Sciences, Central China Normal University, Wuhan 430079, China)
Cultivating combination of different life forms is an efficient way to restore aquatic vegetation. A common combination is the floating and submerged plants. In this study, we cultivated two submerged plants with different types of nutrient uptake (rootless Ceratophyllum demersum, absorbing nutrients only from water column; and rooted Myriophyllum spicatum, taking up nutrients from both water and sediment) in three kinds of sediment with different levels of nutrients. The floating Hydrocharis dubia was added to explore the effects of floating plants on submerged plants in different sediments. The results showed that H. dubia grew more vigorously in silt and the mixed sediment of sand and silt that contained higher level of nutrients than sand sediment. However, the total mass and ramet number of C. demersum and M. spicatum were not affected significantly by sediment. The floating H. dubia did not suppress the growth of the two submerged plants. To compete with H. dubia for light and nutrients in water, rootless C. demersum tended to increase leaf mass ratio, branch number and stem length. As a result, C. demersum accumulated higher total mass in presence of H. dubia. Rooted M. spicatum adapted to shading of H. dubia by regulating plant morphology without suppressing growth of M. spicatum. These results revealed an efficient way to increase the species diversity of aquatic community by cultivating submerged plants with a small amount of floating plants.
Floating plants; Submerged plants; Sediment; Nutrient; Biomass
Q142
A
1000-3207(2017)02-0420-08
10.7541/2017.52
2016-04-06;
2016-08-14
汉丰湖湖滨带湿地生态修复技术示范 (2013ZX07104-004-03); 华中师范大学中央高校基本科研业务费专项资金(No. CCNU16A02032)资助 [Supported by Demonstration of Riparian Wetland Restoration Technology in Hanfeng Lake (2013ZX07104-004-03); Self-determined Research Funds of CCNU from the Colleges’ Basic Research and Operation of MOE (No. CCNU16A02032)]
刘娜(1990年—), 女, 河南驻马店人; 硕士; 主要从事水生高等植物种群生态学研究。E-mail: 791128065@qq.com
曹前进, 女; E-mail: caoqj1009@163.com; caoqj1009@mail.ccnu.edu.cn
