纳米复合型AC负载Cu/Nd催化剂的制备及性能
2017-04-11曹志勇屈钧娥何云斌王海人湖北大学材料科学与工程学院湖北武汉430062
周 庶,肖 松,邬 杰,曹志勇,屈钧娥,何云斌,王海人(湖北大学材料科学与工程学院,湖北 武汉 430062)
纳米复合型AC负载Cu/Nd催化剂的制备及性能
周 庶,肖 松,邬 杰,曹志勇,屈钧娥,何云斌,王海人*(湖北大学材料科学与工程学院,湖北 武汉 430062)
本文采用溶胶-凝胶法,以Cu(NO3)2﹑Nd(NO3)3为活性组分,制备了Cu/Nd-AC负载催化剂.将内部填充了Cu/Nd-AC负载催化剂的不锈钢丝篮作阳极,空气扩散电极作阴极,应用电催化氧化方法来处理模拟含酚废水,考察了不同条件下负载催化剂的催化性能,以含酚废水的COD去除率和苯酚去除率为负载催化剂性能评价对象.结果表明,504mg/L含酚废水最佳处理条件为反应时间1h, Cu/Nd-AC负载催化剂投加量5g/L,废水pH=3,电解电流密度400mA/dm2,此时含酚废水COD去除率和苯酚去除率分别可达到98.32%和99.59%.
溶胶-凝胶法;负载催化剂;电催化氧化;含酚废水;空气扩散电极
近年来,因电催化氧化方法具有使有机污染物分解更加彻底、不易产生有毒的中间产物、操作简便、与环境兼容等优点[1-3],而受国内外研究者的青睐.其中伍波等[4]以颗粒活性炭(AC)为载体,热分解法制备炭载纳米SnO2-Sb-Mn粒子电极,实验结果表明,在电流密度1.2A/cm2和反应时间140min条件下,SnO2-Sb-Mn/AC粒子电极的苯酚及COD 去除率分别为94.7%和90.4%.施周等
[5]利用电感耦合空气等离子体对涂覆法制备的 CNT/TiO2复合电极,其结果表明,经过等离子改性处理的P-CNT/TiO2电极对苯酚的吸附量较未改性的 CNT/TiO2电极提高了 45%,刘咏等[6]采用浸渍焙烧法制备了以 Y分子筛为载体的Mn-RE复合催化剂,构建Mn—RE多相催化电解氧化体系处理人工模拟苯酚废水,实验结果表明,复合催化剂在电流密度为7.2A/dm2,电解时间1h条件下,苯酚浓度为500~550m/L,COD去除率可达到66.3%.上述方法就COD而言都难达到很高的去除率,而且高电压或高电流、电解时间长.
目前电催化氧化法的普遍缺点:电极与废水接触面积小;使用贵金属做电极;电吸附能力有限,耗时较长;电-Fenton法须要添加可溶的亚铁盐作催化剂,这会增加废水中的阴离子污染.为了克服上述缺点,本文设想用装有负载纳米催化剂的活性炭篮做阳极,这样可得到一个巨大比表面积且具有催化功能的阳极,可大大提高电催化氧化效率,同时降低能耗和成本[7-9].另一方面,阴极材料很大程度决定电解过程H2O2生成量,常规阴极与空气(O2)接触面积通常较小,阴极 H2O2生成量不高,本文拟采用自制的空气扩散电极作阴极,来提高H2O2生成量,间接提高电解效率.
本文采用溶胶-凝胶法,制备Cu/Nd-AC负载型催化剂,参照本文课题组发明专利:ZL 2012 1 0398371.0,将内部填充有Cu/Nd-AC负载催化剂的阳极篮作阳极工作电极,空气扩散电极作阴极,同时利用小型空气机对电解体系进行曝气,采用电催化氧化方法来处理模拟含酚废水,考查反应时间、电解质Na2SO4投加量、负载催化剂投加量、溶液pH值、电解电流密度等因素对电催化氧化效率的影响.
1 材料与方法
1.1 试剂与仪器
试剂:硝酸钕(Nd(NO3)3·6H20)、硝酸铜(Cu(NO3)2·3H20)、氨水、柠檬酸、苯酚、无水硫酸钠、异丙醇、硫酸银、硫酸汞、重铬酸钾、邻菲啰啉、氢氧化钠、浓硫酸、硫酸亚铁铵、重铬酸钾,以上试剂均为分析纯,活性炭为市售.
仪器:分析天平,武汉新科试验仪器设备有限公司;CS310电化学工作站,武汉科思特仪器有限公司; pH计PHS-3C,上海今迈仪器仪表有限公司;鼓风干燥箱,合肥华德利科学器材有限公司;电子万用炉,天津市泰斯特仪器有限公司; SX2-4-10箱式节能电阻炉,湖北英山县建力电炉制造有限公司;美国 Micromeritics ASAP 2000HD88型物理吸附仪;德国 Bruker D8A25X射线衍射仪; JSM6510LV扫描电镜/X射线能谱仪,日本电子;UV-3600紫外可见分光光度计,日本岛津.
1.2 催化剂制备
称取一定质量的活性炭用稀硝酸浸泡 24h,去离子水洗涤至洗涤液 pH值为 7,在干燥箱100℃下干燥备用.
取一定质量稀硝酸改性过的活性炭加入到Cu(NO3)2、Nd(NO3)3、柠檬酸等具有相关物质的量比的混合溶液中,然后逐滴滴加氨水,搅拌均匀,调节溶液 pH6.5,后在 80℃下水浴反应1h,所生成粘稠状的液体,在 100℃恒温水浴中蒸干,得到的固体置于 l20℃干燥箱中干燥 24h后,置于马弗炉中 500℃下焙烧 5h,即得到 Cu/ Nd-AC催化剂.
1.3 空气扩散电极(ADC)制备
首先将1.5mL蒸馏水、1.5mL质量分数60%的PTFE分散液和0.27g炭黑的混合溶液搅拌20s后,将该混合液均匀的涂在PAN碳毡(10×5cm2)上面. 改性后的 PAN碳毡自然干燥后,在马弗炉条件下350℃焙烧30min.然后将5.82mL蒸馏水、0.09mL质量分数60%的PTFE分散液、0.18g炭黑和0.5mL异丙醇的混合溶液搅拌20s,再次将该混合液均匀的涂在焙烧后的 PAN碳毡的同一面上,自然干燥后,空气扩散电极制备完成.
1.4 实验方法
先取苯酚配制约 504mg/L的模拟含酚废水备,其COD测定为1200mg/L.
首先利用稀硫酸或 NaOH溶液调节模拟含酚废水至预先设定的pH值(1~8),后取300mL调节过 pH值的模拟含酚废水,加入到自制的圆柱形反应容器中(反应容器上面装有磁力搅拌,减少传质阻力),以Na2SO4作为含酚废水电解质,将内部填充有Cu/Nd-AC负载催化剂的阳极篮(不锈钢丝网)作阳极,空气扩散电极作阴极,在外加400mA/dm2恒电流以及通入恒定速率空气的条件下,进行电催化氧化实验,反应一段时间后,取出部分溶液,静置24h,过滤获取上层清液,按照国家标准 GBll914—89[10](重铬酸钾法)测定其CODCr和分光光度法测定苯酚浓度,计算含酚废水的 COD和苯酚去除率.为了减少实验测量误差,以下实验结果为3个平行样的平均值.
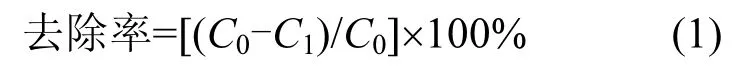
式中:C0为处理前废水的COD(或苯酚浓度)值浓度,Cl为处理后废水的COD(或苯酚浓度)值浓度.
1.5 分析测试
采用物理吸附仪测定液氮在77.35K的吸附等温线,采用BET方程和BJH方程计算载体的BET比表面积和孔径分布,测试前样品预先300℃抽真空处理3h.
采用 X射线衍射仪测定样品表面相结构和相组成,测试条件为:Cu Kα (λ=1.5418Å),管电压40kV,管电流30mA,扫面范围2θ = 10º~80º;利用德拜-谢乐方程估算样品表面晶粒尺寸.
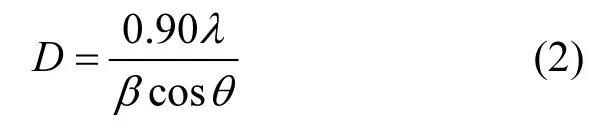
式中:D为晶粒尺寸大小,nm ; λ为波长,nm ; β为最大半宽衍射角,弧度;θ为布拉格角度,弧度.
采用扫描电镜/X射线能谱仪测定样品表面形貌和元素含量.采用分光光度计草酸钛钾滴定法在λmax= 400nm测量H2O2浓度.采用紫外可见分光光度计在270nm处测定废水中苯酚的吸光度.采用直接分光光度法测量水样中的苯酚浓度.采用国家标准重铬酸钾法(GBll914—89)测定废水CODCr.
2 结果与讨论
2.1 催化剂表征
2.1.1 BET 从表1可以看出,Cu/Nd-AC负载活性炭的比表面积和总孔容明显大于未负载的活性炭,比表面积由 695.453m2/g增加到788.006m2/g,总孔容由 0.363cm/g 增加到0.409cm/g,但平均孔径略有减小,从2.087nm减小到 2.077nm.这是因为经溶胶-凝胶法制备的Cu/Nd-AC负载活性炭,在其表层均匀分布着纳米结构的金属氧化物颗粒,导致负载后的活性炭比表面积增大,这一点从SEM图像中得到证实.
2.1.2 XRD 从图 1可以看出,空白活性炭在2θ=25.11º和 43.34º出现较强的衍射峰,对应于碳元素特征衍射峰,与文献[11]中碳元素特征衍射峰相吻合.在Cu/Nd-AC XRD谱图中,2θ =35.48º、38.76º、48.71º、53.44º、58.33º、61.55º、66.28º、 68.17º、75.26º出现衍射峰,它们对应于CuO特征衍射峰(JCPDS#41-254).但是未出现钕氧化物的衍射峰,可能是因为Cu/Nd-AC表面钕元素含量很低.利用德拜-谢乐方程估算Cu/Nd-AC表面晶粒尺寸为121.374nm (表1).
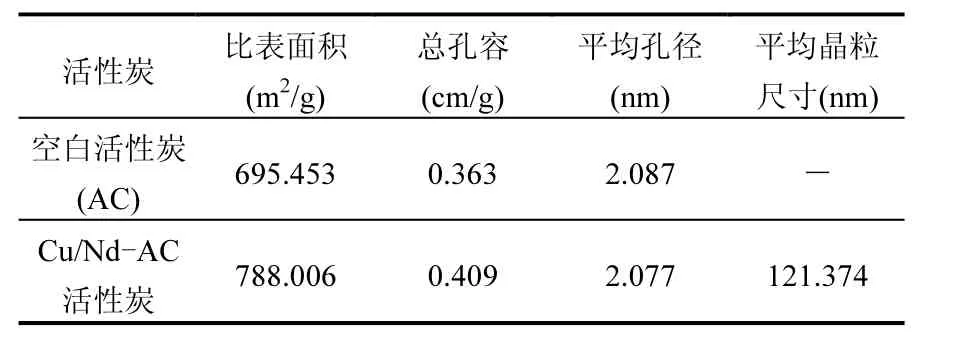
表1 空白活性炭AC和Cu/Nd-AC负载催化剂的结构特性Table 1 The textural properties of blank AC and Cu/Nd-AC supported catalyst
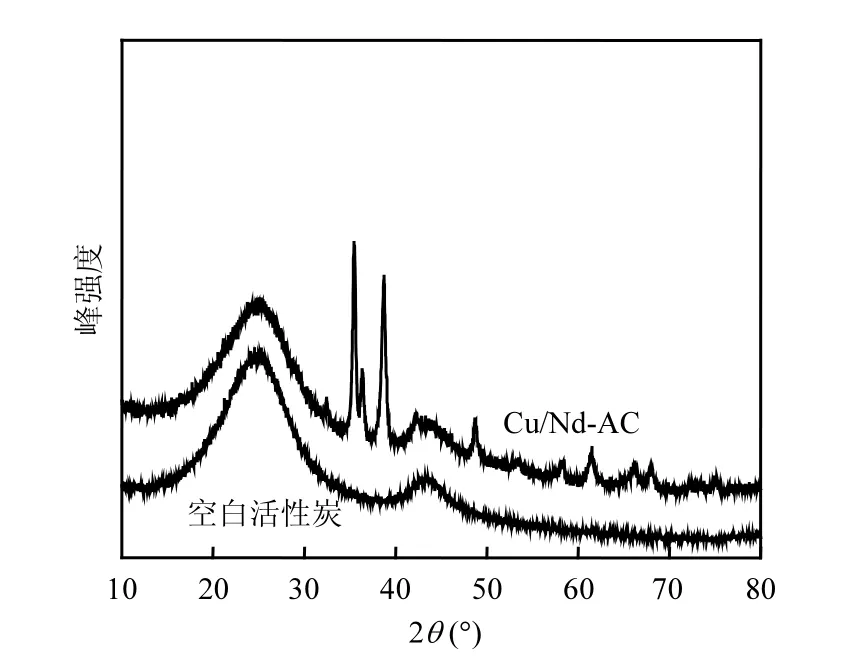
图1 空白活性炭和Cu/Nd-AC催化剂的XRD谱图Fig.1 XRD energy spectrums of blank AC and Cu/Nd-AC supported catalyst
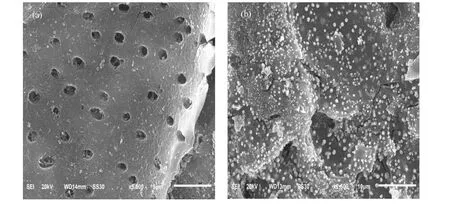

图2 空白活性炭(a)和Cu/Nd-AC(b,c,d) 的SEM图Fig.2 SEM images of blank AC (a) and Cu/Nd-AC(b,c,d)
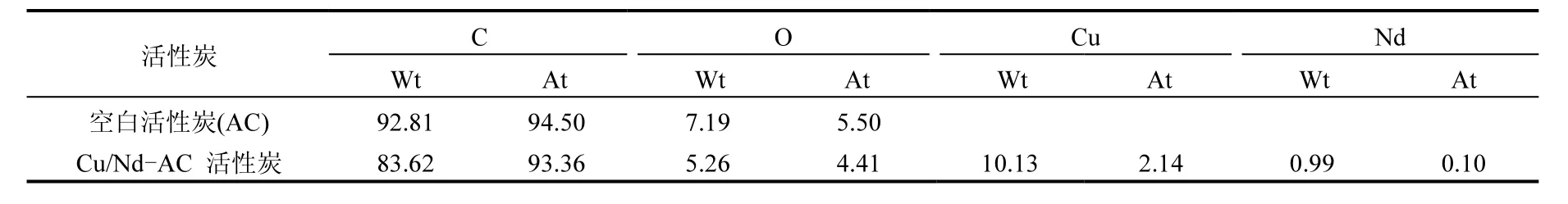
表2 空白活性炭AC和Cu/Nd-AC负载催化剂中元素含量(%)Table 2 The element contents of blank AC and Cu/Nd-AC supported catalyst (%)
2.1.3 SEM 对经稀硝酸处理的空白活性炭、Cu/Nd-AC负载活性炭的表观形貌和结构进行SEM扫描,结果如图2所示.如图2(a)所示,经稀硝酸处理的空白活性炭,其表面比较光滑,活性炭表面的孔洞清晰可见.如图(b)(c)所示,经金属负载后的活性炭,其表面形成一层均匀小颗粒.小颗粒平均尺寸已达到纳米级别,与XRD中德拜-谢乐方程估算表面晶粒平均尺寸基本相吻合.但仍需要对表面小颗粒成分作进一步检测.
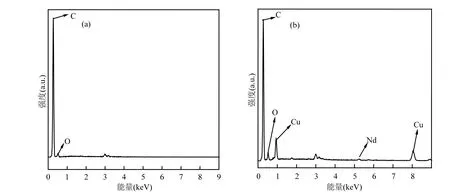
图3 空白活性炭(a)和Cu/Nd-AC(b) 的EDS能谱Fig.3 EDS of (a) blank AC , (b)Cu/Nd-AC
2.1.4 EDS 对经稀硝酸处理的空白活性炭、Cu/Nd-AC负载活性炭的表面进行EDS元素扫描,结果如表2和图3所示.其中,经稀硝酸处理的空白活性炭,其表面主要元素为C、O元素,含量分别为92.81%和7.19%.经Cu(NO3)2、Nd(N03)3负载后的活性炭,发现C元素依然为主要元素,同时含有10.13%Cu、0.99%Nd和5.26%O元素,由此可证明负载后的活性炭表面小颗粒为铜钕氧化物的混合物.
2.2 实验条件优化
2.2.1 阴极材料的选择 用已制备好的空气扩散电极和具有相同几何面积的不锈钢片分别作阴极,反应体系中无降解产物,其他条件相同,考查不同阴极材料对 H2O2生成量的影响.如图 4所示.
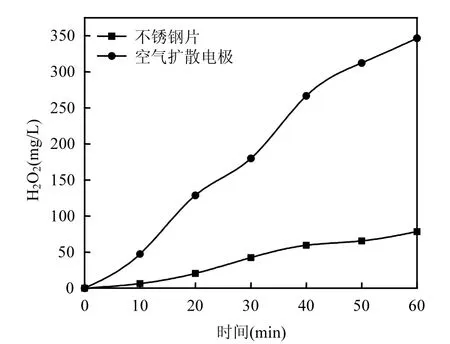
图4 不同阴极材料条件下H2O2生成量与电解时间的关系曲线Fig.4 The dependence of H2O2content versus electrolysis time in case of using different cathode material
反应时间在0~1h之间,随着反应时间的增加,体系中 H2O2生成量不断增大.尤其是空气扩散电极,反应1h时H2O2浓度达到346.58mg/L,远远高于不锈钢片阴极(78.52mg/L).这是因为在一定压力下,空气或氧气可从空气扩散电极的一侧直接扩散到电极的另一侧,同时空气扩散电极的多孔结构为氧还原提供了较大的气液固三相接触面积和大量的薄液膜,从而提高了氧传质浓度和还原效率[12].因此以下实验均选择空气扩散电极作阴极.
2.2.2 反应体系的选择 将已制备好的 Cu/Nd-AC负载活性炭进行电催化氧化,在不输入电流情况下进行吸附试验和直接曝气氧化实验.反应时间对含酚废水COD去除率的影响如图5所示.
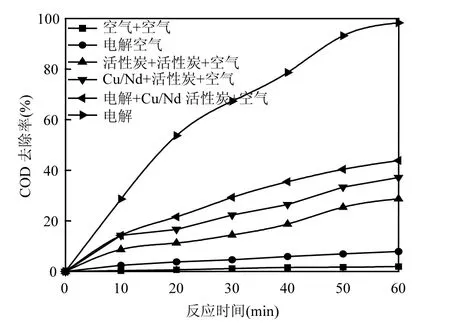
图5 不同体系中含酚废水COD去除率与时间关系曲线Fig.5 The COD removal efficiency of phenolic wastewater versus electrolysis time for different system
可以看出,在0~1h之间,6种体系中含酚废水COD去除率随着反应时间的增加而增大.然而,只对反应体系进行曝气处理,1h后含酚废水COD去除率仅为1.98%;阳极篮作阳极,空气扩散电极作阴极,直接对含酚废水进行曝气和电解,1h后COD去除率也只有7.84%.说明空气及其与电解的组合对废水中苯酚的氧化能力都很低.当将空白活性炭或 Cu/Nd-AC负载活性炭填充入阳极篮,对含酚废水从底部曝气,在不输入电流情况下进行吸附实验,1h COD去除率分别可达28.71%和34.12%.表明Cu/Nd-AC负载活性炭吸附能力高于空白活性炭,可能是由于其比表面积高于空白活性炭所致.当将填充有空白活性炭的阳极篮作阳极,空气扩散电极作阴极,对含酚废水从底部曝气,进行电催化氧化实验,1h内COD去除率极速增加可达到 43.83%,最后趋于平缓.说明空气及其与空白活性炭电解的组合对废水中苯酚的处理能力有限.当将填充有Cu/Nd-AC负载活性炭的阳极篮作阳极,空气扩散电极作阴极,对含酚废水从底部曝气,进行电催化氧化实验,1h内COD去除率极速增加可达到98.32%.这是因为随着电解时间的增加,Cu/Nd-AC负载活性炭与电解产生的H2O2反应产生大量⋅OH,含酚废水中的苯酚不断被氧化成CO2和H2O,COD去除率不断增大.但随着电解时间的增加,COD去除率增加变缓,这可能有两方面原因,一方面含酚废水中苯酚的含量不断减少,另一方面随着电解时间的增加,阳极篮中负载催化剂表面碳质沉淀量增加[13],阻碍废水中有机物与催化剂活性位点接触,催化剂活性降低.
因此实验体系选择电解+Cu/Nd-AC负载活性炭+空气组合,电解时间选择1h.
2.2.3 废水pH值的选择 利用稀硫酸和稀氢氧化钠溶液调节含酚废水pH值(pH=1,2,3,4,5,6, 8),进行电催化氧化实验,反应时间为1h.由图6可以看出,当废水pH1~3时,含酚废水COD去除率随着pH值增加而增大.当废水pH 3~8时,含酚废水COD去除率随着pH值增加而减小.
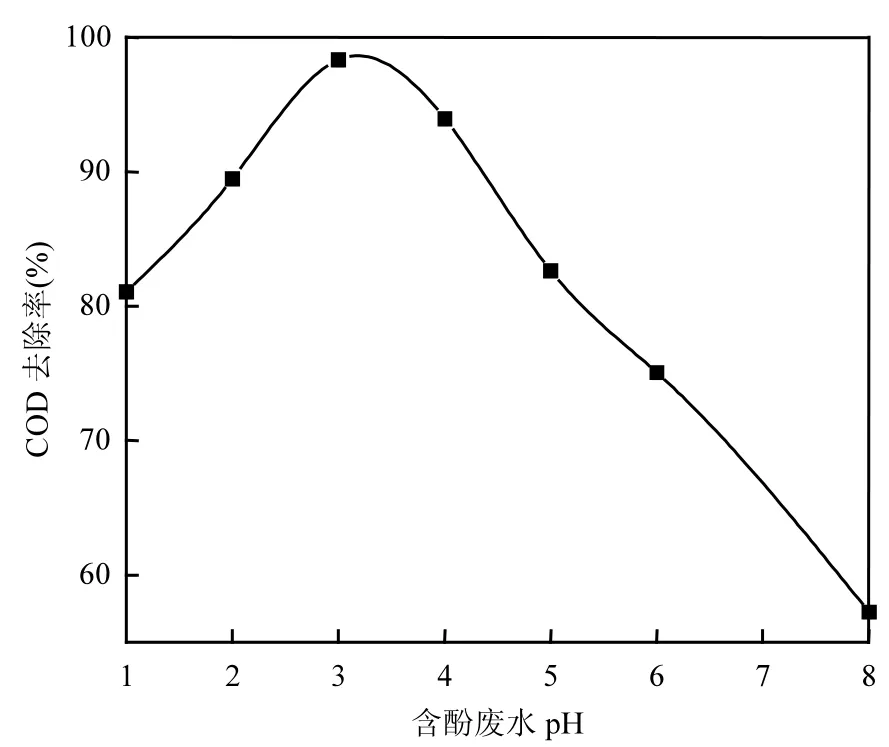
图6 废水pH值对含酚废水COD去除率的影响Fig.6 The effect of pH value of phenolic wastewater on COD removal efficiency
这可能是因为当废水 pH 1~3时,此时废水处于强酸性状态,反应生成的·OH会与 H+结合生成H2O,降低体系中·OH浓度[14],如式(3)所示.
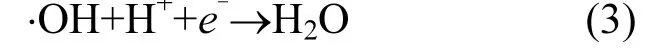
当废水 pH 3~8时,随着废水 pH值的增大,H+浓度进一步在减小,电催化氧化反应体系产生的CO2溶解在废水中形成的OH-、CO32-相对含量增大,抑制反应体系中·OH的产生,以及在pH>7后,废水显碱性, H2O2变得不稳定,容易分解为O2和H2O,氧化能力减弱,并且碱性条件下,废水中含有大量OH-,自由基·OH形成受到抑制,体系中·OH生成量大大减少[15],含酚废水COD去除率急剧下降.本次实验选择废水pH值为3.
2.2.4 电解质Na2SO4投加量的选择 调节废水pH=3,改变电解质 Na2SO4投加量(0,0.5,1.0,1.5, 2.0,2.5,3.0g/L),进行电催化氧化实验,反应时间为1h.如图 7所示,在电解质 Na2SO4投加量为 0~1.0g/L之间时,含酚废水 COD 去除率随着Na2SO4投加量增加而增大;在电解质 Na2SO4投加量为1.0~3.0g/L之间时,含酚废水COD去除率随着Na2SO4投加量增加而减小.
由于含酚废水中苯酚初始含量为 504mg/L,苯酚含量不高,溶液导电能力有限.当电解质投加量为0时,溶液中通电电流较小,含酚废水降解速率低, COD去除率不是很高.随着电解质投加量的增加,废水的导电能力增强,电解效率提高, COD去除率增大.
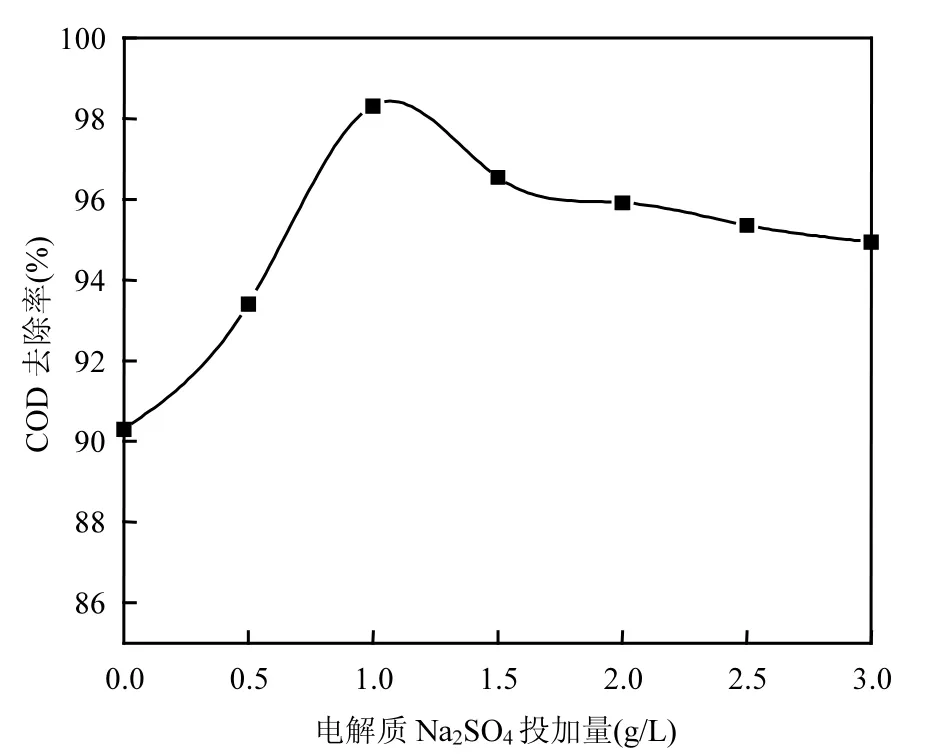
图7 电解质Na2SO4投加量对含酚废水COD去除率的影响Fig.7 The effect of Na2SO4dosage on COD removal efficiency of phenolic wastewater
但是当电解质投加量增加到1.0g/L后,电解效率趋于平缓,并开始有所降低.这是因为电解质Na2SO4为强电解质,在溶液中是完全电离的,电解质投加量过大,溶液中离子之间的静电吸引力增大,离子迁移运动不自由,同时反应体系中电解质的浓度过大,会造成降解体系的短路电流增加,实际有效工作电流减小,电解效率减小[16],含酚废水COD去除率减小.实验选择电解质Na2SO4投加量1.0g/L.
2.2.5 阳极篮中负载催化剂投加量的选择 控制废水pH=3,电解质Na2SO4投加量为1.0g/L,改变Cu/Nd-AC负载催化剂投加量(0,1,2,3,4,5, 6g/L),进行电催化氧化实验反应时间为1h.如图8所示,当Cu/Nd-AC负载催化剂投加量在0~5g/L之间时,含酚废水COD除去率随着Cu/Nd-AC负载催化剂投加量增加而增大.当Cu/Nd-AC负载催化剂投加量在超过5g/L以后,含酚废水COD去除率随着Cu/Nd-AC负载催化剂投加量增加有所降低.
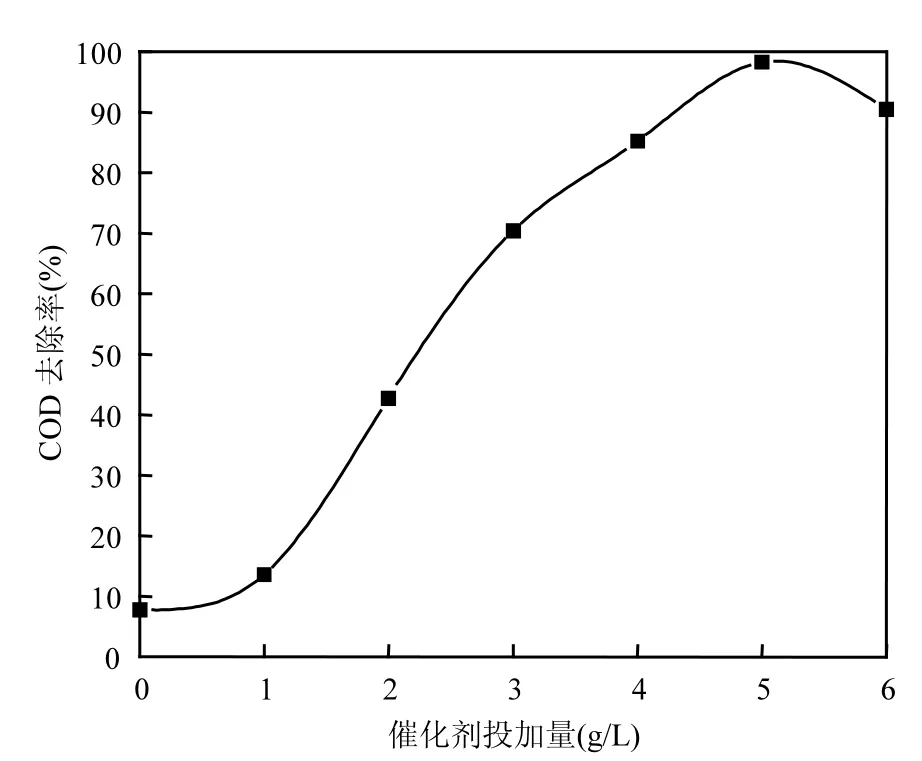
图8 Cu/Nd-AC负载催化剂用量对含酚废水COD去除率的影响Fig.8 The effect of Cu/Nd-AC amount on COD removal efficiency of phenolic wastewater
这可能因为负载催化剂投加量较小时,负载催化剂投加量增加,其表面吸附面积增大,对含酚废水中苯酚吸附能力增强,同时与阴极产生的H2O2反应产生的·OH量增大,含酚废水COD去除率增大. 当负载催化剂投加量增加到一定量后,负载催化剂相互堆积,其表面实际有效吸附面积增加量减小,另一方面,增加负载催化剂的投加量,反应体系中活性中心在增多,此时体系中生成的·OH含量急剧增加,·OH自消耗作用增加[17-19],含酚废水 COD去除率有所降低. 实验选择Cu/Nd-AC负载催化剂投加量为5g/L.
2.2.6 电解电流密度的选择 控制废水pH=3,电解质Na2SO4投加量为1.0g/L,Cu/Nd-AC负载催化剂投加量 5g/L,改变电解电流密度大小(0,100, 200,300,400,500,600mA/dm2),进行电催化氧化实验,反应时间为 1h.如图 9所示,当电解电流密度在0~400mA/dm2之间时,含酚废水COD去除率随着电解电流密度增加而增大.当电解电流密度在400~600mA/ dm2之间时,含酚废水COD去除率随着电解电流密度增加反而有所减小.
这可能是因为当电解电流密度为 0mA/dm2时,阳极中的Cu/Nd-AC负载催化剂在外界曝气条件下,能够吸附废水中一定量的苯酚,此时COD去除率为 34.12%.随着电解电流密度的增加,阴极还原生成的 H2O2量增大,与阳极金属离子反应生成的·OH量增加,电催化氧化效率提高,COD去除率增大;当电解电流密度在 400~600mA/dm2之间时,随着电解电流密度的进一步增加,电催化氧化阳极析氧副反应大大增加,以及阳极负载催化剂中金属活性组分的溶出[20],电催化氧化效率降低,COD去除率有所减小.实验选择电解电流密度为400mA/dm2.
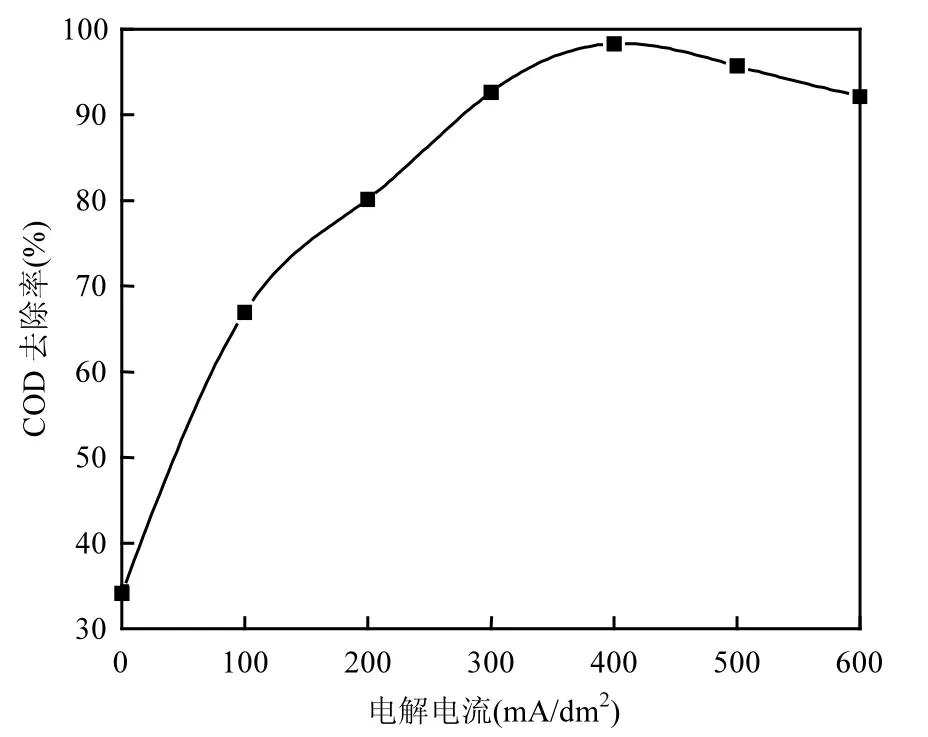
图9 电解电流密度对含酚废水COD去除率的影响Fig.9 The effect of electrolysis current density on COD removal efficiency of phenolic wastewater
2.2.7 最优条件下苯酚浓度去除率 在废水pH=3,电解质Na2SO4投加量为1.0g/L,Cu/Nd-AC负载催化剂投加量 5g/L,电解电流密度大小400mA/dm2条件下,进行电催化氧化实验,反应时间为1h.如图10所示,随着电解时间的增加,含酚废水中苯酚浓度去除率逐渐增大,在反应时间40~60min之间时,苯酚浓度去除率开始趋于平缓,可能是因为含酚废水中苯酚浓度越来越低.在60min时苯酚浓度去除率可以达到99.59%,表明此方法已取得很理想的苯酚去除效果.
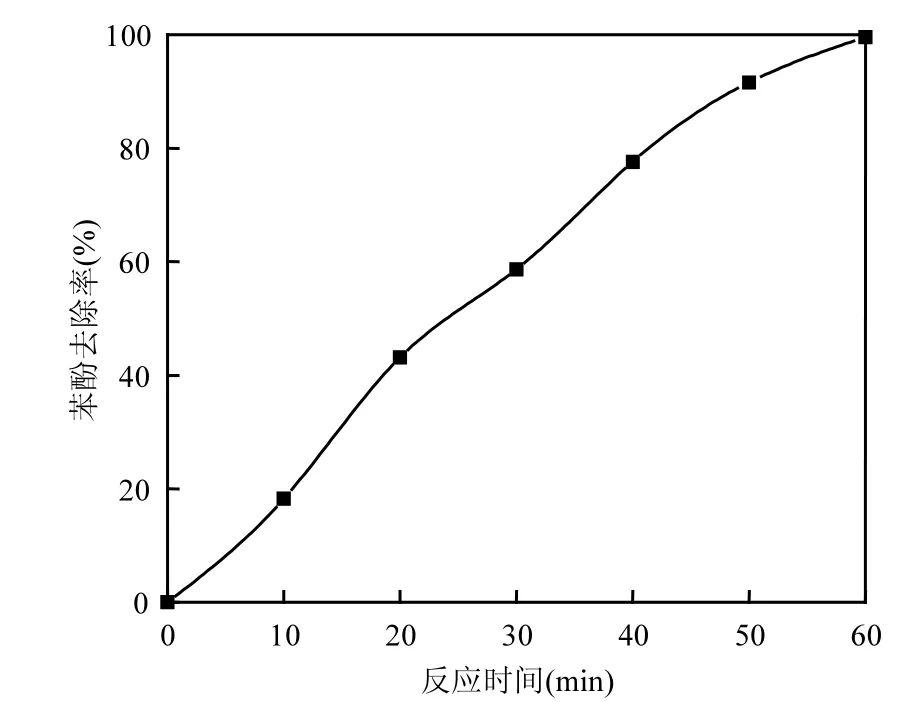
图10 反应时间对苯酚浓度去除率的影响Fig.10 The effect of reaction time on phenol removal efficiency of wastewater
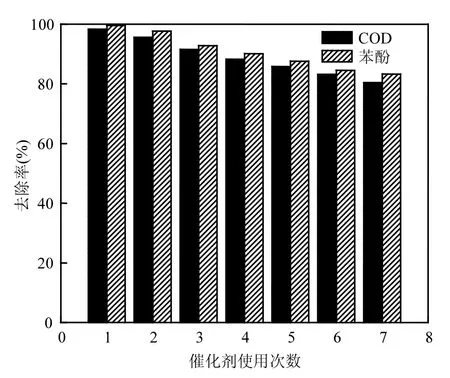
图11 Cu/Nd-AC使用次数对含酚废水COD和苯酚去除率的影响Fig.11 The effect of cycle using number on phenol removal efficiency of wastewater
2.2.8 Cu/Nd-AC负载催化剂的稳定性 为了测试Cu/Nd-AC负载催化剂的稳定性,每次电催化氧化降解含酚废水实验后,将Cu/Nd-AC负载催化剂取出,在乙醇溶液中超声震荡清洗 30min,再用去离子水洗涤数次放入 100℃烘箱中干燥6h,进行下一次电催化氧化实验,反应时间为 1h.如图11所示,随着Cu/Nd-AC负载催化剂使用次数的增加,含酚废水 COD苯酚去除率呈阶梯状递减,不过变化幅度不大,使用7次后COD和苯酚去除率依然都能保持在 80%以上,可见催化剂稳定较好.
2.3 含酚废水处理前后紫外可见光谱图
为了进一步证明含酚废水中苯酚电催化氧化降解效果,量取 300mL含酚废水(苯酚浓度约为504mg/L,相当于COD1200mg/L)到反应器中,调节pH=3,电解质Na2SO4投加量为1.0g/L,阳极篮中Cu/Nd-AC负载催化剂填充量为5g/L,电解电流密度为400mA/dm2,从反应器底部曝气,进行电催化氧化实验,每隔10min取样,分别对反应前后的含酚废水做紫外可见光谱分析,结果如图12所示.
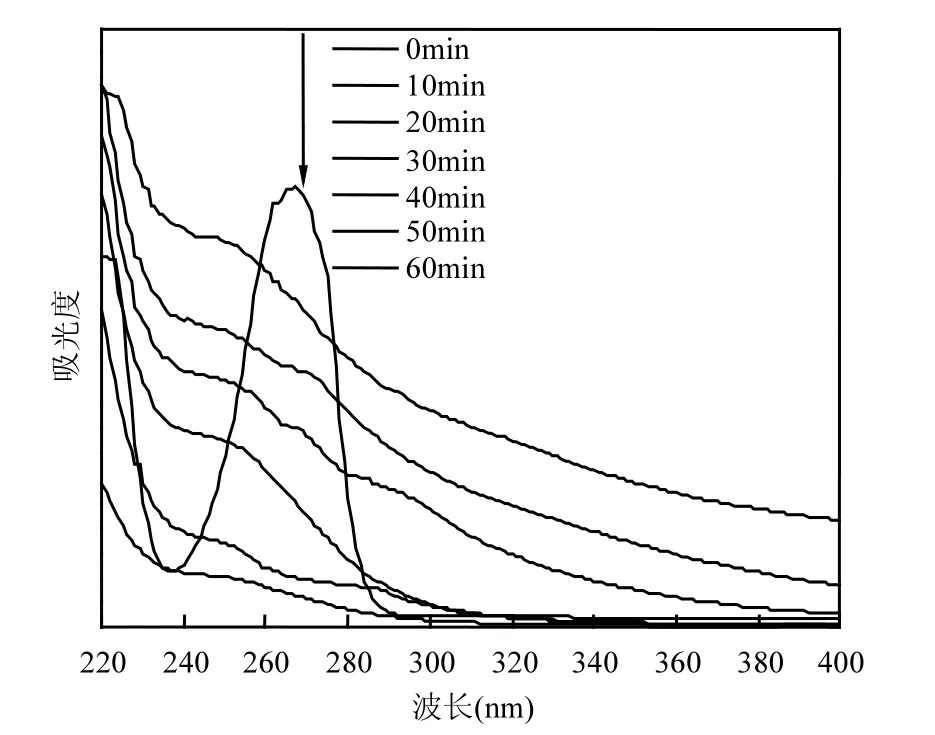
图12 含酚废水处理前后紫外可见光谱Fig.12 UV-vis absorption spectra of phenolic wastewater before and after electro-catalytic oxidation reaction
依文献[21]可知,处理前的含酚废水中苯酚在270nm处有很强的吸收峰,从图中可以得到证实,经过1h连续处理后,270nm吸收峰强度不断被削弱,由此可证明,含酚废水中苯酚被反应体系中生成的⋅OH所降解,但是吸收峰发生蓝移,可能是因为反应过程中有对苯二酚、邻苯二酚、邻苯酚、对苯醌、己二烯二酸等中间产物[22-23],上图中246nm吸收峰便对应的是中间产物对苯醌[24],但随着电解时间的增加最终都氧化成无机小分子化合物(如CO2,H2O).
2.4 降解能力实验与去除效率对比
为了探讨本文方法的降解能力,选择以上最优方案分别降解COD为3500mg/L(苯酚含量约为 1469mg/L)、1200mg/L(苯酚含量约为504mg/L)、380mg/L(苯酚含量约为 159mg/L)的含酚废水实验,结果表3所示.
对比相关研究,当苯酚废水浓度600mg/L,电解140min,苯酚去除率才为94.7%,COD去除率达 90.4%[4];当苯酚含量为 200mg/L,耗时 5h, P-CNT/TiO2电极吸附量仅达249.01mg/g[5];当苯酚浓度550.2mg/L,电解1h后,COD去除率仅达66.3%[6].可以看出,本实验采用阳极篮作阳极、空气扩散电极作阴极的电催化氧化方法,由于电极巨大表面积的设计优势,其电化学降解效率得到大大提高.
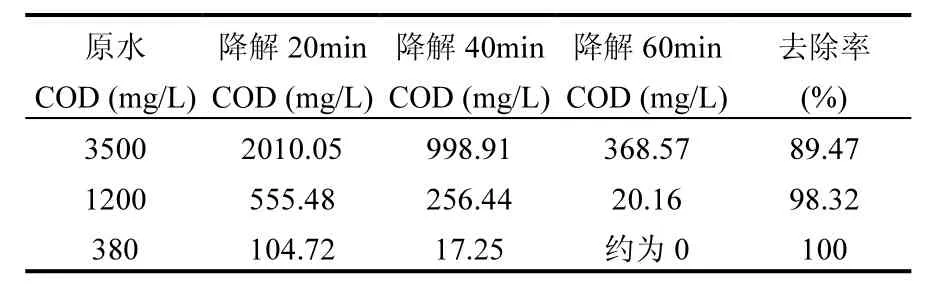
表3 不同水样的降解效率Table 3 The degradation efficiencies of different wastewater samples
2.5 电催化氧化降解机制
对反应体系从底部进行曝气处理,阴极发生还原反应,O2会被还原成 H2O2,而阳极篮 Cu/ Nd-AC负载活性炭中的Cu2+经过错综复杂的机制与 H2O2反应生成⋅OH,最终实现苯酚的降解,具体过程如[25-27]下:
第一步:
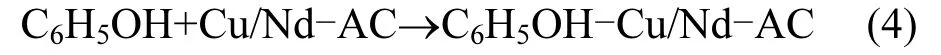
第二步:阴极:
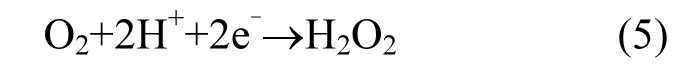
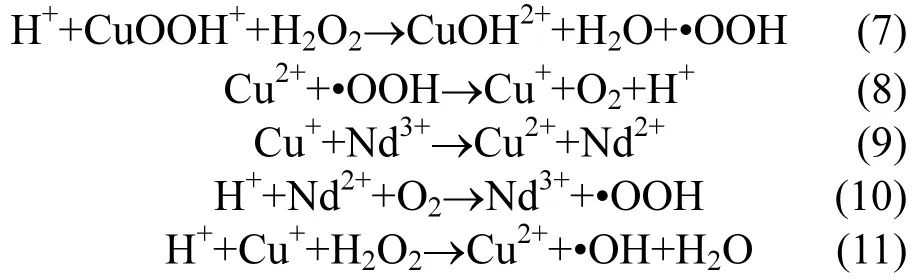
首先第一步,由于阳极Cu/Nd-AC负载催化剂具有巨大的表面积,通过反应(4)苯酚将会吸附到负载催化剂表面.
第二步,外界通入的空气(O2)通过反应(5),会在阴极还原生成H2O2.由于反应体系中磁力搅拌器的传质作用,通过反应(6) H2O2首先会与Cu/Nd-AC负载活性炭晶格中 Cu2+反应生成氢过氧化铜离子CuOOH+,通过反应(7) CuOOH+继续与H2O2反应生成•OOH. 通过反应(8) Cu2+被还原成Cu+,然后通过反应(11)Cu+与H2O2反应生成羟基自由基•OH.其中反应(9)(10)中 Nd3+/Nd2+与 Cu2+/Cu+组成氧化还原对,加速体系中电子传输,促进氧还原.最后,通过反应(12),苯酚被•OH逐渐氧化降解,生成小分子产物.
3 结论
3.1 经BET检测,溶胶-凝胶制备的Cu/Nd-AC负载活性炭,相对于空白活性炭具有更大比表面积,比表面积由695.453m2/g增加到788.006m2/g.通过SEM-EDS检测,其表面覆盖有一层均匀的纳米结构铜钕氧化物小颗粒.
3.2 504mg/L含酚废水最佳处理条件为反应时间1h,电解质Na2SO4投加量为1.0g/L,Cu/Nd-AC负载催化剂投加量 5g/L,废水pH=3,电解电流密度400mA/dm2,此时含酚废水COD和苯酚去除率分别可达到 98.32%,99.59%.经紫外光谱检测,苯酚已经被完全降解.且经过再生处理后Cu/Nd-AC负载催化剂,7次电催化氧化实验后含酚废水 COD和苯酚去除率依然能保持在80%以上.
[1] Brillas E, Sirés I. Electro-Fenton process and relatedelectrochemical technologies based on Fenton’s reaction chemistry [J]. Chemical Reviews, 2009,109(12):6570–6631.
[2] Natija Barhoumi, Lazhar Labiadh, Mehmet A Oturan, et al. Electrochemical mineralization of the antibiotic levofloxacin by electro-Fenton-pyrite process [J]. Chemosphere, 2015,141:250–257.
[3] 岳 琳,王开红,郭建博,等.多金属氧酸盐电催化降解染料废水的研究 [J]. 中国环境科学, 2013,33(1):88-94.
[4] 伍 波,李 鹏,张 波,等.负载型粒子电极电催化氧化苯酚的研究 [J]. 中国环境科学, 2015,35(8):2426-2432.
[5] 施 周,杨文浩,杨灵芳,等.等离子改性CNT/TiO2电极吸附去除水中苯酚的研究 [J]. 中国环境科学, 2015,35(9):2664-2669.
[6] 刘 咏,李 妍,赵仕林,等.锰一稀土/Y分子筛复合电催化处理含酚模拟废水 [J]. 中国环境科学, 201l,3l(5):740-747.
[7] 王海人,王麒钧,王麒宁.一种活性炭篮作阳极电化学降解有机废水的方法及装置 [P]. 中国专利:2012103983710, 2013.2.6.
[8] 王海人,王麒钧,王麒宁.一种多级流道式废水处理装置及废水处理方法 [P]. 中国专利: 2012104049499,2013.2.6.
[9] 王麒钧,王海人,张 俊,等.一种可连续分离油水渣的电化学废水处理装置 [P]. 中国专利: 201220699759,2013.4.17.
[10] GB11914—89 重铬酸钾法测化学需氧量 [S].
[11] Zhao Hongying, Wang Yujing, Wang Yanbin, et al. Electro-Fenton oxidation of pesticides with a novelFe3O4@Fe2O3/ activated carbon aerogel cathode; High activity, wide pH range and catalytic mechanism [J]. Applied Catalysis B: Environmental, 2012,125:120–127.
[12] 宋叶青,曹礼梅,杨 骥.高效产 H2O2气体扩散电极的研究 [J].环境化学, 2015,34(4):692-695.
[13] Ana Vallet, Gabriel Ovejero, Araceli Rodriguez, et al. Ni/MgAlO regeneration for catalytic wet air oxidation of an azo-dye in trickle-bed reaction [J]. Journal of Hazardous Materials, 2013, 244–245:46–53.
[14] Wang Nannan, Zheng Tong, Zhang Guangshan, et al. A review on Fenton-like processes for organic wastewater treatment [J]. Journal of Environmental Chemical Engineering, 2014,6:762–787.
[15] Ma Hongzhu, Zhou Qiongfang, Wang Bo. Characteristics of CuO-MoO3-P2O5catalyst and its catalytic wet oxidation (CWO) of dye wastewater under extremely mild conditions [J]. Environmental Science & Technology, 2007,41:7491-7496.
[16] 孔令国.负载型三维电极降解偶氮类印染废水的研究 [D]. 南京:南京航空航天大学, 2011.
[17] Wang Bo, Gu Lin, Ma Hongzhu. Electrochemical oxidation of pulp and paper making wastewater assisted by transition metal modified kaolin [J]. Journal of Hazardous Materials, 2007,14(3): 198-205.
[18] GuoFang, XuJunqiang, LiJun. Kinetics studies for catalytic oxidation of methyl orange over the heterogeneous Fe/Beta catalysts [J]. Advanced Materials Research Vols, 2013,361-364.
[19] Li Hongya, Zhao Binxia, Bai Weili, et al. Study on catalytic wet oxidation of H-Acid Containing Water over Fe/Si02catalyst [J]. Advanced Materials Research, 2013:181-284.
[20] 岳 琳,王启山,徐美娟,等.粒子电极对垃圾渗滤液的电催化降解 [J]. 水处理技术, 2008,34(4):65-68.
[21] Song Xu Chun, Zheng Yi Fan, Yin Hao Yong. Catalytic wet air oxidation of phenol over Co-doped Fe3O4nanoparticles [J]. Nanopart Research, 2013,15:1856.
[22] 袁付庆,张 静,方 超.稀土元素对镁合金晶粒细化的研究 [J].材料热处理技术, 2012,41(2):30-33.
[23] Liotta L F, Gruttadauria M, Di Carlo G, et al. Heterogeneous catalytic degradation of phenolic substrates; Catalysts activity [J]. Journal of Hazardous Materials, 2009,162:588–606.
[24] Zhou Shiwei, Qian Zhenying, Sun Tao, et al. Catalytic wet peroxide oxidation of phenol over Cu–Ni–Al hydrotalcite [J]. Applied Clay Science, 2011,53:627–633.
[25] Yasnessya Hardjono, Hongqi Sun, Huyong Tian, et al. Synthesis of Co oxide doped carbon aerogel catalyst and catalytic performance in heterogeneous oxidation of phenol in water [J]. Chemical Engineering Journal, 2011,174:376–382.
[26] Angela Anglada, Ane Urtiaga, Inmaculada Ortiz, et al. Treatment of municipal landfill leachate by catalytic wet air oxidation; Assessment of the role of operating parameters by factorial design [J]. Waste Management, 2011,31:1833–1840.
[27] Belgin Gozmen, Berkant Kayan, Murat Gizir A, et al. Oxidative degradations of reactive blue 4dye by different advanced oxidation methods [J]. Journal of Hazardous Materials, 2009,168: 129–136.
Preparation and property investigation of nano-composite AC supported Cu/Nd catalyst.
ZHOU Shu, XIAO Song, WU Jie, CAO Zhi-yong, QU Jun-e, HE Yun-bin, WANG Hai-ren*(School of Materials Science and Engineering, Hubei University, Wuhan 430062, China). China Environmental Science, 2017,37(3):915~924
Nano composite AC (active carbon) supported Cu/Nd catalyst was prepared by sol-gel method using Cu(NO3)2and Nd(NO3)3as active components. Electro-catalytic oxidation of phenolic wastewater was performed by using a stainless steel wire basket filled with Cu/Nd-AC catalyst as anode, and air diffusion electrode as cathode (ADE). The catalytic activity of the prepared catalyst was evaluated by of COD (chemical oxygen demand) and phenol removal rates of the wastewater. The optimum parameters were found to be as follows: Cu/Nd-AC catalyst dosage = 5g/L, solution pH = 3, and electrolysis current density = 400mA/dm2. In this case, the COD and phenol removal rates could reach 98.32% and 99.59%, respectively, after 1h degradation for a phenol solution of 504mg/L concentration.
sol-gel method;supported catalyst;electro-catalytic oxidation;phenolic wastewater;air diffusion electrode
X703
A
1000-6923(2017)03-0915-10
周 庶(1990-),男,湖北黄冈人,湖北大学硕士研究生,主要研究方向废水处理.发表论文2篇.
2016-06-20
国家自然科学基金资助项目(51202062,61274010, 51572073);湖北省自然科学基金(2015CFA038)
* 责任作者, 教授, whr9999whr@163.com
