微小RNA在类风湿关节炎免疫应答中的作用
2017-04-11马婧一党秋杰
马婧一,党秋杰Δ,李 洋
(Δ哈尔滨医科大学附属第二医院风湿免疫科,哈尔滨 150086)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,RA的特征病变是滑膜增生,自身抗体的产生,软骨和骨的破坏。其导致的关节畸形、进展性功能丧失和其他关节外表现,会降低患者平均寿命,并且给患者家庭和社会带来巨大的经济损失。RA的病因至今未明确,根据Mcinnes等[1]的总结,RA的发生与遗传因素与环境因素(如吸烟和微生物感染等)相互作用有关。免疫系统紊乱则是RA发生的重要机制,包括免疫细胞的异常增殖、细胞因子的异常表达等。
微小RNA(microRANA,miRNA)是一种单链、长度约为21~23个核苷酸的非编码小分子RNA,通过阻止蛋白质翻译或影响mRNA稳定来调节基因的表达。miRNA在免疫应答中发挥调控作用,与自身免疫性疾病息息相关。近年来,许多研究都揭示了miRNA在RA的病理机制中的作用,本综述试从免疫机制角度描述miRNA在RA中的作用。
miRNA在 RA中对免疫细胞的调节作用
miRNA对T细胞的调节作用
RA患者在受累关节滑膜中可以检测到T细胞数量的明显升高,T细胞在关节滑膜中的积聚是RA的一种常见病理机制,因此应当充分理解T细胞与miRNA的关系。
CD4+T细胞可以分为几个亚型,包括Th1、Th2、Th17和调节性T细胞(regulatory T cells,Treg)等。Treg细胞主要通过分泌细胞因子 白细胞介素(interleukin,IL)- 10和转化生长因子-β(transforming growth factor-β,TGF-β),发挥免疫抑制功能,维持免疫稳态。研究显示,miRNA可以调节Treg的增殖能力和生理功能,如miR- 92a、miR- 21和miR- 155等均可调控Treg,所以miRNA在Treg中的异常表达可以导致自身免疫性疾病的发展[2]。在研究miRNA对于Treg细胞功能的调控时发现,miR- 146a表达下降可导致Treg细胞出现促炎表型。在RA疾病活动度高时,信号传导及转录激活因子1(signal transducers and activators of transcription 1,STAT1)作为miR- 146a的靶点,在miR- 146a下调时活化增加,从而促进了促炎表型的Treg细胞增殖[3]。国内也有has-miR- 146a转基因小鼠的研究[4],实验结果推测has-miR- 146a可以抑制肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factors 6,TRAF6)蛋白的表达,可能与CD4+T细胞功能异常有关。van der Geest等[5]的研究也表明miR- 21在RA患者的滑膜液(synovial fluid, SF)中表达上调可使记忆表型Treg细胞增殖活跃、凋亡减少,并可在SF中积聚。
根据Dong等[6]的描述,Th17细胞和Treg细胞数量的失衡也是RA病理进展的机制之一,RA患者的外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中Th17细胞数量显著高于Treg细胞数。经研究发现,RA患者PBMC中miRNA- 21水平的下调,伴随着促炎性细胞因子[IL- 17、IL- 6、IL- 1β和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)]水平上调,可以导致Th17/Treg细胞数量失衡,以上结果证明在RA的慢性炎症反应过程中,miR- 21可以通过正向调控Treg细胞或负向调控信号转导及转录激活因子3(signal transducers and activators of transcription 3,STAT3)抑制炎症反应;而miR- 21水平下降可能导致STAT3表达和活化的增加,同时抑制STAT5的表达,分化Th17增多而分化Treg受限,最终产生炎症反应。
Fulci等[7]的研究表明,miR- 223在RA患者幼稚CD4+T淋巴细胞中表达增加。随后,Lu等[8]发现,miR- 223和miR- 34b在RA患者的T细胞中过表达,但类风湿因子(rheumatoid factor,RF)的滴度只随miR- 223的水平升高,因此miR- 223表达的增加可以减少RA 患者T细胞IGF- 1介导的IL- 10的产生,从而导致促炎性细胞因子和抗炎性细胞因子的失衡。
此外,Li等[9]发现,miR- 363和miR- 498在RA患者CD4+T细胞中的表达下调;而miR- 146a表达升高,TNF-α水平也随之升高。体外实验证明,miR- 146a上调了TNF-α的表达,增加的miR- 146a也可以通过调节Fas相关因子1(Fas associated factor 1,FAF1)抑制T细胞的凋亡[10]。
另有研究发现,RA的发生与CD4+T细胞相关DNA低甲基化有关,而miRNA是调节DNA甲基化水平的重要因素之一[11]。而miRNA- 126水平的上升 可能会抑制甲基转移酶1(DNA methyctransferace1,DNMT1)的表达,从而使CD4+T细胞中CD11a和CD70基因启动子的DNA甲基化程度下降,CD4+T细胞表达增多,导致了RA的发生和进展[12]。
miRNA对B细胞的调节作用
B细胞被激活时会分化为浆细胞,并分泌大量免疫球蛋白;免疫球蛋白和类风湿因子(rheumatoid factor,RF) 形成免疫复合物后,由补体激活诱发炎症。B细胞活化因子(B cell activating factor belonging to the TNF family,BAFF)能够维持体内B细胞稳态,在介导B细胞活化中起到关键性作用,BAFF的过表达可使自身反应性B细胞增殖产生自身抗体。在RA患者血清和关节液中,BAFF的水平显著升高,且与疾病活动度相关[13]。miR- 30a- 3p在RA患者SF中表达下调,同时BAFF合成增加,也可能是在RA患者体内自身免疫应答发生的主要机制之一[14]。
miRNA对细胞因子网络的调节作用
细胞因子信号网可以通过调控炎症和免疫过程而导致RA的病理进展,迄今的研究表明,细胞因子介导的RA疾病进展过程(早期、急性期和慢性期)分别由特异的miRNA调控。
miRNA对TNF-α的调节作用
TNF-α是一种具有免疫调节功能的细胞因子,由单核细胞、巨噬细胞、B细胞、T细胞、成纤维细胞等合成,表达于破骨细胞前体细胞表面,可以刺激滑膜细胞和软骨细胞合成前列腺素E2和胶原酶,罗心静等[15]的实验证实TNF-α可诱导RA滑膜细胞核因子κB(nuclear factor-κB,NF-κB)信号通路活化,说明其可能与RA炎症进程有关。而在Li和Schwarz[16]建立的TNF-α转基因关节炎小鼠模型中,我们发现多种miRNA(如miR- 146a/b等)都与TNF-α的表达水平相关。
在Abouzeid等[17]研究中,RA患者相比骨关节炎(osteoarthritis,OA)患者体内miRNA- 146a的水平更高,研究证明在RA患者滑膜组织中,提高TNF-α和IL- 1β的水平后,miR- 146a/b水平也随之上调[18]。Semaan等[19]发现,TNF-α的释放及其相关mRNA的稳定性由miR- 346维持。此外,miR- 125b和miR- 939在RA成纤维细胞样滑膜细胞(RA fibroblast-like synoviocytes,RAFLS)中表达上调,但抑制两种miRNA的表达并不能使RAFLS中TNF-α的数量恢复至原值,所以此两种miRNA与TNF-α的关系仍没有明确结论。Li等[20]的研究则发现miR- 155的高表达可以抑制细胞因子信号抑制蛋白1(suppressor of cytokine signaling 1,SOCS1)表达,和RA患者体内TNF-α和IL- 1β分泌增多有关。
miRNA对IL- 1β的调节作用
IL- 1是一种促炎性细胞因子,该细胞因子家族中包含IL- 1α和IL- 1β等,多数miRNA与IL- 1的研究都与IL- 1β有关。IL- 1β的表达由固有免疫细胞中的NF-κB信号通路所调控,作用于RA发生过程中,促进软骨细胞的破坏。miR- 146a/b除可在RAFLS中表达上升外[18],也可在其他有软骨细胞破坏的骨性疾病如OA中升高[21],因此,研究miRNA在OA中的表达也可为在RA发展中miRNA与IL- 1β关系的研究提供思路。
miRNA对IL- 6的调节作用
IL- 6是由单核细胞、巨噬细胞、T细胞和滑膜成纤维细胞等分泌的具有多向性的炎性细胞因子,在各项免疫反应中发挥重要作用。Stanczyk等[22]发现,在RA患者体内,miR- 203的上调可直接影响NF-κB信号通路,进而导致MMP- 1和IL- 6的表达水平增高。Alsaleh等[23]发现,在RA患者SF中,IL- 6分泌增加致SF对脂多糖(lipopolysaccharide,LPS)反应性增高,在这些SF细胞中检测到DICER1基因和一些miRNA(包括miR- 19b、- 199b等20种)表达下降。
miRNA对IL- 17和IL- 21的调节作用
IL- 17是由活化的CD4+T细胞产生的一种促炎性细胞因子,可以使其他细胞因子如TNF-α、IL- 1β、IL- 6、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、TGF-β等分泌增加。
在RA患者中研究发现,在产生IL- 17的T细胞中,6种miRNA(如let- 7a、miR- 26、miR- 146a/b、miR- 150和miR- 155)表达显著增加。其中,miR- 146a在增生的滑膜中和分泌IL- 17的T细胞中过表达最为明显[24]。其他研究则发现,在自身免疫性疾病中,miR- 23b和miR- 21表达下调均可使IL- 17分泌增加[10]。
IL- 6和IL- 21介导的STAT信号通路在Tfh细胞分化和Bcl- 6基因表达中起到关键作用,miR- 17- 92基因簇可以诱导Tfh分化,而miR- 10a则负向调控Bcl- 6在T细胞中的表达[25]。
miRNA对IL- 18的调节作用
IL- 18在许多慢性自身免疫性疾病中表达都有上调[26],而在RA的炎症期,IL- 18在患者的关节滑膜中表达也可增高。Alsaleh等[27]研究发现miR- 346可通过抑制LPS介导的Bruton酪氨酸激酶表达调节IL- 18的分泌。
然而迄今为止,IL- 18与miRNA相关的文献数量仍较少,有待进一步研究。
前景与展望
RA目前病因不清,并且没有明确的根治方法,所以RA的病理机制分析以及治疗靶点都成为研究的热点。我们已知miRNA在RA的进展过程中扮演了非常重要的调控角色。多种miRNA可以影响RA免疫反应的过程(表1)。但是,仍然有许多miRNA和RA的关系未知,需要我们进一步研究。近年来,检测miRNA水平的技术已经十分成熟,可以在患者的血液或尿液中检测到[28],使得临床研究更加方便。但仍需要进一步了解miRNA是否可作为RA的临床生物标记物,甚至能否作为临床治疗RA的有效靶点。
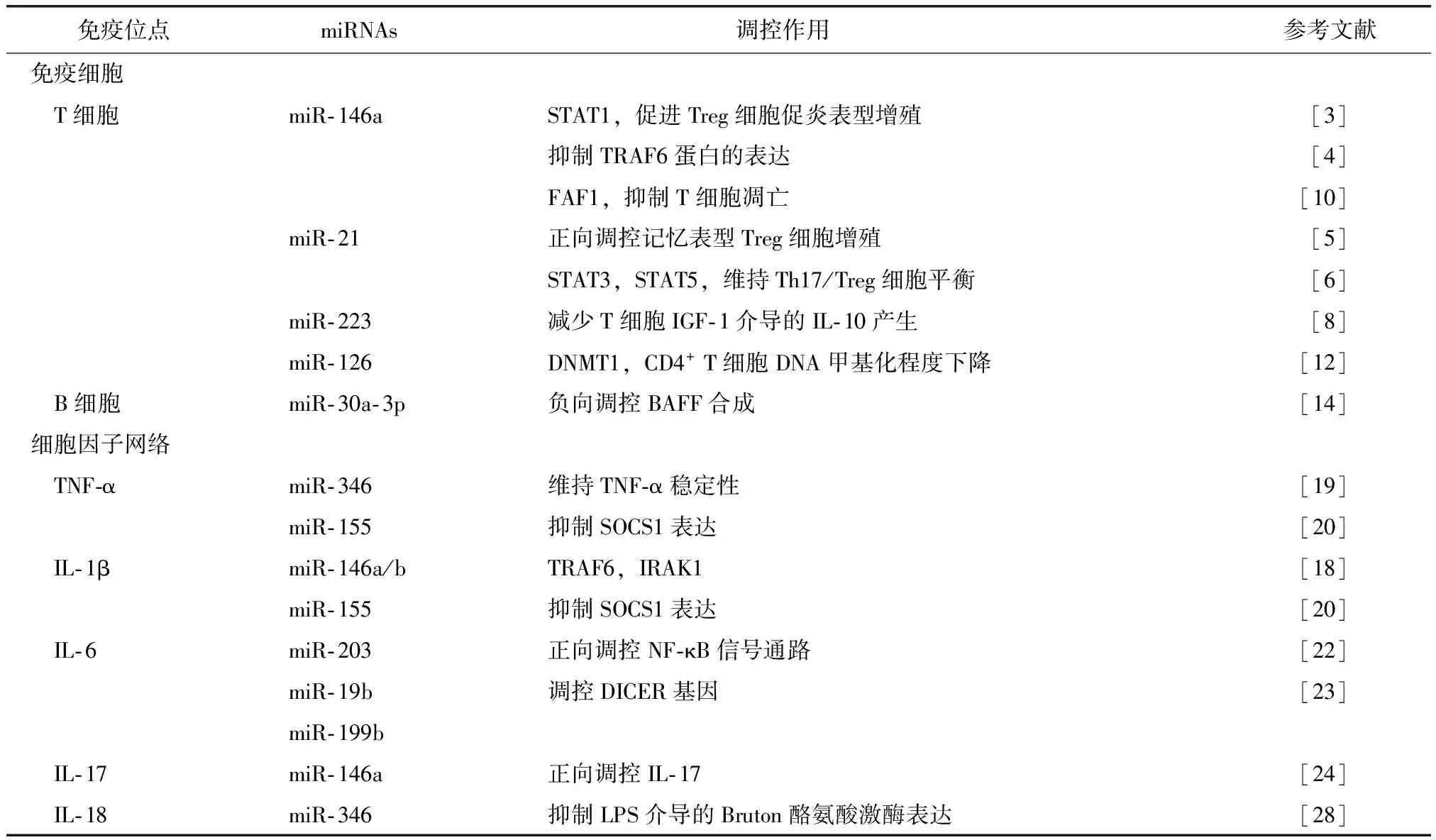
表1 RA研究中的miRNATable 1 miRNAs in the research on RA
STAT:信号传导及转录激活因子;FAF1:Fas相关因子1;DNMT1:甲基转移酶1;TRAF:肿瘤坏死因子受体相关因子;IRAK1:白细胞介素1受体相关激酶;SOCS1:细胞因子信号抑制蛋白1
[1]Mcinnes IB, Schett G. Cytokines in the pathogenesis of rheumatoid arthritis[J]. Nat Rev Immunol, 2007, 7:429- 442.
[2]Smigielska-Czepiel K, Berg AVD, Jellema P, et al. Comprehensive analysis of miRNA expression in T-cell subsets of rheumatoid arthritis patients reveals defined signatures of naive and memory Tregs[J]. Genes Immun, 2014, 15:9- 14.
[3]Zhou Q, Haupt S, Kreuzer JT, et al. Decreased expression of miR- 146a and miR- 155 contributes to an abnormal Treg phenotype in patients with rheumatoid arthritis[J]. Ann Rheum Dis, 2015, 74:1265- 1274.
[4]李景怡. 类风湿关节炎CD4T细胞相关miRNA的鉴定和功能研究[D]. 重庆:第三军医大学, 2010:1345- 1354.
[5]van der Geest KS, Smigielska-Czepiel K, Park JA, et al. SF Treg cells transcribing high levels of Bcl- 2 and microRNA- 21 demonstrate limited apoptosis in RA[J]. Rheumatology (Oxford), 2014, 64:2760- 2768.
[6]Dong L, Wang X, Tan J, et al. Decreased expression of microRNA- 21 correlates with the imbalance of Th17 and Treg cells in patients with rheumatoid arthritis[J]. J Cell Mol Med, 2014, 18:2213- 2224.
[7]Fulci V, Scappucci G, Sebastiani GD, et al. miR- 223 is overexpressed in T-lymphocytes of patients affected by rheumatoid arthritis[J]. Hum Immunol, 2009, 71:206- 211.
[8]Lu MC, Yu CL, Chen HC, et al. Increased miR- 223 expression in T cells from patients with rheumatoid arthritis leads to decreased insulin-like growth factor- 1-mediated interleukin- 10 production[J]. Clin Exp Immunol, 2014, 177:641- 651.
[9]Li J, Wan Y, Guo Q, et al. Altered microRNA expression profile with miR- 146a upregulation in CD4+T cells from patients with rheumatoid arthritis[J]. Arthritis Res Ther, 2010, 12:304- 305.
[10] Zhu S, Pan W, Song X, et al. The microRNA miR- 23b suppresses IL- 17-associated autoimmune inflammation by targeting TAB2, TAB3 and IKK-α[J]. Nat Med, 2012, 18:1077- 1086.
[11] Rossi M, Tagliaferri P, Tassone P. Emerging role of microRNAs in the pathophysiology of immune system[J].Immunodeficiency, 2012:207- 218.
[12] Yang G, Wu D, Zeng G, et al. Correlation between miR- 126 expression and DNA hypomethylation of CD4+T cells in rheumatoid arthritis patients[J]. Int J Clin Exp Pathol, 2015, 8: 8929- 8936.
[13] Fang W, Yan C, Wei W. The role of BAFF in the progression of rheumatoid arthritis[J]. Cytokine, 2015, 76:537- 544.
[14] Alsaleh G, François A, Philippe L, et al. miR- 30a- 3p negatively regulates BAFF synthesis in systemic sclerosis and rheumatoid arthritis fibroblasts[J]. PLoS One, 2013, 9:146- 149.
[15] 罗心静, 莫选荣, 周玲玲. TNF-α诱导类风湿关节炎滑膜细胞NF-κB信号通路活化的探讨[J]. 免疫学杂志, 2012,28:321- 323.
[16] Li P, Schwarz EM. The TNF-alpha transgenic mouse model of inflammatory arthritis[J]. Springer Semin Immunopathol, 2003, 25:19- 33.
[17] Abouzeid A, Saad M, Soliman E. MicroRNA 146a expression in rheumatoid arthritis: association with tumor necrosis factor-alpha and disease activity[J]. Genet Test Mol Biomarkers, 2011, 15:807- 812.
[18] Nakasa T, Miyaki S, Okubo A, et al. Expression of microRNA- 146 in rheumatoid arthritis synovial tissue[J]. Arthritis Rheum, 2008, 58:1284- 1292.
[19] Semaan N, Frenzel L, Alsaleh G, et al. miR- 346 controls release of TNF-α protein and stability of its mRNA in rheumatoid arthritis via tristetraprolin stabilization[J]. PLoS One, 2011, 6:e19827.
[20] Li X, Tian F, Wang F. Rheumatoid arthritis-associated microRNA- 155 targets SOCS1 and upregulates TNF-alpha and IL- 1beta in PBMCs[J]. Int J Mol Sci, 2013, 14:23910- 23921.
[21] Yamasaki K, Nakasa T, Miyaki S, et al. Expression of MicroRNA- 146a in osteoarthritis cartilage[J]. Arthritis Rheum, 2009, 60:1035- 1041.
[22] Stanczyk J, Ospelt C, Karouzakis E, et al. Altered expression of microRNA- 203 in rheumatoid arthritis synovial fibroblasts and its role in fibroblast activation[J]. Arthritis Rheum, 2011, 63:373- 381.
[23] Alsaleh G, Nehmar R, Blüml S, et al. Reduced DICER1, expression bestows rheumatoid arthritis synoviocytes proinflammatory properties and resistance to apoptotic stimuli[J]. Arthritis Rheum, 2016, 68:1839- 1848.
[24] Niimoto T, Nakasa T, Ishikawa M, et al. MicroRNA- 146a expresses in interleukin- 17 producing T cells in rheumatoid arthritis patients[J]. Bmc Musculoskeletal Disorders, 2010, 11:1- 11.
[25] Park HJ, Kim DH, Lim SH, et al. Insights into the Role of Follicular Helper T Cells in Autoimmunity[J]. Immune Netw, 2014, 14:21- 29.
[26] Dinarello CA. Interleukin- 18[J]. Methods, 1999, 19:121- 132.
[27] Alsaleh G, Suffert GN, Juncker T, et al. Bruton’s tyrosine kinase is involved in miR- 346-related regulation of IL- 18 release by lipopolysaccharide-activated rheumatoid fibroblast-like synoviocytes[J]. J Immunol, 2009, 182:5088- 5097.
[28] Kokkonen H, Söderström I, Rocklöv J, et al. Up-regulation of cytokines and chemokines predates the onset of rheumatoid arthritis[J]. Arthritis Rheum, 2010, 62:383- 391.
