微乳液相色谱法同时分离7种水溶性维生素
2017-04-10吴宏星郑艾妮苏草茵余诺君
吴宏星, 郑艾妮, 苏草茵, 余诺君, 李 宁
(广东药科大学, 广东 广州 510006)
研究论文
微乳液相色谱法同时分离7种水溶性维生素
吴宏星, 郑艾妮, 苏草茵, 余诺君, 李 宁*
(广东药科大学, 广东 广州 510006)
采用微乳液相色谱法同时分离7种水溶性维生素(VB1、VB2、VB6、VB12、叶酸、烟酰胺和VC)。考察了微乳流动相体系中表面活性剂、油相、助表面活性剂的种类以及流动相的pH值、柱温等对水溶性维生素分离的影响。优化后微乳体系的组成为:十二烷基硫酸钠(SDS)/聚氧乙烯月桂醇醚(Brij35)/正丁醇/乙酸乙酯/水(质量比为2∶60∶66∶8∶864)。色谱柱为Agilent TC C18(250 mm×4.6 mm, 5 μm),柱温为30 ℃,检测波长为254 nm,流速为0.5 mL/min。7种水溶性维生素在20 min内达到基线分离。在4~36 mg/L范围内,7种水溶性维生素的质量浓度与峰面积的相关系数均大于0.999 1。不同添加水平下,VB1、VB2、VB6、VC和烟酰胺的平均回收率为93.9%~102.9%。该方法可用于食品和药品中的多种水溶性维生素的分离、鉴别及快速测定。
微乳液相色谱法;水溶性维生素;分离选择性
维生素是维持人体正常物质代谢和某些特殊生理功能不可缺少的低分子有机化合物,且人体不能合成或合成量很少,必须从食物或其他途径获取。根据其溶解性差异,维生素分为水溶性维生素和脂溶性维生素两大类[1]。水溶性维生素主要包括B族维生素和VC(抗坏血酸)。B族维生素是多种辅酶的组成部分,参与有机体中的糖、脂肪、蛋白质及核苷酸的合成代谢,常见的有VB1、VB2、VB6、VB12、叶酸和烟酰胺;VC作为强氧化剂参与氨基酸羟化反应和去除自由基等过程[2]。
近年来,已有许多关于水溶性维生素检测分析的报道,主要包括微生物法[3]、分光光度法[4]、荧光法[5]、毛细管电泳法[6]、HPLC法[7]等。传统的HPLC法流动相需要使用大量的有机溶剂,耗费较高,对环境污染大;采用梯度洗脱的方法对多种组分进行分离,程序繁多复杂,耗时较长。微乳液相色谱是在胶束液相色谱(MLC)基础上发展起来的一种液相色谱新技术[8],它以独特的分离选择性和广泛的适用性引起了人们极大的关注。应用较多的是水包油型反相微乳液相色谱法(MELC),其分离机制是溶质在固定相、伪固定相(表面活性剂在固定相上的吸附层)、多相分散相(微乳液滴)和水相进行动态吸附-解吸过程。由于分离过程复杂,可控参数较多,具有不同极性的组分能在等度洗脱下于短时间内达到有效分离。MELC主要应用在中药[9]、药物制剂[10-13]以及生物样品[14]的分析中。目前,MELC在水溶性维生素中的应用尚未见报道。本文采用微乳液相色谱法,通过对微乳溶液影响因素的优化,实现了7种水溶性维生素的快速分离。此方法的研究为分析检测食品和药品中的多种水溶性维生素提供了很好的参考价值。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪:包括LC-15C泵、SPD-M20A检测器、LC solution工作站、SIL-10AF自动进样器、CTO-10ASVP柱温箱(日本岛津有限公司); SB52000超声波清洗器(宁波新芝生物科技股份有限公司); SHZ-D(Ⅲ)循环水式真空泵(巩义予华仪器责任有限公司); FB-10T溶剂过滤瓶(天津奥特赛恩斯仪器有限公司); TD4台式离心机(湖南凯达科学仪器有限公司)。
VB1(纯度100%)、VB2(纯度98.7%)、VB6(纯度100%)、VB12(纯度95.7%)、叶酸(纯度89.7%)、烟酰胺(纯度98.5%)和VC(纯度99.9%)(中国药品生物制品检定所);甲醇(色谱纯,Dikma公司);十二烷基硫酸钠(SDS,分析纯,美国Sigma公司);聚氧乙烯月桂醇醚(Brij35,纯度99.9%,美国Amresco公司);善存佳维片(美国惠氏制药有限公司);蒸馏水(广州屈臣氏食品饮料有限公司);其他试剂均为国产分析纯。
1.2 色谱条件
色谱柱为Agilent TC C18柱(250 mm×4.6 mm, 5 μm);柱温:30 ℃;流动相:SDS/Brij35/正丁醇/乙酸乙酯/水(质量比为2∶60∶66∶8∶864);检测波长:254 nm;流速:0.5 mL/min;进样量:20 μL。
1.3 溶液的制备
1.3.1 微乳流动相的制备
按顺序添加表面活性剂(SDS、Brij35)、油相(乙酸乙酯)、助表面活性剂(正丁醇)及水(质量比为2∶60∶66∶8∶864),混合,超声30 min,形成透明稳定的微乳液,经0.45 μm微孔有机相滤膜过滤,静置过夜,即得微乳流动相。
1.3.2 对照品溶液的制备
精密称取真空干燥至恒重的VB1、VB2、VB6、VB12、叶酸、烟酰胺和VC对照品各2 mg,加适量水溶解,定容至10 mL,作为对照品储备液。
1.3.3 供试品溶液的制备
精密称取善存佳维片粉末约3.8 g(相当于2 mg VB1、2 mg VB2、2 mg VB6、0.004 mg VB12、24 mg烟酰胺、0.003 mg叶酸和176.3 mg VC)。用微乳流动相溶解,定容至10 mL,超声20 min,在3 000 r/min的转速下离心5 min,取上清液,作为供试品储备液。

图 1 微乳液中不同表面活性剂及离子对浓度对7种水溶性 维生素分离的影响Fig. 1 Effects of different surfactants and ion pair concentrations on the separation of the seven water-soluble vitamins B: Brij35 (polyoxyethylene lauryl ether); S: SDS (sodium dodecyl sulfate).
2 结果与讨论
2.1 色谱条件的优化
2.1.1 不同表面活性剂以及离子对浓度对分离的影响
初始流动相为Brij35/正丁醇/正辛醇/水(质量比为60∶66∶8∶866),用磷酸调节pH值为3,在此基础上进行单因素考察和条件优化。如图1所示,分别采用Brij35、SDS和Brij35-SDS作为表面活性剂,考察其对7种水溶性维生素的分离效果。采用Brij35作为表面活性剂时,叶酸出峰时间相对较长,其余组分分离较差。当用SDS作为表面活性剂时,VB1出峰时间大于30 min,这是由于VB1噻唑环上的季铵基团和嘧啶环上的氨基与部分阴离子表面活性剂SDS形成离子对。用Brij35-SDS作为表面活性剂时,7种水溶性维生素的分离度有所提高。配制SDS质量分数为0.1%~0.3%的微乳流动相,考察不同质量分数SDS对分离选择性的影响。结果表明随着SDS质量分数的增加,VB1与VB6的保留时间有所增加,其余组分的保留时间变化不大,SDS质量分数为0.2%时,能实现较好的分离,并且峰形较好,分析时间也比SDS质量分数为0.3%时短,故选择含6.0%(质量分数)的Brij35和0.2%(质量分数)的SDS作为表面活性剂。

图 2 微乳液中不同油相对7种水溶性维生素分离的影响Fig. 2 Effects of different oil phases in microemulsion on the separation of the seven water-soluble vitamins
2.1.2 不同油相对分离的影响
在MELC中,油相的加入可以增加流动相中有机相的比例,使保留时间缩短;另一方面,油相分子也可以部分分配到固定相上,使固定相的极性变小,化合物保留和选择性的变化更复杂。Marsh等[15]的研究表明,油相在水包油型微乳中的质量分数一般为0~1.2%。当油相的质量分数高于1%时,微乳系统不稳定,色谱重现性较差;微乳中油相的最佳质量分数约为0.8%。固定微乳其他组分不变,分别以质量分数为0.8%的正庚烷、环己烷、正辛醇、正辛烷和乙酸乙酯作为油相,考察其对分离选择性的影响。结果如图2所示,不同油相洗脱能力的大小顺序为:正辛醇>正辛烷>正庚烷>环己烷>乙酸乙酯。这可能是由于水溶性维生素与正辛醇的结合能力更强,在固定相上的保留减弱。分别用正庚烷、环己烷、乙酸乙酯作为油相时,7种水溶性维生素能实现较好的分离。以乙酸乙酯为油相时,峰形可以得到明显改善,这可能是由于乙酸乙酯在一定程度上阻碍了碱性基团与硅醇基之间的静电作用,消除拖尾,故选择乙酸乙酯作为油相。
2.1.3 不同助表面活性剂对分离的影响
助表面活性剂一般为短链醇,常用的有异丙醇、正丁醇和戊醇等。本试验考察了异丙醇、正丁醇和异丙醇-正丁醇混合助表面活性剂对水溶性维生素分离的影响。结果表明,以异丙醇作为助表面活性剂时,VB1保留时间接近40 min;以异丙醇-正丁醇作为助表面活性剂时,VB2与VC不能达到基线分离,并且VB1保留时间较长;以正丁醇作为助表面活性剂时,各组分分离较好。故选择正丁醇作为助表面活性剂。

图 3 微乳液中不同pH值对7种水溶性维生素分离的影响Fig. 3 Effects of different pH values of microemulsion on the separation of the seven water-soluble vitamins
2.1.4 不同pH值对分离的影响
在RP-HPLC中,物质在固定相中的保留与其疏水性有关。如果物质发生了解离,疏水性减弱,该物质在固定相的保留减弱。本试验考察了不同pH微乳体系(pH 2.5~4.5)对水溶性维生素分离的影响。由图3可知,随着微乳体系pH值的增加,叶酸与VC的保留时间减小,这是由于叶酸和Vc解离成离子状态,极性增大,其在固定相上的保留减弱。VB1与VB6的保留时间呈现先增加后减少的趋势,这可能由于流动相pH值在2.5~4.0之间时抑制了VB1与VB6的电离,使其主要以分子形式存在,因此疏水性增加,保留时间也随之增加;当pH值达到4.0后,固定相上产生的负电荷(吸附的SDS)吸附VB1与VB6中带正电的碱性基团,这在一定程度上促进了其电离,更多地以离子形式存在,因此保留时间减小。减少其余组分的保留时间基本不受pH值的影响。当pH=3.5时,相比于其他pH值,各组分之间基本能达到基线分离。因此选择微乳流动相pH值为3.5。
2.1.5 不同柱温对分离的影响
采用SDS-Brij35-正丁醇-乙酸乙酯-水微乳流动相,分别在25、30、35和40 ℃的条件下考察柱温对水溶性维生素分离的影响。由图4可知,随着柱温的升高,VB1保留时间的减少较为明显,其余组分的保留时间变化不大。这可能是由于在微乳液相色谱中存在两种对立的机制,一方面碱性药物的解离常数pKa会随着温度升高而减小,使碱性药物更多以未解离状态存在,因此在固定相上的保留增强;另一方面,碱性药物会随着温度的升高增加其在油滴中的分配,流动相洗脱能力变强,因而保留时间减小[12]。本试验中,VB1保留时间的减小受第二种机制的影响更多。在不同温度下,各组分都能实现较好的分离。当柱温为30 ℃时,7种水溶性维生素的拖尾因子均小于1.5,各组分的峰形相对较好,故选择柱温为30 ℃。

表 1 系统适用性试验结果以及各水溶性维生素的最大紫外吸收波长(n=6)
-: not detected.

图 4 不同柱温对7种水溶性维生素分离的影响Fig. 4 Effects of different column temperatures on the separation of the seven water-soluble vitamins
通过考察微乳各组分类型,pH以及温度等因素对水溶性维生素分离的影响,得出了能够同时分离7种水溶性维生素的微乳流动相,其组成为SDS/Brij35/正丁醇/乙酸乙酯/水(质量比为2∶60∶66∶8∶864),流动相pH为3.5,柱温为30 ℃。
2.2 方法学验证
2.2.1 系统适用性
精密量取各水溶性维生素对照品储备溶液1 mL,置于10 mL容量瓶中,加水至刻度,混匀,得0.02 g/L混合维生素溶液。按1.2节中方法检测,重复进样6次。结果显示相邻色谱峰之间的分离度均大于1.5,各色谱峰理论塔板数均大于2 000,拖尾因子小于1.5,重复进样6次,峰面积的RSD均小于2.0%,说明系统适用性良好。系统适用性试验结果以及各水溶性维生素的最大紫外吸收波长见表1。
2.2.2 线性方程、检出限、定量限及精密度
精密量取各水溶性维生素对照品储备溶液适量,用微乳流动相稀释成系列质量浓度的标准溶液。按1.2节中条件进样,记录色谱图,以峰面积y对质量浓度x(单位g/L)进行线性回归。结果显示各水溶性维生素的峰面积与质量浓度在4~36 mg/L范围内线性关系良好。按1.3.3节中的方法平行制备6份样品溶液,按1.2节中的条件进行分析,各水溶性维生素含量的RSD均小于2.0%,表明该方法的精密度良好。按照信噪比为10时的质量浓度为定量限(LOQ),信噪比为3时的质量浓度为检出限(LOD),结果见表2。
2.2.3 稳定性试验
精密量取1 mL供试品储备液,用流动相稀释成质量浓度为0.02 g/L的溶液,分别在配制后0、2、4、6、8、16和24 h测定VB2、VB6、VB1、VC和烟酰胺的峰面积。结果显示,VB2、VB6、VB1、VC和烟酰胺在24h时的峰面积与0 h时相比,RSD均小于2.0%,表明善存佳维片样品溶液在24 h内稳定。
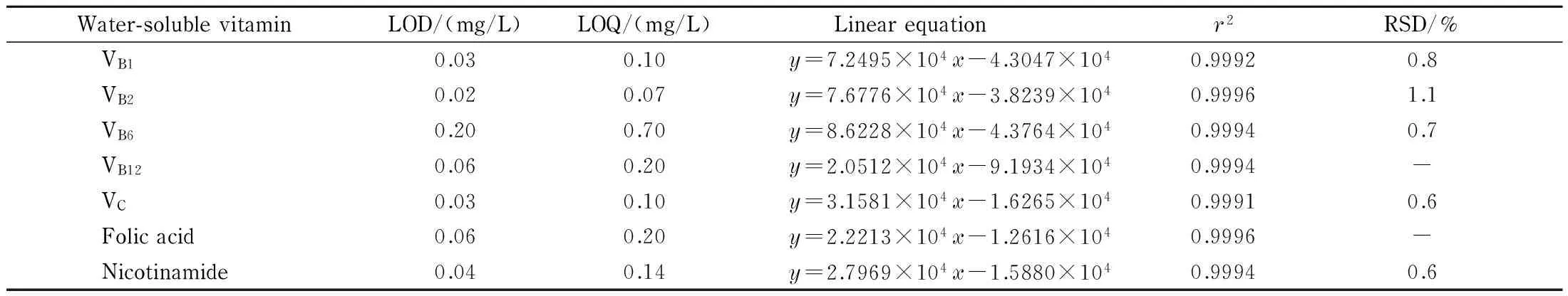
表 2 各水溶性维生素的线性方程、检出限、定量限、相关系数(r2)和精密度(n=6)
y: peak area;x: mass concentration, g/L. -: not detected.
2.2.4 加标回收率
精密量取0.5 mL 0.2 g/L供试品储备液,置于10 mL容量瓶中,加流动相稀释至刻度,摇匀,作为本底溶液。另量取0.3、0.5、0.7 mL的0.2 g/L对照品储备液(分别相当于含量测定的80%、100%和120%)各3份,置于10 mL容量瓶中,分别准确加入0.5 mL 0.2 g/L供试品储备液,加流动相稀释至刻度,摇匀,制成质量浓度分别为16、20和24 mg/L的加标回收样品。按1.2节条件检测,记录色谱图,结果见表3。5种水溶性维生素回收率为93.9%~102.9%,表明它们在片剂中的回收率良好。

表 3 各水溶性维生素的加标回收率(n=3)
2.2.5 实际样品测定
按1.3.3节方法平行配制3份供试品溶液,分别进样测定,按外标法计算善存佳维片中VB1、VB2、VB6、VC和烟酰胺占标示量的百分比,分别为92.3%、90.8%、90.2%、98.6%和95.1%。样品中VB12的浓度低于检出限,无法检出。图5为善存佳维片样品及7种水溶性维生素混合标准溶液谱图。

图 5 (a)7种水溶性维生素混合标准溶液和(b)善存佳维片的色谱图Fig. 5 Chromatograms of (a) the mixture of the seven water-soluble vitamins standards and (b) Centrum Tablets sample
3 结论
本研究通过考察微乳流动相体系中表面活性剂的种类、油相的种类、助表面活性剂的种类、流动相的pH值和柱温等对7种水溶性维生素分离的影响,确定了微乳流动相的组成。应用优化后的色谱条件,7种水溶性维生素能在20 min达到基线分离。该法可用于食品和药品中多种水溶性维生素的分离鉴别及快速测定。由于MELC的理论研究及药物分析方面的应用较少,有待于在今后的工作中做进一步研究。
[1] Li K, Wang H J, Pan C H, et al. Chinese Journal of Chromatography, 2003, 21(1): 66
李克, 王华娟, 潘朝晖, 等. 色谱, 2003, 21(1): 66
[2] Zhao M M, Peng M M, Zhou Y X, et al. Hubei Agricultural Sciences, 2013, 52(23): 5676
赵明明, 彭茂民, 周有祥, 等. 湖北农业科学, 2013, 52(23): 5676
[3] Li Q X, Cui Y J, Zhao Y F, et al. Food Science, 2013, 34(13): 338
李全霞, 崔亚娟, 赵寅菲, 等. 食品科学, 2013, 34(13): 338
[4] Ye Q L. Guangdong Chemical Industry, 2016, 43(6): 184
叶群丽. 广东化工, 2016, 43(6): 184
[5] Tian L, Kong B, Du C S, et al. Chinese Journal of Pharmaceutical Analysis, 2012, 32(12): 2150
田兰, 孔彬, 杜晨松, 等. 药物分析杂志, 2012, 32(12): 2150
[6] Hu X Q, You H Y. Chinese Journal of Chromatography, 2009, 27(6): 835
胡晓琴, 尤慧艳. 色谱, 2009, 27(6): 835
[7] Chen P J, Yan Z, Tu X K, et al. Chinese Journal of Chromatography, 2015, 33(7): 771
陈沛金, 颜治, 涂小珂, 等. 色谱, 2015, 33(7): 771
[8] Bethod A, De Carvalho M. Anal Chem, 1992, 64: 2267
[9] Huang H, Xuan X, Xu L, et al. J Chromatogr B, 2014, 955: 124
[10] Yang J R, Huang L N, Huang G L, et al. Chinese Journal of Chromatography, 2011, 29(10): 995
杨建锐, 黄丽娜, 黄光亮, 等. 色谱, 2011, 29(10): 995
[11] Momenbeik F, Roosta M, Nikoukar A A. J Chromatogr B, 2014, 1217: 3770
[12] Althanyan M S, Assi K H, Clark B J, et al. J Pharm Biomed Anal, 2011, 55: 397
[13] Jiang J, Yang R Y, Ren J B, et al. Journal of Shenyang Pharmaceutical University, 2012, 29(6): 456
江洁, 杨若因, 任晶波, 等. 沈阳药科大学学报, 2012, 29(6): 456
[14] Zhou J, Zhang Q, Sun J, et al. J Chromatogr B, 2014, 951: 24
[15] Marsh A, Clark B J, Altria K D. Chromatographia, 2004, 59: 531
Simultaneous separation of seven water-soluble vitamins with microemulsion liquid chromatography
WU Hongxing, ZHENG Aini, SU Caoyin, YU Nuojun, LI Ning*
(GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
A novel method was developed for the separation of seven water-soluble vitamins (VB1, VB2, VB6, VB12, VC, folic acid and nicotinamide) with microemulsion liquid chromatography. The impacts of following factors on the separation selectivity were investigated: the type of surfactant, the type of oil phase, the type of co-surfactant, the pH of mobile phase and the column temperature. The optimal conditions for the separation of the seven water-soluble vitamins were as follows: Agilent TC C18 (250 mm×4.6 mm, 5 μm) was used at 30 ℃; the microemulsion mobile phase was sodium dodecyl sulfate (SDS)/polyoxyethylene lauryl ether (Brij35)/n-butanol/ethyl acetate/water (2∶60∶66∶80∶864, mass ratio). Baseline separation of the seven water-soluble vitamins was achieved within 20 min with a flow rate of 0.5 mL/min and the detection wavelength of 254 nm. The calibration curve showed a good linearity with the correlation coefficients above 0.999 1 in the linear range from 4 to 36 mg/L. The mean recoveries of VB1, VB2, VB6, VCand nicotinamide were 93.9%-102.9% at different spiked levels. The optimized and validated method can be used for simultaneous determination of water-soluble vitamins in food and pharmaceuticals.
microemulsion liquid chromatography (MELC); water-soluble vitamins; separation selectivity
10.3724/SP.J.1123.2016.09037
2016-09-19
国家自然科学基金项目(81173525).
Foundation item: National Natural Science Foundation of China (No. 81173525).
O658
A
1000-8713(2017)04-0439-06
* 通讯联系人.Tel:(020)39352136,E-mail:13724117338@163.com.
