甘草酸对博莱霉素诱导的实验性肺纤维化的干预作用*
2017-04-10苏程程彭守春魏路清姬文婕
李 祎, 李 鑫, 李 琦,3, 苏程程, 周 欣, 彭守春, 魏路清△, 姬文婕△
(1天津中医药大学研究生院,天津300193; 2中国人民武装警察部队后勤学院附属医院呼吸与重症医学科, 3锦州医科大学武警后勤学院附属医院研究生培养基地, 4中国人民武装警察部队后勤学院附属医院心脏医院,天津 300162)
·短篇论著·
甘草酸对博莱霉素诱导的实验性肺纤维化的干预作用*
李 祎1,2, 李 鑫2, 李 琦2,3, 苏程程2, 周 欣4, 彭守春2, 魏路清2△, 姬文婕2△
(1天津中医药大学研究生院,天津300193;2中国人民武装警察部队后勤学院附属医院呼吸与重症医学科,3锦州医科大学武警后勤学院附属医院研究生培养基地,4中国人民武装警察部队后勤学院附属医院心脏医院,天津 300162)
目的: 探讨甘草酸(GA)对博莱霉素(BLM)诱导的小鼠肺纤维化的干预作用及其可能机制。方法: 将160只雄性C57BL/6J小鼠随机分为生理盐水(NS)组、BLM组、BLM+NS组和BLM+GA组。通过口咽气管吸入法吸入博莱霉素(2.5 mg/kg)建立实验性肺纤维化模型,BLM+GA组及BLM+NS组每天给予40 mg/kg甘草酸或等体积的生理盐水灌胃,于术后第3、7、14、21天取材。采用HE染色和Masson染色观察肺组织病理学变化及纤维化程度,采用流式细胞术检测循环单核细胞和肺泡巨噬细胞的亚群比例变化,采用RT-qPCR检测肺组织中转化生长因子β1(TGF-β1)mRNA的表达水平,采用碱水解法检测肺组织中羟脯氨酸(HYP)含量。结果:与NS组相比,BLM组和BLM+NS组肺组织的炎症浸润及胶原含量明显增多,实验性肺纤维化模型制备成功。与BLM+NS组相比:BLM+GA组肺组织的炎症细胞浸润及胶原纤维沉积较少;第3、7天的Ly6Chi单核细胞亚群比例和第7、14天肺泡巨噬细胞M2表型比例显著降低(P<0.01);肺组织TGF-β1 mRNA表达量和HYP含量显著降低(P<0.01)。结论:GA可以减轻博莱霉素诱导的小鼠肺组织的炎症反应和胶原纤维沉积,可能与GA对单核巨噬细胞的表型偏移和调控以及肺组织TGF-β1的表达下调有关。
甘草酸; 肺纤维化; 单核细胞; 肺泡巨噬细胞; 转化生长因子β1
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性、纤维化间质性肺炎,其发病率逐年增加,发病机制尚不明确[1-2],尚无有效治疗手段。甘草酸(glycyrrhizic acid,GA)是中草药甘草根部提取的重要组成成分之一,呈水溶性[3]。现代研究表明,甘草酸具有抗炎、抗氧化、抗纤维化及提高机体免疫调节能力等作用[4]。本研究使用博莱霉素(bleomycetin,BLM)经口、咽、气管吸入法制备小鼠肺纤维化模型[5],采用GA灌胃干预,通过观察单核巨噬细胞亚群、转化生长因子β1(transforming growth factor-β1,TGF-β1)、羟脯氨酸(hydroxyproline,HYP)在肺纤维化过程中的变化,探讨GA在博莱霉素(bleomycin, BLM)诱导的小鼠肺纤维化进展中的作用。
材 料 和 方 法
1 动物
C57BL/6小鼠,雄性,8周龄,18~20 g,购自中国人民解放军军事医学科学院实验动物中心,许可证号为SCXK-(军)2012-0004。小鼠在12 h/12 h光照周期,通风良好、温度和湿度合格环境中适应性饲养1周。
2 主要试剂
注射用盐酸博莱霉素(盐酸博莱霉素A2,NIPPON KAYAKU);甘草酸、流式抗体(Biolegend);TRIzol试剂(Invitrogen);MMLV 反转录酶、dNTPs(Promega);SYBR Green实时定量PCR试剂盒(Roche);羟脯氨酸测试盒(南京建成生物工程研究所);异氟烷﹙河北一品制药有限公司﹚;其余试剂均为国产分析纯。所用引物由北京鼎国昌盛生物技术有限公司根据设计合成。
3 主要方法
3.1 动物模型的制备及标本的采集处理 将160只C57BL/6小鼠随机分为生理盐水(normal saline, NS)组、BLM组、BLM+NS组及BLM+GA组,每组40只。经2%异氟烷麻醉后,采取经口咽吸入BLM法建立实验性肺损伤模型,BLM组按2.5 mg/kg剂量给予博莱霉素50 μL,NS组吸入同等体积的无菌生理盐水,待小鼠完全苏醒后常规饲养;模型制备完成第1天开始,BLM+GA组按每日40 mg/kg的剂量经灌胃给予GA,BLM+NS组给予等体积的无菌生理盐水。造模后的第3、7、14、21天将各组小鼠分为灌洗组和非灌洗组,取下颌外周静脉血行外周血单核细胞亚群流式细胞术检测。灌洗组行支气管肺泡灌洗术,取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),离心后取细胞沉淀进行肺泡巨噬细胞表型流式细胞术检测,肺组织待检测羟脯氨酸含量;非灌洗组取左肺行病理学染色,右肺用于提取RNA。
3.2 小鼠肺组织的病理学检测 小鼠左肺在4 %多聚甲醛中固定24 h后常规石蜡包埋切片(7~8 μm),进行HE染色和Masson染色,用Nikon i80显微镜观察肺组织炎症反应和纤维化程度。观察HE染色图像的炎症细胞浸润程度及肺泡腔变化,采用炎症评分(inflammation score,IS)表示炎症反应程度;观察Masson染色图像的胶原纤维含量分布变化,采用胶原容积分数(collagen volume fraction,CVF)代表纤维化程度。
3.3 碱水解法检测羟脯氨酸含量 依照HYP试剂盒说明书配制试剂,碱水解法水解肺组织,调pH值,冷却后3 500 r/min离心10 min,取上清1 mL,于550 nm波长处测量各管吸光度,计算肺组织中HYP含量。
3.4 流式细胞术检测小鼠循环单核细胞亚群比例 取小鼠外周循环新鲜EDTA抗凝血30 μL,加入staining buffer/Ly6G/CD11b/Ly6C抗体混匀,并设立阴性对照,室温避光孵育15 min,加入红细胞裂解液混匀,再避光孵育10 min,上流式细胞仪检测。设门策略:首先从SSC/Ly6G散点图中选定Ly6G-群,再识别SSC/CD11b+细胞,最后按荧光标记划分Ly6C为Ly6Chi和Ly6Clo。
3.5 流式细胞术检测小鼠肺泡巨噬细胞亚群比例 取小鼠BALF在4 ℃、300×g条件下离心15 min,红细胞裂解液重悬细胞沉淀,细胞计数取一定量细胞,离心,弃上清,staining buffer重悬,加入7-AAD/CD64/CD206抗体混匀,室温孵育15 min,再次离心重悬,上机,流式细胞仪检测。设门策略:Count/7-AAD直方图中选定活细胞,FSC/CD64散点图中选定CD64+细胞,FSC/CD206标记肺泡巨噬细胞为AM1和AM2。
3.6 RT-qPCR检测小鼠肺组织的 mRNA水平 采用TRIzol提取法提取第7天各组肺组织的总RNA,NanoDrop 2000 C分光光度法测定计数总RNA含量及浓度。首先RNA甲醛变性电泳检测其完整性,然后行反转录为cDNA,再按照OneStep Real-Time PCR试剂盒说明书的标准操作步骤行PCR,β-actin作为内参照,扩增条件为95 ℃ 10 min;75 ℃ 15 s、60 ℃ 1 min,45个循环。依据GenBank数据库中的目的基因cDNA序列,由北京鼎国昌盛生物技术有限公司合成设计特异性引物序列(表1),运用2﹣ΔΔCt法计算RT-qPCR结果并分析。
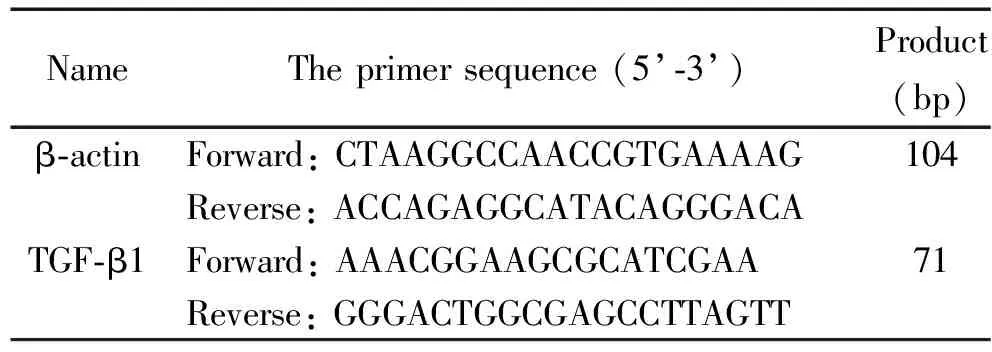
表1 引物序列
4 统计学处理
用GraphPad Prism 6.0统计软件进行分析,计量资料以均数±标准误(mean±SEM)表示,组间比较采用t检验及单因素方差分析,多重比较应用Tukey’s法。以P<0.05为差异有统计学意义。
结 果
1 各组小鼠肺组织的病理学变化
光学显微镜下观察,各时点的NS组肺组织结构基本正常,而造模后第3、7天的HE染色图像中,BLM组可见大量炎症细胞浸润和肺泡结构破坏,第7天的炎症评分明显高于NS组(P<0.01);与BLM+NS组比较,BLM+GA组可见炎症细胞浸润及肺泡破坏结构情况明显减轻,差异有统计学意义(P<0.01)。造模后第21天的Masson染色图像中,BLM组可见纤维结节及大量蓝染胶原纤维沉积,胶原容积分数均高于NS组(P<0.01);BLM+GA组中胶原纤维含量较少,具有统计学差异(P<0.01),见图1。
2 各组小鼠羟脯氨酸检测结果
检测第21天各组小鼠肺组织中羟脯氨酸含量,BLM组HYP含量明显高于NS组,差异具有统计学意义(P<0.01);而BLM+GA组的HYP含量较BLM+NS组明显降低(P<0.01),见图1。
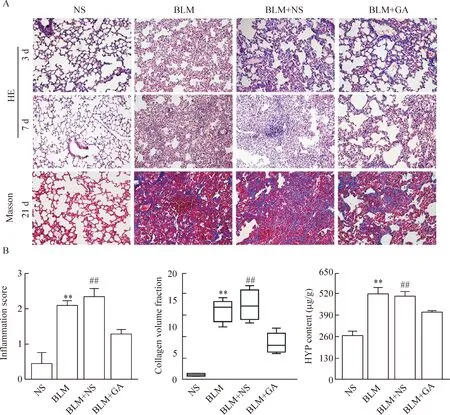
Figure 1.GA reduced BLM-induced alveolar inflammation and pulmonary fibrosis. A: HE staining of lung tissues from each group at 3 d and 7 d (×200), and Masson, trichrome staining at 21 d (×200); B: GA reduced BLM-induced alveolitis, collagen volume fraction and lung HYP content. Mean±SEM. n=5. **P<0.01 vs NS group; ##P<0.01 vs BLM+GA group.
3 各组小鼠不同单核细胞亚群比例变化
循环单核细胞Ly6Chi亚群比例在博莱霉素诱导肺损伤早期升高较多,BLM组及BLM+NS组第3、7天均明显升高,BLM+GA组与BLM+NS组相比显著下降,具有统计学意义(P<0.01)。而循环单核细胞Ly6Clo亚群比例变化趋势与Ly6Chi相反,见图2。

Figure 2.Temporal dynamics of circulating monocyte subsets after BLM administration. A: the gating strategies for circulating monocyte subsets; B: the representative dynamic profiles of Ly6Chi and Ly6Clo monocytes in different groups; C: the percentage of monocyte subsets detected in different groups. Mean±SEM. n=5. **P<0.01 vs NS group; ##P<0.01 vs BLM+GA group.
4 各组小鼠不同肺泡巨噬细胞亚群比例偏移
与NS组比较,BLM组肺泡巨噬细胞M2型亚群比例第7、14天均明显升高,BLM+GA组与BLM+NS组相比显著下降,具有统计学意义(P<0.01)。M1型亚群比例变化趋势与M2型相反,见图3。
5 肺组织中TGF-β1 mRNA的表达
与NS组比较,BLM组第7天的TGF-β1相对表达水平显著升高,差异具有统计学意义(P<0.01);而BLM+GA组的TGF-β1相对表达水平与BLM+NS组比较明显降低(P<0.01),见图4。
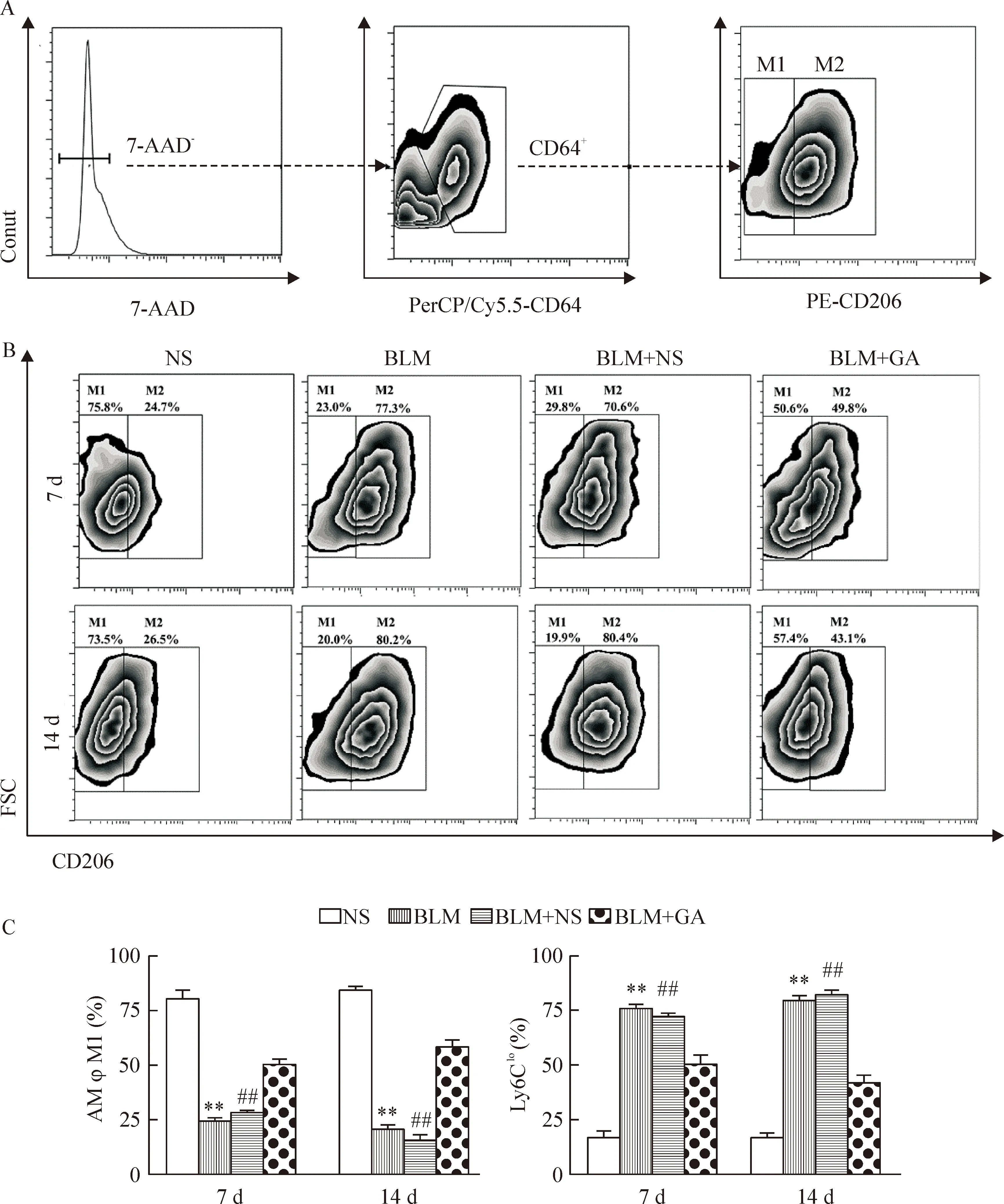
Figure 3.Temporal dynamics of alveolar macrophage (AM) subsets after BLM administration. A: the gating strategies for alveolar macrophage subsets; B: the representative dynamic profiles of AMφM1 and AMφM2 in different groups; C: the percentage of AM subsets detected in different groups. Mean±SEM. n=5. **P<0.01 vs NS group; ##P<0.01 vs BLM+GA group.
讨 论
IPF是最常见的一种特发性间质性肺炎,主要病变为弥漫性肺泡炎和肺泡结构紊乱,最终发展为肺纤维化。多发于老年人群,具有较高的死亡率,尚未发现有效的预防与治疗手段[2, 6]。甘草酸在体内水解成化学结构类似于甾体激素的甘草次酸,是甾体激素代谢失活酶抑制剂,可以提高糖皮质激素的活性[7]。有研究表明,甘草酸可通过核因子κB(nuclear factor-κB,NF-κB)信号通路,抑制单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等大量促炎因子,调控炎症和氧化应激相关反应,有效改善肝脏、肾脏等组织的急性炎症损伤与纤维化发展[8-9]。
在肺纤维化过程中,循环单核细胞可分化为肺泡巨噬细胞,其中抗炎作用的Ly6Chi单核细胞亚群分化为经典活化M1型巨噬细胞,Ly6Clo单核细胞亚群分化为具有选择性活化,抑制炎症发展的M2型巨噬细胞。M2型巨噬细胞的偏移引起成纤维细胞的过度增殖,促进纤维化形成[10-11]。本实验室的前期研究中证明,通过早期降低Ly6Chi单核细胞比例可以减轻肺部炎症反应的发展,抑制选择性活化的M2型巨噬细胞比例可以缓解胶原纤维的沉积[12-14]。有研究报道,TGF-β1是肺纤维化过程中最重要最直接的细胞因子,可以促进成纤维细胞增殖、分化为肌成纤维细胞,肌成纤维细胞产生大量基质蛋白成分分泌到细胞外基质中,如α-SMA、胶原蛋白等细胞外基质成分在TGF-β1的刺激下合成增多并沉积,进一步增加TGF-β1诱导肺成纤维细胞分化为肌成纤维细胞,进一步促进肺纤维化的发展[15-16]。

Figure 4.TGF-β1 mRNA level in the lung tissues after GA intervention. Mean±SEM. n=5. **P<0.01 vs NS group; ##P<0.01 vs BLM+GA group.
本实验研究过程中,经GA干预组的 Ly6Chi单核细胞比例和M2型肺泡巨噬细胞比例均较BLM+NS组明显降低,减轻了肺组织早期炎症反应及后期胶原纤维的沉积程度。与本实验室的前期研究,博莱霉素诱导小鼠肺纤维化的炎症反应及纤维化进展期中Ly6Chi单核细胞亚群比例和M2型巨噬细胞表型偏移的变化趋势一致,单核巨噬细胞表型偏移起到了重要的调节作用[14]。GA干预组TGF-β1 mRNA的表达水平呈下调趋势。因此,GA可能是通过调控单核巨噬细胞表型偏移和调节TGF-β1的表达量,从而减轻炎症细胞聚集和成纤维细胞增生,进而缓解肺组织纤维化程度。
[1] Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011, 183(6):788-824.
[2] Bendstrup E, Hyldgaard C, Altraja A, et al. Organisation of diagnosis and treatment of idiopathic pulmonary fibrosis and other interstitial lung diseases in the Nordic countries[J]. Eur Clin Respir J, 2015, 2.
[3] Asl MN, Hosseinzadeh H. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds[J]. Phytother Res, 2008, 22(6):709-724.
[4] 韩瑶聃, 王 彬, 王政雨, 等. 甘草酸药理作用的研究进展[J]. 中国新药杂志, 2012, 20(21):2499-2505.
[5] Lakatos HF, Burgess HA, Thatcher TH, et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation[J]. Exp Lung Res, 2006, 32(5):181-199.
[6] Baddini-Martinez J, Baldi BG, Costa CH, et al. Update on diagnosis and treatment of idiopathic pulmonary fibrosis[J]. J Bras Pneumol, 2015, 41(5):454-466.
[7] 张明发, 沈雅琴. 甘草酸及其苷元甘草次酸的糖皮质激素样作用[J]. 现代药物与临床, 2011,26(1):33-35.
[8] Zhao H, Liu Z, Shen H, et al. Glycyrrhizic acid pretreatment prevents sepsis-induced acute kidney injury via suppressing inflammation, apoptosis and oxidative stress[J]. Eur J Pharmacol, 2016, 781:92-99.
[9] Zhao H, Zhao M, Wang Y, et al. Glycyrrhizic acid attenuates sepsis-induced acute kidney injury by inhibiting NF-κB signaling pathway[J]. Evid Based Complement Alternat Med, 2016, 2016:8219287.
[10]Gibbons MA, MacKinnon AC, Ramachandran P, et al. Ly6Chi monocytes direct alternatively activated profibrotic macrophage regulation of lung fibrosis[J]. Am J Respir Crit Care Med, 2011, 184(5):569-581.
[11]Murray PJ, Wynn TA. Protective and pathogenic functions of macrophage subsets[J]. Nat Rev Immunol, 2011, 11(11):723-737.
[12]Ji WJ, Ma YQ, Zhou X, et al. Temporal and spatial characterization of mononuclear phagocytes in circulating, lung alveolar and interstitial compartments in a mouse model of bleomycin-induced pulmonary injury[J]. J Immunol Methods, 2014, 403(1-2):7-16.
[13]Xiang GA, Zhang YD, Su CC, et al. Dynamic changes of mononuclear phagocytes in circulating, pulmonary alveolar and interstitial compartments in a mouse model of experimental silicosis[J]. Inhal Toxicol, 2016, 28(9):393-402.
[14]马永强, 姬文婕, 郑春秀, 等. 实验性肺纤维化小鼠循环单核细胞亚群的动态变化及意义[J]. 医学研究生学报, 2014, 27(9):909-914.
[15]Harris WT, Muhlebach MS, Oster RA, et al. Plasma TGF-beta(1) in pediatric cystic fibrosis: potential biomarker of lung disease and response to therapy[J]. Pediatr Pulmonol, 2011, 46(7):688-695.
[16]Buckley ST, Medina C, Ehrhardt C. Differential susceptibility to epithelial-mesenchymal transition (EMT) of alveolar, bronchial and intestinal epithelial cellsinvitroand the effect of angiotensin II receptor inhibition[J]. Cell Tissue Res, 2010, 342(1):39-51.
(责任编辑: 陈妙玲, 余小慧)
Effect of glycyrrhizic acid on bleomycin-induced pulmonary fibrosis
LI Yi1, 2, LI Xin2, LI Qi2, 3, SU Cheng-cheng2, ZHOU Xin4, PENG Shou-chun2, WEI Lu-qing2, JI Wen-jie2
(1GraduateSchoolofTianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China;2DepartmentofRespiratoryMedicineandIntensiveCareUnit,AffiliatedHospitalofLogisticsUniversityofChinesePeople’sArmedPoliceForce,3PostgraduateTrainingBase,AffiliatedHospitalofLogisticsUniversityofChinesePeople’sArmedPoliceForce,JinzhouMedicalUniversity,4InstituteofCardiovascularDiseaseandHeartCenter,AffiliatedHospitalofLogisticsUniversityofChinesePeople’sArmedPoliceForce,Tianjin300162,China.E-mail:ji_wenjie@hotmail.com;wei_luqing@hotmail.com)
AIM: To investigate the influence of glycyrrhizic acid (GA) on bleomycin (BLM)-induced pulmonary fibrosis. METHODS:C57BL/6 male mice were randomly divided into normal saline (NS) group, BLM group, BLM+NS group and BLM+GA group. The mice were administered with BLM (2.5 mg/kg) via oropharyngeal aspiration. GA (40 mg/kg) or NS was delivered daily via oral gavage after BLM administration. The mice were sacrificed on days 3, 7, 14 and 21. HE staining and Masson’s trichrome staining were used to conduct histopathologic examination. The proportions of different circulatory monocytes subsets and polarization state of the bronchoalveolar lavage fluid (BALF) -derived alveolar macrophages (AM) were measured by flow cytometry. The mRNA expression of transforming growth factor-β1 (TGF-β1) was examined by RT-qPCR. RESULTS: Compared with BLM+NS group, GA significantly alleviated BLM-induced inflammation and collagen levels, and then decreased the proportions of Ly6Chimonocytes on day 3, 7 and AM M2 on day 7, 14. GA effectively down-regulated the mRNA level of TGF-β1 and the content of HYP in the BLM-treated lung tissues. CONCLUSION: GA attenuates the BLM-induced pulmonary inflammation and fibrosis, which may be related to adjusting and controlling a dynamic view of mononuclear phagocyte changes and down-regulation of TGF-β1 in the lung tissues.
Glycyrrhizic acid; Pulmonary fibrosis; Monocytes; Alveolar macrophage; Transforming growth factor-β1
1000- 4718(2017)03- 0528- 06
2016- 09- 05
2016- 11- 03
国家自然科学基金资助项目(No. 81102088;No. 81441101;No. 81570335);天津市自然科学基金资助项目(No. 15JCZDJC35000);武警后勤学院附属医院重点项目(No. FYZ201510;No. FYZ201605)
△通讯作者 姬文婕 Tel: 022-60578746; E-mail: ji_wenjie@hotmail.com; 魏路清Tel: 022-60578671; E-mail: wei_luqing@hotmail.com
R363
A
10.3969/j.issn.1000- 4718.2017.03.024
