基于适配体技术的雌性激素检测方法研究进展
2017-04-08张桂兰黄亚飞陈爱亮
张桂兰,朱 超,黄亚飞,闫 娇,陈爱亮
(中国农业科学院 农业质量标准与检测技术研究所,北京 100081)
综 述
基于适配体技术的雌性激素检测方法研究进展
张桂兰,朱 超,黄亚飞,闫 娇,陈爱亮*
(中国农业科学院 农业质量标准与检测技术研究所,北京 100081)
雌激素是一种类固醇激素,属于环境内分泌干扰物,可在人体和动物体内积累并起到类似雌激素的作用,使生物体的内分泌失衡,因此开发简单快速灵敏的雌激素检测方法具有重要意义。核酸适配体是通过指数富集配体系统进化技术(SELEX)筛选得到的一条寡核苷酸序列,能够与靶标高亲和力特异性结合,与传统抗体相比,具有靶标范围广、易合成修饰、稳定性高等特点,因而被广泛用于分析检测领域。该文主要综述了雌激素适配体的筛选进展以及适配体技术在雌激素检测中的应用,并对核酸适配体技术在雌激素检测领域的应用前景进行了展望。
雌激素;适配体;比色法;荧光法;电化学;综述
雌激素[1]是由性腺分泌的一种类固醇激素。雌激素按照来源可分为内源性雌激素和外源性雌激素两类。内源性雌激素是指人和动物体内天然存在的雌激素,主要包括雌酮(Estrone,E1)、雌二醇(17β-Estradiol,E2)和雌三醇(Estriol,E3)等;外源性激素即环境激素,主要指由人工合成,具有模拟雌激素作用的化合物,既包括与雌二醇相似的类固醇衍生物,如乙炔雌二醇(17∂-Ethinylestradiol,EE)、己烯雌酚(Diethylstilbestrol),也包括结构简单的同型物非甾体激素及滴滴涕(DDT)和多氯联苯(PCBs)等化学合成类物质[2]。
雌激素在自然界中较为普遍且化学性质稳定,在动物体内没有特定的代谢系统,容易在动物脂肪中累积,可以通过食物链在动物体内不断放大,扰乱人体及动物的正常内分泌功能,影响机体发育,诱导生殖、免疫、神经等系统的多种病变,即使在极低浓度(ng/L)也会对生物产生很大的影响[3-4]。欧盟早在1996年就提出雌激素的限制使用政策[5]。近年来,为促进动物生长、产奶量增加而使用雌激素,导致蛋类、肉类和乳类的雌激素残留问题日益严重,并有相关报道指出在一些自然河流、江、海里检测出较高量的雌激素。2013年,圣元奶粉致儿童性早熟事件,让大家谈奶色变。Aksglaede等[6]在2005年已证明儿童对雌激素更为敏感;雌激素对未成年人的生长和发育影响显著。Ganmaa等[7]研究发现,乳腺癌、卵巢癌和子宫内膜癌与摄入牛奶中的高含量雌激素有关。雌激素对人体的不良影响使得大家对雌激素的检测十分关注。
目前,国内外已报道的雌二醇的检测方法有高效液相色谱法(HPLC)[8-9]、气相色谱-质谱联用法(GC-MS)[10]、液相色谱-质谱联用法(LC-MS/MS)[11]、薄层色谱法[12]、酶联免疫法(ELISA)[13]、免疫组织化法[14]、荧光分析法[15]、电化学分析法[16]等。然而这些方法均存在一定的不足。例如仪器分析方法虽可以达到较低的检测限,但要求样品前处理精细,程序复杂,工作量大,耗时长,需配备昂贵的精密仪器等;免疫分析方法的特异性好,灵敏度高,但在操作过程中易被污染,抗体活性易受影响等。因此,开发一种简单、快速、灵敏的雌激素检测技术,对食品及环境中的雌激素进行现场快速检测,以及保障人们的身体健康具有重要意义。
1 核酸适配体技术
1990年,Ellington[17]和Tuerk[18]首次提出适配体(Aptamer)这一概念。核酸适配体是通过指数富集配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)从特定的DNA文库中筛选得到的一段具有高亲和力与特异性识别作用的单链寡核苷酸(10~100碱基)片段,又称为适配体、核酸适体或适配子等,可为ssDNA和RNA。适配体自身可通过折叠形成特定的二级或三级结构,如茎、环、凸、发卡结构、假结体、四角环和G-四链体等。基于适配体可形成多样的空间结构,它可与靶标通过构象高亲和力结合,且靶标范围广,可从单个小分子到复杂的混合物,也可以是完整的有机体[19]。与传统的抗体相比,核酸适配体具有稳定性好、易制备、检测方法多样等优点(表1)[20-23]。基于核酸适配体的高亲和力、高特异性等特点,目前已经建立了针对多种靶标(如抗生素[24-25]、霉菌毒素[26-28]、过敏原[29]、重金属[30-31]和微生物[32]等)的检测方法,如比色法[33]、荧光法[34]、电化学法[35]等。同时适配体还被作为药物靶向运输的载体[36-37]或直接作为治疗药物用于临床治疗研究。
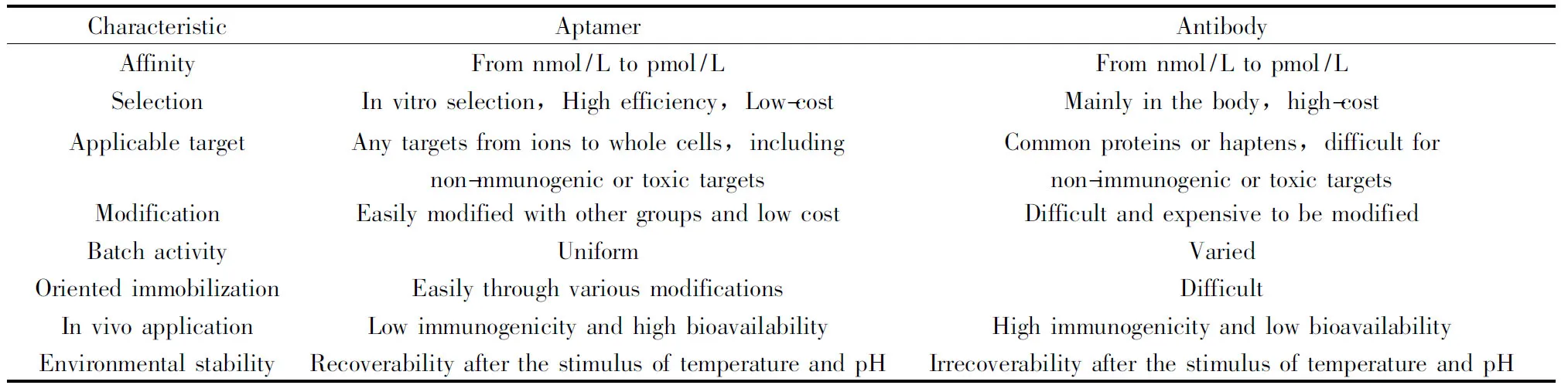
表1 适配体与抗体的性能比较Table 1 Comparison of aptamers with antibodies
2 雌激素适配体筛选进展
目前已筛选出适配体的雌激素有E2,EE和孕酮(Progesterone,P4)。其中,由于E2雌激素效应最强,E2适配体的研究最多。
Kim等[38]在2007年筛选出E2的第一条核酸适配体。首先,在1个包含大约7.2×1014mol DNA分子的随机单链DNA文库中通过指数富集配体系统进化技术(SELEX)经过7轮循环筛选得到长度为76mer的适配体序列。然后利用平衡过滤法(Equillibrium-filtration method,EFM)评估出适配体与靶标之间的亲和力,即平衡分离常数(Kd值)为0.13 μmol/L,并通过mfold软件和最小自由能法(The free-energy minimization algorithm)对该适配体的二级结构进行分析,提出了如图1A所示的结构图。最后,该团队利用表面等离子共振技术(SPR)和电化学分析法验证了适配体可通过标记生物素固定在表面修饰链霉亲和素的金电极上,并建立了基于适配体的电化学传感器成功地用于E2的检测,最低检测限可达0.01 nmol/L。
本课题组[39-40]利用Kim团队筛选的这条适配体建立了基于纳米金比色的E2检测方法,在此基础上,为了提高纳米金比色法的灵敏度,本课题组还首次将E2适配体从中间突环处剪切成2个片段,结果表明2个片段均可以和E2结合。
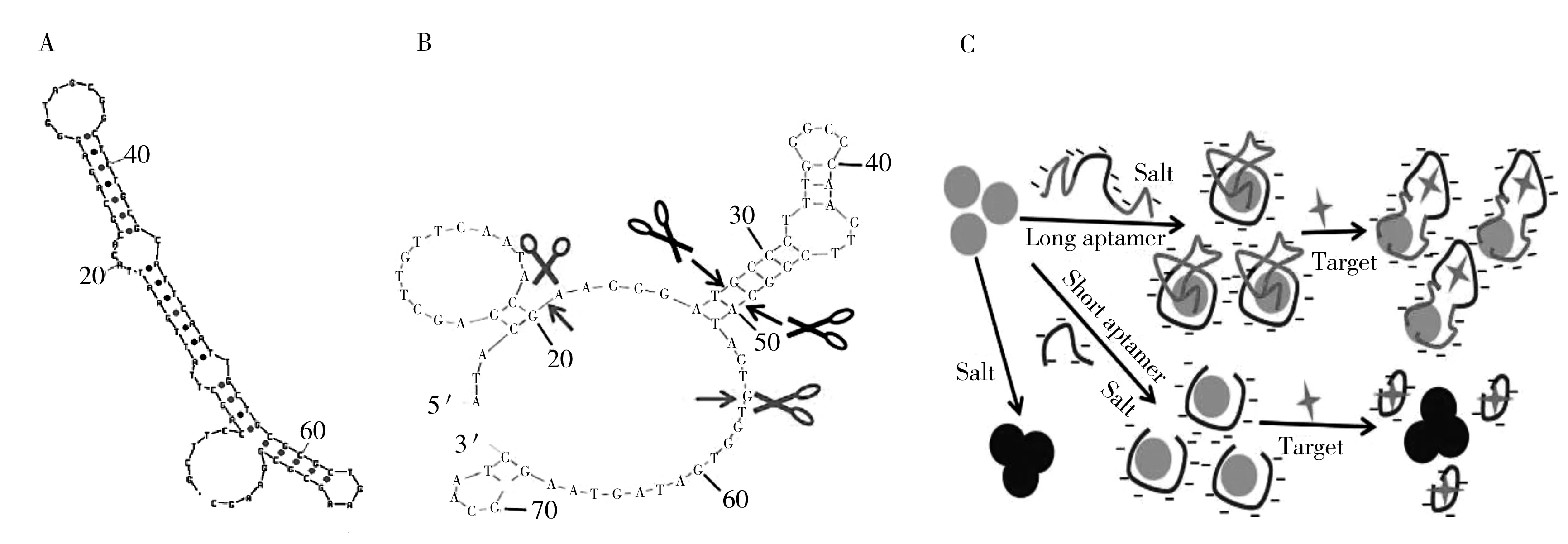
图1 17β-雌二醇适配体的二级结构及适配体截短部位示意图Fig.1 Scheme of 17β-estradiol aptamer structure and the split aptamer fragments
2014年,Alsager等[41]通过SELEX在含7.2×1014mol单链DNA分子的随机文库中筛选出1条长度为75 mer的E2适配体,并利用纳米金荧光法测定出该适配体的Kd值为25 nmol/L。2015年,Alsager等[42]利用圆二色谱(CD)测定到该适配体上有3个颈环(图1B),结合纳米金适配体比色法并根据3个凸环及与靶标的结合位点,将该75 mer的适配体截短为35,22 mer两个短链适配体,测定其Kd值分别为14 nmol/L和11 nmol/L。在建立纳米金比色法检测E2的过程中,作者利用测定动电电位(ζ-potential)和计时库伦分析法(Chronocoulometry)分析发现35 mer和22 mer的特异性和选择性显著优于75 mer,并且检测灵敏度提高了25倍(图1C)。然而,22 mer的适配体由于去除了冗余的寡核苷酸,当它吸附到纳米金表面形成嵌入型结构,便不再与E2结合;相反,如果它先与E2孵育,便不再与纳米金粒子(AuNPs)结合。而35 mer的Aptamer既可较好地与AuNPs耦合,又可从NPs表面脱离下来与Aptamer结合。因此,该研究证明,去除超多的侧翼寡核苷酸,保留一小部分额外的碱基对提高纳米金比色法的灵敏度有很大帮助。
为提高筛选适配体的特异性,Vanschoenbeek等[43]创新性地提出在两个独立包含1 015 mol单链DNA的随机寡核苷酸库中分别建立SELEX(A和B)程序,筛选针对E2上不同功能团亲和的适配体。每个SELEX程序均采用正筛选和反筛选重复轮换的策略,其中,针对羟化芳香环A(图2A)的SELEX用去甲基睾酮作为反筛靶标;针对上段B,C和D环(图2B)的Aptamer SELEX过程中则将地塞米松作为反筛靶标。SELEX A在经历5轮筛选后获得19条DNA单链,SELEX B经历10轮筛选获得24条DNA单链,利用SPR技术测定其亲和力分别在27~124 μmol/L和0.9~6 μmol/L之间。在验证适配体的特异性时,除了E2,还选用了EE,雄烯二酮、可的松、脱氧胆酸、E1、睾酮6种类固醇激素。SELEX A得到的适配体对E2,EE,睾酮均有较强的亲和作用,对其他激素有不同程度的结合;其中,Aptamer 6A对E2的亲和力明显高于EE,睾酮,并且对雄烯二酮、可的松、脱氧胆酸、E1无结合现象。SELEX B的两个适配体对E2,EE,E1均有结合,其中,对EE的结合力强于E2,对E1的结合力弱于E2,但对其他激素无结合。
Akki等[44]也通过SELEX筛选出E2的高特异性与高亲和力的适配体,并利用EFM评估出E2 Aptamer 1(85 mer)和E2 Aptamer 2(86 mer)的Kd值分别为0.6 μmol/L和0.56 μmol/L,同时用此方法测定出E2的适配体对E2的选择度是EE的74倍,且新筛选出的适配体的灵敏度和选择度在自然水样品中基本保持不变。Akki等[44]还利用SELEX筛选到EE的适配体EE Aptamer 1(89 mer),并通过EFM表征其Kd值为0.95 μmol/L,EE Aptamer 1对EE的选择度是E2的53倍。
Jiménez等[45]首次通过SELEX在一个包含1.8×1015mol单链DNA的随机文库经过15轮筛选后得到P4的适配体,利用电化学阻抗谱(EIS)测定Kd值为17 nmol/L。而且该适配体对E2,诺塞甾酮无任何亲和反应,特异性极高。表2列出了目前已筛选到的雌激素适配体序列、长度、亲和力等信息。

图2 17β-雌二醇的分子结构式及其适配体(6A)的二级结构Fig.2 Molecular structure of 17β-estradiol and secondary structure of aptamer(6A)

表2 目前已经筛选到的雌激素适配体Table 2 Aptamers of estrogen have been screened
3 基于适配体技术的雌激素检测方法
随着筛选出的雌激素适配体的多样化,目前国内外基于适配体检测雌激素的方法也多种多样,主要有电化学法、荧光法、纳米金比色法等。
3.1 纳米金比色法
AuNPs作为一种制备简单、吸附性强的纳米材料,具有极高的消光系数和强烈的粒子间距光学效应,其在分散状态下呈红色,发生凝聚后变为蓝色,反之也可由蓝色变为红色。适配体可以吸附到AuNPs表面,保护AuNPs免于高盐度引起的聚集变蓝现象;当加入靶标后,适配体与靶标结合,从AuNPs上解离,AuNPs粒子在高盐度下聚集,溶液由红色变蓝。基于Aptamer的纳米金比色法具有稳定、实验结果肉眼可见、操作简单快速、方便用于现场检测等优点[33,46]。
本课题组基于上述原理,建立了基于Aptamer的E2纳米金比色快速检测方法,可在20 min内完成检测[39]。该方法的灵敏度可达10 ng/mL,线性范围为10~10 000 ng/mL,在河水基质中的加标回收率为99%~112%。由于长链适配体与AuNPs亲和力高于短链Aptamer的亲和力,为了提高纳米金比色法检测E2的灵敏度,本课题组又将76 mer适配体剪切为33 mer和43 mer两段建立了E2的比色检测方法(图3A),结果显示灵敏度提高了10倍,检测限可达1 ng/mL[40]。 Alsager等[42]则通过化学方式将35 mer的适配体偶联到AuNPs上,通过检测AuNPs-Aptamer复合物的大小和脉冲持续时间的变化,建立了E2的比色检测方法(图3B),该方法的检测限为200 pmol/L。该实验对比了75,35,22 mer的检测灵敏度,结果显示短链Aptamer的灵敏度和检测限是75 mer Aptamer的25倍。
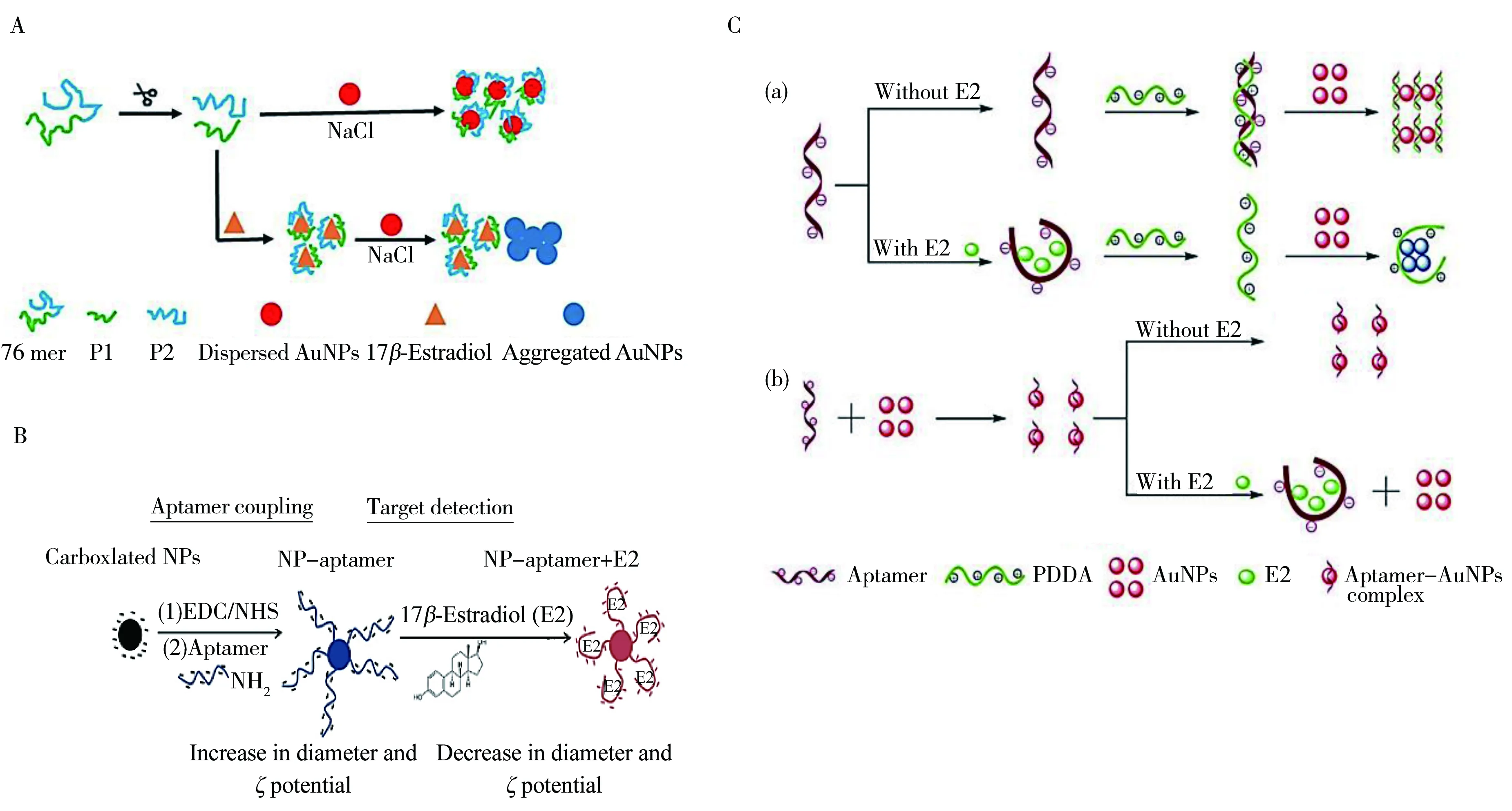
图3 基于适配体技术的雌激素比色检测方法Fig.3 Aptamer-based colorimetric assay for detection of estrogen
Zhang等[47]基于金粒子聚集溶液变蓝这一现象,利用阳离子聚合物PDDA吸附单链DNA,使得AuNPs聚集,从而设计了一个由Aptamer和PDDA组装的纳米金比色生物传感器用于对E2的含量检测(图3C)。该方法的检测限为1.57 nmol/L,线性范围为1.57~350 nmol/L,在实际环境水中的加标回收率为104.5%~114.5%,RSD为2.79%~4.34%。2016年,Du等[48]利用AuNPs的聚集变色特性,设计了基于Aptamer的P4的比色检测方法。该方法的检测限为2.6 nmol/L,线性范围为2.6~800 nmol/L,在含有各种干扰物的水、自来水、尿液实际样品中的加标回收率分别为89.7%~117.5%,84.4%~115.0% 和 94.7%~118.8%。
3.2 荧光分析法
基于荧光染料的荧光强度高、发射波长范围广、可标记性强等优点,将荧光染料通过化学合成,修饰到Aptamer上,当Aptamer与靶标结合后,可检测到荧光信号。适配体荧光分析法具有灵敏度高、操作简单、易自动化等优点。目前常用的荧光染料主要是荧光素和量子点。Yildirim等[49]利用E2-BSA和E2均可与Aptamer结合的竞争关系,设计了一个检测E2的适配体荧光生物传感器。首先,将E2-BSA固定在光纤维表面,当荧光素标记的Aptamer与E2-BSA结合后,即可检测到荧光信号,而与E2形成复合结构的Aptamer-E2则不会再与E2-BSA结合,从而得出E2的含量与荧光强度的负相关关系(图4A)。该方法的检测限是为2.1 nmol/L,在实际样品废水中的加标回收率为95%~105.0%。
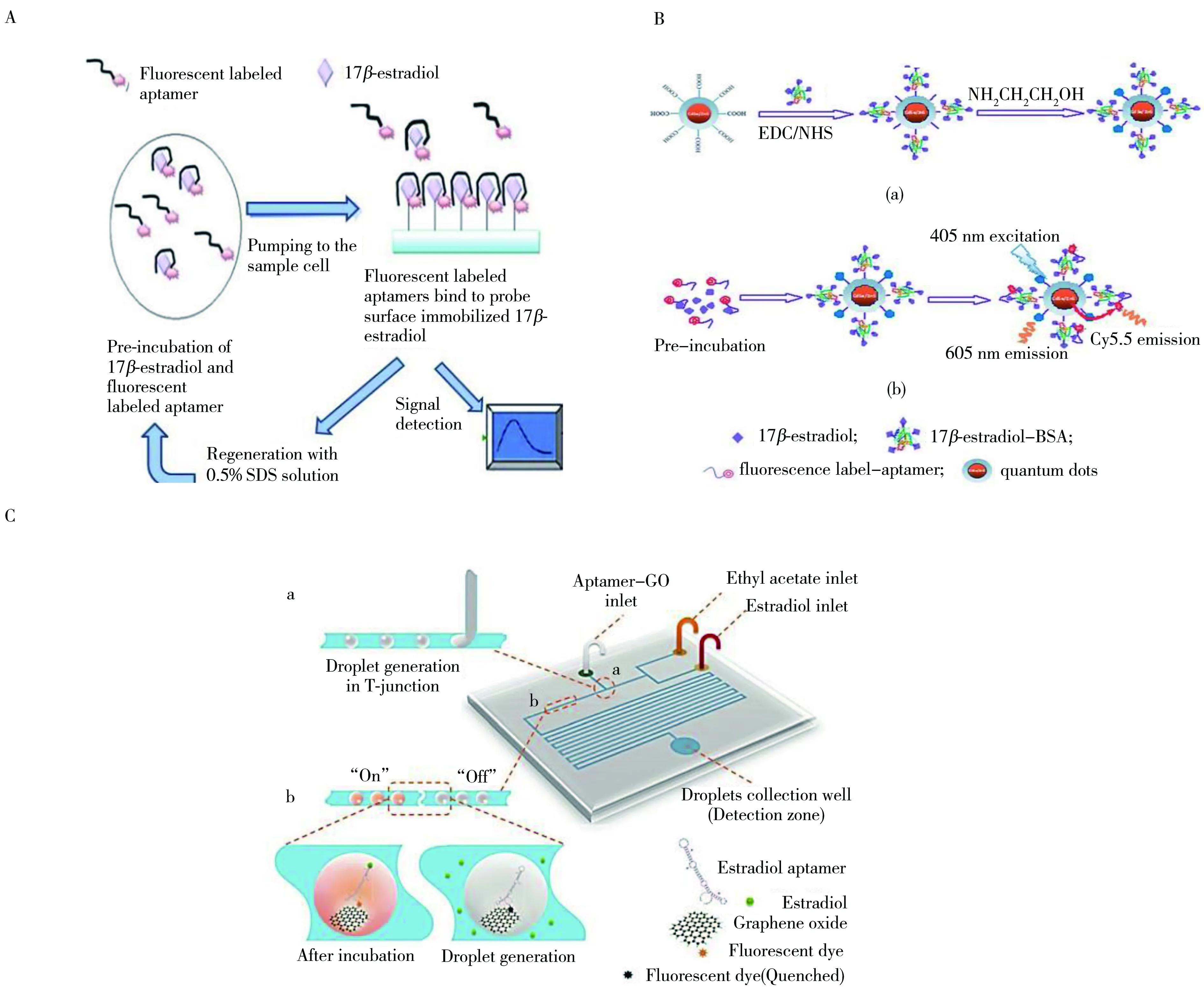
图4 基于适配体技术的雌激素荧光检测方法Fig.4 Fluorescent assay for detection of estrogen
鉴于荧光素信号易被干扰的特性,Long等[50]选用性质较为稳定的量子点和Cy5.5共同作为信号标记物,利用荧光共振能量转移原理,建立了基于量子点标记Aptamer的E2的荧光分析法(图4B)。该方法的检测限可达0.22 nmol/L,相对于电流型免疫传感器[51],该方法的灵敏度提高了10倍,线性范围为0.82~20.5 nmol/L,在水样中的加标回收率为80.0%~115.0%,RSD为3.6%~11.3%。在传统荧光法的基础上,Dou等[52]引入微流控液滴新型技术,并结合新型多功能纳米材料石墨烯、荧光素和“信号开关”荧光猝灭物质,建立了检测E2的高灵敏荧光分析法(图4C)。该实验将Aptamer功能化修饰的氧化石墨烯放在液滴中,一个液滴即是一个反应体系;并且,整个实验操作只需一步即可完成,操作简单、快速,避免了可能的污染。该方法的检测限为0.07 pmol/L,远高于其他荧光分析法和比色法,其线性范围为0.1 pmol/L~1 nmol/L。
3.3 电化学分析法
电化学分析法是基于物质在溶液中的电化学性质的一类仪器分析方法。将Aptamer固定在电极上,当Aptamer与靶标结合后,影响电极上的氧化还原反应,从而导致电化学性质的变化。因此,可通过检测电极电位、电流、电势等测定被检物质的浓度。电化学分析法具有灵敏度高,准确度强,测量范围宽等优点。
2007年,Kim等[38]在筛选出E2的第一条Aptamer时,用此Aptamer设计了一个基于Aptamer的雌激素电化学检测方法。首先,将适配体固定在金电极上,当有雌激素结合到适配体时,电极上的氧化还原反应则被抑制,导致电流变化,因此,通过电流的变化程度测定体系中E2的含量。该方法的检测范围可达0.01~1 nmol/L。基于此原理和方法,2010年,Olowu等[53]将Aptamer固定在PEDOT修饰的金电极上,采用循环伏安法(CV)和方波伏安法(SWV)检测电流的变化,进而对雌激素的含量进行检测。该方法的检测限为0.02 nmol/L。同时,该团队在2011年[54]更换电极修饰物为树枝状的聚丙烯亚胺和星形共聚物聚噻吩,建立了检测E2的光谱电化学传感器方法,其检测范围为0.1~100 nmol/L。Lin等[55]采用CV和EIS,通过检测电阻信号的变化,设计了检测E2的电化学阻抗生物传感器。该方法的检测限为2 pmol/L,检测范围为0.1 pmol/L~0.1 nmol/L,在尿液实际样品中的加标回收率为91.7%~103.1%。
为了进一步提高检测的灵敏度,Fan等[56]设计了E2的光电化学检测方法。通过将Aptamer固定在CdSe NPs-TiO2NTs电极上,当Aptamer与靶标结合后,光电流会降低。因此,通过光电流的降低程度,可实现测定物质浓度的目的。该方法的检测限可达33 fmol/L,检测范围为0.05~15 pmol/L,并且在医用废水、湖水、自来水中有较好的加标回收率(90.0%~102.8%),RSD小于5.45%。而Huang等[57]则利用硫化铜和AuNPs修饰的玻璃碳电极和酶信号放大技术,建立了一种基于Aptamer检测E2的电化学方法,检测限可达60 fmol/L,线性范围为0.5 pmol/L~5 nmol/L,在尿样中的加标回收率为96.3%~104.3%。需指出的是,此电极在4 ℃储存1周后,5.0 pmol/L的信号响应值保持最初的95.2%,此方法有较好的稳定性和重复性。

Jiménez等[45]在筛选出P4的首个Aptamer之后,设计了一个基于此Aptamer的P4的电化学检测方法,提出并验证了使用10 mer的互补链使得灵敏度更高。该方法的检测限为0.9 ng/mL,检测范围为10~60 ng/mL,并在自来水中有良好的回收率。
3.4 其他方法
除了上述比较常用的分析检测方法之外,鉴于雌激素检测的重要性以及新检测方法的出现,利用Aptamer还建立了一些其他的检测方法。如Alsager等[41]利用适配体建立了基于尺寸收缩效应的E2检测方法,检测范围为5~150 nmol/L,检测限为5 nmol/L。他们利用动态光散射(Dynamic light scattering,DLS)、电阻脉冲传感器(Resistive pulse sensing,TRPS)观察到当E2的浓度在nmol范围内时,共轭体的尺寸明显下降,产生较少的负的电动电势,并用CD法进行了确证。此适配体传感器对E2的同类雌激素也具有类似的亲和力,并且可排除非甾体激素的干扰。重要的是,该适配体传感器将构象变化与特异性结合信号结合一起,不需绑定和未绑定的Aptamer明确信息,只要求结合后产生信息的改变。表3列出了部分基于适配体技术的雌激素检测方法。
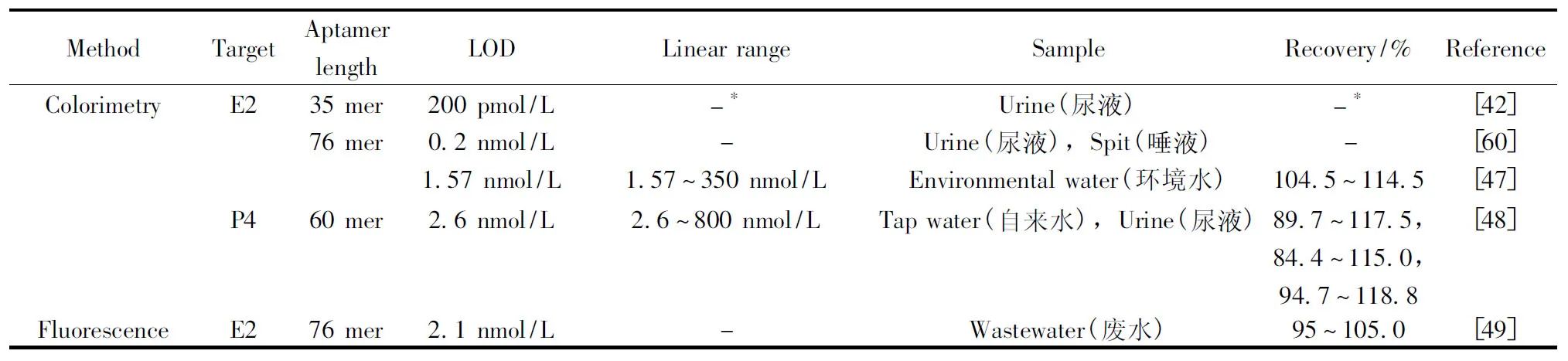
表3 基于适配体技术的雌激素检测方法Table 3 Detection methods for estrogen based on aptamer
(续表3)

MethodTargetAptamerlengthLODLinearrangeSampleRecovery/%Reference80.22nmol/L0.82~20.5nmol/L80~115[50]35mer37nmol/L0.08~0.4μmol/LBovinefetalserum(牛胎血清)96.5~104.8[61]76mer0.07pmol/L0.1pmol/L~1nmol/L--[52]ElectrochemistryE276mer-0.01~1nmol/L--[38]0.02nmol/L---[53]-0.1~100nmol/L--[54]2pmol/L0.1nmol/L~0.1pmol/LUrine(尿液)91.7~103.1[55]33fmol/L0.05~15pmol/LMedicalwastewater(医用废水),Lakewater(湖水),Tapwater(自来水)90.0~102.8[56]1.1pmol/L0.01~10nmol/LSerum(血清),Urine(尿液),Tapwater(自来水)89.8~100,90.0~103.5,89.5~95.0[57]60fmol/L0.5pmol/L~5nmol/LUrine(尿液)96.3~104.3,[58]0.07pmol/L1pmol/L~1nmol/LUrine(尿液)94.4%~104.0[59]75mer1fmol/L1fmol/L~1μmol/LUrine(尿液)-[62]P460mer0.9ng/mL10~60ng/mLTapwater(自来水)-[45]
* no data
4 总结与展望
在雌激素的检测领域中,传统方法虽然展现了灵敏度高、精确度好等优点,但同时存在耗时长、仪器设备大、不利于现场操作、成本高等弊端。Aptamer作为一种特异性高、稳定性好、靶标范围广的分子识别探针,备受研究者推宠。本文综述了适配体技术的应用研究进展、雌激素的适配体筛选工作进展以及基于适配体技术的雌激素检测方法。雌激素的基于适配体检测方法主要以荧光法、比色法和电化学法为主,虽然他们均具有快速、灵敏、简便等优点,但尚未做成实际成品的方法,依然不便于现场监测工作。而且,目前筛选出适配体的雌激素仅有E2,P4和EE,虽然基于Aptamer检测E2的方法已有很多,但对P4和EE的检测方法依然很少。因此,在利用适配体技术检测雌激素的工作中,如何简单、快速、高效、定向筛选所需适配体将是未来的研究热点,也是对科研人员的一个挑战;而如何将实验室检测方法转化为稳定、灵敏、低成本的快速检测成品(如试纸条),以及同时检测多种雌激素也是另一巨大挑战。总之,在安全检测领域中雌激素的检测尚需进一步的探究和完善,相信随着广大科研者的共同努力,基于适配体技术的雌激素检测将会越来越成熟,越来越完善。
[1] Zeng Q Z,Li Y M,Zhao J M,Gu G W.Environ.Sci.Technol.(曾庆珍,李咏梅,赵俊明,顾国维.环境科学与技术),2007,30(10):108-111.
[2] Caupos E,Mazellier P,Croue J P.WaterRes.,2011,45:3341-3350.
[3] Suzuki Y,Maruyama T.WaterRes.,2006,40:1061-1069.
[4] Andersson A M,Skakkebk N E.Eur.J.Endocrinol.,1999,140:477-485.
[5] Feng C H,Lin J D,Shao J,Liu S F,Yang M,Li Y X,Zhang R H.Environ.Pollut.Control(冯成洪,林建德,邵坚,刘姝芳,杨明,李艳霞,张荣华.环境污染与防治),2011,33(12):82-86.
[6] Aksglaede L,Juul A,Leffers H,Skakkebaek N E,Andersson A M.HumanReproduct.Update,2006,12(4):341-349.[7] Ganmaa D,Sato A.MedicalHypotheses,2005,65:1028-1037.
[8] Lu H Z,Xu S F.Talanta,2015,144:303-311.
[9] Alonso R G,Viera S S,Ferrera Z S,Rodriguez J J S.J.Sep.Sci.,2015,38(22):3961-3968.
[10] Janssens G,Mangelinckx S,Courtheyn D,Kimpe N D,Matthijs B,Bizec B L.J.Agric.FoodChem.,2015,63:7574-7581.
[11] Yang F X,Huang W,Xie W,Lu C S,Liu W P.Environ.Int.,2015,74:119-124.
[12] Wang Q Y,Jiao X M,Dong Y.PracticalPharmacyandClimicalRemedies(王全一,矫筱蔓,董宇.实用药物与临床),2011,14(2):134-135.
[13] Wang J,Wang W,Zhang X N,Tian H,Ru S G.Chemosphere,2015,132:166-171.
[14] Adriana V C,Marco P H.Int.J.Morphol.,2012,30(3):1090-1093.
[15] Wang D,Xie J B,Zhu X C,Li J Q,Zhao D Q,Zhao M P.Biosens.Bioelectron.,2014,55:391-395.
[16] Guo Z Z,Zine N,Balaguer P,Zhang A D,Namour P,Lagarde F,Renault N J.Electroanalysis,2013,25(7):1765-1772.
[17] Ellington A D,Szostak J W.Nature,1990,346:818-822.
[18] Tuerk C,Gold L.Science,1990,249(4968):505-510.
[19] Stoltenburg R,Reinemann C,Strehlitz B.Biomol.Eng.,2007,24:381-403.
[20] Jayasena S D.Clin.Chem.,1999,45(9):1628-1650.
[21] Citartan M,Gopinath S C B,Tominaga J,Tan S C,Tang T H.Biosens.Bioelectron.,2012,34:1-11.
[22] Rhouati A,Yang C,Hayat A,Marty J L.Toxins,2013,5:1988-2008.
[23] Won J Y,Choi J W,Min J.Biosens.Bioelectron.,2013,40:161-166.
[24] Soheili V,Taghdisi S M,Khayyat M H,Bazzaz B S F,Ramezani M,Abnous K.Microchim.Acta,2016,183:1687-1697.[25] Nikolaus N,Strehlitz B.Sensors,2014,14:3737-3755.
[26] Zhou W L,Kong W J,Dou X W,Zhao M,Ouyang Z,Yang M H.J.Chromatogr.B,2016,1022:102-108.
[27] Shi Z Y,Zheng Y T,Zhang H B,He C H,Wu W D,Zhang H B.Electroanalysis,2015,27:1097-1103.
[28] Luan Y X,Chen J Y,Xie G,Li C,Ping H,Ma Z H,Lu A X.Microchim.Acta,2015,182:995-1001.
[29] Svobodova M,Mairal T,Nadal P,Bermudo M C,O’Sullivan C K.FoodChem.,2014,165:419-423.
[30] Tang X,Wang Y S,Xue J H,Zhou B,Cao J X,Chen S H,Li M H,Wang X F,Zhu Y F,Huang Y Q.J.Pharm.Biomed.,2015,107:258-264.
[31] Divsar F,Habibzadeh K,Shariati S,Shahriarinour M.Anal.Methods,2015,7:4568-4576.
[32] Chung J,Kang J S,Jurng J S,Jung J H,Kim B C.Biosens.Bioelectron.,2015,67:303-308.
[33] Wang C,Qian J,Wang K,Yang X,Liu Q,Hao N,Wang C,Dong X,Huang X.Biosens.Bioelectron.,2016,77:1183-1191.
[34] Zhu L,Xu G H,Song Q,Tang T,Wang X,Wei F D,Hu Q.Sens.ActuatorsB,2016,231:506-512.
[35] Xue J K,Liu J,Wang C S,Tian Y P,Zhou N D.Anal.Methods,2016,8:1981-1988.
[36] Yang Y,Liu J J,Sun X Q,Feng L Z,Zhu W W,Liu Z,Chen M W.NanoRes.,2016,9(1):139-148.
[37] Leach J C,Wang A,Ye K M,Jin S.Int.J.Mol.Sci.,2016,17(380):1-11.
[38] Kim Y S,Jung H S,Matsuura T,Lee H Y,Kawai T,Gu M B.Biosens.Bioelectron.,2007,22:2525-2531.
[39] Niu S C,Lü Z Z,Liu J C,Jiang X L,Li C,Chen A L.J.Instrum.Anal.(牛书超,吕珍珍,刘金钏,蒋小玲,李诚,陈爱亮.分析测试学报),2014,33(7):835-839.
[40] Liu J C,Bai W H,Niu S C,Zhu C,Yang S M,Chen A L.Sci.Reports,2014,4:7571-7576.
[41] Alsager O A,Kumar S,Willmott G R,McNatty K P,Hodgkiss J M.Biosens.Bioelectron.,2014,57:262-268.
[42] Alsager O A,Kumar S,Zhu B C,Travas-Sejdic J,McNatty K P,Hodgkiss J M.Anal.Chem.,2015,87:4201-4209.[43] Vanschoenbeek K,Vanbrabant J,Hosseinkhani B,Vermeeren V,Michiels L.J.SteroidBiochem.Mol.Biol.,2015,14:710-716.
[44] Akki S U,Werth C J,Silverman S K.Environ.Sci.Technol.,2015,49:9905-9913.
[45] Jiménez G C,Eissa S,Ng A,Alhadrami H,Zourob M,Siaj M.Anal.Chem.,2015,87:1075-1082.
[46] Kong D Z,Liu L Q,Song S S,Suryoprabowo S,Li A K,Kuang H,Wang L B,Xu C L.Nanoscale,2016,8:5245-5253.[47] Zhang D W,Zhang W L,Ye J Y,Zhan S S,Xia B,Lv J,Xu H C,Du G S,Wang L M.Aust.J.Chem.,2016,69:12-19.
[48] Du G S,Zhang D W,Xia B,Xu L R,Wu S J,Zhan S S,Ni X,Zhou X T,Wang L M.Microchim.Acta,2016,183:2251-2258.
[49] Yildirim N,Long F,Gao C,He M,Shi H C,Gu A Z.Environ.Sci.Technol.,2012,46:3288-3294.
[50] Long F,Shi H C,Wang H C.Rsc.Adv.,2014,4:2935-2941.
[51] Butler D,Guilbault G G.Sens.Actuators.B,2006,113:692-699.
[52] Dou M W,Garcia J M,Zhan S H,Li X J.Chem.Commun.,2016,52(17):3470-3473.
[53] Olowu R A,Arotiba O,Mailu S N,Waryo T T,Baker P,Iwuoha E.Sensors,2010,10:9872-9890.
[54] Olowu R A,Ndangili P M,Baleg A A,Ikpo C O,Njomo N,Baker P,Iwuoha E.Int.J.Electrochem.Sci.,2011,6:1686-1708.
[55] Lin Z Y,Chen L F,Zhang G Y,Liu Q D,Qiu B,Cai Z W,Chen G N.Analyst,2012,137:819-822.
[56] Fan L,Zhao G,Shi H,Liu M,Wang Y,Ke H.Environ.Sci.Technol.,2014,48:5754-5761.
[57] Huang K J,Liu Y J,Zhang J Z.Microchim.Acta,2015,182:409-417.
[58] Zhang J J,Cao J T,Shi G F,Huang K J,Liu Y M,Chen Y H.Anal.Methods,2014,6:6796-6801.
[59] Huang K J,Liu Y J,Zhang J Z,Cao J T,Liu Y M.Biosens.Bioelectron.,2015,67:184-191.
[60] Soh J H,Lin Y Y,Rana S,Ying J Y,Stevens M M.Anal.Chem.,2015,87:7644-7652.
[61] Huang H L,Shi S,Gao X,Gao R R,Zhu Y,Wu X W,Zang R M,Yao T M.Biosens.Bioelectron.,2016,79:198-204.
[62] Zhu B,Alsager O A,Kumar S,Hodgkiss J M,Travas-Sejdic J.Biosens.Bioelectron.,2015,70:398-403.
Research on Aptasensor Development for Estrogen Detection
ZHANG Gui-lan,ZHU Chao,HUANG Ya-fei,YAN Jiao,CHEN Ai-liang*
(Institute of Quality Standards and Testing Technology for Agro-products,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Estrogen is a kind of steroid hormone,belonging to endocrine disruptors,which seriously interfere with the normal endocrine function of human and wildlife.Therefore,it is quite necessary to develop a simple and rapid method for the sensitive determination of estrogen present in the environment to protect public and environment health.Aptamers are selected in vitro by systematic evolution of ligands by exponential enrichment(SELEX),and are single-stranded DNA or RNA molecules that can bind to various targets with high sensitivity and specificity.Aptamer has been widely used in analysis field because of its several overwhelming advantages over antibodies,such as target diversity,high stability,easy of synthesis and modification for applications.In this review,the researches on estrogen aptamer selection and aptamer based detection methods were summaried,and the development trend of aptasensor application in estrogen detection was also discussed.
estrogen;aptamer;colorimetry;fluorescence;electrochemistry;review
10.3969/j.issn.1004-4957.2017.03.023
2016-09-13;
2016-10-23
公益性行业(农业)科研专项资助(201203046)
O657.63;TQ460.72
A
1004-4957(2017)03-0422-09
*通讯作者:陈爱亮,博士,副研究员,研究方向:食品安全快速检测技术,Tel:010-82106557,E-mail:ailiang.chen@gmail.com
